Ультразвуковая допплеровская диагностика в клинике
под редакцией Ю.М. Никитина и А. И. Труханова
ОГЛАВЛЕНИЕ
Глава 1. ФИЗИКО-ТЕХНИЧЕСКИЕ ОСНОВЫ УЛЬТРАЗВУКОВОЙ ДОППЛЕРОГРАФИИ
Глава 2. НОВЫЕ УЛЬТРАЗВУКОВЫЕ ТЕХНОЛОГИИ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Глава 3. УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА ПОРАЖЕНИЙ СОСУДОВ ДУГИ АОРТЫ И ОСНОВАНИЯ МОЗГА
Глава 4. УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА ЦЕРЕБРОВАСКУЛЯРНЫХ НАРУШЕНИЙ У НОВОРОЖДЁННЫХ ДЕТЕЙ
Глава 5. ВЕНОЗНЫЕ ДИСГЕМИИ И ВЕРТЕБРОГЕННАЯ НЕДОСТАТОЧНОСТЬ ЦЕРЕБРАЛЬНОЙ ГЕМОДИНАМИКИ У ДЕТЕЙ
Глава 6. ТРАНСКРАНИАЛЬНАЯ ДОППЛЕРОГРАФИЯ В ДЕТЕКЦИИ ЦЕРЕБРАЛЬНОЙ ЭМБОЛИИ
В. П. Куликов, Н.П. Хорее, Ю.В. Смирнова
Глава 8. ЦВЕТОВОЕ ДУПЛЕКСНОЕ СКАНИРОВАНИЕ И ТРАНСКРАНИАЛЬНАЯ ДОППЛЕРОГРАФИЯ ПРИ ОБСТРУКТИВНЫХ НАРУШЕНИЯХ ЦЕРЕБРАЛЬНОГО ВЕНОЗНОГО КРОВООБРАЩЕНИЯ
Глава 9. РЕГУЛЯЦИЯ МОЗГОВОГО КРОВООБРАЩЕНИЯ И УЛЬТРАЗВУКОВЫЕ МЕТОДЫ ЕЁ ОЦЕНКИ
Глава 10. КЛИНИКО-ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА СМЕРТИ МОЗГА
Глава 11. ЦВЕТОВОЕ ДУПЛЕКСНОЕ СКАНИРОВАНИЕ В ОФТАЛЬМОЛОГИИ
Глава 12. ЦВЕТОВАЯ ДОППЛЕРОВСКАЯ СОНОГРАФИЯ Е ДИАГНОСТИКЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Глава 13. ЦВЕТОВОЕ ДОППЛЕРОВСКОЕ СКАНИРОВАНИЕ И ТРЕХМЕРНАЯ РЕКОНСТРУКЦИЯ АБДОМИНАЛЬНЫХ СОСУДОВ
Глава 14. ДОППЛЕРОВСКИЕ УЛЬТРАЗВУКОВЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ В УРОНЕФРОЛОГИИ
Глава 15. ЦВЕТОВАЯ ДОППЛЕРОВСКАЯ СОНОГРАФИЯ Е ГИНЕКОЛОГИИ
О.В. Проскурякова, Б. И. Зыкин
Глава 16. УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ АРТЕРИЙ НИЖНИХ КОНЕЧНОСТЕЙ
Глава 17. УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ВЕН НИЖНИХ КОНЕЧНОСТЕЙ
А.Р. Зубарев, И.А. Асеева, Ю.Е. Ким
СПИСОК ОСНОВНЫХ СОКРАЩЕНИЙ
|
АВМ |
- артерио-венозная мальформация |
НПА |
- наружная подвздошная артерия |
|
АД |
- артериальное давление |
НСА |
- наружная сонная артерия |
|
АПС |
- аорто-подвздошный сегмент |
OA |
- основная артерия |
|
АТС |
- артерия тыла стопы |
ОБА |
- общая бедренная артерия |
|
БА |
- брюшная аорта |
ОПА |
- общая подвздошная артерия |
|
ВБА |
- верхняя брыжеечная артерия |
ОСА |
- общая сонная артерия |
|
ВПА |
- внутренняя подвздошная артерия |
ПА |
- позвоночная артерия |
|
ВСА |
- внутренняя сонная артерия |
ПББА |
- передняя большеберцовая артерия |
|
ВЧД |
- внутричерепное давление |
ПБК |
- поверхностная бедренная артерия |
|
ВЯВ |
- внутренняя яремная вена |
ПГС |
- плече-головной ствол |
|
ГА |
- глазная артерия |
ПДС |
- пиковая диастолическая скорость |
|
ГБА |
- глубокая бедренная артерия |
ПКА |
- подключичная артерия |
|
Дс |
-дуплексное сканирование |
ПкА |
- подколенная артерия |
|
ЗББА |
- задняя большеберцовая артерия |
ПМА |
- передняя мозговая артерия |
|
ЗМА |
- задняя мозговая артерия |
ПНМК |
- преходящее нарушение мозгового |
|
ЗСА |
- задняя соединительная артерия |
|
кровообращения |
|
ИД |
- индекс давления |
ПОРГ |
- постокклюзионная реактивная гиперемия |
|
ИП |
- индекс пульсации |
ПСА |
- передняя соединительная артерия |
|
ИР |
- индекс резистентности (пери- |
ПСС |
- пиковая систолическая скорость |
|
|
ферического сопротивления) |
СМА |
- средняя мозговая артерия |
|
ИЦР |
- индекс цереброваскулярной реактивности |
ССД |
- сегментарное систолическое давление |
|
кт |
- компьютерная томография |
ткЦДС |
транскраниальное цветовое дуплексное |
|
лск |
- линейная скорость кровотока |
|
сканирование |
|
МАГ |
- магистральные артерии головы |
ткД |
- транскраниальная допплерография |
|
МДС |
- минимальная диастолическая скорость |
УЗДГ |
- ультразвуковая допплерография |
|
МЖ |
- молочная железа |
УЗИ |
- ультразвуковое исследование |
|
МРА |
- магнитно-резонансная ангиография |
ЦДС |
- цветовое дуплексное сканирование |
|
МРТ |
- магнитно-резонансная томография |
|
(цветовая допплеровская |
|
МСС |
- максимальная систолическая скорость |
|
сонография) |
|
НА |
- надблоковая артерия |
ЦДК |
- цветовое допплеровское картирование |
|
НБА |
- нижняя брыжеечная артерия |
эдк |
- энергетическое допплеровское |
|
НГТ |
- надбровный гемодинамический тест |
|
картирование |
|
НМК |
- нарушение мозгового кровообращения |
|
|
ГЛАВА 1
ФИЗИКО-ТЕХНИЧЕСКИЕ ОСНОВЫ УЛЬТРАЗВУКОВОЙ ДОППЛЕРОГРАФИИ
1. Физические принципы метода и его аппаратурной визуализации
1.1. Эффект Допплера
Тот, кто пьет воду, должен помнить о том кто вырыл колодец.
Древняя китайская мудрость
Кристиан Андреас Допплер родился 29 ноября 1803 г. в семье Иоганна Допплера - потомственного каменщика г. Зальцбурга.
В возрасте 19 лет родители отправили его в Политехнический институт в Вену, где после трех лет обучения Кристиан Андреас Допплер получил образование по физике и математике и продолжил его в течение двух последующих лет в своем родном Зальцбурге.
Следующие четыре года (1829-1833) он был ассистентом высшей математики в Политехническом институте в Вене, где в 1831 г напечатал первую из своих 51 научных публикаций. Период с 1835 по 1847 год, который он провел в Праге, стал наиболее плодотворным в деятельности Кристиана Допплера.
6 марта 1841 г. Допплер стал профессором математики и практической геометрии в Техническом институте в Праге, а 25 мая 1842 г на заседании Королевского научного общества Богемии представил доклад «О цветном свете двойных звезд и ряда других небесных тел» [1]. Данное сообщение содержащее описание явления смещения линий в сторону красного части спектра в излучении двойных звезд, положило основание в создание теории измерения скоростей движущихся объектов.
Было отмечено, что, когда источник излучения движется по отношению к наблюдателю значение принимаемой частоты волны отличается от значения частоты излученной волны.
Для звуковых волн эффект Допплера нашел подтверждение в 1845 г во время экспериментов Байеса Бейлота [2], проведенных на железной дороге Амстердам-Утрехт. Интересно отметить, что первоначально эксперименты задумывались с целью опровергнуть основные постулаты теории Допплера.
В 1847 г. Кристиан Допплер получил почетное звание доктора. Пражского университета, а в 1848 г был избран членом Академии наук в Вене. Вершины академической карьеры он достиг в 1850 г., став первым директором Института физики, созданного им в Венском королевском университете согласно указу императора Франца-Иосифа.
Заболевание легочным туберкулезом вынудило Кристиана Допплера отвлечься от хлопот по набору персонала для своего института, закупке оборудования и комплектованию библиотеки. По рекомендации врачей он направился на лечение в Венецию, где после пяти месяцев болезни скончался 17 марта 1853г.
Подробности биографии Кристиана Допплера стали доступны благодаря неоценимой работе нашего современника - немецкого физика Алека Эдена [3], внесшего заметный вклад и в развитие медицинских диагностических методов, построенных на эффекте Допплера.
В одной из своих последних работ Кристиан Допплер писал: «Наиболее передовыми исследованиями следует признать те, которые не только приносят радость ученому, но и служат прогрессу всего человечества».
Дальнейшая история подтвердила, что слова великого ученого с полным правом могут быть отнесены и на его счет.
На основе его теории были проведены измерения параметров вращения Солнца и планет, колец Сатурна, что позволило уточнить их структуру. Теория нашла многочисленные практические применения в физике, навигации, аэронавтике, геодезии, медицине.
Более столетия прошло с момента кончины Допплера, прежде чем была обнаружена возможность использования его теории в медицине. Впервые анализ скоростных показателей кровотока на основе явления отражения ультразвуковых волн от эритроцитов был выполнен в 1956 г. [4].
Эффект Допплера состоит в том, что частота волн, принимаемых наблюдателем, зависит от скорости движения источника излучения и наблюдателя. Другими словами, если направить ультразвуковой луч по направлению кровеносного сосуда, то движущиеся эритроциты будут выполнять роль отражателей, вызывая изменение частоты принимаемой волны. Это изменение частоты (допплеровский сдвиг) прямо пропорционально скорости потока крови. Далее, может быть определено направление потока крови, так как поток, направленный в сторону ультразвукового излучателя-приемника, увеличивает принимаемую частоту, а направленный в противоположную сторону ее уменьшает.
В диагностических приложениях в медицине эффект Допплера используется как с ультразвуковым, так и с лазерным излучением. При этом ультразвуковые методы получили значительно более широкое распространение и являются основным предметом изложения данной книги.
1.2. Физические принципы ультразвуковой диагностики
Ультразвук - это неслышимые человеком звуковые волны с частотой 20 кГц. Как и обычные звуковые волны, ультразвук представляет собой колебательное движение частиц упругой среды, распространяющееся в виде волн в газообразной, жидкой или твердой среде. В отличие от электромагнитных волн, в частности рентгеновских лучей, которые широко применяются в медицинской диагностике, ультразвуковые волны распространяются в упругих средах, например в воде, мягких тканях. При распространении ультразвуковой волны частицы среды совершают колебания около положения равновесия. Если
направление этих колебаний совпадает с направлением распространения волны, то волну называют продольной. В случае колебания частиц среды в направлении, перпендикулярном направлению распространения волны, волну называют поперечной. В ультразвуковой диагностике используют энергию продольных волн, так как поперечные волны чрезвычайно быстро затухают в биологических средах.
Колебания частиц среды, сопровождающие процесс распространения упругой ультразвуковой волны, приводят к образованию зон сжатия и разрежения. Расстояние между двумя соседними зонами разрежения или сжатия называется длиной волны А. Частота колебаний волны f определяется как число полных циклов колебаний за единицу времени. Один цикл колебаний в секунду определяется как один герц. В зависимости от частоты колебаний упругие волны подразделяют на инфразвуковые (частоты ниже 20 Гц), звуковые (частоты от 20 Гц до 20 кГц), ультразвуковые (частоты от 20 кГц до 1000 МГц) и гиперзвуковые (частоты выше 1000 МГц).
Одной из особенностей ультразвуковых волн, способствующей их широкому применению в диагностических целях, является возможность сравнительно просто ориентировать волны в определенном направлении путем концентрации их в узком пучке. В медицинской диагностике используют частоты ультразвуковых волн в диапазоне от 1 до 10 МГц, причем более низкие частоты 1-2 МГц применяются для обследования структур головного мозга, частоты 2-5 МГц при абдоминальных обследованиях, 5-10 МГц в офтальмологии, ангиологии и при обследовании малых органов.
Одним из основных параметров ультразвуковой волны является скорость распространения в среде, которая определяется как расстояние, проходимое волной за единицу времени. Зависимость между скоростью С, частотой f и длиной ультразвуковой волны ![]() определяется соотношением:
определяется соотношением:
![]()
где С - скорость распространения волны, f- частота колебаний, ![]() - длина волны, Т- период колебаний.
- длина волны, Т- период колебаний.
Анализ процессов распространения ультразвуковых волн в различных биологических средах показал, что каждой среде соответствует определенное значение скорости, причем оно практически не зависит от частоты ультразвука. Используя данное положение, можно определить расстояние (S), проходимое ультразвуковой волной в среде, измерив время распространения (t):
![]()
В табл. 1 приведены значения скоростей для различных сред при температуре 36°С.
Некоторые отличия в значениях скоростей ультразвука для одних и тех же биологических сред, приводимые в работах различных авторов, объясняются температурной зависимостью скорости, которая, как правило, не учитывается при подготовке табличных данных.
Таблица 1. Скорость распространения ультразвука в различных средах
|
Среда |
Скорость, |
Среда |
Скорость, |
Среда |
Скорость, |
Среда |
Скорость, |
|
|
м/с |
|
м/с |
|
м/с |
|
м/с |
|
Воздух |
330 |
Вода |
1520 |
Печень |
1549 |
Кровь |
1570 |
|
Лёгкое |
1160 |
Мягкие ткани |
1540 |
Почка |
1561 |
Мышца |
1585 |
|
Жир |
1450 |
Мозг |
1541 |
Сердце |
1568 |
Кость |
4080 |
Анализ данных, приведенных в табл. 1, показывает, что скорость распространения ультразвука в тканях и органах (за исключением легких и костей) изменяется незначительно. Это позволило при конструировании и калибровке ультразвуковой диагностической аппаратуры принять за среднее приближенное значение скорости распространения ультразвука величину 1540 м/с. Таким образом, зная время прохождения ультразвука через определенную ткань или орган тела человека, можно определить размеры данного органа, используя формулу (2). Данная возможность заложена в конструкции всех современных ультразвуковых диагностических систем.
Физические характеристики среды, которые определяют скорость распространения в ней ультразвуковых волн в предположении постоянной температуры, - это упругость (эластичность) и плотность. Для продольных волн в твердых средах мерой упругости является модуль Юнга Е. Плотность среды![]() - это масса на единицу объема вещества. Следующее соотношение определяет зависимость между скоростью ультразвука в среде и ее физическими характеристиками:
- это масса на единицу объема вещества. Следующее соотношение определяет зависимость между скоростью ультразвука в среде и ее физическими характеристиками:
![]()
Из соотношения (3) следует, что с увеличением плотности среды скорость ультразвука в ней уменьшается. В то же время из анализа данных, приведенных в табл. 1, прослеживается обратная зависимость - наибольшее значение скорость ультразвука имеет в кости и наименьшее в воздухе. Это объясняется тем, что модуль Юнга для сред с высокой плотностью имеет также очень высокое значение.
Распространение ультразвуковой волны в среде сопровождается тепловыми эффектами, что свидетельствует о переносе энергии. Для характеристики энергетических свойств ультразвуковой волны используется такой параметр, как интенсивность - количество энергии, проходящей через единицу площади, перпендикулярной направлению распространения волны, за единицу времени. Измеряется интенсивность в ваттах на квадратный сантиметр - Вт/см2 или в мВт/см2, так как среднее значение интенсивности в задачах ультразвуковой медицинской диагностики находится в диапазоне от 0,1 до 100 мВт/см2.
Знание абсолютных значений интенсивности ультразвука особенно важно при оценке биологических эффектов, возникающих в организме при распространении ультразвуковой волны. В то же время при работе с ультразвуковой аппаратурой при сравнении значительно отличающихся интенсивностей более удобным является применение относительных значений, выраженных в децибеллах (дБ). При сравнении двух интенсивностей l1 и l2 их отношение ![]() в дБ определяется из следующего выражения:
в дБ определяется из следующего выражения:
![]()
При распространении ультразвуковой волны и отражении ее от различных неоднородностей для оценки падающей и отраженной составляющих волны используются их амплитуды Аn и А0. Интенсивность пропорциональна квадрату амплитуды, что позволяет применять следующую формулу при определении
выраженного в дБ отношения интенсивностей падающей и отраженной волн:
![]()
Как уже отмечалось, при падении ультразвуковой волны на границу раздела двух сред с разными акустическими характеристиками часть волны отражается от препятствия, а часть проходит в следующую среду (рис. 1). Сигнал, отраженный от границы, принято называть эхо-сигналом. Принципы регистрации эхо-сигналов и формирование на их основе изображений сечений исследуемых органов легли в основу построения аппаратуры для ультразвуковой медицинской диагностики.

Рис. 1. Геометрия распространения ультразвуковой волны при падении на границу двух сред (а - нормальное падение; 6 - падение под углом).
При падении ультразвуковой волны перпендикулярно границе раздела доля отраженной энергии зависит от значений (в обеих средах) акустической характеристики, которая называется волновым сопротивлением среды. Поскольку волновое сопротивление среды для плоских волн представляет собой удельный импеданс, то в прикладных областях акустики часто при описании явлений отражения используют в том же значении термин «акустический импеданс среды» или для краткости «импеданс» (подчеркнем, что на самом деле акустический импеданс - более сложное понятие, чем волновое сопротивление среды). Акустический импеданс среды Z определяется (с отмеченными оговорками) как произведение плотности среды ![]() и скорости ультразвука в данной среде С:
и скорости ультразвука в данной среде С:
Z = ![]() C. (6)
C. (6)
В табл. 2 приведены значения импеданса для некоторых типичных биологических сред.
Таблица 2. Значения акустического импеданса для основных биологических сред
|
Среда |
Акустический импеданс, кг/(м2с) |
Среда |
Акустический импеданс, кг/(м2с) |
|
Воздух |
0,00046 |
Почка |
1,62 |
|
Жир |
1,38 |
Печень |
1,65 |
|
Вода |
1,54 |
Сердце |
1,66 |
|
Мозг |
1,58 |
Селезёнка |
1,69 |
|
Кровь |
1,61 |
Кость |
7,80 |
Незначительные отличия между значениями акустических импедансов большинства мягких тканей человека способствуют распространению ультразвуковых волн в заданном направлении. Величина образующегося эхо-сигнала определяется не только импедансами граничащих сред, но и углом падения ультразвуковой волны на границу раздела. В случае нормального (перпендикулярного) падения (рис. 1а) эхо-сигнал отразится в направлении источника ультразвуковой волны, а часть волны, прошедшая в следующую среду, продолжить свой путь по первоначальному направлению, без отклонения. Эхо-сигнал, образующийся в данном случае, получил название «зеркального» эхо-сигнала. В случае падения ультразвуковой волны под произвольным углом![]() , отличным от нормального, направления отраженной и прошедшей в среду волн изменяются (рис. 16) Отраженная волна отражается под углом
, отличным от нормального, направления отраженной и прошедшей в среду волн изменяются (рис. 16) Отраженная волна отражается под углом ![]() , который равен углу падения а, а прошедшая волна преломляется под углом у. Угол зависит от соотношения скоростей распространения ультразвука С1 и С2 в первой и во второй средах и определяется из соотношения Снелля:
, который равен углу падения а, а прошедшая волна преломляется под углом у. Угол зависит от соотношения скоростей распространения ультразвука С1 и С2 в первой и во второй средах и определяется из соотношения Снелля:
![]() (7)
(7)
Как отмечалось ранее, частота ультразвука остается постоянной в процессе распространения, отсюда с учетом соотношения (1) следует, что изменение скорости ультразвука при переходе границы между средами вызывает не только изменение направления ультразвуковой волны, но и соответствующее изменение длины волны А. Данное обстоятельство является причиной возможных артефактов, проявляющихся на сформированном ультразвуковом изображении.
Интенсивность падающей волны l0, отраженной волны lr и прошедшей волны ld связаны соотношением

или
Отношение lг/l0 называется коэффициентом отражения R1, который характеризует часть энергии ультразвуковой волны, отраженной от препятствия Отношение ld/l0 называется коэффициентом пропускания D1 который характеризует часть ультразвуковой энергии, прошедшей в граничную среду. Зная акустические импедансы граничных сред Z1 и Z2, можно определить коэффициент отражения из следующего соотношения:
![]()
![]()
Учитывая, что интенсивность пропорциональна квадрату амплитуды ультразвуковой волны, можно получить выражение для коэффициента отражения по амплитуде RA:
Если две среды имеют одинаковый акустический импеданс, то Z2- Z1 = 0, и в этом случае падающая ультразвуковая волна полностью без отражений проходит в граничную среду. Данное явление учитывается при конструировании ультразвуковых датчиков, в которых внешняя поверхность, контактирующая с телом пациента и называемая согласующим слоем, подбирается по значению акустического импеданса поверхностных тканей человека. Также одним из требований к контактной среде, которая наносится на поверхность датчика или на кожу пациента перед обследованием, является соответствующее значение акустического импеданса, близкое по значению к акустическому импедансу кожи пациента. Выполнение данного требования является одним из условий, позволяющих получить ультразвуковое изображение при минимальной мощности ультразвукового излучения.
Воспользовавшись данными табл. 2 для воды и для воздуха, можно определить, что коэффициент отражения от границы между данными средами близок к единице. Это свидетельствует о практически полном отражении ультразвука на границе вода-воздух, т. е. воздух является серьезным препятствием на пути распространения ультразвуковой волны, что следует принимать во внимание при установке датчика на поверхности тела пациента и при обследовании воздухсодержащих органов.
Следует отметить, что выражения (10) и (11) справедливы только для случая нормального падения ультразвуковой волны. При падении ультразвука под произвольным углом а в расчетах следует учитывать величину данного угла.
Во взаимодействии, показанном на рис. 16, звуковая волна с амплитудой А, падает под углом а к поверхности раздела между двумя средами с акустическими импедансами Z1 и Z2. При этом часть волны отражается, а часть проходит Отраженный компонент имеет амплитуду Аr:
![]()
Прошедший компонент амплитуды Аt выражается уравнением
![]()
Таким образом, взаимодействие между звуковой волной и плоской поверхностью раздела может полностью характеризоваться изменением акустического импеданса (или акустическим рассогласованием) на поверхности раздела и углом падения волнового пучка. В результате рассогласования акустического импеданса возрастает амплитуда отраженного компонента. Более того, отраженная волна будет возвращаться обратно к источнику-приемнику, только когда угол падения нормален к поверхности. На практике поверхности раздела между тканями организма человека редко абсолютно плоские, и неровность поверхности создает углы отражения, не равные углам падения. Кроме того, в реальной ситуации падающая волна сжатия будет занимать ограниченную ширину пучка, которая непрерывно расходится из-за дифракционных эффектов поверхности.
Взаимодействие ультразвука с потоком крови еще более сложно, если учесть, что кровь человека состоит из жидкой плазмы, в которой взвешены частицы-эритроциты, лейкоциты, тромбоциты и др. Эритроцит является гибким двояковогнутым диском, имеющим средний диаметр 7 мкм и среднюю толщину 2 мкм. Средний объем эритроцита приблизительно 90 мкм3 и в одном кубическом миллиметре находится приблизительно 5 х 106 эритроцитов. Принимается, что эритроциты являются главным источником рассеяния ультразвука, так как лейкоцитов (хотя они гораздо больше эритроцитов) относительно мало в крови (7,5 х 103 мм-3), а тромбоциты, чья концентрация гораздо больше (3,5 х 105 мм-3), гораздо меньше эритроцитов по размеру.
В основе всех ультразвуковых диагностических приборов для определения гемодинамических параметров сердечно-сосудистой системы человека лежит эффект Допплера который заключается в том что если сам приемник движется относительно источника звуковых волн и направление движения совпадает с направлением распространения волн, то детектируемая приемником частота f отличается от частоты ft, передаваемой источником
![]()
Здесь vr- скорость перемещения приемника относительно источника Знак «+» будет в случае, если приемник движется к источнику, знак «-» - от источника. Частота допплеровского смещения fd или резонансная частота) определяется как разность между принятой частотой fr и переданной ft что дает выражение
![]()
При оценке реального допплеровского смещения частоты учитывается также угол в между направлением вектора скорости приемника и направлением излучения волны от ультразвукового датчика:
![]()
На практике обычно источник и приемник конструктивно совмещены в одном преобразователе (датчике), а измерение частотного сдвига выполняется для движущегося отражающего объекта. В этом случае (поскольку ультразвук проходит двойное расстояние между источником и отражателем) частотный сдвиг определяется выражением
![]()
При движении отражающего элемента со скоростью vr в направлении от датчика частота принимаемой датчиком отраженной волны уменьшается на величину, определяемую вышеприведенной формулой, а при движении в направлении к датчику – увеличивается.
Реально на практике исследуемый объем представляет собой не одну отражающую мишень, а их композицию, которая формирует суммарный вклад в допплеровский сдвиг. При этом каждый из элементов, входящих в композицию, может иметь свою скорость перемещения. Поскольку скорость движения отдельных элементов крови изменяется в течение сердечного цикла, то отраженный сигнал содержит изменяющийся во времени набор (спектр) допплеровских частот.
В результате задача получения объективной информации о скорости движения кровотока в исследуемом объеме сводится к следующим основным этапам выбор участка тела, на который устанавливается источник ультразвуковых колебаний (ультразвуковой датчик), используемый для получения информации о допплеровском сдвиге; ориентация датчика по углу в для получения приходящего сигнала с максимальной амплитудой; локализация глубины залегания исследуемого объема для выделения сигнала допплеровского сдвига соответствующей зоны интереса на фоне сигналов от других движущихся объектов, расположенных на пути распространения ультразвуковой волны; анализ сигнала, принятого от исследуемого объема во временной и частотной области, для определения скоростей движения отдельных отражающих элементов в течение сердечного цикла.
1.3. Основные принципы построения допплеровской аппаратуры
Для технической реализации отмеченных этапов разработчиками были последовательно созданы несколько поколений ультразвуковых допплеровских приборов: с непрерывным излучением (CW - continuous wave) без выделения направления кровотока (простейшие индикаторные приборы); с выделением направления - разделением прямого и обратного кровотока и получением графического отображения кривой (огибающей) усредненной по объему скорости кровотока; с импульсным излучением (PW- pulsed wave) для локализации по глубине исследования; со спектральным анализом информации - для получения частотного и временного распределения скоростей в исследуемом объеме.
Для построения приборов непрерывного и импульсного излучения используется ряд известных радиотехнических электронных узлов и блоков, разработанных с учетом специфики взаимодействия с электроакустическим элементом допплеровского прибора - ультразвуковым датчиком.
Блок-схема непрерывноволнового допплеровского прибора показана на рис 2. Задающий генератор 1 вырабатывает синусоидальную волну, поступающую на усилитель мощности 2 и далее на передающий пьезоэлемент 3, который создает непрерывную ультразвуковую волну 4. Отражаясь от движущихся в кровеносном сосуде 5 форменных элементов крови 6, ультразвуковая волна поступает на приемный пьезоэлемент 7 и далее на вход предусилителя 5 с малым уровнем шума, который усиливает слабые отраженные сигналы до уровня их детектирования демодулятором 9. На выходе демодулятора сигнал имеет форму допплеровской разностной волны с частотой ![]() fd.
fd.
Главным недостатком измерителя потока крови с непрерывным излучением ультразвука является отсутствие разрешения по дальности. Любая движущаяся цель, попадающая в зону диаграммы направленности ультразвукового датчика, будет вносить вклад в окончательный допплеровский выходной сигнал. В результате во время клинического использования таких приборов не всегда представляется возможным выделить потоки крови в соседних сосудах. А селективность по дальности иногда может быть главным требованием в допплеровских исследованиях.

Рис. 2. Блок-схема непрерывноволнового допплеровского прибора.
1 - задающий генератор;
2 - усилитель мощности;
3 - передающий пьезоэлемент;
4 - ультразвуковая волна;
5 - кровеносный сосуд;
6 - эритроциты;
7 - приемный пьезоэлемент;
8 — предусилитель;
9 - демодулятор.
Наиболее простым методом кодирования ультразвуковой волны является амплитудная модуляция непрерывных колебаний. В приборе, известном как импульсный допплеровский анализатор скорости кровотока, короткие импульсы ультразвука передаются с регулярными интервалами на движущуюся цель, а отраженные сигналы исследуются для определения допплеровских сдвигов частоты
Импульсный допплеровский прибор объединяет возможности разрешения по дальности и детектирования допплеровских эхо-сигналов. Как и у любой эхо-импульсной системы, в основу работы прибора положен принцип передачи коротких импульсов волн на цель и последующего ожидания возвращения отраженных сигналов. Так как звуковые волны проходят сквозь человеческую ткань с примерно постоянной скоростью, задержка времени между передачей импульса и приемом отраженных сигналов зависит от дальности цели. Когда отраженные сигналы обрабатываются для получения допплеровских сдвигов, результирующий допплеровский сигнал может возникать только от целей, движущихся внутри «объема выборки», соответствующей выбранной задержке времени. В любой момент после передачи импульса объем выборки может быть определен как область, расположенная перед преобразователем, в которой должны возникать все возвращающиеся отраженные сигналы. Размеры объема выборки определяются в осевом направлении длительностью импульса, принимаемого приемником, а в поперечном - шириной пучка объединенной системы передатчик-приемник. Используя выборку только тех допплеровских компонентов, которые после передачи возвращаются с существующей постоянной задержкой, возможно, определить положение фиксированного объема выборки и, таким образом, опросить только цели, движущиеся на определенной дальности от преобразователя.

Рис. 3. Блок-схема импульсного допплеровского прибора. 1 - задающий генератор 2 - селектор передачи; 3 - усилитель мощности 4 - генератор импульсов: 5 — предусилитель; 6 - селектор по дальности: 7 - когерентный демодулятор" 8 - селектор задержки, 9 - схема выборки хранения 10 - полосовой фильтр. 11 - датчик; 12 - выбранная дальность; 13 - объем выборки.
На рис 3 представлены основные узлы эхо-импульсной допплеровской системы. Задающий генератор вырабатывает синусоидальную волну на резонансной частоте преобразователя. Один раз за каждый период повторения импульса несколько периодов задающего колебания проходят через селектор передачи и усилитель для преобразования Селектор задержки вырабатывает временную задержку, которая, позволяет пачке переданных ультразвуковых колебаний проходить на выбранную дальность и возвращаться обратно. Затем возвращающиеся отраженные сигналы дискретизируются посредством открытия селектора по дальности и подачи на когерентный демодулятор, который управляется задающим генератором. Каждый отселектированный по времени отраженный сигнал вызывает короткий выходной импульс демодулятора, который формирует часть отсчитанного выходного сигнала допплеровского прибора. В случае необходимости эти отсчеты могут собираться (например, в схеме выборки-хранения) до прихода следующего переданного импульса. Этот так называемый метод с «запоминанием отсчета» позволяет получать выходной сигнал более сглаженной формы, который затем может быть отфильтрован для устранения каких-либо компонентов остающихся от частоты повторения импульсов, а также для устранения мешающих низкочастотных эхо-сигналов. К недостаткам эхо-импульсных допплеровских приборов следует отнести:
дальностно-скоростные ограничения, выражаемые формулой
![]()
где vmax - максимальная скорость цели. Smax - максимальная дальность цели, С - скорость распространения ультразвука, f0 - частота излучения ультразвука; большое отклонение максимальной от средней излучаемой мощности (интенсивности). Поскольку средняя интенсивность строго определяет чувствительность системы и есть подтверждения того, что ультразвук высокой интенсивности может оказывать определенное воздействие на человеческую ткань, то характеристика сигнал/шум, а следовательно, чувствительность импульсной допплеровской системы строго ограничивается условиями безопасности пациента.
В соответствии с эффектом Допплера каждой скорости движения элементов кровотока соответствует допплеровский сигнал определенной частоты, поэтому формирование распределения допплеровских скоростей элементов кровотока сводится к выявлению набора частотных составляющих в сигнале, т.е. к спектральному анализу сигнала. При выполнении спектрального анализа формируется распределение допплеровских скоростей элементов кровотока. Спектральный анализ осуществляется путем использования набора («гребенки») фильтров, равномерно делящих частотный диапазон сигнала. При этом каждый фильтр выделяет узкий участок спектра сигнала, и чем уже частотная характеристика фильтра (соответственно увеличивается общее число фильтров для охвата полного частотного диапазона сигнала), тем лучше разрешение по частоте. Для получения приемлемого спектрального разрешения допплеровских сигналов число фильтров должно быть достаточно велико. Поэтому использование спектрального анализа а допплеровских приборах стало возможным только с появлением малогабаритных устройств цифровой обработки сигналов - цифровых спектроанализаторов.
В цифровом спектроанализаторе формирование спектральных составляющих сигнала выполняется цифровым способом на основе реализации эффективного в вычислительном отношении алгоритма быстрого преобразования Фурье (БПФ) Перед выполнением спектрального анализа сигнала в цифровой форме осуществляется преобразование выходного сигнала приемного тракта в последовательность цифровых кодов с помощью аналого-цифрового преобразователя. Далее отсчеты сигнала накапливаются в буферной памяти.

После накопления последовательности отсчетов сигнала выполняется вычисление спектра сигнала с помощью алгоритма БПФ.
Рис. 4. Блок-схема допплеровского прибора со спектральным анализом
При реализации алгоритма БПФ размера N из последовательности N отсчетов входного сигнала выполняется вычисление N спектральных составляющих. При увеличении размера БПФ улучшается спектральное разрешение сигнала. Однако на практике размер БПФ обычно не превышает величины 256, Связано это не только с увеличением объема вычислений Накопление большого количества отсчетов сигнала (N) приводит к ухудшению временного разрешения допплерограммы, что проявляется в размывании спектральных составляющих на допплерограмме вдоль оси времени
Современная допплеровская система со спектральным анализом выполняет следующие основные функции формирование зондирующих сигналов; прием эхо-сигнала и выделение допплеровских смещений; формирование звуковых сигналов прямого и обратного кровотока, формирование допплерограммы и отображение ее в реальном масштабе времени на экране монитора; вычисление параметров и индексов кровотока.
Реализацию вышеперечисленных функций рассмотрим на примере допплеровской системы «Сономед-300», блок-схема которой приведена на рис 4
Допплеровская система включает в себя: ультразвуковой датчик импульсного излучения 2 МГц; ультразвуковые датчики непрерывного излучения 4 и 8 МГц; передатчик, приемник; цифровой спектроанализатор; управляющий компьютер (совместимый с персональным PC).
Передатчик генерирует электрический сигнал возбуждения датчиков. В датчике электрический сигнал преобразуется в механические колебания пьезоэлектрической пластины, которые и передаются на тело пациента.
Эхо-сигналы от внутренних структур тканей, поступающие на датчик, преобразуются с помощью пьезоэлектрической пластины датчика в электрические колебания.
Приемник путем смешения сигнала возбуждения с эхо-сигналом и последующей фильтрации выделяет допплеровский сигнал кровотока, который поступает затем на цифровой спектроанализатор. После дополнительной обработки с помощью фазосдвигающих цепей, выполняющих разделение сигналов прямого и обратного кровотока, и усиления этот сигнал выдается на громкоговорители для звукового воспроизведения.
В цифровом спектроанализаторе выполняется преобразование допплеровского сигнала в цифровую форму, после чего производится вычисление спектра допплеровского сигнала.
Сформированные спектральные линии накапливаются в видеопамяти управляющего компьютера и выдаются на экран монитора. Кроме формирования изображения управляющий компьютер обеспечивает интерфейс с пользователем для задания режимов работы прибора, выполняет расчет параметров кровотока, накопление результатов измерений на магнитных носителях, регистрацию результатов с помощью внешних печатающих устройств.
1.4. Основные этапы развития допплеровских методов
На первом этапе создания ультразвуковых допплеровских приборов были разработаны простейшие приборы с непрерывным излучением и представлением информации допплеровского сдвига в виде звуковых сигналов через встроенный в прибор динамик. В дальнейшем совершенствование элементной базы и новые методические подходы позволили менее чем за два десятилетия достичь уровня технических решений, которые в наиболее полной мере отвечают функциональным задачам потребителя (табл. 3).
Появление в начале 80-х годов приборов с цветовым картированием потоков (CFM - color flow mapping) позволило потребителю успешно решать задачи локализации исследуемого сосуда по направлению и глубине, детектировать направление потоков с помощью специальных цветовых шкал, производить объективную оценку как интегральных скоростей потоков, так и распределений в частотно-временной области на основе спектрального анализа, выполнять вычисление объемных показателей скоростей потоков в выбранном сечении сосуда.
На сегодняшний день допплеровские методы стали неотъемлемым элементом практически во всех областях клинического применения ультразвуковой диагностики. Подтверждением этого факта являются данные клинических исследований, приведенные в следующих главах книги.
Определенных успехов в разработке современных ультразвуковых допплеровских приборов достигли и отечественные разработчики.
Первые серийные образцы простейших приборов с непрерывным излучением «ИСКН» были созданы в конце 70-х годов [5]. В дальнейшем появились приборы «Диск» с выделением направления потоков и простейшей компьютерной обработкой [6].
На новый качественный уровень вывела отечественные разработки научно-производственная кооперация ВНИИ медицинского приборостроения и французской фирмы DMS.
Таблица 3. Основные достижения в области создания ультразвуковой допплеровской аппаратуры [20]
|
Достижение |
Год |
Ранние ссылки (авторы) |
|
Описание эффекта Допплера |
1842 |
Doppler (1843) |
|
Первые сообщения о применениях в медицине |
1956 |
Satomura (1956), Franklin et al. (1961, 1963) |
|
Допплеровские системы с выделением |
1966 |
Pourcelot (1966), |
|
направлении |
|
McLeod (1967), Gross, Light (1971) |
|
Импульсные допплеровские системы |
1967 |
Wells (1969), Baker (1970) |
|
Мультистробируемые системы |
1970/75 |
Baker (1970), Keller et al. (1976), Brandestini (1978), Nowicki& Reid (1972) |
|
Допплеровская визуализация |
1971 |
Mozersky et al. (1971), Reid & Spencer (1972), Fish (1975) |
|
Дуплексные эхо-импульсные системы |
1974 |
Barber et al. (1974), Phillips et al. (1980) |
|
Цветовое допплеровское картирование |
1979/82 |
Pourcelot (1979), |
|
в режиме реального времени |
|
Eyeretal. (1981) Namekawa et al. (1982) |
|
Транскраниальная допплерография |
1982 |
Aaslid (1982) |
|
Энергетический допплер, допплеровская |
1994 |
Arenson (1994) |
|
тканевая визуализация |
|
|
С 1989 г. в рамках лицензионного соглашения было освоено производство приборов «Ангиодоп», создано оригинальное программное обеспечение [7], освоена технология производства ультразвуковых допплеровских датчиков (рис. 5).

Рис. 5. Прибор Angiodop-2 для исследования периферического кровообращения совместного российско-французского производства (ВНИИ МП-DмS).

Рис. 6. Модель С-300 - базовая система семейства ультразвуковых допплеровских приборов «Сономед» фирмы «Спектромед» (Россия).

Рис. 7. Двухканальный ультразвуковой допплеровский диагностический комплекс «Биомед» фирмы «Биосс» (Россия).
Значительно расширить функциональные возможности приборов и повысить их эксплуатационные характеристики позволило активное применение современных компьютерных технологий, передовой электронной элементной базы, единых унифицированных решений. В 1992-1994 годах было разработано семейство приборов «Сономед» [8], которое на основе модульного принципа построения позволило реализовать полный спектр допплеровских приборов - от простейших (с непрерывным излучением) до приборов с визуализацией потоков (рис. 6). Отечественные спектральные анализаторы допплеровских сигналов по своим функциональным возможностям стали сравнимы с зарубежными аналогами.
Передовые технические решения были реализованы в серии приборов «Биомед» [9], которые позволили осуществить режим мониторинга при интракраниальных обследованиях, реализовали режим двухканальной визуализации спектров, расширили диапазон ультразвуковых датчиков до 16 МГц, обеспечили возможность детектирования эмболов (рис. 7).
Разработанная допплеровская аппаратура создает достаточную техническую базу для проведения полного спектра экстра- и интракраниальных обследований, методика выполнения которых представлена в следующих главах книги.
Для эффективного применения аппаратуры на практике необходимо знание основных принципов работы допплеровского прибора, его режимов и функциональных возможностей.
2. Электроакустические принципы построения допплеровских приборов
2.1. Основные критерии оценки допплеровской информации
Ультразвуковой допплеровский прибор представляет собой локационное устройство, принцип работы которого заключается в излучении зондирующих сигналов в тело пациента, приеме и обработке эхо-сигналов, отраженных от движущихся элементов кровотока в сосудах. Функционирование допплеровского прибора аналогично работе любого другого локационного устройства движущихся объектов для самых различных применений, например радиолокатора обнаружения и сопровождения самолетов, сонара для определения перемещения подводных лодок и пр.
Особенность ультразвукового прибора состоит в использовании в качестве зондирующего сигнала механических колебаний, передаваемых в тело человека.
Возбуждение ультразвуковых колебаний и прием эхо-сигналов при работе допплеровского прибора выполняется датчиком, в состав которого входит один или несколько ультразвуковых преобразователей. Ультразвуковой преобразователь представляет собой пластину из пьезоэлектрического материала и предназначен для преобразования поступающих на него электрических сигналов в ультразвуковые волны при излучении зондирующего сигнала и, соответственно, для обратного преобразования ультразвуковых волн в электрические сигналы в процессе приема эхо-сигналов.
Широкий спектр ультразвуковых исследований сосудов современным допплеровским прибором обеспечивают за счет применения датчиков различного назначения, отличающихся характеристиками излучаемого ультразвука (непрерывным или импульсным типом излучения, интенсивностью и частотой излучения), а также конструктивными параметрами (датчики для скрининговых обследований, датчики со специальными держателями для мониторинга, плоские датчики для хирургических применений).
При работе допплеровского прибора ультразвуковая волна излучается в мягкие ткани, после чего осуществляется прием и анализ отраженных эхо-сигналов от движущихся в кровеносных сосудах элементов крови (главным образом эритроцитов). Ультразвуковой допплеровский прибор выделяет допплеровские частоты следующим образом. Принимаемый эхо-сигнал смешивается с сигналом генератора, формирующего сигнал излучения, и в результате последующей фильтрации в приемном устройстве выделяется разность частот между этими сигналами, которая и есть допплеровская частота.
Для скоростей движения в системе кровообращения человека и используемых частот излучения допплеровские частоты находятся в звуковом диапазоне. Так, движения стенок сосудов и сердца производят допплеровское смещение в диапазоне от 0 до 1200 Гц. В норме кровоток вызывает допплеровское смещение в диапазоне от 0 до 5 кГц, при нарушениях кровотока возникает смещение в диапазоне 5-20 кГц.
Поскольку человеческое ухо способно хорошо различать вышеуказанные частоты сигналов в присутствии широкополосных шумов, то допплеровские приборы снабжаются громкоговорителями для звукового воспроизведения допплеровских сигналов.
За счет реализуемой в приемном устройстве квадратурной обработки сигналов обеспечивается разделение положительных и отрицательных допплеровских смещений. При этом положительные допплеровские смещения обусловлены структурами, движущимися в направлении к датчику, а отрицательные смещения - движением структур от датчиков. Для раздельного воспроизведения сигналов прямого и обратного (по отношению к датчику) кровотока используется звуковая стереосистема.
Поскольку прием эхо-сигнала ведется не из одной точки, а из объема, захватываемого ультразвуковым лучом, то эхо-сигнал содержит спектр допплеровских частот, обусловленных движением отдельных элементов кровотока з анализируемом объеме. Поэтому для получения подробной информации о характере движения элементов кровотока в допплеровских приборах используют спектральный анализ сигналов.
Метод спектрального анализа позволяет получить распределение по скоростям элементов кровотока через однозначно связанное с ним частотное распределение допплеровских сигналов. Каждая частотная составляющая на выходе спектроанализатора соответствует определенной скорости движения элементов кровотока, причем амплитуда спектральной составляющей характеризует количество элементов кровотока в измерительном объеме, перемещающихся с данной скоростью.
Трехмерное изображение типичного спектра кровотока артерии представлено на рис. 8. В систоле максимум частотного спектра смещается в сторону высоких частот, а ширина спектра уменьшается. В диастоле наблюдается расширение спектра и смещение в область низких частот.
При отображении спектра допплеровских частот на экране монитора прибора амплитуда каждой допплеровской частоты обычно задается яркостью свечения или цветом. При этом спектр частот отображается в виде двухмерного графика - допплерограммы, у которого по вертикали проходит ось частот, а по горизонтали - ось времени. Амплитуда сигнала кодируется соответственно с помощью цвета.
Состояние кровотока оценивают как по качественным, так и по количественным характеристикам.
К качественным показателям относят: характер звукового допплеровского сигнала; форму допплерограммы; распределение частот в допплерограмме; направление кровотока.
Вид допплерограммы позволяет более точно оценить состояние кровотока, поскольку при нарушениях кровотока форма спектра претерпевает существенные изменения.
При наличии стеноза (сужение сосуда) на допплерограмме наблюдается увеличение максимальной скорости, изменение формы волны потока крови.
Количественная оценка кровотока производится как на основании непосредственно измеряемых параметров, так и с помощью рассчитываемых на их основе индексов. К непосредственно измеряемым параметрам кровотока относятся: максимальная систолическая скорость (S); скорость в конце диастолического цикла (D); средняя скорость за один сердечный цикл (М).
Однако необходимо помнить, что указанные параметры зависят от угла наклона датчика по отношению к направлению кровотока. На практике наклон датчика выставляют таким образом, чтобы получить максимальную насыщенность изображения спектра, которая достигается при значении угла около 45°. Далее это значение угла используют при расчете вышеуказанных параметров.

Рис. 8. Трехмерное представление спектре кровотока артерии.
Чтобы получить количественные параметры кровотока, не зависящие от угла наклона датчика, широко применяют специальные индексы: индекс сопротивления Rl = (S- D)/S (Pourcelot index - индекс Пурсело); систоло-диастолический индекс ISD = S/D (Stuart index - индекс Стюарта); индекс пульсации РI = (S - D)/M (Goesling index - индекс Гёслинга); процент стеноза STI.
2.2. Эксплуатационные параметры допплеровской системы
Эксплуатационные параметры допплеровской системы определяются способами реализации основных этапов формирования, обработки и отображения сигналов.
Качество эксплуатационных характеристик ультразвуковой допплеровской системы непосредственно связано с понятиями пространственного разрешения, разрешения по времени и скорости (допплеровской частоте).
Параметры зондирующих сигналов и способы обработки эхо-сигналов определяют следующие характеристики допплеровской системы: пространственное разрешение; глубину зондирования; вид допплерограммы.
Для получения качественной диагностической информации в допплеровской системе предусматривают управление параметрами тракта формирования зондирующего сигнала, приемного тракта и тракта формирования допплерограммы.
К основным параметрам допплеровской системы, которые могут изменяться оператором, относят: параметры зондирующего сигнала - тип излучения, мощность, частоту и длительность излучения; параметры обработки эхо-сигналов - усиление, характеристики фильтров шумов и мешающих отражений; параметры формирования допплерограммы.
В настоящем разделе изложен физический смысл методов формирования и обработки допплеровских сигналов кровотока, параметров допплеровской системы и их влияния на результаты исследований.
2.2.1. Параметры зондирующего сигнала
Поскольку зондирующий сигнал представляет собой ультразвуковую волну, то, как и в случае любого волнового процесса, при определении его характеристик используют следующие параметры: амплитуда сигнала А0; частота сигнала F0; период сигнала T0; скорость распространения сигнала С; длина волны ![]() .
.
Амплитуда А0 ультразвуковой волны характеризует интенсивность излучения. В допплеровском приборе предусматривается регулировка интенсивности излучения для обеспечения безопасности пациента. Например, исследование глазных артерий, как правило, проводят только при пониженной мощности излучения. Несмотря на то, что многочисленные исследования не выявили вредного воздействия ультразвука на пациента, мощность ультразвукового излучения допплеровского прибора обычно не превышает 100 мВт/см2.
Частоту зондирующей волны для конкретных типов обследований выбирают путем компромисса между противоречивыми требованиями высокого разрешения по скорости кровотока и большой глубины зондирования. Чем выше частота ультразвуковой волны, тем большие возможности по определению скорости могут быть обеспечены. Но при этом необходимо помнить, что затухание ультразвука в тканях сильно зависит от частоты. Для мягких тканей затухание ультразвукового сигнала составляет приблизительно 1 дБ/см/МГц. Поэтому на практике ультразвук с частотой порядка 8-10 МГц используют для исследования только поверхностных сосудов, для исследования же кровотока на большой глубине (в частности сосудов головного мозга, сердца) частота зондирующего сигнала составляет величину порядка 2 МГц.
На рис. 9 показан вид зондирующей ультразвуковой волны при непрерывном излучении. В режиме импульсного излучения ультразвуковая волна имеет пульсирующий характер и представляет собой пачку импульсов. Для описания импульсного зондирующего сигнала наряду с вышеперечисленными используют дополнительные параметры: длительность импульса T; частоту повторения импульсов PRF.
Длительность импульса Тj - это длительность излучения ультразвуковой волны; она влияет на пространственное разрешение по глубине и на разрешение допплеровских сигналов по частоте. Чем меньше длительность импульса излучения, тем лучше разрешение по глубине и, соответственно, хуже разрешение сигналов по допплеровской частоте и наоборот. В современных допплеровских приборах предусмотрено управление длительностью излучаемого импульса. Диапазон перестраиваемых значений длительности сигнала при этом расположен в пределах от 2 до 20 мкс.
Частота повторения импульсов PRF - это число периодов излучений в единицу времени. Частота повторения импульсов влияет на максимальную измеряемую глубину зондирования и максимальную анализируемую скорость кровотока. В случае увеличения частоты повторения импульсов возможен прием одновременно с нескольких участков глубины, т. е. уменьшается однозначно измеряемая глубина, но при этом увеличивается диапазон анализируемых допплеровских скоростей. Соответственно, при уменьшении частоты повторения импульсов однозначно измеряемая глубина увеличивается, а диапазон анализируемых допплеровских скоростей за счет эффекта наложения частот уменьшается.

Рис. 9. Виды зондирующей ультразвуковой волны. Р * - амплитуда сжатия, Р- - амплитуда растяжения, а - непрерывное излучение, б - импульсное излучение.
Каждый из методов зондирования имеет свои преимущества и недостатки, но при проведении допплеровских исследований оба метода - и непрерывный, и импульсный - эффективно дополняют друг друга.
2.2.2. Характеристика измерительного объема
Пространственное разрешение определяют как минимальное расстояние между элементами кровотока, при котором прибор может еще разделять поступающие от них допплеровские сигналы. Пространственное разрешение зависит как от конструктивных параметров датчика, так и от параметров зондирующего сигнала.
Характеристика пространственного разрешения тесно связана с понятием измерительного объема. Измерительный объем представляет собой область исследуемой ткани, попадающую в зону чувствительности прибора. Элементы - кровотока, находящиеся в пределах измерительного объема, формируют суммарный эхо-сигнал и не могут быть разделены. Поэтому, чем меньше измерительный объем, тем лучше пространственное разрешение.
Величина измерительного объема в продольном и поперечном сечении ультразвукового луча определяется разными параметрами прибора: размер зоны чувствительности в поперечном направлении зависит от геометрических размеров датчика, а в продольном направлении - от типа излучения и параметров зондирующего сигнала. Поэтому в характеристику пространственного разрешения обычно включают две составляющие - продольное (аксиальное) и поперечное (латеральное) разрешение.
Продольное разрешение представляет собой минимальное расстояние между движущимися элементами кровотока, находящимися на разной глубине вдоль луча, сигналы от которых могут быть еще разделены.
Разделение эхо-сигналов от элементов кровотока, находящихся на разной глубине, осуществляют по величине их временного запаздывания относительно момента излучения: от структур тканей, находящихся на близких расстояниях от датчика, отраженный эхо-сигнал проходит меньший путь и соответственно имеет меньшее временное запаздывание относительно момента излучения зондирующего сигнала, чем эхо-сигнал от более удаленных структур.
Поскольку в случае непрерывного излучения осуществляется одновременный прием эхо-сигналов от всех элементов кровотока, попадающих в зону чувствительности датчика, то не представляется возможным различить сигналы от структур находящихся на различной глубине вдоль луча. При этом понятие продольного разрешения не имеет смысла
Если излучается импульсный зондирующий сигнал длительностью Тj то для любой глубины зондирования измерительный объем Sv в продольном направлении ультразвукового луча имеет значение
Sv = СТj / 2. (18)
Таким образом, при уменьшении длительности зондирующего импульса увеличивается продольное разрешение. Однако необходимо отметить, что при разработке допплеровских приборов предусматривают уменьшение величины Тj, лишь до определенных пределов, связанных с ухудшением качества спектрального анализа допплеровских сигналов.
Поперечное разрешение представляет собой минимальное расстояние между движущимися элементами кровотока, находящимися в плоскости, перпендикулярной направлению пуча, от которых сигналы могут быть еще разделены. Поперечное разрешение определяют шириной диаграммы направленности датчика, которая в свою очередь зависит от конструктивных параметров датчика.
2.2.3. Прием и обработка эхо-сигналов
Для допплеровской системы полезными являются эхо-сигналы, формируемые в результате рассеивания излученной ультразвуковой волны элементами кровотока. Одновременно с полезными сигналами на приемный тракт допплеровской системы поступают гораздо более мощные (на 2-3 порядка) сигналы отражений от границ внутренних органов, в частности от стенок сосудов. Поэтому основной задачей приемного тракта допплеровской системы является не только выделение слабых допплеровских сигналов кровотока, но и подавление мощных мешающих отражений. При приеме эхо-сигнала и выделении допплеровских смещений выполняются следующие операции обработки сигналов: демодуляция допплеровских сигналов; фильтрация сигналов для выделения полосы анализируемых частот и устранение мешающих отражений от стенок сосудов; выделение и звуковое воспроизведение сигналов прямого и обратного кровотока.
При демодуляции допплеровских сигналов существенную часть энергии отраженного эхо-сигнала составляют отражения от границ органов, в частности отражения от стенок сосудов - лишь приблизительно 1/1000 части уровня отражений от стенок сосудов соответствуют эхо-сигналы, рассеиваемые элементами кровотока. Поэтому входной усилитель приемного тракта имеет большой динамический диапазон обработки сигналов (порядка 100 дБ).
После предварительного усиления производится демодуляция эхо-сигналов с целью выделения допплеровских смещений. Чтобы выделить допплеровские сигналы кровотока, достаточно использовать смеситель, на входы которого подаются сигнал возбуждения датчика и принимаемый эхо-сигнал. С помощью смесителя осуществляется частотный сдвиг принимаемого сигнала таким образом, что эхо-сигналы от неподвижных объектов будут иметь нулевую частоту, что существенно упрощает задачу их подавления. Сигналы от элементов кровотока после преобразования будут находиться в области звуковых частот.
Способ выделения допплеровских сигналов с помощью одного смесителя часто используется в простейших приборах, таких как детектор сердцебиений плода человека. Но в данном случае не представляется возможным выделить информацию о направлении кровотока.
Для получения информации о направлении кровотока применяется более сложный узел демодуляции, в состав которого входит дополнительный смеситель. На один из входов этого смесителя подается принимаемый эхо-сигнал, а на второй вход поступает сигнал, формируемый из сигнала возбуждения датчика путем фазового сдвига на 90°. При этом на выходе узла демодуляции формируются два квадратурных допплеровских сигнала, имеющих сдвиг по фазе 90°. Знак фазового сдвига между этими сигналами соответствует направлению допплеровского смещения относительно частоты излучения, т.е. направлению кровотока.
После частотного преобразования принимаемых эхо-сигналов выполняется низкочастотная фильтрация, причем полоса фильтра низких частот устанавливается в зависимости от анализируемого диапазона допплеровских частот.
В режиме импульсного излучения на этапе демодуляции дополнительно производится стробирование входного сигнала для выделения анализируемого участка глубины зондирования.
Движущиеся стенки сосудов производят мощные низкочастотные допплеровские сигналы, в 100 и более раз превышающие сигналы кровотока. Для устранения этих мешающих отражений в допплеровском приборе предусматривают фильтр высоких частот, обеспечивающий подавление низкочастотных сигналов. Необходимо отметить, что данный фильтр подавляет наряду с мешающими сигналами от стенок сосудов и низкочастотные составляющие сигналов кровотока. Поэтому в допплеровском приборе предусматривают несколько полос режекции фильтра высоких частот, что позволяет с учетом индивидуальных особенностей пациента и частоты излучения датчика устанавливать минимальную допустимую полосу режекции.
Звуковое воспроизведение допплеровских сигналов прямого и обратного кровотока осуществляют путем обработки квадратурных сигналов демодулятора с использованием фазосдвигающих цепей и сумматоров.
Поскольку после демодуляции допплеровские сигналы кровотока находятся в области звуковых частот, то для возможности их прослушивания используют обычную звуковую стереосистему или наушники. При этом в одном из громкоговорителей стереосистемы воспроизводятся сигналы прямого кровотока и одновременно в другом громкоговорителе - сигналы обратного кровотока.
2.2.4. Формирование допплерограммы и ее отображение
На этапе формирования допплерограммы выполняются следующие операции обработки квадратурных допплеровских сигналов: спектральный анализ; постобработка спектральных компонентов сигнала для выполнения сглаживания спектра и сжатия динамического диапазона спектра.
Перед выдачей спектральных отсчетов сигнала на экран монитора производится преобразование амплитудных значений спектральных отсчетов в значения цветовой или полутоновой палитры с помощью функции гамма-коррекции.
Постобработку спектра сигнала используют как дополнительное средство улучшения вида допплерограммы и выполняют по выбору оператора.
При сглаживании за счет дополнительной фильтрации спектральных составляющих устраняются артефакты, вызванные наличием шумов и внешних помех, однако при этом уменьшается детальность прорисовки допплерограммы.
Дополнительное сжатие амплитуд спектральных составляющих позволяет одновременно наблюдать энергетически мощные и слабые сигналы кровотока.
Получение качественных спектров кровотока для последующего расчета индексов является основной задачей допплеровского прибора. Влияние различных артефактов или некорректная установка основных управляющих параметров прибора могут значительно исказить спектр кровотока и, следовательно, привести к неправильному расчету индексов.
2.3. Ограничения допплеровского метода
Каждый из двух используемых в допплеровской системе режимов излучения имеет свои преимущества и недостатки, которые необходимо учитывать для выбора оптимального режима работы с системой.
Преимущества использования непрерывного излучения: 1) качественное выделение сигналов с малым уровнем шумов; 2) приемлемые характеристики, получаемые при небольшой мощности излучения; 3) отсутствие ограничений по величине измеряемой скорости кровотока.
Ограничения при использовании непрерывного излучения: 1) поскольку эхо-сигнал выделяется со всей глубины в пределах зоны чувствительности, то невозможно разделить сигналы от разных сосудов, попадающих в зону чувствительности прибора, а также невозможно оценить диаметр сосуда; 2) минимально возможная измеряемая допплеровская скорость ограничивается фильтром высоких частот, который используют для подавления мощных сигналов от медленно движущихся стенок сосудов; недостаточное подавление этих сигналов приводит к перегрузке приемного тракта; 3) при установленных нормах на безопасную для пациента мощность излучения кость является непреодолимым препятствием распространению ультразвука, что делает невозможным проведение транскраниальных исследований.
Преимущества использования импульсного излучения: 1) возможна точная установка измерительного объема на выбранной глубине, что делает возможным разделение сигналов от разных сосудов вдоль направления излучения, и в частности сигналов от близкорасположенных сосудов с разными направлениями кровотока; 2) поскольку для излучения и приема используют одну пьезокерамическую пластину, то ультразвуковой луч может быть более узким, чем в случае непрерывного излучения с использованием разделенного датчика.
Ограничения при использовании импульсного излучения: 1) наименьшая измеряемая допплеровская частота определяется характеристикой фильтра высоких частот, используемого для подавления мощных сигналов от медленно движущихся стенок сосудов; 2) максимальная измеряемая скорость определяется частотой повторения импульсов излучения.
Если скорость движения элемента кровотока превысит некоторое граничное значение, определяемое частотой повторения зондирующих импульсов, то за счет эффекта наложения частот соответствующее допплеровское смещение будет переноситься в область низких частот, что соответствует малой скорости движения. Иными словами, возникает неоднозначность при измерении скорости кровотока.
2.3.1. Ограничение максимальной анализируемой скорости кровотока
В случае непрерывного излучения нет практических ограничений на максимальную анализируемую скорость кровотока. При использовании же импульсного сигнала существует ограничение на максимальную скорость кровотока, связанное с дискретной природой сигнала. Для однозначного определения допплеровского сдвига необходимо, чтобы значение допплеровской частоты не превышало значения PRF/2 Природа этого ограничения получившего название эффекта наложения частот (aliasing effect), состоит в следующем, поскольку выборка (накопление) сигнала в режиме импульсного излучения производится в дискретные моменты времени, то не представляется возможным отследить колебания сигнала между выборками. Так, например, если сигнал между выборками проделывает целое число периодов колебаний, то к моменту текущей выборки его значение будет таким же, как на предыдущей выборке. При этом приемное устройство будет воспринимать сигнал как постоянный.
Если допплеровская частота кровотока превышает удвоенную частоту повторения импульсов, то имеет место неправильная интерпретация допплерограммы. Положительные допплеровские смещения, превышающие частоту PRF/2, отображаются в области отрицательных частот. Таким образом, для увеличения диапазона анализируемых частот в режиме импульсного излучения необходимо увеличивать частоту повторения импульсов. Однако нужно помнить, что увеличение частоты повторения импульсов может привести к неоднозначному определению глубины сосуда.
2.3.2. Неоднозначное определение глубины локализации
Как уже указывалось ранее глубина исследуемого сосуда определяется только в режиме импульсного излучения по величине временной задержки между моментом излучения и моментом прихода эхо-сигнала. В действительности имеет место неоднозначность измерения дальности, обусловленная приходом в заданное время одновременно с эхо-сигналом последнего излученного импульса от исследуемого элемента ткани эхо-сигналов предыдущих излученных импульсов от более глубоких слоев ткани. Однако вследствие затухания эхо-сигналы от более глубоких слоев значительно ослаблены, и при малой частоте повторения импульсов их влиянием можно пренебречь. Если же частота повторения достаточно высока, то допплеровская система будет воспринимать эхо-сигналы одновременно от двух и более участков ткани по глубине. В пределе, при увеличении частоты повторения импульсов, импульсный режим по характеристикам приближается к непрерывному режиму излучения при этом теряется понятие глубины, но нет ограничений на максимальную скорость кровотока.
2.3.3. Влияние величины измерительного объема на разрешение по скорости
Основное преимущество импульсной допплеровской системы по сравнению с системой непрерывного излучения - это точная локализация измерительного объема по глубине. При этом чем более короткий импульс излучения используют, тем большую точность определения глубины достигают. При этом возможность локализации измерительного объема увеличивается, возможность точного измерения скорости уменьшается. Таким образом, становится понятным, что каждый из двух используемых в допплеровской системе режимов излучения имеет свои преимущества и недостатки, которые необходимо учитывать для выбора оптимального режима работы с системой.
Правильный подбор параметров зондирующего сигнала, управление режимами обработки эхо-сигнала и оптимизация формы получаемой допплерограммы позволяют клиницисту получить графическое изображение частотно-временной спектрограммы, характеризующей распределение скоростей потоков в выбранном сечении исследуемого сосуда. В то же время система спектрального анализа не позволяет получить информацию о пространственном расположении исследуемого объекта, что препятствует объективизации данных о реальном диаметре сосуда. Это не позволяет объективно оценить объемные характеристики кровотока, которые являются одними из наиболее нужных показателей во многих медицинских приложениях допплеровского метода.
Устранить отмеченные принципиальные ограничения возможно только при совмещении режимов двухмерного сканирования (В-режим) с одновременным получением допплеровской информации (D-режим).
3. Допплеровские системы с двухмерной визуализацией
Существуют два возможных подхода к комбинированию допплеровской информации и информации двухмерного сканирования. Первый состоит в получении полутонового двухмерного изображения (В-режим) в реальном времени, определении зоны интереса и направлении в эту область одномерного допплеровского излучения. Такой подход известен как дуплексный режим.
Второй метод предусматривает формирование изображения потоков на основе оценки допплеровской информации в каждом из элементов выбранной двухмерной зоны интереса с одновременным цветовым кодированием получаемой информации в зависимости от направления потока. Данный подход получил название «метод цветового допплеровского картирования» - ЦДК (CFM - color flow mapping). Допплеровская информация, получаемая при этом методе, как правило, воспроизводится на экране прибора совместно с двухмерным полутоновым изображением для совместной оценки морфологии исследуемого сосуда, геометрии потоков и их функциональных характеристик. Одновременное формирование в режиме реального времени полутонового двухмерного изображения, информации ЦДК в выбранной двухмерной области и спектрограммы потока в зоне установленного строба получило название триплексного режима.
В данном разделе будут рассмотрены технические принципы, положенные в основу приборов, реализующих отмеченные выше подходы и режимы.
3.1. Дуплексные системы
Простейшая техническая реализация дуплексного режима состоит в механическом креплении под фиксированным углом допплеровского датчика к корпусу двухмерного сканирующего датчика. При этом обеспечивается синхронное, независимое функционирование каждого из датчиков. Допплеровский датчик обеспечивает как непрерывный (CW), так и импульсный режим (PW) работы. При этом направление излучения обозначается на экране выделенной линией, а зона интереса в импульсном режиме - двумя маркерами или стробом Дуплексный режим может быть реализован за счет использования в разнесенные временные интервалы одного и того же пьезокерамического преобразователя двухмерного датчика как в сканирующем, так и в допплеровском режиме. При этом к преобразователю предъявляются повышенные электроакустические требования, так как получение информации с одной и той же глубины требует в оптимальном режиме различных частотных характеристик сканирующего и допплеровского преобразователей. К примеру, в акушерской практике оптимальной частотой для получения двухмерных изображений является частота 3,5 МГц, в то время как для допплеровского исследования предпочтительной является частота 2 МГц
При конструировании дуплексных датчиков необходимо учитывать и геометрические требования. Как известно для получения двухмерного изображения сосуда оптимальным углом между ультразвуковым лучом и сосудом является 90°. В целях повышения частоты кадров для получения в дуплексном режиме двухмерного изображения было бы предпочтительным обеспечить одновременную во времени работу как двухмерного преобразователя, так и допплеровского датчика. На практике реализация данного условия представляется трудновыполнимой из-за невозможности надежного разделения приходящих на датчик эхо-импульсных сканирующих и допплеровских сигналов. Теоретически данная задача может быть решена при работе двух преобразователей на различных частотах.
В большинстве известных приборов компромиссное решение достигается за счет работы преобразователя большей части временного интервала в допплеровском режиме с регулярным обновлением двухмерного изображения с периодичностью 1-2 с. Также применяют режим полной остановки двухмерного изображения после выбора оптимального направления допплеровского излучения. Как правило, информацию о конкретной технической реализации не приводят в рекламе, предлагаемой на рынке аппаратуры. В результате требуется консультация с опытным экспертом для выбора прибора с оптимальной для заданных медицинских применений частотой формирования изображений.
Решение проблемы устранения артефактов наложения частот (aliasing) при работе в импульсном режиме с высокоскоростными потоками достигают за счет применения нескольких элементов в допплеровском излучателе Конструктивно данную задачу реализуют путем использования матричных излучателей.

Рис. 10. Варианты конструктивного исполнения дуплексных датчиков: а - секторный датчик с механическим креплением допплеровского канала; б - линейный датчик с механическим креплением допплеровского канала; в - электронный датчик со встроенным допплеровским каналом; г - электронный датчик с фазированной решеткой; д - совмещенный датчик с механическим сканированием; е - дуплексный датчик с водной задержкой. Штрихпунктирном показано направленное допплеровское излучение, пунктиром обозначена область сканирования.
Различные варианты конструктивного исполнения дуплексных датчиков приведены на рис. 10.
На рис. 10 а приведен простейший вариант крепления на корпусе двухмерного механического датчика независимого допплеровского излучателя. Данная конструкция является оптимальной с точки зрения развязки электроакустических параметров датчиков, но имеет меньшие возможности по изменению геометрии допплеровского излучения и временной синхронизации работы излучателей, а также создает некоторые конструктивные неудобства для пользователя. Такая конструкция была присуща первым образцам дуплексных систем и в настоящее время практически не встречается. Аналогичные преимущества и недостатки характерны для дуплексного датчика с электронным линейным сканированием (рис. 10 б, 10 в). Одним из его основных преимуществ является возможность получения большой зоны сканирования, что особенно важно при обследованиях в акушерстве. В то же время датчик с такой конструкцией совершенно непригоден для кардиологических применений, где доступ к исследуемому объекту ограничен межреберным пространством.
Наиболее универсальной по областям применения является конструкция электронного датчика с фазированной решеткой (рис 10 г) Каждый из элементов решетки может работать как в непрерывном, так и в импульсном режиме допплеровского излучения и в зависимости от временной последовательности управляющих импульсов изменять произвольно направление излучения (рис. 10 г).
При исследовании сердца возможно также использование совмещенного датчика с механическим сканированием (рис 10 д). Совмещение реализуется за счет многоэлементной конструкции, выполненной по анулярной технологии. Преимуществом данной системы по сравнению с фазированной решеткой является возможность получения улучшенных характеристик отношения сигнал/шум при сопоставимых интенсивностях излучаемых сигналов.
Дуплексный датчик с водной задержкой (рис 10 е) предназначен для исследования малых органов. Сканирующий элемент имеет частоту 7 или 10 МГц, частота допплеровского излучателя как правило, 5 МГц.
Приборы с режимом дуплексного сканирования позволяют успешно решать задачи пространственной локализации исследуемого сосуда и получать результаты спектрального анализа допплеровских частот в объективно определенной зоне интереса Определение размеров исследуемого сосуда по двухмерной эхограмме позволяет получить оценку объемных показателей кровотока
Для решения задачи получения «реальных» допплеровских изображений - получения двухмерной картины распределения значений скоростей кровотока в выбранном сечении - используются методы ЦДК.
3.2. Системы с цветовым картированием потоков
Первоначально системы позволяющие строить двухмерные распределения допплеровских скоростей в выбранном сечении, были реализованы в конце 70-х годов на основе позиционных X-Y-сканирующих систем с механическим перемещением одноэлементного допплеровского датчика Системы имели ограниченное применение Они были предназначены для исследования периферических сосудов и требовали значительного времени (от 30 с до 5 мин ) для построения изображения. Получаемое изображение восстанавливало профиль сосуда, но наличие шумовых составляющих из-за движений пациента не позволяло адекватно оценить направление движения потоков и их интенсивность. В силу своего технического несовершенства и ограниченного применения системы механического позиционирования достаточно быстро были вытеснены с рынка и прекратили свое существование
На смену им пришли системы с ЦДК, работающие в режиме реального времени с автоматическим сканированием исследуемой зоны
Реализация таких систем стала возможной в 1982 г [10] благодаря разработке автокорреляционных методов обработки приходящей допплеровской информации.
Как отмечалось ранее, одним из недостатков допплеровских визуализирующих систем с ручным сканированием являлось длительное время формирования изображения. Причина этого состояла в необходимости посылки до 50 излучающих импульсов по одному и тому же направлению для получения достоверных оценок допплеровского сдвига на различных глубинах выбранного направления. Применение методов автокорреляционной обработки позволило не только сократить количество последовательных излучений до 3-12, но и обеспечить возможность определения направления потока крови. Было принято окрашивать в красный цвет поток по направлению к датчику и в синий цвет - от датчика; при этом более насыщенная окраска соответствует повышенным значениям скоростей потоков.
Для реализации данного метода возможно использование всех типов датчиков, которые обеспечивают требуемую частоту излучений, - секторных механических, электронных линейных и фазированных. В дальнейшем были разработаны специализированные полостные датчики, в которых также реализован режим ЦДК.
При формировании изображений ЦДК (рис. 11) принимаемые эхо-сигналы обрабатываются параллельно по двум каналам: 1 - для формирования двухмерного полутонового изображения (В-режим), 2 - для обработки допплеровских сигналов. В канале 2 устанавливается пороговый детектор эхо-сигналов, который отделяет полезный допплеровский сигнал малой амплитуды от высокоамплитудных эхо-сигналов В-изображения. Полученный после выделения полезный сигнал обрабатывается параллельно по каналам 2.1 и 2.2 для определения значений скоростей и направлений потоков. Сформированные независимо изображения В-режима и ЦДК поступают на смеситель телевизионных сигналов для получения результирующего двухмерного изображения с зоной ЦДК.
Как правило, при формировании изображений ЦДК используют до 64 ультразвуковых линий, при этом на каждой линии производится расчет до 128 элементов. Частота кадров формируемых ультразвуковых изображений находится в пределах от 5 до 40 Гц и зависит от размера выбранной зоны интереса и глубины ее расположения в используемом объекте. Качество получаемого изображения может быть улучшено за счет генерации дополнительных усредненных линий или кадров. К примеру, при уменьшении угла сканирования объекта с 90° до 60° может быть повышена плотность линий на допплеровском изображении или увеличена глубина расположения исследуемой зоны. Соотношение, определяющее взаимосвязь между параметрами изображения ЦДК, имеет следующий вид:
![]()
где LD- плотность ультразвуковых линий, PRF- частота повторения зондирующих импульсов, W- ширина поля сканирования, FR - частота кадров, Zmax- максимальная глубина проникновения, N - количество сигналов, излучаемых по каждому направлению.
Остановка сформированного изображения может быть произведена в произвольный момент времени или синхронизирована с сигналами ЭКГ.
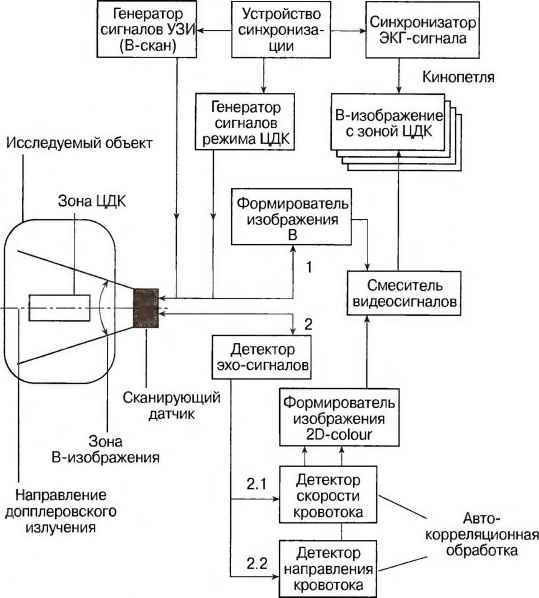
Рис. 11. Блок-схема формирования изображения с режимом ЦДК
В целях более детального анализа быстроизменяющихся процессов используется режим кинопетли, который позволяет воспроизвести с заданной скоростью из памяти прибора последовательность (как правило, не менее 64) ультразвуковых изображений Таким образом, системы ЦДК содержат ряд дополнительных по отношению к режиму В-сканирования управляющих режимов: «усиление» - управление чувствительностью приемного тракта сигналов ЦДК, «фильтры» - высокочастотный и низкочастотный для устранения шумовых сигналов от стенок сосудов и сигналов высоких частот; «порог» - устранение низкоамплитудных эхо-сигналов; «выбор цветовой шкалы» - выбор наиболее удобной гаммы цветов для отображения относительных значений скоростей; «усреднение кадров» - сглаживание изображения ЦДК в течение сердечного цикла и уменьшение уровня помех на изображении; «М-режим/поток» - для выбранного направления излучения строится кривая М-режима, характеризующая изменения скоростей во времени.
Таблица 4. Характеристики основных режимов получения допплеровской информации
|
Показатели |
Режим | ||
|
непрерывный (CW) |
импульсный (PW) |
ЦДК(CFM) | |
|
Зона исследования |
Один протяженный участок |
Один или несколько коротких участков |
Двухмерный массив коротких участков |
|
Ультразвуковой преобразователь |
Двухэлементный |
Одно- или многоэлементный |
Одно- или многоэлементный |
|
Дуплексная визуализация |
Есть |
Есть |
Есть |
|
Режим отображения |
Допплерограмма |
Допплерограмма |
Двухмерное цветовое изображение и допплерограмма |
|
Количество излучений, необходимых для расчета скорости кровотока |
|
50 |
Минимум 3. Как правило, 10 |
|
Ограничения по эффекту наложения частот (aliasing) |
Нет |
Есть |
Есть |
|
Максимальная точность определения скорости |
2% |
2% |
10% |
|
Разрешающая способность по времени |
10 мс |
10 мс |
100 мс |
|
Выходная излучаемая интенсивность (spta) |
50 мВт/см2 |
500 мВт/см2 |
100 мВт/см2 |
|
Количественное измерение потока |
Возможно |
Возможно |
Возможно |
|
Зависимость от угла излучения |
Есть |
Есть |
Есть |
Для получения более достоверных (точных) оценок значений скоростей потоков в выбранной зоне интереса используются традиционные методы непрерывного (CW) и импульсного (PW) режимов излучения по выделенному направлению и в пределах установленного строба с последующим спектральным анализом.
Для более эффективного применения каждого из режимов при определении тактики ультразвукового обследования можно использовать сравнительную таблицу возможностей этих методов (табл. 4).
3.3. Развитие методов цветового допплеровского картирования
Появление методов ЦДК в начале 80-х годов и разработанная на их основе аппаратура, безусловно, сыграли революционную роль в ультразвуковой диагностике сосудистых поражений. Была решена задача визуализации двухмерных распределений скоростей потоков в режиме реального времени, что открыло широкие возможности для применения метода в области эхокардиографии. В то же время новой методике не удалось избежать ряда ограничений и недостатков традиционных допплеровских режимов и методов В-сканирования: зависимости допплеровской информации от угла излучения по отношению к направлению потока; ограниченного частотного диапазона допплеровских сигналов, определяемого максимальной частотой лоцируемых сигналов; ограничения верхнего диапазона частоты кадров, формируемых изображений ЦДК.

Рис. 12. Типичная форма спектра допплеровского сигнала.
Активные научные поиски и разработки привели в начале 90-х годов к появлению ряда разновидностей метода ЦДК, позволяющих снизить или устранить влияние отмеченных ограничений. Наиболее популярным стал режим цветового допплеровского картирования по энергии (CDE - color Doppler energy) - ЦДКЭ [11] В данной модификации метода ЦДК вместо отображения скоростей потоков в каждом пикселе изображения было предложено отображать мощность допплеровских сигналов. Получаемая при этом информация характеризует интенсивность потока крови в выбранном сечении, а не абсолютную его скорость, что делает результирующее изображение практически независимым от угла ультразвукового сканирования. Сущность метода проиллюстрирована на рис. 12, где показана типичная форма спектра допплеровского сигнала.
В зависимости от угла наклона излучения по отношению к направлению потока может изменяться значение средней скорости потока vcp и ширина спектра скоростей, но энергия отраженных допплеровских сигналов, пропорциональная площади под кривой на рис. 12, остается постоянной.
Режим ЦДКЭ позволяет также расширить частотный диапазон отображаемых допплеровских сигналов в целях визуализации низкоскоростных потоков.
Это достигается путем «отказа» от функции выделения направленности потока, что снижает ограничение по частоте опроса анализируемых допплеровских сигналов. Данная функция подробно описана в последующих главах, поскольку имеет особую эффективность при исследовании малых периферических сосудов и сосудов брюшной полости, что значительно расширяет сферу применения метода ЦДК.
Например, на участках тканей с высокой степенью перфузии традиционный режим ЦДК может не обеспечить получения цветного изображения из-за взаимной компенсации векторов скоростей различных направлений от малых сосудов, что приводит к обнулению средней направленной скорости потока. При этом энергия потока безусловно не будет нулевой, что найдет свое отражение при формировании изображения в режиме ЦДКЭ.
Режим ЦДКЭ доказал свою практическую значимость при диагностике тромбозов глубоких вен, дифференциации объемных поражений, а также в такой труднодоступной области для сканирования, как транскраниальная дуплексная методика.
Дальнейшее техническое совершенствование ультразвуковых сканирующих систем позволило преодолеть одно из наиболее жестких ограничений - по частоте кадров формируемых изображений ЦДК. Как известно, данное ограничение было вызвано определенной скоростью распространения ультразвука в тканях и фиксированным временем, необходимым для получения достоверной информации о допплеровской частоте по выбранному направлению излучения. Последним и наиболее значимым техническим достижением в области сканирующих систем явилось применение методов обработки не только амплитуды, но и фазы приходящих эхо-сигналов, что позволило подключить на каждый сканирующий элемент до четырех приемно-передающих каналов и таким образом добиться повышения в 4 раза верхнего порога частоты кадров формируемых изображений.
Применение новой архитектуры построения приемно-передающих систем и значительное увеличение скорости обработки информации позволило в 1996 г. [12] предложить новую модификацию метода ЦДК - «конвергентный цветовой допплер» (CCD - convergent color Doppler) - КЦД. Данный метод объединил преимущества и возможности традиционного метода ЦДК - отображение распределения скоростей потоков и их направлений - с методом ЦДКЭ, обеспечивающим отображение энергетических характеристик потока.
Ключевым моментом для представления информации КЦД стал оптимальный подбор цветовых шкал, который позволил на одном и том же изображении совместить информацию о скорости и энергии допплеровского сигнала. При выработке алгоритма формирования изображения было принято, что для слабых эхо-сигналов (до определенного порога) происходит формирование «энергетического» изображения, а при увеличении амплитуды работает комбинированный режим картирования по скорости и по энергии.
Было предложено три семейства цветовых шкал: контурные, направленные и пороговые. При использовании контурной шкалы происходит цветовое кодирование по энергии для слабых допплеровских сигналов и комбинированное кодирование по энергии и скорости для более сильных сигналов. Данную шкалу наиболее эффективно использовать для характеристики объемных потоков. Направленная энергетическая шкала воспроизводит во всем диапазоне сигналов энергетическое кодирование, которое совмещается с информацией о направленности потоков. В режиме пороговой шкалы до определенного уровня сигналов происходит кодирование по энергии, а выше этого уровня воспроизводится информация о скоростях и направлениях.
Для управления различными цветовыми шкалами введена функция «балансировка», которая позволяет увеличивать или уменьшать насыщенность соответствующей зоны на шкале для более определенного выделения информации о скоростях потоков или их энергии.
С точки зрения клинического применения метод КЦД с набором цветовых шкал позволяет более четко прорисовывать границы завихрений потоков, отображать цветовую информацию в течение всего сердечного цикла, подчеркивать зоны повышенных и пониженных скоростных потоков.
Скорость восприятия оператором воспроизводимой цветовой информации в режиме КЦД и ее адекватная оценка являются предметом более детальных клинических испытаний.
3.3.1. Технология «Sequoia™».
Когерентное формирование изображения
Последним словом в мире непрерывно развивающихся ультразвуковых технологий стало появление в апреле 1996 г. разработки корпорации «Acuson» - принципиально новой технологии «Sequoia™», которая явилась результатом многолетних фундаментальных исследований. Эта технология представляет собой революционный вклад в развитие медицинской диагностической визуализации благодаря уникальным подходам к обработке и анализу ультразвуковой информации. Технология «Sequoia™» базируется на четырех «краеугольных камнях»: когерентном формировании изображения; новых допплеровских технологиях - SST™ Color Doppler; Solo™ Spectral Doppler; новой технологии датчиков; интегрированной ультразвуковой рабочей станции DIMAQ.
Когерентное формирование изображения, используемое в рассматриваемых системах, отражает принципиально новый подход к обработке принимаемого ультразвукового сигнала. Существующие на рынке ультразвуковые системы работают по принципу построения изображения «по лучу», используя данные только об амплитуде отраженного эхо-сигнала, что позволяет получать лишь половину информационной емкости сигнала.
Технология когерентного формирования изображения использует 512 или 256 электронных приемо-передающих каналов и принцип формирования множественных лучей с закодированной в них информацией как об амплитуде, так и о фазе отраженного сигнала, выстраивая так называемые «ячейки изображения». Данный подход к сбору, анализу и обработке получаемых ультразвуковых данных позволяет иметь вдвое больше информации за половину времени. В результате значительно повышается разрешающая способность по времени, пространству и контрастности при высокой однородности качества изображения по всему полю обзора.
Только с появлением технологии «Sequoia™» стало возможным получать изображение, основанное на использовании полной информации об объекте, содержащейся как в амплитуде, так и в фазе отраженного сигнала.
3.4. Допплеровская тканевая визуализация
Одной из первых областей клинического применения традиционного (использующего кодирование по скорости) метода ЦДК стала кардиология. В дополнение к двухмерному сканированию, позволяющему оценить морфологию, и спектральному допплеровскому анализу, характеризующему гемодинамические показатели, метод ЦДК позволил более эффективно диагностировать нарушения внутренних потоков.
Дополнительным инструментом в исследовании функций миокарда явился новый допплеровский метод - допплеровская тканевая визуализация (DTI-Doppler tissue imaging) - ДТВ (реализован в аппаратуре начиная с 1994 г.) [13]. Данный метод основан на алгоритме выделения полезной информации с инверсной фильтрацией по отношению к методу ЦДК. Слабые допплеровские сигналы движения стенок, которые воспринимаются в методе ЦДК как помеха и устраняются путем фильтрации, в методе ДТВ стали полезными сигналами. Специализированный фильтр отсекает информацию о скоростях движущихся потоков и выделяет информацию о скоростях движения тканей. Появляется возможность оценить динамику и стенок миокарда, и его внутренних слоев. При этом определяется не только скорость, но и направление движения стенок. Для кодировки, как правило, используются цветовые шкалы, как и в режиме ЦДК.
На основании исходной допплеровской информации в методе ДТВ возможна оценка кинетики тканей по трем режимам, регистрации скорости, регистрации ускорения и регистрации энергии отраженного сигнала. Применение данных режимов в клинических условиях позволяет решать диагностические задачи по улучшению визуализации миокарда, оценке нарушений региональной сократимости и энергетической активности.
Имеются сообщения об экспериментальном использовании метода ДТВ при реконструкции трехмерных изображений сердца в процессе транспищеводной эхокардиографии [14]. Исследования показали, что двухмерные изображения, полученные по методу ДТВ, содержали более полную информацию о границах стенок миокарда, чем традиционные изображения по В-режиму.
Следует отметить, что на данной стадии метод проходит широкую клиническую апробацию, и вполне вероятно, что в будущем он продемонстрирует новые диагностические возможности.
Завершая рассмотрение методов цветового допплеровского картирования, следует отметить, что их внедрение в клиническую практику в 1983 г. открыло принципиально новый этап в диагностике сердечно-сосудистых заболеваний.
Таблица 5. Методы цветового допплеровского картирования
|
Название |
Отображаемые |
Цветовая шкала |
Область применения |
Год |
|
метода |
параметры |
отображения |
(предпочтительно) |
внедрения |
|
ЦДК |
Скорость потока, направление потока |
Красно-синяя |
Кардиология, крупные сосуды всего тела |
1983 |
|
ЦДКЭ |
Интенсивность потока |
Красно-желтая |
Малые сосуды |
1994 |
|
ДТВ |
Средняя скорость стенок, ускорение стенок |
Красно-синяя |
Эхокардиография |
1994 |
|
КЦД |
Скорость потока, |
Набор шкал |
Универсальный |
1996 |
|
|
направление, |
комбинированный |
(сосуды всего тела) |
|
|
|
интенсивность потока |
(красно-синяя, красно-желтая) |
|
|
|
Когерент- |
Скорость потока, |
Набор шкал |
Универсальный |
1996 |
|
ный цве- |
направление, |
комбинированный |
(сосуды всего тела) |
|
|
товой |
интенсивность потока, |
(красно-синяя, |
|
|
|
допплер |
фазовый сдвиг между отраженными сигналами |
красно-жёлтая) |
|
|
От одномерного представления перешли к двухмерному представлению с визуализацией направлений потоков, таким образом, максимально приблизив воспроизводимую ультразвуковую информацию к реальной анатомической картине. Врач получил доступ к морфологической информации о структуре и направленности потоков, смог оценивать скоростные и энергетические характеристики потоков, изучать весь диапазон допплеровских частот, сделать обследование независимым от угла, преодолеть ограничение по частоте кадров формируемого изображения (табл. 5).
Логическим завершением исследований последнего десятилетия явилась разработка метода КЦД, который объединил, по сути, все возможные методы двухмерной визуализации допплеровской информации о потоках.
Оценив уровень технических достижений, реализованный в серийно выпускаемой аппаратуре, каждый энтузиаст допплеровского метода диагностики мечтает заглянуть в завтрашний день и получить ответ на вопросы: есть ли предел техническим новациям в ближайшем будущем и составит ли данный метод реальную конкуренцию методам контрастной ангиографии и магнитно- резонансной томографии?
Следует ожидать, что в ближайшие годы в лучших образцах ультразвуковых допплеровских систем будет реализован режим трехмерной визуализации потоков крови на основе информации, получаемой с помощью метода ЦДКЭ. Первые сообщения о методике 3D Colour Power Angio [15] говорят о возможности трехмерной визуализации в режиме, близком к реальному времени, не только отдельных участков сосудистого русла, но и целиком сосудистой системы отдельных органов - почки, системы мозгового кровообращения у новорожденных, пуповины и др.
Специальные режимы обработки позволяют отфильтровывать традиционную полутоновую тканевую информацию и воспроизводить в результирующем изображении только информацию о сосудистых потоках, т. е. получать «чисто» допплеровское изображение Клиническая значимость таких изображений особенно велика при определении тактики хирургических вмешательств для лечения сосудистых заболеваний Принципиально новые возможности в диагностике сосудистых заболеваний открывает применение разработанных в последние годы контрастных веществ [16, 17]. Сочетание контрастных веществ и методики получения изображений по методу второй гармоники явилось базой для развития еще одной модификации метода ЦДК - Harmonic Contrast Imaging Использование данной методики позволяет повысить чувствительность допплеровской системы по детектированию слабых сигналов на 25-30 дБ. тем самым создав возможность для получения допплеровского изображения мелких сосудов и вен. которые ранее были не видны даже на исходном эхографическом полутоновом изображении. Следует отметить перспективность данной методики при транскраниальном исследовании, при исследовании артерий нижних конечностей, васкуляризации опухолевых поражений и т. п.
Приведенные примеры двух новых методик подтверждают, что допплеровское направление в ультразвуковой диагностике является одним из наиболее динамичных, и в ближайшие годы в нем следует ожидать новых открытий.
4. Автоматизация анализа ультразвуковой допплеровской информации
Технические разработки, проведенные за последние 30 лет, позволили создать полный спектр ультразвуковой допплеровской аппаратуры: от простейших индикаторных приборов со звуковым воспроизведением скоростных характеристик кровотока до суперсовременных систем на основе метода цветового допплеровского картирования с режимом конвергентного допплера, позволяющих получать двухмерные распределения скоростей потоков максимально приближенные к реальным анатомическим сечениям.
Благодаря современной аппаратуре врач получает за время одного обследования многоразмерный массив полезной информации в виде звуковых сигналов кровотока, огибающих кривых средней и максимальной скорости, спектрального состава кровотока в выбранном сечении, набора информативных параметров в виде расчетных индексов, двухмерного изображения кровотока с цветовой индикацией направления, объемных показателей кровотока в выбранном сечении сосуда. При этом можно с достаточной степенью определенности утверждать, что время обследования пациента за прошедшие годы революционных технических новаций изменилось незначительно. Это означает, что врачу приходится обрабатывать значительно больший объем информации в единицу времени, что, безусловно, улучшает качество и объективность диагноза, но увеличивает при этом нагрузку на врача.
Очевидной становится необходимость автоматизации обработки информации, которая складывается из следующих этапов: 1) компьютерная обработка в режиме реального времени и архивация результатов допплеровского обследования; 2) систематизация допплеровских диагнозов для различных видов
патологических изменений и нормы; 3) построение базы знаний, учитывающей исходные физиологические данные и систематизированную информацию, полученную в процессе выполнения второго этапа; 4) разработка автоматических алгоритмов постановки диагноза или выявления нарушений кровообращения на основе оценки совокупности информативных параметров; 5) создание обучающейся экспертной системы с использованием элементов теории искусственного интеллекта; 6) построение модели системы кровообращения для комплексирования данных, полученных другими методами исследования, и результатов ультразвуковых допплеровских исследований.
В настоящий момент в большинстве серийно выпускаемых приборов реализован только первый этап автоматизации - обработка и архивация данных обследования. Это стало возможным только в последние годы благодаря широкому использованию при построении допплеровских систем стандартных компьютерных платформ [18].
Работы по другим этапам носят в основном научно-исследовательский характер. В то же время необходимость систематизации уже имеющейся информации о проводимых перспективных исследованиях требует проанализировать наметившиеся тенденции и предложить читателю материалы такого анализа.
4.1. Методы автоматического анализа допплеровских сигналов
Для выявления патогенетических механизмов дисциркуляций врач в своих действиях должен воспользоваться оценками изменений амплитуды, частоты и фазы аудиовизуального представления допплеровского сигнала кровотока. При этом диагносту приходится анализировать и сопоставлять значительные объемы информации, связанные с местом локации артерии, индивидуальными анатомическими особенностями обследуемого, а также проводить достаточно сложные и трудоемкие вычисления при обработке сигналов.
Одна из основных особенностей допплеровского исследования заключается в том, что амплитуда регистрируемого сигнала является, как правило, не очень надежным показателем, так как зависит от многих факторов, не связанных со скоростью кровотока: от угла между датчиком и направлением кровотока, надежности контакта между кожей и датчиком, коэффициента усиления измерительного тракта и т. д. Однако значительное изменение амплитуды сигнала, например при исследовании симметричных артерий, является достаточно информативным для диагностики. Поэтому при анализе допплеровского сигнала используют показатели, связанные как с формой, так и с амплитудой. Задача анализа допплеровского сигнала обычно решается в два этапа, на первом определяют огибающие спектрального представления сигнала, а на втором на основе анализа огибающих вычисляют различные показатели кровотока. На рис. 13 показан типичный допплеровский сигнал с нанесенными на него огибающими.
Обычно при анализе типовых огибающих допплеровского сигнала выделяют для анализа шесть основных точек: 1) открытие аорты; 2) максимальная систолическая скорость; 3) дикротический зубец; 4) постдиастолический заброс; 5) максимальная амплитуда постдиастолической позитивной волны; 6) конечная диастолическая скорость.

Рис. 13. Спектрограмма кровотока по средней мозговой артерии.
Рис. 14. Типовая огибающая допплеровского сигнала (расшифровка цифр в тексте).
Типовая огибающая допплеровского сигнала с нанесенными на нее опорными точками изображена на рис. 14.
Для автоматического распознавания этих опорных точек удобно использовать структурно-лингвистический подход [7, 19, 20]. При таком подходе проводят сегментацию огибающей и выделение типовых ее элементов, каждый из которых характеризует тот или иной пик на кривой. Всю кривую целиком описывают в виде периодической последовательности типовых элементов. Это позволяет свести задачу распознавания опорных точек к нахождению отдельного цикла и определению элементов его составляющих на основе грамматического анализа цепочки, описывающей допплерограмму. Такой анализ удается провести в реальном масштабе времени и выдать на экране врачу рассчитанные показатели (рис. 13, верхняя строка над допплеровским сигналом). Контроль за правильностью проведенного анализа возлагается при этом на врача. При необходимости врач всегда может вмешаться в работу комплекса и осуществить расчеты самостоятельно.
Решение задач диагностики сосудистых заболеваний требует в ряде случаев оценить динамику изменения кровотока при проведении компрессионных проб и фармакологических тестов. Решение этих задач возможно при использовании различных средств архивирования.
При проведении компрессионных проб обычно требуется наблюдать за изменением допплеровского сигнала в течение нескольких минут. Задача диагностики сводится в этом случае к анализу динамики изменения амплитуды и формы сигнала. Решение такой задачи стало возможно при появлении быстрых магнитных накопителей большой емкости. Для просмотра сигнала во всем временном диапазоне записи обычно используют специальную линейку скролинга, как это показано на рис. 13.
При мониторинге, который бывает необходим при проведении сердечнососудистых операций, наблюдать за допплеровским сигналом приходится по несколько часов. В этом случае обычно осуществляют запись только огибающих, что позволяет экономить объем памяти. Однако при этом осуществляется автоматический контроль сигнала и при его изменении, например при появлении эмболов в сосудистом русле, реализуется автоматический переход на запись полного допплеровского сигнала с одновременной подачей звукового сигнала. В дальнейшем врач может просмотреть полную запись и выбрать для анализа требуемые участки.

Pис. 15 Пример диалогового рабочего окна при допплерографическом исследовании.
При длительном наблюдении за пациентом часто необходимо сопоставить результаты текущего исследования с предшествующим. Для этого в современных комплексах предусматривается база данных обследований, которая позволяет просматривать результаты в многооконном режиме. На рис. 15 показан такой типичный режим работы (на примере комплекса БИОМЕД). Кроме того, в такой базе данных хранится текстовая информация о пациенте, данные других исследований, а также информация о предполагаемом диагнозе Обычно такая база данных является сетевой, что позволяет подсоединять комплекс к единой информационной сети лечебного учреждения и проводить комплексирование различных методов исследования [21]
4.2. Подходы к созданию экспертной системы анализа ультразвуковой допплеровской информации
Важным аспектом восприятия допплеровской информации о кровотоке в сосудах является то, что она отражает состояние отдельных элементов единой гемодинамической системы сосудов данного бассейна (например, бассейна головного мозга) на уровне опыта клинического врача. Для такого восприятия необходимы модели физических процессов, лежащих в основе гемодинамики. Желательно, чтобы эти процессы были формально описаны на математическом языке и позволяли бы наиболее адекватно увязывать изменения в проходимости сосудов с данными допплеровских измерений. По сути дела для проведения диагностики необходимо построить семейство математических моделей, описывающих гидродинамические процессы артериальной системы кровообращения в состояниях нормы и с различными типами нарушений, и уметь выбирать из этого семейства модель с соответствующей патологией, которая наилучшим образом согласуется с результатами ультразвуковых допплеровских измерений.
Для повышения эффективности использования допплеровской информации может быть сформулирована концепция ультразвуковой диагностики на основе математических моделей артериальной системы. Эта концепция строится на положениях, приведенных ниже.
- Гемодинамическую картину распределения кровотока в сосудах, выявленную в результате клинических исследований, воспроизводят в семействе математических моделей путем настройки их параметров. В результате настройки моделей определяют средние значения параметров и их разброс для нормального состояния системы кровообращения и для рассматриваемых случаев сосудистых заболеваний. Полученное таким образом семейство моделей можно рассматривать как исходную базу знаний будущей экспертной системы. Эта база знаний может пополняться новыми экспериментальными и клиническими данными о поведении сосудистой системы с различными видами поражений.
- Измерения кровотока в одном и том же сечении у различных пациентов одной возрастной группы в норме или с одинаковыми нарушениями могут отличаться из-за погрешностей измерений, а также из-за случайного разброса параметров, характеризующих гемодинамические свойства. Поэтому обнаружение нарушений в сосудистой системе является вероятностной задачей. В связи с этим на основе статистических методов для каждой модели семейства определяют корреляционные зависимости параметров кровотока в различных сечениях, наиболее характерные для данного типа нарушений сосудистой системы. Совокупность таких зависимостей, полученных для состояний системы кровообращения с различными поражениями, представляет собой корреляционную базу априорных знаний для применения вероятностных методов ультразвуковой диагностики.
- Диагностика нарушений сосудистой системы по результатам ультразвуковых измерений с использованием априорной базы знаний производится на основе статистических методов проверки гипотез. В данном случае рассматриваются гипотезы о наличии тех или иных патологических изменений в сосудистой системе пациента из заданного списка нарушений. Далее на основе сравнительного анализа допплеровских измерений, сделанных в различных сечениях сосудистой системы, находятся взаимосвязи между измерениями. Суть диагностики состоит в том, чтобы для данной совокупности измерений найти модель системы с наиболее близкими корреляционными зависимостями. В результате определяют наиболее вероятный тип поражения сосудистой системы. Помимо выявления наиболее вероятных патологических изменений, в результате диагностического анализа могут быть указаны еще несколько других, менее вероятных, но возможных нарушений. При этом окончательное решение о состоянии пациента принимает врач с учетом имеющихся у него профессиональных знаний и опыта.
В сформулированной концепции ключевое место занимает проблема построения математических моделей системы кровообращения. По этой проблеме есть публикации и за рубежом, и в отечественной литературе [22, 24]. Система кровообращения представляет собой сложную распределенную динамическую систему со специфическим многоконтурным механизмом регуляции. Уровень физиологических знаний об этой системе является далеко не полным. В связи с этим при математическом описании процессов кровообращения наиболее продуктивным является подход, основанный на построении локальных моделей, ориентированных на конкретное назначение и отображающих определенную группу свойств и закономерностей моделируемой системы.
Для понимания процессов циркуляции крови в сосудах полезным оказывается рассмотрение системы кровообращения как гидродинамической системы, описываемой на основе известных законов механики жидкостей. С помощью гидродинамических моделей кровообращения могут исследоваться сложные процессы распространения пульсовой волны по артериям, нелинейные эффекты, течение крови с учетом изгибов и бифуркаций сосудов.
Применительно к задаче анализа поведения средних значений скоростей кровотоков в различных участках системы будем использовать сравнительно простые модели с сосредоточенными параметрами, описываемые линейными алгебраическими уравнениями. Рассмотрим систему артерий головного мозга человека. Эта система представляет собой ветвящуюся сеть сосудов. Участки этой сети между ветвлениями будем рассматривать как элементы с сосредоточенными параметрами. Каждый элемент будем характеризовать эквивалентным гидравлическим сопротивлением, на котором возникают потери давления, пропорциональные расходу. Физической причиной падения давления на элементе могут быть сужение и ветвление сосудов, изгибы тракта, вязкое трение.
Таким образом, весь бассейн кровоснабжения артерий головного мозга может быть представлен в виде гидравлической цепи, составленной из элементов с сосредоточенными параметрами и изображенной на рис. 16.
Каждому элементу цепи соответствует участок определенной артерии. Названия артерий, отображенных в цепи, приведены в табл. 6. Стрелками на рис. 16 показаны положительные направления потоков.
Изображенная на рис. 16 гидравлическая цепь представляет собой базовую модель системы кровообращения головного мозга, включающую как основные артериальные пути циркуляции крови, так и резервные каналы в виде анастомозов. Из базовой модели путем простых структурных изменений и изменений сопротивлений элементов могут быть получены частные модели системы для состояний нормы и нарушения кровообращения типа стеноза или окклюзии (последние сопровождаются изменениями путей кровотока). Аналогичным образом могут быть учтены изменения в системе при проведении компрессионных проб.
Математическое описание цепей основано на применении законов сохранения, часто называемых обобщенными законами Кирхгофа и формулируемых для узлов и контуров цепи.

Рис. 16. Схема модели гидравлической цепи кровоснабжения головного мозга (обозначения см. в табл. 6).
Для гидравлических цепей эти законы формулируют в виде уравнений баланса расходов для узлов и баланса падения давления для контуров с граничными условиями.
Граничное условие на входе в систему (на входе в левый фрагмент дуги аорты) задается в виде постоянного давления. Рассматриваемая цепь имеет несколько выходов, каждый из которых связан со своим периферическим участком (мелкими артериями и артериолами, питающими соответствующую область капиллярной сети). Падения давлений на всех периферических участках будем считать одинаковыми. В этом случае все выходы цепи можно объединить в один.
С учетом сделанных допущений процессы циркуляции крови в рассматриваемой цепи артерий головного мозга можно описать системой алгебраических уравнений:
![]()
Таблица 6. Номера и названия артерий в блоках модели цепи.
|
№ элемента |
Название артерии |
№ элемента |
Название артерии |
|
|
Общие сонные. |
|
|
|
1 |
правая |
26, 27, 28 |
Дуга аорты |
|
4 |
левая |
|
|
|
|
Внутренние сонные. |
|
Глазные: |
|
2, 18, 30 |
правая |
32 |
правая |
|
6 20,28 |
левая |
31 |
левая |
|
|
Наружные сонные |
|
Тыльные артерии носа: |
|
3 41, 46 |
правая |
34 50 |
правая |
|
5, 40. 45 |
левая |
33,49 |
левая |
|
|
Подключичные: |
|
Надблоковая: |
|
8, 23, 44 |
правая |
37 38 |
правая |
|
7, 24, 43 |
левая |
35,36 |
левая |
|
|
Позвоночные |
|
|
|
10 |
правая |
39 |
Анастомоз |
|
9 |
левая |
|
надблоковых артерий |
|
|
Задние: |
|
|
|
12, 13 |
правая |
42 |
Обобщение анастомозов |
|
15. 16 |
левая |
|
(подъязычных тыльных |
|
|
|
|
и губных артерий) |
|
|
Задние соединительные |
|
|
|
14 |
правая |
|
Анастомоз верхней и нижней |
|
17 |
левая |
|
щитовидной: |
|
|
|
48 |
правый |
|
|
|
47 |
левый |
|
|
Обобщение средних |
|
Обобщение ветвей |
|
|
переднемозговых: |
|
внешних сонных. |
|
19 |
правой |
53 |
правой |
|
21 |
левой |
51 |
левой |
|
22 |
Передняя соединительная |
|
Обобщение анастомозов |
|
|
|
|
тыльных артерии носа |
|
|
|
|
и надглазничных: |
|
|
|
52 |
правая |
|
|
|
54 |
левая |
|
25 |
Плече-головной ствол |
11 |
Основная |
приближенными. Поэтому для использования моделей [21] при диагностике заболеваний необходимо, по крайней мере, убедиться, что они отражают известные из клинической практики свойства реальной системы. Кроме того, необходимо задать параметры базовой модели (средние значения гидравлических сопротивлений элементов и диапазон их случайных отклонений) и параметры модели, настраиваемые на основе известных клинических данных о скорости кровотока в сосудах здоровых людей и ее изменениях из-за нарушений и при компрессионных пробах, а также данных о геометрических характеристиках сосудов. Настройку параметров производили путем минимизации критерия, характеризующего отличие указанных априорных данных от значений кровотока и сопротивлений элементов, получаемых в модели.
Таким образом, для системы артерий головного мозга было получено семейство сравнительно простых моделей, отражающих распределение средних значений линейных скоростей движения крови в различных участках системы в состояниях нормы и с нарушениями.

Рис. 17. Структурная схема экспертной системы диагностики поражений артерий головы.
Это семейство моделей можно совершенствовать и расширять, адаптируя к новым клиническим данным и интегрируя в единую базу знаний опыт врачей с аналитической информацией о гидродинамике процессов кровообращения [25, 26].
Такая база знаний может быть положена в основу построения экспертной системы ультразвуковой допплеровской диагностики артерий головного мозга. Структура экспертной системы представлена на рис. 17.
В плане создания экспертной диагностической системы необходимо дальнейшее развитие исследований гемодинамических моделей системы кровообращения, ориентированных на: 1) создание теоретической основы и общей методологии ультразвуковой допплеровской диагностики нарушений артериальной системы; 2) разработку простых, удобных в практической реализации алгоритмов диагностики, применение которых в составе ультразвуковых допплеровских приборов обеспечит их интеллектуализацию и сделает их советчиками врачей по выявлению сосудистых заболеваний.
5. Вопросы безопасности при использовании ультразвуковой допплеровской аппаратуры
Применение ультразвука для диагностических целей имеет более чем тридцатилетнюю историю, и в течение всего этого периода одним из наиболее дискутируемых и неоднозначных оставался вопрос о безопасности применения энергии ультразвуковых волн для пациента.
Следует отметить, что вопрос безопасности врача, проводящего обследование, обсуждался с не меньшим энтузиазмом, особенно на первом этапе появления сканирующих приборов. Тогда использовали несовершенные средства отображения информации, конструкция датчиков была неудобной, тяжелой, с выраженными механическими вибрациями. Безусловно, все эти факторы воздействовали на оператора работавшего с прибором, и практика широкого клинического применения требовала разработки и утверждения соответствующих санитарно-гигиенических норм. При этом следует понимать, что среди рассматриваемых факторов отсутствовали эффекты ультразвуковой энергии, так как конструкция всех ультразвуковых датчиков, используемых в диагностической аппаратуре, исключает распространение ультразвуковых волн в направлении оператора Отраженная энергия, распространяемая в тканях организма воспринимается только лицевой поверхностью датчика которая находится в контакте с телом пациента благодаря применению специализированных акустически согласованных (прозрачных) гелей. Таким образом, можно сделать вывод, что вопросы безопасности работы оператора с ультразвуковым оборудованием не имеют особой «лучевой» специфики, присущей другим методам лучевой диагностики; соответствующие нормативы содержатся в специализированных изданиях
Предметом рассмотрения данного раздела являются вопросы безопасности для пациента при проведении обследований на различных видах допплеровского оборудования в различных режимах.
Вопросами биологического воздействия ультразвука и его безопасного применения занимались в течение последних двадцати лет многие авторитетные международные организации. Всемирная организация здравоохранения, Всемирная федерация по применению ультразвука в медицине и биологии. Международная электротехническая комиссия (Технический комитет ТК 87 - «Ультразвук») ряд национальных обществ Все эти организации пришли к заключению в своих отчетных документах, что к настоящему времени не обнаружены эффекты, которые могли бы препятствовать широкому применению ультразвуковых волн для диагностических целей При этом наиболее значимым и определенным как для разработчиков, так и для пользователей считается заключение сделанное в декабре 1987 г. организацией AIUM (Американский институт по применению ультразвука в медицине).
«В диапазоне ультразвуковых частот, используемых для диагностических целей, до настоящего времени не было подтверждений значимых биологических эффектов при воздействии на ткани in vivo нефокусированным ультразвуком с интенсивностями ниже 100 мВт/см2 или фокусированным ультразвуком с интенсивностями ниже 1000 мВт/см2
Далее для времени экспозиции более 1 с и менее 500 с (для нефокусированного ультразвука) или 50 с (для фокусированного) такие эффекты не были зарегистрированы и при более высоких интенсивностях, когда произведение интенсивности и времени экспозиции не превышало 50 Дж/см2»
Данное заключение подтверждалось несколько раз и в последующие годы Таким образом, в течение последнего десятилетия было общепризнанным считать ультразвуковое воздействие полностью безопасным при условии интенсивности излучения менее 100 мВт/см2. При этом в целом ряде публикаций отмечалось, что данный порог является условным и принят для определенности как временный ориентир. В дальнейшем по мере проведения дополнительных экспериментов и исследований его значение может быть пересмотрено.
Следует отметить, что большинство ультразвуковых полей, генерируемых в допплеровских режимах, относятся к категории несфокусированных. Приведенное заключение AIUM можно представить в виде графика (рис. 18). На графике сплошной линией обозначена зона, в которую попадают уровни интенсивности большинства из эксплуатируемых в настоящее время ультразвуковых приборов.
В то же время в некоторых моделях приборов не все новые методы формирования изображений и режимы излучения, в том числе импульсный допплеровский, удается реализовать, руководствуясь обозначенными порогами интенсивности. Данное оборудование условно показано на графике пунктирной линией. Подтверждением представленного графика служит информация, полученная во время экспериментального исследования, проведенного на 13 приборах с непрерывным допплеровским режимом и 19 дуплексных приборах с режимом импульсного излучения [27], Были выбраны приборы нескольких областей клинического назначения и с различными типами датчиков. Результаты измерений продемонстрировали значительный разброс параметров. При этом, если для режима непрерывного излучения пороговый уровень интенсивности был превышен только в 30% случаев, то для дуплексных систем с импульсным режимом порог был превышен в 95% случаев. Следует отметить, что измерения проводили в максимальных положениях излучаемой мощности и частоты повторения импульсов. Безусловно, полученные данные должны быть приняты во внимание, как разработчиками новой аппаратуры, так и ее пользователями (см. соответствующие рекомендации в конце главы).
Для урегулирования данного вопроса (разброса значений интенсивности) организация Food and Drug Administration в США приняла документ (табл. 7), регламентирующий пороговые уровни интенсивностей в зависимости от области клинического применения.

Рис. 18. Область безопасной эксплуатации ультразвукового диагностического оборудования
Как видно из приведенной таблицы, значения интенсивностей могут превышать установленный порог в несколько раз.
Таблица 7 Уровень пороговой интенсивности ультразвука в зависимости от области клинического применения
|
Область применения |
LSPTA, мВт/см2 |
|
Кардиология |
430 |
|
Периферические сосуды |
720 |
|
Офтальмология |
17 |
|
Визуализация плода |
94 |
|
Другие применения |
94 |
При этом следует руководствоваться последней фразой из Заключения AIUM: «...такие эффекты не были продемонстрированы и при более высоких интенсивностях, когда произведение интенсивности и времени экспозиции составляло менее 50 Дж/см2».
В результате следует сделать вывод, что для выполнения отмеченного ограничения необходимо следить также за временем проведения обследования. Имеющиеся на сегодняшний день экспериментальные данные не позволяют определить предельно допустимые значения дозы ультразвуковых излучений, как это сделано для ионизирующих излучений. В то же время следует руководствоваться правилом минимально необходимого времени экспозиции для получения достаточной диагностической информации. Выполнение этого правила сопровождается рядом практических рекомендаций: 1) применение минимально необходимых для получения результата уровней излучаемой мощности; 2) использование минимально достаточного времени проведения процедуры; 3) применение минимально необходимых значений частоты повторения импульсов при работе в импульсном режиме; 4) предпочтительное применение режима непрерывного допплеровского излучения по сравнению с импульсным там, где это позволяет достичь адекватного результата; 5) в дуплексном режиме - переключение в режим В-сканирования сразу после получения необходимой допплеровской информации.
Следование этим рекомендациям может позволить уменьшить энергетическое воздействие на пациента в десятки раз, тем самым полностью обезопасив пациента даже от тех биологических эффектов, которые не получили значимого экспериментального подтверждения к настоящему времени, но могут быть открыты в рамках дальнейших исследований.
Итак, в представленной главе были рассмотрены основные исторические этапы развития метода ультразвуковой допплерографии, сформулированы принципы построения допплеровской аппаратуры, даны основные определения режимов работы аппаратуры, приведены расчетные формулы для количественной оценки результатов исследований.
В целях практического применения даны рекомендации по минимизации энергетического воздействия на пациента при проведении ультразвукового допплеровского обследования, приведены условия безопасной эксплуатации оборудования, которые должны учитываться разработчиками при проектировании. Предложены подходы к автоматизации процедуры допплеровского исследования путем создания экспертных баз данных на основе модельных представлений системы кровообращения.
Одним из наиболее значимых открытий в рассматриваемой области за последнее десятилетие следует признать разработку и внедрение в клиническую практику методов цветового допплеровского картирования. Проанализированы основные достоинства и ограничения новых методов ЦДК, возможные области их клинического применения.
Следует ожидать, что поиски разработчиков в ближайшие годы по таким передовым направлениям, как трехмерная визуализация в режиме реального времени, микроминиатюризация датчиков для внутрисосудистых исследований, высокочастотный ультразвук (20-100 МГц), позволят расширить функциональные возможности ультразвукового допплеровского метода и еще больше увеличат круг его сторонников и энтузиастов его клинического применения.
ГЛАВА 2
НОВЫЕ УЛЬТРАЗВУКОВЫЕ ТЕХНОЛОГИИ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Ультразвуковое исследование в современной клинике уже невозможно представить без использования самого широкого спектра методик сканирования. Сегодня преобладает комплексный подход, который подразумевает выполнение в начале исследования базовых, основных методик В-режима, с последующим переходом к использованию методик цветового допплеровского картирования, трехмерной реконструкции. Новые компьютерные технологии значительно обогатили диагностические возможности ультразвукового метода. Появились уникальные методики тканевой гармоники, панорамного сканирования, 3-х мерной объемной реконструкции, эхоконтрастирования, методики ультразвуковой ангиографии. С помощью новых ультразвуковых технологий стало возможным быстро и неинвазивно получать морфологическую и функциональную информацию об органах и сосудах. Все вышесказанное заставляет нас уделять все больше внимания постоянно появляющимся новым ультразвуковым компьютерным технологиям, чтобы своевременно внедрять их в клиническую практику.
1. Современные методики сканирования в В-режиме
Многие ультразвуковые приборы уже сегодня содержат набор стандартных программ для исследования различных органов и структур человеческого организма и оснащены дополнительными режимами сканирования, которые позволяют значительно расширять диагностические возможности обычного сканирования в В-режиме. Речь идет о таких режимах сканирования, как нативная или тканевая гармоника, панорамное сканирование и трехмерная реконструкция.
При получении диагностических изображений с помощью методики нативной гармоники используется более широкий спектр отраженных частот. Это позволяет получать больше информации по всей глубине сканирования и сделать изображение более контрастным, чем при обычном сканировании, получить качественное изображение различных по плотности структур, сделать контуры исследуемого органа или дополнительного образования более четкими. Режим панорамного сканирования позволяет получить расширенное изображение сразу всего органа, отобразить его топографическое соотношение с рядом лежащими структурами. Трехмерная реконструкция обеспечивает получение не только волюметрической информации, но и дает возможность анализа многоплоскостных срезов исследуемого органа, в том числе и фронтальных.
Принципиально новым является применение высокочастотных ультразвуковых датчиков, которые обеспечивают визуализацию различных по эхогенности и глубине залегания структур. Эти датчики значительно повысили разрешающую способность в ближних зонах, с одновременным повышением проникающей способности ультразвукового луча. В них используется узкий ультразвуковой луч, работающий в высокочастотном диапазоне. Узкий луч способствует значительному повышению латеральной разрешающей способности в зоне ультразвукового фокуса, а внедрение мощных компьютеров обеспечивает одновременное действие нескольких передающих и принимающих фокальных зон, охватывающих все поле интереса, при сохранении адекватной частоты кадров.
2. Ультразвуковая ангиография
Ультразвуковая ангиография это собирательное понятие, куда входит несколько способов получения УЗ-изображений сосудов: цветовое допплеровское картирование, энергетическое картирование, методики гармонического изображения, искусственное контрастирование с помощью внутривенно вводимых контрастных веществ, трехмерная реконструкция сосудов. Все перечисленные способы получения УЗ-изображений вносят различный вклад в отображение сосудистых структур, но каждый из них способствует подчеркнутой визуализации и выделению стенок сосудов, несет информацию о характере гемодинамики.
С помощью УЗ-ангиографии можно неинвазивно, или только при внутривенном введении небольшого количества эхоконтрастного препарата, визуализировать различные сосудистые структуры и получить ранее не доступную для ультразвукового исследования информацию. При помощи методик УЗ- ангиографии можно изучать сосудистый рисунок, оценивать его характер, прослеживать фазы накопления и выведения контрастных препаратов, изучать гемодинамику. Сегодня информация, получаемая при ультразвуковой ангиографии, сопоставима с информацией получаемой при КТ и МР-ангиографии, классической рентгеновской ангиографии, и в большинстве случаев ее бывает достаточно для установления правильного диагноза. При этом УЗ-ангиография имеет перед ними преимущества, так как позволяет регистрировать показатели линейной, а при необходимости и объемной скорости кровотока.
Цветовое допплеровское картирование (ЦДК) с успехом вошло в клиническую практику, так как дало возможность как бы изнутри отображать движение по сосуду форменных элементов крови, преимущественно эритроцитов. Метод основан на определении скорости движения эритроцитов и определении направления этого движения. В основе метода лежит отображение с помощью цвета частотного сдвига движущихся эритроцитов (эффект Допплера). Эритроциты, направляющиеся к датчику, окрашиваются в красный цвет (положительный сдвиг), а от датчика - в синий цвет (отрицательный сдвиг) (рис. 19). При этом более светлые тона цвета указывают на более высокую скорость движения эритроцитов и обычно присутствуют в зонах выраженного стеноза, а также в центре ламинарного потока крови. Цвет сам по себе не может четко представлять артериальный или венозный кровоток, то есть красный сосуд не обязательно является артериальным сосудом. Но с помощью импульсного доппле- ра или допплерографии, мы можем получить информацию в виде допплеровской кривой, которая уже несет информацию о характере сосуда. Эта информация может быть проанализирована количественно. Допплеровская кривая (допплерограмма) несет в себе информацию как о типе сосуда - артерия или вена, так и о состоянии этого сосуда - систолическая и диастолическая скорость, индекс пульсации (ИП), индекс резистентности (ИР) или индекс периферического сопротивления (ИПС). Последний отражает информацию о состоянии кровенаполнения ткани и сосудов, расположенных дистальнее (рис. 20).
Метод ЦДК имеет ряд ограничений, которые существенно снижают его диагностические возможности. Так, информация о потоке крови зависит от угла ультразвукового сканирования, а сосуды, располагающиеся перпендикулярно к датчику, вообще не получают своего отображения. Довольно часто при ЦДК возникают артефакты в виде «aliasing effect», которые путают цветовую картинку. Но наиболее значимым ограничением следует считать невозможность при ЦДК получать изображения мелких сосудов с очень малой скоростью кровотока в них. Известно, что в очень мелких сосудах уловить различия в допплеровском сдвиге частот от медленно движущейся крови и от движений стенки сосуда и окружающих тканей практически невозможно, так как это стоит на пороге технических возможностей прибора и законов физики. Рентгеновская ангиография преодолевает трудности в отображении мелких сосудов с помощью субтракции, то есть вычитания одной картинки из другой, когда на рентгенограмме можно оставить только изображение сосудистых структур.

Рис. 19. ЦДК сосудов левой почки. Четкая дифференциация почечной артерии и вены по направлению тока крови.

Рис. 20. Допплерография на уровне сегментарной артерии почки. Тип допплеровской кривой («tardus-parvus») и высокая систолическая скорость указывают на гемодинамически значимый стеноз почечной артерии.
Энергетическое допплеровское картирование было использовано в ультразвуковой диагностике для визуализации мелких сосудов, для чего было предложено использовать не частотный сдвиг, а амплитуду сигналов. Если при ЦДК используют частотный сдвиг, отражающий скорость движения эритроцитов, то при энергетическом допплеровском картировании (ЭДК) используют амплитуду эхо-сигнала, которая отражает плотность эритроцитов в заданном объеме. С помощью ЭДК можно получать уголнезависимые изображения сосудистых структур, и практически любой сосуд, идущий под любым углом и направлением получает отображение на экране монитора (рис. 21). При сопоставлении изображений сосудов, полученных с помощью ЦДК и ЭДК, последние имеют ряд преимуществ по чувствительности и точности передачи информации, особенно в мелких сосудах [1]. Новые компьютерные технологии обеспечивают даже панорамные изображения сосудов, но при ЭДК отсутствует возможность определить направление тока крови в нем. К недостаткам ЭДК следует отнести высокую зависимость от движения окружающих структур и возникновение, так называемых, артефактов движения.
Нативное контрастирование позволяет получать отображение движения эритроцитов в просвете сосуда при сканировании в В-режиме, так называемое спонтанное контрастирование (естественное контрастирование). Применение специальных программных средств и высокочувствительных широкополосных датчиков, использующих матричную технологию сбора информации, позволяет сейчас получать диагностически значимое естественное (нативное) контрастирование тока крови в просвете сосудов без использования эхоконтрастных препаратов и цветового картирования (методики B-Flow, Sie-Flow, Dynamic-Flow). Основным преимуществом таких методик является их независимость от угла сканирования и отсутствие артефактов. Все эти методики способны хорошо отображать естественный ток крови преимущественно в поверхностно расположенных сосудах.
Возможности ультразвукового сканирования существенно расширились в связи с внедрением в практику новых ультразвуковых технологий, основанных на эффекте Допплера. Примером такой технологии может служить методика Dynamic-Flow, которая способна обеспечить отображение тока крови вне зависимости от глубины залегания сосуда (рис. 22). Эта ее способность основана на одновременном использовании технологии широкополосного сканирования и оценки допплеровского сдвига эритроцитов.

Рис. 21. Эхограмма глаза. Режим ЭДК. Сосуды хориоидеи и ретробульбарного пространства Четкое отображение неизмененных сосудов.

Рис. 22. Эхограмма плода. Технология Dynamic Flow. Хорошо видны брюшная аорта и внутрипочечные сосуды.
Следует подчеркнуть, что новые методики ультразвуковой ангиографии позволяют визуализировать кровоток в зоне опухолевых и воспалительных изменений. Особенно эффективны методики ультразвуковой ангиографии в сочетании с трехмерной реконструкцией, обеспечивающей изображение как крупных, так и мелких сосудов даже без дополнительного контрастного усиления. Трехмерная реконструкция сосудов в режиме энергетического картирования высоко информативна в оценке характера васкуляризации образования и органа в целом, и все шире используется в клинической практике для диагностики и мониторинга лечения различных патологических состоянии [2-7]
3. Трехмерная эхография
Сегодня почти половина диагностических изображений, получаемых с помощью КТ и МРТ представлены в трехмерном режиме и обрабатываются на компьютерной рабочей станции [8] Обозначенные тенденции в равной мере можно отнести и к ультразвуковому методу. Тем более, что для обработки ультразвуковых трехмерных изображений используются апробированные при КТ и МРТ компьютерные технологии: многоплановая реконструкция Multiplanar Reconstruction или «MPR», проекция максимальной «МIР» и минимальной интенсивности «MinlP», поверхностная реконструкция объекта Surface shading rendering или «3D Volume Rendering». Преимуществами трехмерной эхографии являются
- Получение объемного представления об органе и его послойной структуре во всех трех плоскостях с возможностью анализа фронтальных срезов, получение которых невозможно при двухмерном сканировании.
- Возможность хранения и воспроизведения волюметрической информации.
- Возможность независимого ретроспективного анализа всего объема информации другими исследователями,
4 Компьютерная обработка полученных объемных изображений в различных режимах" многоплановая реконструкция, проекция максимальной и минимальной интенсивности, поверхностная реконструкция объекта.
5. Сокращение времени обследования пациента.
Получение с помощью методик УЗ-ангиографии качественных изображений сосудистых структур разного калибра и направления позволило перейти к новой оценке этих сосудов, а именно построению пространственной карты сосудистого дерева. Это стало возможным с новыми компьютерными программами обработки изображений сосудов в трехмерном режиме (3D). ЗD-изображения сосудов сейчас можно получать практически в реальном времени, затратив на весь процесс не более 10 секунд. При этом сканирование ведется как в В-режиме, так и в режиме УЗ-ангиографии, а получаемые изображения отслеживают или на мониторе ультразвукового сканера, или на экране дополнительного компьютера
При построении трехмерных изображений применяют либо автоматический сбор объемной информации при использовании специального трехмерного ультразвукового датчика, либо поступательное перемещение исследователем обычного датчика с последующей компьютерной реконструкцией объема. Более сложные и качественные изображения исследуемых структур можно получать после обработки всех собранных данных на компьютерной станции. Возможность пространственной или объемной оценки хода сосудов, изучение взаимоотношения сосудов органа и опухоли являются определяющими для хирурга при планировании операции (рис. 23). Новые диагностические возможности ультразвукового метода, связанные с ЗD-реконструкцией сосудов, обуславливают большой интерес к новому методу, что ускоряет его внедрение в практику.
Нами уже накоплен определенный опыт использования 3D эхо-ангиографии при исследовании печени, почек, органов мошонки, предстательной железы и мочевого пузыря [9-15]. Сегодня есть возможность использовать при построении ультразвуковых трехмерных изображений хорошо апробированные при КТ и МРТ компьютерные технологии. В их число входят: многоплановая реконструкция (Multiplanar Reconstruction или «MPR»), проекция максимальной интенсивности (Maximum Intensity Projection или «М1Р»), поверхностная реконструкция объекта (Surface shading rendering или «3D Volume Rendering»). Применение вышеупомянутых технологий в ультразвуке обеспечивает создание объемных высокоинформативных виртуальных изображений различных органов (рис. 24 а, б). Использование мощных компьютерных возможностей сканера во время проведения ультразвукового исследования обеспечивает получение уникальных «живых» изображений. Трехмерная эхография обладает несомненным преимуществом перед двухмерным сканированием, что отмечено в многочисленных публикациях [8- 26]. Визуализация исследуемых структур на фронтальных срезах при трехмерной реконструкции является хорошим дополнением к информации, получаемой при обычном двухмерном исследовании.

Рис. 23. Технология Dynamic Flow и объемная реконструкция сосудов печени. Хорошая пространственная дифференциация вен печени.

Рис. 24 а. Виртуальная объемная эхография глазного яблока. Неизмененный хрусталик.

Рис. 24 б. Виртуальная объемная эхография глазного яблока. Посттравматическая катаракта хрусталика.
Часто двухмерная ультразвуковая ангиография не позволяет выявить взаимоотношения почечных сосудов, лоханки и мочеточника. 3D виртуальная эхо-ангиография с использованием мультипланарной реконструкции, режима Maximum Intensity Projection помогает установить уровень отхождения почечных сосудов от аорты, возможное наличие добавочного сосуда, а последующий анализ изображений в режиме Minimum intensity projection дополнительно обеспечивает визуализацию чашечно-лоханочной системы с мочеточником и показывает их взаимоотношение (рис. 25).
К преимуществам нового метода следует также отнести возможность проведения ретроспективного анализа всего объема информации другими исследователями, что значительно сокращает время на обследование пациентов и может быть использовано для стандартизации подхода к диагностике при ультразвуковом исследовании.

Рис, 25 3D виртуальная эхография почки. В режиме ангиографии (MIP) и урографии (MinIP) хорошо видно взаимоотношение сосудов почки и мочеточника. Стриктура мочеточника, без признаков уретерова зального конфликта.
Последним достижением интенсивно развивающихся ультразвуковых технологий является появление коммерческой модели УЗ-аппарата, позволяющего производить трехмерную реконструкцию сосудов и сердца в реальном времени простым нажатием кнопки переводя изображение из двухмерного в трехмерное
Использование для этих целей аппаратов с высокочастотными датчиками выигрышно с физической точки зрения. С увеличением частоты посылаемого сигнала пропорционально увеличивается и частота допплеровского сигнала. При этом сила возвращающегося сигнала, отраженная частота, увеличивается в 4 раза по отношению к исходной, излученной частоте. Теоретически, повышая частоту датчика, мы улучшаем его разрешающую способность. На практике, повышая частоту сканирования, мы снижаем проникающую способность ультразвукового сигнала. Поэтому, проникающая способность ультразвукового луча, ограничена максимальным пределом допустимых к использованию частот.
Устранить эти основные помехи помогли эхоконтрастные вещества, обеспечившие усиление отраженного ультразвукового сигнала от элементов крови. Принцип резонирующего действия эхоконтрастных препаратов (ЭКП) основан на циркуляции в крови ничтожно малых частиц, обладающих акустическими свойствами. Наиболее важными из этих акустических эффектов считают: усиление отраженного эхо-сигнала; уменьшение затухания эхо-сигнала; скорость распространения акустического эффекта; циркуляцию ЭКП в сосудистой системе или их избирательный захват определенными тканями.
Микропузырьки взаимодействуют с ультразвуковым сигналом двояким образом: энергия ультразвукового излучения разрушает микропузырьки; при высокочастотном ультразвуковом излучении микропузырьки начинают резонировать и лопаться. Так, в основу использования первого поколения эхоконтрастов был положен физический принцип линейного преобразования отраженного ультразвукового сигнала от микрочастиц («linear» microbubble backscatter response). При этом методе используется излучаемая частота низких и средних значений. К недостаткам линейной модели ответа относится быстрое разрушение микрочастиц контраста, что является препятствием для качественной оценки их эффекта. В последнее время в разработке ЭКП доминирующее положение стала занимать нелинейная модель ответа («non-linear» backscatter response), когда повышение амплитуды ультразвукового сигнала до средних значений приводит к появлению энергии субгармоники, второй, третьей гармоники и т. д. Этот эффект контрастного усиления можно считать аналогичным феномену осцилляции или «вспышки». Начало осцилляции происходит, когда микропузырьки увеличиваются примерно в два раза перед разрывом. Эффективность изображений при второй гармонике находится в сложной зависимости от дозы используемого контраста и параметров оборудования. Под воздействием высокоамплитудного ультразвукового сигнала происходит разрыв микропузырьков, и начинает генерироваться своеобразный акустический сигнал. Эта нелинейная, преходящая, временная реакция получила название «стимулированной акустической эмиссии», которая стала новым направлением развития ЭКП.
Особые акустические резонансные свойства микропузырьков позволяют создавать специальные, ориентированные на эти свойства методы сканирования. Как уже упоминалось, этот метод сканирования получил название второй гармоники [1, 7, 27-30]. Он основан на феномене нелинейной осцилляции резонирующих микропузырьков, позволяет повысить чувствительность обнаружения мелких сосудов. Комбинация контрастного усиления и методики второй гармоники способна значительно улучшить визуализацию мелких сосудов. Сильное новое отраженное эхо с удвоенной частотой носит название «второй гармоники». С помощью компьютерной обработки подавляются сигналы от окружающих тканей и даже эритроцитов, но сохраняются сигналы от микропузырьков газа в сосудистом русле (рис. 26). Происходит явление аналогичное субтракции при рентгеновской ангиографии. Сочетанное использование методики второй гармоники и ЭДК позволяет получать четкое изображение сосудов, располагающихся рядом с двигающимся или пульсирующим органом, так как исчезают артефакты движения. При работе с широкополосными многочастотными датчиками, в отличие от классической второй гармоники, когда посылается одна частота и принимается только удвоенная, может быть получена широкополосная гармоника, так как сканирование идет в диапазоне различных частот. Поскольку микропузырьки контрастного вещества генерируют больше гармоник, чем ткань исследуемого органа, то возникает сигнал, перекрывающий сигнал от ткани органа. Этот сигнал можно изучать в широком спектре частот, обеспечивая сбор всех отраженных сигналов.
Принципиально отличной является методика инверсионной гармоники, когда в режиме серой шкалы одновременно посылаются два ультразвуковых импульса: первый - обычный, а второй - его перевернутая копия. Суммарный отраженный сигнал от ткани органа можно представить в виде прямой линии, так как каждая ее точка имеет положительный и отрицательный ответ, которые как бы отрицают друг друга. Микропузырьки же контрастного вещества по разному реагируют на положительный и отрицательный импульсы и выглядят как более светлые точки, чем ткань органа между двумя импульсами.

Рис. 26. Фокально-узловая гиперплазия печени. Эхоконтрастное исследование с использованием «второй гармоники». Хорошо видны контрастированные сосуды в опухоли по типу «колеса телеги».

Рис. 27. Эхоконтрастное исследование почки с Левовистом. Отмечается хорошее контрастирование сосудов по периферии и в центре опухоли.
Наиболее клинически апробированным эхоконтрастным препаратом является Левовист, который прошел широкие клинические испытания на большом количестве пациентов, в том числе и в России, и зарекомендовал себя как абсолютно безопасный, неэмбриотоксичный, неканцерогенный, не обладающий тератогенными свойствами и не вызывающий генных мутаций препарат.
Наш опыт применения Левовиста показал, что препарат обеспечивает достаточно хорошее контрастирование небольших по диаметру сосудов, в том числе опухолевых, визуализация которых без эхоконтраста невозможна (рис. 27) Входящие в состав Левовиста галактоза и пальмитиновая кислота являются веществами природного происхождения, входящими в состав пищевых продуктов, таких, например, как молоко. Галактоза в используемом диапазоне доз и концентраций не оказывает влияния на функции центральной нервной, сердечно-сосудистой, дыхательной и других систем организма. В организме препарат быстро метаболизируется. Период полужизни галактозы составляет 10-11 минут у взрослых и 7-9 минут у детей. В печени D-галактоза превращается в галактозо-1-фосфат или метаболизируется с выделением СО2 после изомеризации до глюкозо-1 -фосфата. При наличии заболеваний печени до 60% введенной галактозы элиминируется почками, а остальные 40% - утилизируются внепочечными механизмами; кумулятивным эффектом она не обладает. Применение Левовиста у пациентов с печеночной недостаточностью не оказывает никаких побочных реакций. Широкие клинические испытания у пациентов с ишемической болезнью сердца продемонстрировали абсолютную безвредность Левовиста даже у пациентов с серьезной коронарной патологией [20]. Специальные тесты на микроэмболизацию показали отсутствие этого риска. Эффект разрыва микропузырьков (их резонирование) не вызывает никаких ощутимых физиологических эффектов.
Акустические свойства Левовиста зависят от его дозы. Чем больше концентрация препарата, тем сильнее контрастирование. Надо отметить, что более концентрированные растворы Левовиста стабильнее, чем менее концентрированные. Для контрастного усиления используют концентрации Левовиста от 200 до 400 мг. Большинство исследований проводится с двукратным введением раствора контрастного вещества каждому пациенту - ЗООмг/мл в первый раз и в концентрации 400 мг/мл - во второй раз от 4 до 10 мл. Но можно вводить препарат и более двух раз - для получения более стойкого и четкого эффекта усиления. Максимальная разрешенная доза - 70 мл Левовиста в концентрации 400 мг/мл, что соответствует восьмикратной диагностической дозировке.
Готовят раствор Левовиста непосредственно перед его применением. Для этого от 4 до 10 мл стерильной воды, прилагаемой к каждой упаковке, набирают в шприц и с помощью пластиковой канюли переносят во флакон, содержащий порошок контрастного вещества. Немедленно вслед за этим производят энергичное встряхивание флакона в течение 10 секунд для получения суспензии. Полученная гомогенная суспензия молочно-белого цвета должна постоять 2 минуты и после этого готова к использованию. Гранулят и раствор контрастного препарата должны иметь комнатную температуру. По возможности следует избегать нагревания суспензии во время приготовления (например, при длительном держании флакона в руках) Через канюлю набирают готовый препарат в шприц и с помощью иглы для внутривенных инъекций Левовист вводят болюсно или инфузионно.
Однако сегодня в большинстве клиник мира более широко используется эхоконтрастный препарат Соновью (BR1, Sono Vue. Bracco) Это препарат уже следующего поколения, который рассчитан на новые технические возможности современной ультразвуковой аппаратуры. Важным при работе с Соновью является возможность прибора обеспечивать низкий механический индекс при сканировании (Ml<0,1). Это позволяет сохранить пузырьки препарата при сканировании и обеспечивает возможность непрерывной визуализации тока крови. Мы применили Соновью и для оценки характера васкуляризации опухолей печени для оценки почечной перфузии (рис 28 а). Соновью - состоит из микропузырьков, наполненных газом сульфургексафлюоридом, который выбран из-за своей высокой устойчивости к давлению. Препарат представлен в виде лиофилизированных частиц, содержащих фосфолипиды и полиэтиленгликоль 4000. Частицы содержатся в пробирке, заполненной газом сульфургексафлюоридом. Контраст приготовляется с помощью добавления 5 мл физиологического раствора к содержимому пузырька, который затем энергично встряхивают. Средний диаметр микропузырьков - 2-3 микрона, Препарат остается стабильным в течение 6 часов. Исследования токсичности препарата показали что в дозировке в 30 раз превышающей рекомендуемую, он не вызывает никаких побочных реакций, не оказывает действия на центральную нервную и сердечно-сосудистую системы Рекомендуемая дозировка - 2,4 мл. Возможно однократное повторение дозировки.

Рис. 28 а. Ультразвуковое исследование левой почки в В-режиме. Подозрение на два объемных солидных образования.
Рис 28 б. Эхоконтрастное исследование с Соновью. Через 33 секунды после введения Соновью в раннюю паренхиматозную фазу контрастирования подтверждается наличие в левой почке только простой кисты.
Представленные методики контрастного усиления могут обеспечить возможность получения уникальной диагностической информации, основанной на изучении гемодинамики исследуемого органа, оценки его перфузии Речь, прежде всего идет об характере контрастирования сосудистых структур непосредственно в самом органе или в новообразовании и зависимости эхоконтрастирования от времени. Доказано, что по характеру накопления контрастного вещества в опухоли возможна их дифференциальная диагностика [16-20 30]. Динамическая контрастная эхография (ДКЭ) позволяет получать информацию, сопоставимую с контрастным усилением при КТ или МРТ. Более того, при ДКЭ имеется возможность наблюдать все фазы контрастирования при непосредственной, «живой» визуализации органа патологического очага или сосуда во время ультразвукового сканирования Методика ДКЭ представляется многообещающей при поиске и дифференциальной диагностике опухолей различных локализаций. С другой стороны чрезвычайно важной является информация о перфузии органа, то есть информация о скорости прохождения крови через ткань органа. Изучение перфузии органа дает нам ценную информацию о состоянии клеточных структур изучаемого органа. Так, с помощью эхоконтрастирования может быть получена информация о состоянии перфузии в миокарде, печеночной и почечной ткани (рис. 28 б). Диагностические возможности ультразвукового метода здесь трудно переоценить, так как информативность эхоконтрастирования чрезвычайно высока, а сама методика относится к безвредным и неинвазивным процедурам.
ГЛАВА 3
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА ПОРАЖЕНИЙ АРТЕРИЙ ДУГИ АОРТЫ И ОСНОВАНИЯ МОЗГА
Общепризнано, что поражения артерий дуги аорты и их интракраниальных ветвей играют ведущую роль в патогенезе нарушений мозгового кровообращения (НМК), развитии инфарктов мозга, преходящих нарушений мозгового кровообращения (ПНМК), дисциркуляторных энцефалопатий, а показатели смертности от инсульта занимают второе место после онкологических заболеваний [1-3]. Из 10 граждан, обращающихся к врачу в поликлинику, 7 жалуются на головную боль, причины которой в большинстве случаев обусловлены функциональными и/или органическими изменениями в сосудистой системе головы. Поэтому трудно переоценить важность и необходимость получения объективной информации о магистральных артериях головы (МАГ) и основания мозга.
В настоящее время установлено, что наиболее доступным достоверным методом неинвазивной диагностики поражений сосудов дуги аорты и их ветвей является ультразвуковая допплерография (УЗДГ). Сравнительно простая, безопасная, недорогая и легко повторяемая методика, не имеющая противопоказаний, сравнимая по информативности с ангиографией [4, 5].
В 1975 году мы впервые в стране применили метод ультразвуковой допплерографии у больных с нарушениями мозгового кровообращения и выявили поражения сонных и позвоночных артерий (подтверждённые при ангиографии), обусловившие эти нарушения, разработали и усовершенствовали технику исследования, создали, проверили и ввели в клиническую практику алгоритмы диагностики поражений магистральных артерий головы [6].
В 1982 г. R. Aaslid et al. [7] усовершенствовали методику ультразвуковой допплерографии, применив её для исследования интракраниальных артерий непосредственно через кожу черепа. Появление транскраниального ультразвукового метода произвело фурор в ангиохирургии и неврологии, открыло широкие диагностические возможности и позволило сделать ещё один шаг в исследовании сосудистой системы мозга [8-11].
Предпосылкой к появлению в стране УЗДГ послужила, начатая в 60-е годы в Институте неврологии АМН под руководством академика Е.В. Шмидта, разработка нового фундаментального направления в неврологии - сосудистых заболеваний нервной системы, т. е. всестороннего изучения сонных и позвоночных артерий и их интракраниальных ветвей [12-13]. По рекомендации Всемирной организации здравоохранения и Министерства здравоохранения в институте изучали вопросы эпидемиологии цереброваскулярных заболеваний методом УЗДГ и было установлено, что у мужчин в возрасте после 45 лет имеют место поражения МАГ и все они нуждаются в диспансерном наблюдении и проведении профилактических мероприятий, для объективного контроля за которыми в каждой поликлинике необходимо наличие 1-2-х допплеровских измерителей кровотока.
Одновременно мы последовательно проводили работу по внедрению в практическую медицину этого эффективного диагностического метода основным препятствием, на пути распространения которого стало отсутствие отечественных ультразвуковых приборов. В 1980 году нами совместно с Ю.С Важновым и др. был создан первый отечественный допплеровский измеритель кровотока с выделением направления, но только с разработкой в середине 90-х годов недорогих отечественных универсальных допплеровских измерителей кровотока («Ангиодин» «Сономед-300», и др.) стало возможным говорить о появлении в России серийных приборов международного класса, что открыло перспективы для распространения метода УЗДГ в практической медицине [14, 15]
Итак, с методикой УЗДГ открылась эра применения ультразвуковых методов диагностики в отечественной неврологии.
Сегодня установлено, что многие заболевания связанные с поражением центральной нервной системы могут иметь в своей основе поражение сосудов дуги аорты, их экстра- и интракраниальных ветвей. Поэтому сегодня уже невозможно представить современную ангионеврологию без использования ультразвуковых методов диагностики. И хотя в медицинской среде понятие «ультразвук» на слуху немного найдется врачей, которые дадут точный ответ на вопрос - «Что такое ультразвук?»
Ультразвук представляет собой гармоническое механическое колебание упругой среды, например тканей тела, обладающие определенной энергией. По физической природе он не отличается от звуков, воспринимаемых человеком а различается лишь более высокой частотой, превышающей верхний порог слышимости (20 кГц).
Основы получения информации о внутренней структуре объекта с помощью ультразвука заложены в принципе эхолокации, который реализуется на практике различными режимами работы, наиболее используемыми являются А-; В- D-режимы, их сочетания и разновидности.
А-режим (от английского amplitude - амплитуда) представляет интенсивность отраженного эхо-сигнала в виде амплитуды и расстояния до лоцируемого объекта. В неврологии получил своё первое клиническое признание - эхоэнцефалоскопия (лоцирование срединных структур мозга)
В-режим (от английского brightness - яркость). В настоящее время большинство ультразвуковых исследований выполняют на аппаратах, работающих в В-режиме, позволяющих получать двухмерное изображение тканей и органов. При этом датчик производит периодическое излучение УЗ импульсов во внутренние структуры организма и прием сигналов, отраженных акустическими неоднородностями структур. Совокупность принятых сигналов (разной яркости), называемых эхо-сигналами, позволяет получить акустическое изображение биологических тканей и органов на мониторе. В литературе и практическом здравоохранении метод сохранил различные названия двухмерное ультразвуковое исследование, эхотомография ультразвуковое сканирование,
УЗИ, ультразвуковая ангиография и др., является сегодня наиболее распространённым и информативным во всех областях медицины.
D-режим (от Допплера-эффект). Метод основан на эффекте, открытом в 1842 г. австрийским физиком К. Допплером. Суть его состоит в изменении длины волны при ее отражении от движущейся преграды. Отражение от препятствия, приближающегося к источнику сигнала, вызывает увеличение частоты исходного колебания, при удалении - приводит к понижению частоты. Измерение частотного сдвига позволяет определить скорость и направление смещения движущихся структур, например, потока крови в сосуде D-режим заложен в основу всех приборов, позволяющих исследовать и оценивать кровообращение в артериях, венах и капиллярах. Они могут иметь одни или несколько режимов работы: постоянно-волновой (CW), импульсный (PW), цветового допплеровского кодирования (CD) и др. D-режим использован в широко распространенных методиках ультразвуковой допплерографии, транскраниальной допплерографии и новых методиках: дуплексного и триплексного сканирования, транскраниального дуплексного сканирования.
Дуплексное сканирование объединяет, возможности двухмерного изображения (В-режим) и одного допплеровского режима, а сочетание В-режима с цветовым и спектральным допплеровским режимом получило название триплексного сканирования (цветового допплеровского сканирования).
Оба метода сканирования являются новыми достижениями в ультразвуковых исследованиях кровообращения человека, продолжают непрерывно совершенствоваться - ежегодно появляются новые технологические режимы (трёхмерное и четырехмерное изображение, внутрисосудистое сканирование и др.), повышающие диагностические возможности ультразвуковых приборов. К сожалению, ввиду их высокой стоимости широкого распространения в медицинской практике они еще не получили.
1. Анатомо-функциональное состояние сосудов дуги аорты и основания мозга
От выпуклой поверхности дуги аорты отходят: плечеголовной ствол (ПГС), левая общая сонная артерия (ОСА) и левая подключичная артерия (ПКА). Плечеголовной ствол, длиной 2-5 см, направляется косо вправо и вверх впереди трахеи и несколько ниже уровня правого грудино-ключичного сустава, делится на правую общую сонную и правую подключичную артерии. Левая ОСА и правая ПКА отходят левее плечеголовного ствола.
Обе общие сонные артерии, направляясь вверх, проходят позади грудино-ключичного сочленения каждой стороны. На шее лежат почти вертикально, причем правая несколько ближе к срединной линии шеи (рис. 29). Медиальнее от сонных артерий располагаются глотка, гортань, трахея и щитовидная железа. Кнаружи и несколько кпереди от каждой общей сонной артерии, в общем с ней влагалище, лежит внутренняя яремная вена, а между ними и позади - блуждающий нерв; все они вместе образуют сосудисто-нервный пучок шеи.
В нижнем отделе шеи каждая сонная артерия прикрыта спереди грудино-ключично-сосцевидной мышцей. Задняя поверхность общей сонной артерии прилежит к лестничным мышцам, к длинной мышце шеи и к передним бугоркам поперечных отростков шейных позвонков, а слева, кроме того, к выступающему из под трахеи краю пищевода.

Рис. 29 Общий вид строения артерий дуги аорты и основания мозга 1 - правая подключичная артерия, 2 - общая сонная артерия. 3 - наружная сонная артерия, 4 - позвоночная артерия, 5 - основная артерия 6 - передние мозговые артерии 7 - задние мозговые артерии, 8 - средняя мозговая артерия 9 - каротидный сифон, 10 - каротидный канал, 11 - большое затылочное отверстие, 12 - внутренняя сонная артерия, 13 - левая подключичная артерия. 14 - дуга аорты. 15 - плечеголовной ствол
На уровне верхнего края щитовидного хряща общая сонная артерия делится на наружную и внутреннюю сонные артерии, но лишь в 50% случаев бифуркация находится на этом уровне. Часто деление сонной артерии происходит на уровне подъязычной кости или между подъязычной костью и верхним краем щитовидного хряща. В редких случаях (0,5%) бифуркация может быть расположена на основании черепа либо на уровне VII шейного -1 грудного позвонков, о чём нужно помнить при определении места бифуркации.
Рис. 30. Схема строения общей сонной артерии и ее ветвей и анатомических путей коллатеральных анастомозов по системе глазной артерии и артериальному кругу большого мозга. 1 - контралатеральная общая сонная, 2 - общая сонная, 3 - наружная сонная, 4 - внутренняя сонная, 5 - средняя менингеальная, 6 - передняя барабанная, 7 - глазная 8 - основная, 9 - задняя соединительная, 10 - задняя мозговая, 11 - поверхностная височная, 12 - средняя мозговая, 13 - поверхностная височная - надглазничная ветвь. 14 - надблоковая ветвь, 15 - передняя соединительная, 16 - передняя мозговая, 17 - надглазничная, 18 - надблоковая, 19 - слезная, 20 - средняя века, 21 - тыльная носа, 22 - боковая века, 23 - угловая, 24 - поперечная лица, 25 - верхнечелюстная, 26 - лицевая.
В расширении бифуркации располагается синокаротидная рефлексогенная зона. Она содержит баро- и хеморецепторы, которые участвуют в регуляции артериального давления и химического состава крови. Особенности строения синокаротидной зоны требуют предельной осторожности при манипуляции в этой области, особенно у пожилых людей.
В области бифуркации общей сонной артерии внутренняя сонная чаще всего лежит сзади и латерально от наружной, что принципиально важно при локации, а по мере удаления от бифуркации внутренняя сонная артерия отклоняется медиально и уже располагается внутри от наружной. Сначала наружная сонная артерия располагается поверхностно, будучи прикрыта широкой подкожной мышцей шеи и поверхностной фасцией шеи. Затем, направляясь вверх, на уровне шейки суставного отростка нижней челюсти она делится на верхнечелюстную артерию и поверхностную височную, которые образуют группу конечных ветвей (рис. 30). Кроме того, она отдает ряд ветвей, которые по своим топографическим особенностям разделяются на три группы: переднюю (верхняя щитовидная, язычная и нижнечелюстная артерии), заднюю (гру- дино-ключично-сосковая, затылочная и задняя ушная артерии), медиальную (восходящая глоточная артерия).
Внутренняя сонная артерия почти отвесно поднимается вверх к черепу, достигая наружного отверстия сонного канала, и проходит через него; при выходе из сонного канала она вступает в пещеристый синус, где образует S-образный изгиб. Затем внутренняя сонная артерия прободает твёрдую мозговую оболочку, делает изгиб выпуклостью вперёд и здесь отдаёт первую крупную ветвь - глазную артерию, после чего поворачивает назад и делится на две конечные ветви - переднюю и заднюю мозговые артерии. Из полости черепа глазная артерия (ГА) через канал зрительного нерва проникает в орбиту, направляясь к её верхнемедиальному отделу, и, подойдя к блоку, делится на свои конечные ветви - надблоковую артерию и артерию спинки носа, которые анастомозируют с ветвями наружной сонной артерии - поверхностной височной и лицевой артериями; от глазной артерии отходит надглазничная артерия, которая в области кожи анастомозирует также с ветвью поверхностной височной артерии. Глазная артерия через свою подглазничную ветвь анастомозирует с одноимённой ветвью верхнечелюстной артерии. Таким образом, глазная артерия с системой своих ветвей является как бы «мостом», связывающим между собой системы циркуляции наружной и внутренней сонной артерий (рис. 30). В норме кровоток по ветвям глазной артерии идёт из черепа наружу (физиологическое или антероградное направление). При возникновении поражений во внутренней сонной артерии может происходить включение анастомозов системы «моста», что приводит к изменению скорости кровотока, а иногда и её направления в самой глазной артерии и её ветвях. Поэтому регистрация кровотока и его направления по надблоковой (или глазной) артерии позволяют получать информацию о проходимости общей и внутренней сонных артерий на всём протяжении от их устья до отхождения глазной артерии.
Позвоночная артерия парная, начинается от верхневнутренней поверхности дуги подключичной артерии и, направляясь кверху, ложится позади общей сонной артерии (возможно сдавление при выполнении пережатия общей сонной артерии) вдоль наружного края длинной мышцы шеи. Она входит в отверстие поперечного отростка VI, а иногда V-III шейного позвонка и направляется вверх в позвоночном канале, образованном отверстиями в поперечных отростках шейных позвонков. Выйдя из поперечного отверстия II шейного позвонка, артерия начинает отклоняться кзади и кнаружи и в таком положении доходит до отверстия поперечного отростка атланта, проходит через него и делает дугообразный изгиб. Затем, повернув кверху, артерия прободает заднюю затылочно-позвоночную связку и твёрдую мозговую оболочку, проходит через большое затылочное отверстие в полость черепа. Здесь позвоночная артерия ложится на скат и под продолговатым мозгом направляется к средней линии. У заднего края моста левая и правая позвоночные артерии сливаются в одну непарную основную артерию. Закупорка или кратковременное пережатие одной позвоночной артерии в экстракраниальном отделе ведёт к падению градиента давления в этом месте и моментальному компенсаторному усилению кровотока по контра- латеральной позвоночной артерии с перетоком крови через место стыка на сторону поражения. При отсутствии слияния обеих позвоночных артерий такого усиления кровотока не происходит.
Основная артерия ложится на переднюю поверхность моста ствола мозга, направляясь вперёд и вверх, и на уровне переднего края моста делится на две конечные ветви - задние мозговые артерии, которые через задние соединительные артерии соединяются с внутренними сонными артериями; внутренние сонные артерии связаны между собой через передние мозговые передней соединительной артерией. Вся эта система образует на основании мозга своеобразный артериальный анастомоз - артериальный круг большого мозга (виллизиев круг). Он соединяет каротидную и вертебрально-базилярную системы и является ведущим коллатеральным путём при недостаточном поступлении крови в мозг, по какой либо из этих систем (рис. 30). При наличии соединительных артерий и нормальном функционировании артериального круга закупорка или кратковременная компрессия одной общей сонной артерии на шее вызывает моментальное компенсаторное усиление кровотока по другим магистральным артериям головы; этот феномен используют при проверке достоверности ультразвуковых сигналов, идущих с позвоночных артерий, и для оценки функционального состояния артериального круга. Артерии, из которых формируется виллизиев круг, вместе с интракраниальными участками позвоночных и основной артерией в литературе принято называть артериями основания мозга [13].
2. Ультразвуковая допплерография в диагностике поражений МАГ
2.1. Методика и техника ультразвуковой допплерографии при исследовании МАГ
При исследовании методом ультразвуковой допплерографии магистральных артерий головы необходимо соблюдать единые методические принципы: 1) располагать перед исследованием (если возможно) информацией о пульсации и положении лоцируемой артерии; 2) не допускать прижатия артерии датчиком во время исследования; 3) поддерживать надежный контакт между датчиком и кожей больного, используя контактную пасту или гель; 4) регистрировать допплерограммы при получении максимального, чёткого и устойчивого ультразвукового сигнала, так называемого артериального тона; 5) соблюдать неподвижность датчика при регистрации кровотока и во время выполнения функциональных проб; 6) выполнять компрессионные функциональные пробы осторожно, но чётко (после предварительной пальпации артерии); 7) считать компрессионную пробу выполненной точно и надежно только после того, как на неё получен 2-3 раза однотипный ответ; 8) повторить исследование через 5-10 мин. при сомнительных, нечётких результатах; 9) проводить исследование, по возможности, не ранее чем за 6 часов до приема лекарственных препаратов или физиотерапевтических процедур; 10) следить за самочувствием больного и отложить исследование при ухудшении.
Основы оценки показателей получаемой при УЗДГ допплеровской информации детально изложены в главе 1. Отметим только, что все характеристики допплерограммы (спектрограммы) разделены на качественные и количественные.
К важнейшим количественным показателям относят: пиковую, диастолическую и среднюю скорость кровотока, индексы резистентности, пульсации и др.
Качественные характеристики составляют: характер звукового допплеровского сигнала, направление кровотока, распределение частот в спектрограмме (подробно главы 1, 16).
Исследование сонных артерий методом УЗДГ выполняют в горизонтальном положении больного на спине. Врач садится рядом (возможно расположение за головой больного) и осуществляет осторожную, но тщательную пальпацию сонных артерий: определяет глубину залегания сонной артерии, ее подвижность, силу пульсации, обращая внимание на расположение бифуркации и особенности хода начальных участков внутренней и наружной сонных артерий. Перед началом исследования врачу необходимо провести эргономическую оценку своего положения в треугольнике: врач-прибор-больной, устранить возможные «неудобства» и несоответствия в расположении, создавая для себя и больного оптимально-комфортные условия, а затем приступить к обследованию.

Рис. 31. Локация кровотока по общей сонной артерии.
Ультразвуковой датчик (4МГц), с предварительно нанесенной контактной пастой, устанавливают над общей сонной артерией на 2-4 см ниже бифуркации, направляя его к голове (рис. 31). Датчик держат свободно, 1-3 пальцами за проксимальную часть под углом 45° и, не производя давления на кожу, медленно изменяют угол его наклона, добиваясь устойчивого звукового сигнала, чистого артериального тона и максимально чёткой допплерограммы (спектрограммы), которая, автоматически фиксируясь на экране прибора, отражает основные показатели кровотока по сосуду. Аналогичным образом регистрируют допплерограммы с начальных участков внутренней и наружной сонных артерий (рис. 32, 33). При этом не всегда возможно зарегистрировать истинные показатели линейной скорости кровотока (ИСК), так как сложно точно выставить угол локации сосуда. Иногда трудно определить, от какой из сонных артерий идет допплеровский сигнал. Для этого во время регистрации кровотока применяют простой прием: пальцем производят несколько ритмичных прижатий (3-5 в/с) поверхностной височной артерии (перед козелком над скуловым отростком височной кости) и/или лицевой (у края нижней челюсти или крыла носа). Такие прижатия (проба поколачивания) вызывают появление дополнительных пиков на спектрограмме, если ее определяют в НСА и не вызывают, если датчик расположен над ВСА.

Рис. 32. Локация кровотока по внутренней сонной артерии.

Рис. 33. Локация кровотока по наружной сонной артерии.

Рис. 34. Локация кровотока по надблоковой артерии.
Исследование кровотока по надблоковой артерии (НА) производят при закрытых глазах больного. Датчик (8 МГц) устанавливают у внутреннего угла глаза, направляя его к верхней стенке глазницы, параллельно стенке носа и медиально (рис. 34). Медленно изменяя угол наклона датчика, добиваются получения устойчивого звукового сигнала и максимально чётких пиков спектрограмм. Иногда надежный сигнал поступает на экран непосредственно с глазной артерии (датчик расположен почти перпендикулярно глазнице). Для регистрации кровотока по надглазничной артерии, датчик располагают на коже надбровной дуги в области надглазничной вырезки. Во время регистрации кровотока по надблоковой (глазной) и/или надглазничной артериям - для уточнения анатомо-функционального состояния системы внутренней и наружной сонных артерий - последовательно выполняют компрессию (на 6-8 с) гомолатеральной поверхностной височной и лицевой артерий и ветвей ГА, выходящих на кожу лба: сдавление кожи внутренних 2/3 надбровной дуги (рис. 35) - надбровный гемодинамический тест (НГТ). При выполнении компрессионных проб врач производит умеренное прижатие указательным пальцем каждой из артерий, прекращая кровоток по ним, что не должно вызывать болевых ощущений у пациента.
Исследование кровотока по верхней глазной вене производят после исследования надблоковой артерии. В медиальный угол глаза наносят большой шарик контактной пасты, в который погружают дистальный конец датчика (8 МГц), направляя его под прямым углом к задней стенке орбиты и медиально, получая четкую спектрограмму кровотока по глазной вене (ЛСК = 8-12 см/с), с физиологическим направлением в орбиту.
Исследование позвоночной артерии выполняют на уровне CI позвонка, голова повернута от лоцируемой артерии. Датчик (4 МГц) устанавливают по заднему краю грудино-ключично-сосковой мышцы на 2-3 см ниже сосцевидного отростка с направлением его оси к противоположной орбите. Путем медленного изменения угла наклона датчика и синхронного перемещения головы больного в сагиттальную плоскость (рис. 36) добиваются получения чёткого звукового сигнала артериального тона и фиксируют допплерограмму. Для идентификации сигнала ПА пережимают на 1-2 с гомолатеральную ОСА: снижение сигнала - показывает, что он поступает от сонной артерии; отсутствие изменений или усиление сигнала - указывает на правильную установку датчика.
Возможна локация позвоночной артерии на уровне CVII позвонка. Для этого голова больного повернута в сторону от исследователя: датчик устанавливают по заднему краю грудино-ключично-сосковой мышцы, как бы между CVI-CVII позвонками (ориентир - остистый отросток CVII позвонка) по направлению к грудине. За счет медленного изменения угла наклона датчика и перемещения головы больного в сагиттальную плоскость добиваются получения стабильного ультразвукового сигнала от ПА. При регистрации спектрограммы голова больного должна находиться в сагиттальной плоскости (даже небольшие повороты в сторону могут изменить показатели гемодинамики), что трудно осуществить при локации позвоночной артерии на уровне CVII позвонка.

Рис. 35. Локация кровотока по надблоковой артерии в сочетании с выполнением надбровного гемодинамического теста (объяснение в тексте).

Рис. 36. Локация кровотока по правой позвоночной артерии на уровне CI позвонка.
Подключичную артерию лоцируют (датчик 4 МГц) в положении больного на спине, в подключичной области на границе наружной и средней трети ключицы, где можно прощупать пульсацию артерии (3-я порция), направляют датчик под ключицу под углом 30-50° и медиально изменяя его наклон, получают на экране монитора типичную допплерограмму периферической артерии с наличием отрицательного пика. Возможна локация артерии и в надключичной ямке (дуга подключичной артерии) - датчик направляют в область пульсации сверху вниз и медиально, под углом 60-80°, обращая внимание на четкость аудиосигнала и получаемой спектрограммы
Плечеголовной этвол исследуют в области за грудиноключичным сочленением справа устанавливая датчик (4 МГц) в надгрудинной вырезке и направляя несколько вправо и вглубь. У полных больных успешно используют датчик 2 МГц, что можно применять у этих же больных, при затруднении локации позвоночных артерий.
2.2. Диагностика окклюзий, стенозов и деформаций
магистральных артерий головы
Окклюзия внутренней сонной артерии на шее чаще всего обусловлена атеросклерозом и составляет 8-12% всех поражений сонных артерий. Ультразвуковая диагностика окклюзии ВСА основана на анализе изменений гемодинамики в системе общей и внутренней сонных, надблоковой и/или надглазничной артерий с обеих сторон
При окклюзии внутренней сонной артерии на стороне поражения определяют следующие допплерографические изменения: 1) кровоток по ВСА не регистрируется; 2) снижение ЛСК по общей сонной артерии более чем на 30% по сравнению с контралатеральной и изменение спектральных характеристик потока; 3) изменение кровотока по надблоковой и/или надглазничной артерии: а) отсутствие кровотока б) ретроградный кровоток; в) антероградный кровоток не уменьшающийся при пережатии на 1-2 с гомолатеральной ОСА.

Рис. 37, Больной К. 48 лет Схема сосудов дуги аорты и спектрограммы кровотока по сонным и глазным артериям окклюзия ВСА слева с ретроградным кровотоком в мозг по левой ГА, стеноз правой ВСА с изменением спектральных характеристик по правым ОСА ВСА и ГА (подробно в тексте).
Достоверно диагностируют окклюзию ВСА при наличии первого и/или второго признаков в сочетании с одним из подпунктов третьего (рис. 37).
Окклюзия позвоночной артерии на шее составляет 3-5% всех поражений и имеет сегментарный характер. При окклюзии ПА на шее на стороне поражения выявляют следующие допплерографические изменения: 1) не определяется кровоток по ПА; 2) компенсаторное усиление кровотока по контралатеральной ПА (если она не поражена); 3) компрессия ПА в надключичной ямке не вызывает усиления ЛСК по контралатеральной позвоночной артерии.
Аналогичные изменения могут иметь место при гипоплазии позвоночной артерии у полных больных, что затрудняет дифференциальную диагностику окклюзии позвоночной артерии от ее гипоплазии.

Рис. 38. Спектральные характеристики кровотока у больных с атеросклеротическим поражением сонных артерий (по Arbeille Ph. et al., 1985). I степень: стеноз < 40 % по площади, < 23% по диаметру.

Рис. 39. Спектральные характеристики кровотока у больных с атеросклеротическим поражением сонных артерий (по Arbeille Ph. et al., 1985). II степень: стеноз 40-60% по площади, 23-40% по диаметру
При стенозе внутренней сонной артерии на стороне поражения могут иметь место следующие изменения: 1) участок ВСА с повышенной скоростью кровотока в области бифуркации, изменяющейся при перемещении датчика дистальнее места локации (подробно ниже); 2) участок ВСА с турбулентным потоком крови, выражающемся в типичном наложении допплеровских высокочастотных сигналов (связанных с повышением скорости) и низкочастотных сигналов, обусловленных вибрацией стенок (подробно ниже); 3) снижение скорости кровотока в общей и/или внутренней сонной артерии на 30% и больше по сравнению с контралатеральными артериями; 4) уменьшение диастолической составляющей скорости кровотока по ОСА и повышение индекса резистентности (ИР) в сравнении с контралатеральной стороной; 5) снижение скорости кровотока по надблоковой артерии на 40% и больше по сравнению с контралатеральной стороной; 6) появление ретроградного кровотока по надблоковой артерии при компрессии на 1-2 с гомолатеральной ОСА; 7) снижение скорости кровотока по надблоковой артерии при компрессии гомолатеральной лицевой и/или поверхностной височной артерии; 8) отсутствие снижения скорости кровотока по надблоковой артерии при выполнении НГТ; 9) усиление скорости кровотока по надблоковой артерии при компрессии (6-8 с) гомолатеральной поверхностной височной или лицевой артерии при отсутствии реакции усиления кровотока по контралатеральной артерии во время компрессии тех же артерий на соименной стороне; 10) снижение ЛСК по общей и внутренней сонным артериям и надблоковой артерии ниже показателей границы нормы; 11) изменение спектральных характеристик кровотока по сонной артерии.
При изменении спектральных характеристик необходимо различать следующие показатели: характер высокочастотной области спектра (размытый, расплывчатый при стенозе); наличие отрицательных частот (при выраженном стенозе и окклюзии); распределение яркостей (неравномерное распределение яркостей спектра и перемещение к зоне низких частот при стенозе); расширение спектра.
В настоящее время принято различать 5 степеней стеноза ВСА, которые представлены ниже.
- Стенозы <23% по диаметру и <40% по площади поперечного среза сосуда (рис. 38) трудны для диагностики и могут сопровождаться следующими изменениями спектра: незначительное снижение систолического пика по сравнению с контралатеральной артерией; небольшой разброс систолического пика; частичное закрытие спектрального окна.
- Стенозы 23-40% по диаметру и 40- 60% по площади (рис. 39) сопровождаются следующими изменениями спектра: разброс спектра высоких частот; снижение и уплощение вершины систолического пика; почти полное закрытие спектрального окна; концентрация яркостей спектра в зоне средних скоростей систолической фазы; увеличение индекса STI.
- Стенозы, составляющие 40-50% по диаметру и 60-75% по площади сопровождаются (рис. 40) теми же изменениями, что и предыдущая группа, но более подчеркнуты. Это не всегда позволяет их дифференцировать между собой.
- Стенозы 50-70% по диаметру и 75-90% по площади (рис. 41) сопровождаются следующими изменениями спектра: выраженное снижение систолического пика с неровной плоской вершиной; выраженный разброс спектра высоких частот; отсутствие спектрального окна; концентрация яркостей спектра в зоне средних и особенно низких частот; появление низкочастотного спектра ниже нулевой линии; появление высокого «свистящего» шума, иногда в сочетании с низкочастотным.

Рис. 40. Спектральные характеристики кровотока у больных с атеросклеротическим поражением сонных артерий (по Arbeille Ph. et al., 1985). Ill степень: стеноз 60-75 % по площади, 40-50% по диаметру.

Рис. 41. Спектральные характеристики кровотока у больных с атеросклеротическим поражением сонных артерий (по Arbeille Ph. et al., 1985). IV степень: стеноз 75-90 % по площади, 50-70% по диаметру.
- Стенозы более 70% по диаметру и более 90% по площади (рис. 42) сопровождаются следующими изменениями спектра: выраженное снижение пика систолической частоты; выраженный разброс и урежение высоких частот; концентрация яркостей спектра в зоне низких частот выше и ниже нулевой линии; повышение индекса ИР; появление грубого низкочастотного шума.
Для стенозирующих изменений позвоночной артерии характерно наличие на стороне поражения следующих отклонений в показателях спектрограммы: 1) снижение максимальной скорости кровотока по ПА ниже нормы; 2) снижение диастолической составляющей скорости кровотока по ПА. 3) изменение аудиохарактеристик регистрируемых звуковых сигналов скорости кровотока. 4) изменение спектральных характеристик, разброс спектра высоких частот, закрытие спектрального окна концентрация яркостей в зоне низких частот и др.; 5) асимметрия скорости кровотока по позвоночным артериям более 50% (возможна при вариантах развития); 6) усиление скорости кровотока по ПА во время сдавливания на 15-20 с манжетой тонометра гомо- латерального плеча с последующим возвращением к исходным цифрам после быстрой декомпрессии манжеты.
Глубоко ошибочным является представление отдельных врачей о том, что изменение показателей ЛСК по позвоночной артерии при поворотах головы в стороны служит признаком функциональной компрессии ПА или ее стеноза В этих случаях изменения ЛСК обусловлены всего лишь изменением угла локации позвоночной артерии, возникающим при поворотах головы, а не появлением функционального стеноза или закрытием просвета артерии.

Рис 42 Спектральные характеристики кровотока у больных с атеросклеротическим поражением сонных артерий (по Arbeille Ph et al. 1985). V степень стеноз > 90 % по площади > 70% по диаметру
Понятие нормальной скорости кровотока для сонных и позвоночных артерий несколько условно, т. к. нельзя точно определить угол локации артерии. Однако, на основании личного опыта (более 10 тыс. исследований) мы считаем что ошибка в измерении угла колеблется в пределах 5%, что совпадает с мнением ведущих зарубежных исследователей [16-18] Показатели нормы средней ЛСК получены нами при обследовании 233 военных лётчиков истребительной авиации на ультразвуковом дебитметре «DUD-02» фирмы «Delaia- nde Electronique» (Франция) и представлены в таблице 8.
Таблица 8. Показатели средней ЛСК (см/с) в норме для каждой возрастной группы [6]
|
Артерии |
Возрастные группы | |||||
|
<20 лет |
20-29 лет |
30-39 лет |
40-49 лет |
50-59 лет |
60 лет и старше | |
|
Левая ОСА |
31,7 ± 1,3 |
25,6 ± 0,5 |
25,4 ± 0,7 |
23,9 ± 0,5 |
17,7 ± 0,6 |
18,5 ± 1,1 |
|
Правая ОСА |
30,9 ± 1,2 |
24,1 ± 0,6 |
23,7 ± 0,7 |
22 6 ± 0,5 |
16,7 ± 0,7 |
18,4 ± 0,8 |
|
Левая НА |
12,3 ± 1,0 |
10,3 ± 0,6 |
10,6 ± 1,0 |
10 4 ± 0,8 |
10,З ± 0,8 |
7,7 ± 0,7 |
|
Правая НА |
11,3 ± 0,9 |
10,1 ± 0,7 |
9,2 ± 0,6 |
9,5 ± 0,6 |
10,3 ± 0.8 |
7,1 ± 0,6 |
|
Левая ПА |
18,4 ± 1,1 |
13,8 ± 0,8 |
13,2 ± 0,5 |
12,5 ±0,9 |
13 4 ± 0,8 |
12,2 ± 0,2 |
|
Правая ПА |
17,3 ± 1,2 |
13,9 ± 0,9 |
13,5 ± 0,6 |
12,4 ± 0,7 |
14,5 ± 0.8 |
11,5 ± 0,8 |
Деформации (перегибы и извитости) внутренних сонных артерий могут проявлять себя как окклюзии или стенозы, являясь причиной НМК. В литературе этот вид патологии получил различные названия: удлинение, извитость образование колец и спиралей аркообразная петля, патологическая извитость с образованием перегибов и др., Как самостоятельную группу поражений (по характеру механизма их возникновения), вызывающих изменения просвета сосуда Верещагин Н.В. 1997 [1] назвал их деформациями, что включает в себя растяжение, сжатие сдвиг, кручение изгиб сосуда. Различают 3 основные формы изменения хода ВСА 1) С- и S-образные удлинения (девиация); 2) петлеобразование (коиллинг): 3) перегибы (кинкинг). С последней группой, которую мы характеризуем как перегибы и извитости, по мнению большинства исследователей и связаны нарушения мозгового кровообращения (подробно в главе 7). Мы разработали простой и эффективный способ диагностики. Перегиб и извитость ВСА на шее диагностируют с помощью УЗДГ, путем выявления на стороне поражения следующих изменений. 1 Снижение (иногда до 0) скорости кровотока по надблоковой артерии; 2, Умеренное снижение ЛСК по ОСА на стороне перегиба с повышением ИР (в пределах нормы) по сравнению с контралатеральной артерией; 3. Выраженное усиление ЛСК по НА (в 1.5-2 раза и более) при компрессии (5-7 с) гомолатеральной височной и/или лицевой артерии; 4 Частичное или полное закрытие спектрального окна в сочетании с разбросом систолического пика на спектрограммах внутренней сонной артерии; 5 Асимметрия реакции на компрессию контралатеральной ОСА при регистрации кровотока по надблоковой артерии, при компрессии общей сонной артерии на стороне изгиба отмечают явное, выраженное (6-10 см/с) увеличение ЛСК по контралатеральной надблоковой артерии; при этом отсутствие увеличения или незначительное усиление скорости кровотока по гомолатеральной надблоковой артерии (чёткая асимметрия по сравнению с противоположной) при пережатии контралатеральной общей сонной артерии.
Если первые 4 признака могут иметь место и при стенозах сонных артерий то пятый является патогномоничным для перегиба внутренней сонной артерии.
2.3. Диагностика синдрома подключичного обкрадывания и оценка коллатерального
кровоснабжения мозга
Окклюзирующие поражения плечеголовного ствола или подключичной артерии в устье, как правило, сопровождаются развитием синдрома подключичного обкрадывания или подключичного стил-синдрома, и имеют место в 1-3% наблюдений [6, 19, 20] При этом на стороне окклюзии происходит снижение давления в подключичной и позвоночной артериях, что ведет к возникновению градиента давления и формированию ретроградного потока крови в ПА, поступающего, чаще всего, из контралатеральной ПА. При определённых условиях это может приводить к снижению кровоснабжения ствола мозга (обкрадыванию) и возникновению нарушения кровообращения в вертебрально-базилярной системе.
Методика определения синдрома подключичного обкрадывания заключается в выявлении изменений ЛСК по позвоночной и/или подключичной артериям в сочетании с регистрацией положительного теста реактивной гиперемии.
Тест реактивной гиперемии является ключевым при постановке диагноза окклюзирующего поражения устья подключичной артерии в сочетании со стил-синдромом и должен быть выполнен при наличии асимметрии ЛСК по позвоночным артериям в 30% и более. Для его выполнения на плечо больного на стороне непрерывно лоцируемой ПА накладывают манжетку тонометра, и на 60-90 с устанавливают в ней давление на 20-40 мм рт.ст. выше артериального давления больного, прекращая дистальный кровоток руки. Если после быстрой декомпрессии манжеты возникает изменение градиента давления между позвоночной и плечевой артериями, что выражается чётким увеличением максимальной скорости кровотока по ПА, то можно говорить о положительном тесте реактивной гиперемии и наличии окклюзирующего поражения подключичной артерии в устье в сочетании с подключичным стил-синдромом (рис. 43).
Заподозрить возможность подключичного стил-синдрома врач может и при выявлении его косвенных признаков, таких как: 1. асимметрия артериального давления в плечевых артериях на 10 мм рт. ст. и более; 2. выслушивание систолического шума в надключичной ямке; 3. снижение амплитуды спектрограммы подключичной артерии с расщеплением или закруглением вершины, исчезновением отрицательного пика и увеличением времени подъема и спада скорости кровотока; 4. идентичность спектрограмм позвоночной и гомолатеральной подключичной артерий.
В зависимости от степени выраженности стенозирующего процесса в устье подключичной артерии в литературе [20-22] различают три вида подключичного стил-синдрома: 1. латентный (скрытый) - стеноз 50-60%; 2. преходящий - стеноз 60-80%; 3 постоянный - окклюзия или стеноз >90 %.
Каждому из них соответствует определённое изменение допплерограмм, которое в сочетании с реакцией на тест реактивной гиперемии - под воздействием которого можно наблюдать переход из одной стадии подключичного обкрадывания к другой - позволяет точно определять степень поражения подключичной артерии в устье.

Рис. 43. Схема положительного теста реактивной гиперемии: усиление ЛСК по позвоночной артерии после декомпрессии гомолатеральной плечевой артерии (стрелка на спектрограмме).
Различают 3 степени изменения кровотока по ПА, прямо обусловленных степенью выраженности окклюзирующего поражения гомолатеральной подключичной артерии в устье. 1-я степень - снижение и расщепление систолического пика спектрограммы ПА. При выполнении теста реактивной гиперемии во время компрессии гомолатерального плеча происходит усиление физиологического кровотока по ПА, и она становится как бы нормальной; после декомпрессии плеча градиент давления возрастает и направление потока в фазе систолы может стать ретроградным, а в фазе диастолы - физиологическим. Таким образом, спектрограмма становится идентичной таковой при преходящем синдроме обкрадывания, а затем возвращается к исходной - все это соответствует латентному синдрому подключичного обкрадывания. 2-я степень - кровоток в позвоночной артерии колеблется в пределах нулевого уровня с ретроградным направлением в фазе систолы и антеградным в фазе диастолы.

Рис. 44. Схема кровотока по артериям дуги аорты и вертебрально-базилярной системы при развитии нарастающего окклюзирующего процесса в устье левой подключичной артерии с развитием синдрома обкрадывания на экстра- и итракраниальном уровнях. 1 - дуга аорты. 2 - плечеголовной ствол. 3 - правая ПКА. 4 - правая ОСА. 5 - правая ПА. 6 - правая ВСА. 7 - левая ОСА. 8 - левая ВСА. 9 - левая ПКА. 10 - левая ПА. 11 - основная артерия. 12-задние мозговые артерии. Допплерограмма при отдельных формах стил-синдрома: I - латентная, II - преходящая, III - постоянная.
При выполнении теста реактивной гиперемии после декомпрессии манжеты появляется стойкий ретроградный кровоток, который медленно возвращается к исходному, что соответствует преходящему синдрому подключичного обкрадывания. 3-я степень - ретроградное направление спектрограммы кровотока, регистрируемой по ПА, в сочетании с положительным тестом реактивной гиперемии, что соответствует постоянному синдрому подключичного обкрадывания. Итак, было принято различать 3 формы подключично-позвоночного стил-синрома: латентную преходящую и постоянную [21].
Однако, комплексное рассмотрение гемодинамики головы (забегая вперед) при окклюзирующем поражении одной подключичной артерии в устье позволяет наблюдать изменения допплерограмм кровотока во всех отделах вертебрально-базилярного бассейна (рис. 44), которые изначально были выявлены при локации позвоночной артерии [21]. Демонстративным является изменение допплерограммы кровотока по основной артерии при преходящем подключичном стил-синдроме - реверберирующий тип кровотока в систолу - к мозгу, в диастолу - ретроградно в руку (рис. 45).
Таким образом, изменение градиента давления в руке на стороне развивающегося стенозирующего процесса может привести к перестройке гемодинамики головы, изменению направления кровотока по ПА и возникновению коллатерального кровотока из ПА в подключичную и плечевую артерии. На этой же патофизиологической основе происходит формирование коллатерального кровообращения по глазному анастомозу и артериальному кругу большого мозга
Коллатеральное кровообращение мозга и его адекватная оценка у больных с цереброваскулярными заболеваниями является едва ли не основной для понимания функционального состояния кровоснабжения мозга, развития его дефицита и компенсации достаточной для нормального функционирования [23-25]. УЗДГ позволяет нам проследить за этапами формирования и развития коллатерального кровоснабжения мозга по глазной артерии и артериальному кругу и дать количественную оценку этому процессу [14, 22 26].

Рис. 45. Спектрограмма кровотока по основной артерии (реверберирующего типа), больной Г. 48 л. со стенозом левой ПКА в устье > 60% развился преходящий синдром обкрадывания ствола мозга.
В норме, при отсутствии изменении во внутренней сонной артерии кровоток по глазной артерии, направлен из глазницы в область кожи лба и угла носа и просто определяем при УЗДГ Возникновение стеноза во внутренней сонной артерии приводило к умеренному снижению ЛСК по надблоковой артерии, что указывало на начало смещения точки подвижного равновесия в глазном анастомозе по направлению к орбите. При нарастании стеноза ВСА точка подвижного равновесия в глазном анастомозе ещё больше смещалась вглубь орбиты, и ПСК в глазной артерии еще более снижалась При дальнейшем увеличении стеноза точка подвижного равновесия смещалась еще глубже - к сифону и ЛСК в глазной артерии становилась нулевой. Когда же стеноз ВСА приближался к 75%, то градиент давления возрастал настолько, что точка подвижного равновесия смещалась в мозг и по глазному анастомозу регистрировали ретроградный кровоток (аналогичная картина может быть и при окклюзии внутренней сонной артерии в устье). Таким образом, при стенозе 75% и более глазной анастомоз превращался в коллатеральный путь и начинал компенсировать дефицит поступления крови в мозг, вызванный нарастающим стенозирующим процессом во внутренней сонной артерии (рис. 46).
Для оценки степени компенсации окклюзии ВСА коллатеральным кровотоком по глазному анастомозу мы использовали величину его интенсивности по показателю ЛСК. Установили четыре группы компенсации: хорошая - показатели ЛСК от 30 до 50 см/с и более; умеренная - ЛСК от 10 до 30 см/с; слабая - ЛСК от 1 до 10 см/с; отсутствие - нулевой кровоток по глазной артерии.
На протяжении 10 лет изучалась возможности объективной оценки коллатерального кровотока по артериальному кругу большого мозга методом УЗДГ при сравнении с церебральной ангиографией.
Коллатеральный кровоток по глазному анастомозу может формироваться из одной или нескольких ветвей наружной сонной артерии (рис. 47), что может быть установлено при УЗДГ путем последовательного пережатия ветвей гомолатеральной НСА во время регистрации ретроградного кровотока по глазной артерии.
Для исследования артериального круга большого мозга необходимо знание законов его функционирования, совершенное владение техникой измерения ЛСК по сонным, позвоночным и глазным артериям в сочетании с надежным выполнением функционально-компрессионных проб.
Все это позволяет объективно оценивать анатомо-функциональное состояние соединительных артерий.

Рис. 46. Схема постепенного развития и формирования коллатерального кровотока по анастомозам глазной артерии при нарастании стенозирующего процесса во ВСА (объяснение в тексте).
Методика исследований проста, но требует точности и внимания при ее выполнении. Пробу на функционирование задней соединительной артерии выполняют при регистрации кровотока по позвоночной артерии, пережимая на 1-2 с гомолатеральную ОСА. Если при этом происходит усиление скорости кровотока по позвоночной артерии, то гомолатеральная задняя соединительная артерия функционирует (положительная проба), если же изменений нет, то соединительная артерия не функционирует (отрицательная проба).
Рис. 47. Схема коллатерального кровотока по основным ветвям НСА и глазному анастомозу (показано стрелками) при окклюзии ВСА на шее. 1 - контралатеральная общая сонная, 2 - общая сонная, 3 - наружная сонная, 4 - внутренняя сонная, 5 - средняя менингеальная, 6 - передняя барабанная, 7 - глазная, 8 - основная. 9 - задняя соединительная, 10 - задняя мозговая, 11 - поверхностная височная, 12 - средняя мозговая, 13 - поверхностная височная - надглазничная ветвь, 14 -поверхностная височная-надблоковая ветвь, 15 - передняя соединительная, 16 - передняя мозговая, 17 - надглазничная, 18 - надблоковая, 19 - слезная, 20 - средняя века, 21 - тыльная носа, 22 - боковая века, 23 - угловая, 24 - поперечная лица, 25 - верхнечелюстная. 26 - лицевая, 27 - место окклюзии.
Исследование передней соединительной артерии разделено на два этапа. На первом этапе регистрируют скорость кровотока по надблоковой артерии с двух сторон и производят на 1-2 с компрессию контралатеральной ОСА:
Таблица 9 Сравнительная оценка анатомо-функционального состояния задних соединительных артерий [22]
|
|
|
Диаметр ЗСА в мм (по данным ангиографии) |
Показатель прироста ЛСК в позвоночной артерии в см/с (по данным УЗДГ) | ||
|
Группы |
Число наблюдений |
средний |
разброс величин |
средний |
разброс величин |
|
I |
35 |
1,6 ± 0,07 |
1,0-2,5 |
12,48 ± 0,32 |
10-16 |
|
II |
46 |
0,93 ± 0,04 |
0,6-1,5 |
6,46 ± 0,18 |
5-9 |
|
Ill |
45 |
0,52 ± 0,2 |
0,3-0,7 |
3,11 ± 0,18 |
1-4 |
|
IV |
26 |
0 |
0 |
нет |
нет |
усиление ЛCK по надблоковой артерии хотя бы с одной стороны указывает на функционирование передней соединительной артерии. При отсутствии увеличения ЛСК по надблоковой артерии переходят ко второму этапу, который заключается в том, что во время регистрации скорости кровотока по ВСА пережимают контралатеральную ОСА Отсутствие при этом реакции усиления кровотока по ВСА позволяет дать заключение о функциональной несостоятельности передней соединительной артерии артериального круга большого мозга.
Результаты сопоставления данных допплерографии и ангиографии при оценке анатомо-функционального состояния задних соединительных артерий представлены в таблице 9 [7, 22], Впервые установлена достоверная связь p<0,001) между величиной прироста ЛСК по позвоночной артерии и диаметром ЗСА.
Исходя из данных, представленных в таблице 9, мы предлагаем различать хорошее, умеренное слабое и нулевое функционирование соединительных артерий, связывая его с величиной диаметра сосуда. Однако необходимо предостеречь от абсолютизации представленных в таблице 9 анатомических показателей, так как диаметр сосудов может меняться под воздействием многих факторов, в том числе и медикаментозных. Поэтому корректней говорить об анатомо-функциональных возможностях компенсации кровотока каждой из соединительных артерий артериального круга большого мозга, определяемых та момент исследования.
3. Транскраниальная допплерография в диагностике поражений артерий основания мозга
Предложенная в 1982 г. R. Aaslia et аl [7] методика неинвазивного ультразвукового исследования интракраниальных артерий непосредственно через кожу головы открыла новые горизонты в изучении сосудистой системы мозга [8. 22. 26-28]. Однако, техника этого метода, получившего в отечественной литературе название «транскраниальная допплерография» (ТКД), непроста в выполнении и освоении, требует от врача специальных знаний, желания и настойчивости при ее освоении. Исходя из своего клинического опыта и данных литературы, мы представим основные диагностические возможности транскраниальной ультразвуковой методики с позиций врача-практика, всесторонне рассмотрим технику ТКД, способы ее изучения и применения.
3.1. Методика и техника транскраниальной допплерографии
Первым шагом на пути освоения метода ТКД является выработка прочных навыков выбора оптимального взаимного расположения врача, больного, ультразвукового аппарата, так как не менее половины неудачных исследований можно отнести на счет неправильного, неудобного положения врача во время работы, зафиксировавшегося с первых дней освоения техники метода.
Исследование выполняют при горизонтальном положении больного на спине с небольшой подушкой под головой. Врач располагается сбоку головы (возможно и за головой), прибор перед ним (рис. 48); как уже говорилось, необходимо обеспечить создание и поддержание для врача максимально комфортных условий в процессе всех этапов ТКД. Возможно выполнение техники локации интракраниальных артерий в положении больного сидя на стуле и расположением исследователя за его спиной.
Непременным условием успешного исследования является удобное положение датчика в руке врача. Датчик берут за ободок основания большим и средним пальцами ближайшей к больному руки, а указательный палец располагают на ступеньке, как бы дополнительно придавливая его. Дистальный конец датчика помещают (чаще всего) в центр ладони с выводом соединительного кабеля между I и II пальцами. Такое расположение обеспечивает минимальное напряжение руки и перераспределение давления (при необходимости) на датчик с пальцев на ладонь с сохранением надежного устойчивого положения на коже головы.
Следующим этапом методики транскраниального исследования является определение места на черепе (ультразвуковое окно), через которое ультразвуковое излучение может легко пройти кость без значительного затухания так, чтобы получить надежный допплеровский сигнал от интракраниальных артерий.
Ультразвуковые окна для исследования интракраниальных артерий принято различать [9, 29] в трех областяхчерепа (рис. 49).
- Височная область, чешуя височной кости - через нее может быть выполнена локация основных стволов артерий основания мозга, формирующих артериальный круг большого мозга.
- Глазница (орбита) - через заднюю и медиальную стенки орбиты может быть выполнена локация сифона ВСА и участка А1 контралатеральной ПМА.

Рис. 48. Общий вид исследования интракраниальных артерий методом ТКД.
- Подзатылочная (субокципитальная) область - через большое затылочное отверстие возможна локация основной артерии и интракраниальных участков (V4) ПА и участок Р1 ЗМА
Височное окно принято считать основным, т. к. через него возможна локация конечных участков ВСА начальных участков передней, средней и задней мозговых артерий, а в части случаев и соединительных артерий (рис 50)
Перед началом каждого исследования наносят ультразвуковую пасту на рабочую поверхность датчика и височную область, тщательно втирая ее в волосистую часть, что обеспечивает надежный контакт во время исследования и снимает необходимость слишком сильного давления на датчик в процессе локации артерий. Типичной ошибкой начинающих является сильное давление на датчик, («сверлят череп»), что вызывает болезненные ощущения у пациента, кроме того, быстро устает рука исследователя и происходит выдавливание пасты из-под датчика
Локацию интракраниальных артерий в височной области проводят через чешую височной кости, т. к. она наиболее тонка. У молодых пациентов, обычно получают сигналы из относительно большей области, у пожилых - эта зона может значительно сузится, а в части случаев (2-12% по данным разных авторов) локация оказывается невозможной из-за отсутствия ультразвукового окна, хотя по нашему мнению частота отсутствия окна обратно пропорциональна настойчивости врача при его поиске Чаще всего у пожилых людей окно в височной области ограничено и даже небольшое (1-2 мм) дополнительное смещение датчика по поверхности черепа может вызвать исчезновение сигнала. Поэтому датчик необходимо перемещать малыми «шагами», все время контролируя эти перемещения поддержанием постоянного надежного контакта между кожей и датчиком.

Рис. 49. ТКД артерий основания мозга из трех областей: 1) височной. 2) орбитальной: 3) субокципитальной.

Рис. 50 Локация интракраниальных артерий через височное окно. Спектрограммы кровотока: ЗМА (1), ПСА (2) - в норме не функционирует бифуркация ВСА СМА/ПМА (3); СМА (4) снижение ЛСК по СМА при компрессии гомолатеральной ОСА (5); ПМА (6), ПМА (7) - обратный кровоток по ПСА при компрессии гомолатеральной ОСА (Otiss Н. 1993).
В чешуе височной кости принято различать три ультразвуковых окна, расположенных преимущественно над скуловой дугой, которая служит надежным ориентиром и легко определяется при пальпации. Иногда необходимо поместить датчик прямо на дугу, чтобы обеспечить локацию при прохождении ультразвука непосредственно над ней, а в отдельных случаях локация артерий возможна лишь при установке датчика на 3-4 см выше дуги. Переднее височное окно расположено над передней поверхностью скуловой дуги возле угла глаза, заднее височное окно расположено впереди ушной раковины, а среднее - между ними, при этом зона окон при локации может быть расширена (рис. 51). Однако знание анатомического расположения окон ещё не гарантирует локации внутричерепных артерий. Необходимо точно выбрать направление ультразвукового луча, величину измеряемого объема и глубину локации, при этом поиск оптимального окна затруднен небольшими размерами внутричерепных артерий.
При локации через переднее окно датчик направляют наклонно и слегка кзади. При исследовании через заднее окно датчик направляют перпендикулярно или слегка кпереди, чтобы получить сигнал с артерий формирующих артериальный круг большого мозга. Через среднее окно предпочтительно исследовать СМА. Все эти установки имеют ориентировочный характер - в отдельных случаях для локации артерий используют все три окна, иногда одно. По нашему мнению, наиболее стабильной и надежной является локация через заднее окно, но в идеале необходимо попытаться выполнять исследование через все височные окна - для выбора объективно лучшего.

Рис. 51. Схема расположения височных окон и диапазон их расширения (жирный пунктир). П - переднее, С - среднее, 3 - заднее окно заходит за ушную раковину.
Поиск окна в височной области затруднен, из-за малых размеров лоцируемых интракраниальных артерий и фокусировки ультразвукового луча. Поэтому необходимо найти не только место в черепе, через которое свободно пройдет ультразвук, но выбрать адекватную величину измерительного объема и точно направить его на артерию для получения четкого допплеровского сигнала. Для упрощения этой задачи R Aaslid [9] рекомендует начинать поиск окна с величины измерительного объема 12-14 мм на глубине 55-60 мм. На этой глубине можно получать допплеровские сигналы от дистального участка ВСА, передней, средней и даже задней мозговых артерий. Датчик направляют горизонтально и под разными углами вплоть до прямого, медленно перемещая его круговыми движениями над областью височных окон. После появления звукового и графического отображения допплеровского сигнала необходимо «зацепиться» за найденную область и найти оптимальное положение датчика, последовательно меняя угол и глубину локации артерии, при которых сигнал будет оптимальной силы и получена четкая запись спектрограммы.

Рис 52. Схема локации интракраниальных артерий через орбитальное (1) и субокципитальное (2) окна (Aaslid R. 1986).
Орбитальное окно позволяет проводить локацию сифона сонной артерии и ПМА (рис 52) Перед началом исследования понижают выходную мощность прибора до 10-15%, что обеспечивает абсолютную безопасность для глаза при этом способе локации Техника исследования несложна Датчик помещают на закрытое верхнее веко, предварительно попросив больного направить взгляд к ногам, обильно наносят на веко пасту, что обеспечивает надежный ультразвуковой контакт без необходимости дополнительного давления на таз. Направляют луч к оптическому каналу и, установив глубину зондирования в 50 мм, начинают ее постепенно наращивать, стремясь получить устойчивый, полноценный сигнал от сифона Ориентиром для локации сифона может служить предварительное или одновременное получение на глубине 30-40 мм сигнала от глазной артерии - он направлен к датчику и имеет характерную форму спектра. Продолжая наращивать глубину локации, доходят до сифона. Направление датчика должно быть передне-задним, с небольшим наклоном к средней плоскости. На глубине от 55 до 70 мм, как правило, обнаруживают сигналы от сегментов сифона верхнеклиновидного согнутого в форме колена и участка около турецкого седла Сигналы, исходящие от сегментов, расположенных ниже колена, направлены к датчику, а от участка в области турецкого седла - от датчика.
Для локации через орбиту контралатеральной ПМА необходимо направить датчик вверх и медиально от оси предыдущего исследования, при этом устойчивый сигнал появляется на глубине не менее 70 мм.
Субокципитальное окне - локация сосудов задней черепной ямки через большое затылочное отверстие хорошо разработана ее выполняют направляя ультразвуковой пучок через щель (окно) между черепом и позвоночником. При этом, возможно получить информацию о гемодинамике по внутричерепным участкам позвоночных артерий (V4), основной (на всем протяжении) и задним мозговым артериям (рис. 52). На вертикальные размеры щели затылочного окна существенно влияет степень наклона головы больного вперед к груди, что позволяет изменять размеры щели в процессе исследования.
Возможны 3 варианта расположения больного во время локации сосудов: сидя на стуле с опущенной головой, лежа на спине или на боку. На наш взгляд, предпочтительнее техника локации в положении больного на спине: голову и плечи больного укладывают на две подушки так, чтобы под шеей образовалось свободное пространство, куда легко входила бы рука с датчиком; такое положение обеспечивает устойчивое расположение руки при локации и оптимально для выполнения компрессионных проб.
Как уже отмечалось выше, OA образуется при слиянии у заднего края варолиева моста двух ПА, ложится на переднюю поверхность варолиева моста, прилегает к скату, направляется вперед, вверх и на уровне переднего края моста делится на две конечные ветви - задние мозговые артерии (рис. 53). Диаметр OA колеблется от 2,5 до 8 мм, в среднем 4,4 мм [30].
При локации OA датчик располагают по средней линии ниже заднего края большого затылочного отверстия затылочной кости с направлением ультразвукового пучка на переносицу. Начинают поиск сигнала на глубине 60-80 мм, медленно, последовательно изменяя угол наклона и положение датчика на поверхности кожи, наращивают глубину, а также увеличивают угол открытия щели окна путем прижатия подбородка больного к груди. После появления устойчивого сигнала от OA (направление от датчика) и записи спектрограммы можно (увеличивая глубину) продолжить локацию уже дистального отдела артерии, включая развилку.

Рис. 53. Схема строения артерий основания мозга. 1 - ПСА, 2 - ПМА, 3 - СМА, 4 -ЗСА, 5 - ЗМА, 6 - верхняя артерия мозжечка, 7 - OA, 8 - ПА, 9 - задняя нижняя артерия мозжечка.
При локации интракраниальных участков позвоночных артерий затруднений не возникает, если не считать частой встречаемости различных вариантов и аномалий сосудов этой области. Техника локации ПА несложна и может быть реализована из той же центральной затылочной точки, с которой исследовали OA. Датчик направляют латерально и на глубине 40-60 мм получают сигнал от ПА, направленный от датчика. Для его идентификации выполняют на гомолатеральной стороне пробу поколачивания ПА. Возможна локация позвоночных артерий из парамедианных точек - для этого необходимо последовательно устанавливать датчик на 3-6 см от средней линии, направляя медиально под углом к краю затылочного отверстия. Сигнал с направлением кровотока отдатчика лоцируют на глубине 40-60 мм (глубина варьируется из-за индивидуальных анатомо-топографических особенностей строения шеи и сосудов).
Локацию ЗМА на участке P1 можно при необходимости выполнить из субокципитального окна. Для этого нужно при исследовании OA «дойти» до ее дистального участка и лоцировать область развилки, что проявится в изменении звуковых и спектральных характеристик сигнала (грубый шум и возрастание низких частот в спектре). После этого, медленно изменяя угол и увеличивая глубину локации (90-110 мм), можно получить спектрограмму с участка Р1 задней мозговой артерии, направленную от датчика. При этом проба с закрыванием-открыванием глаз в течение 30 с позволяет легко дифференцировать сигнал ЗМА от сигнала верхней мозжечковой артерии: при локации первой происходит увеличение ЛСК на 10-20 % в ответ на пробу.
3.1.1. Идентификация артерий
Принципиальным при ТКД является вопрос о точном определении, идентификации каждой лоцируемой артерии, что лежит в основе надежной диагностики поражений интракраниальных артерий и получения развернутой картины циркуляции крови по ним (рис. 54). Это непростая задача, для решения которой исследователю необходимо приобретение устойчивых навыков, опыта и ясного представления о возможных анатомо-физиологических особенностях строения сосудов основания мозга. Для правильного определения лоцируемых артерий R. Aaslid [9] предложил различать три основных источника информации: 1) ответная реакция допплеровского сигнала на сдавление или поколачивание общей сонной и/или позвоночной артерий на шее; 2) пространственное отношение допплеровского сигнала к остальным внутричерепным сигналам (эта информация включает в себя и глубину, и угол зондирования артерий); 3) направление кровотока (к датчику или от него) и спектральное распределение лоцируемого потока.
Сдавление, или компрессия, общей сонной артерии на шее - несложная процедура, но сохраняется некоторый риск возникновения микроэмболии или появления синокаротидных реакций при ее выполнении. Мы считаем, что полностью обезопасить больного от осложнений во время выполнения компрессионных проб можно только при условии предварительного ультразвукового В-сканирования сонных артерий - это позволит выявить наличие в них атеросклеротических бляшек и принять в этом случае меры предосторожности. Кроме того, проведение перед каждым исследованием тщательной пальпации сонных артерий и получение точного представления о расположение бифуркации ОСА, позволяет выполнять пережатие на 3-5 см ниже ее развилки и тем самым избегать возможных осложнений. Можно обойтись и без компрессионных проб, но при этом исследование может оказаться недостаточно полным.

Рис. 54. Схема строения артерий основания мозга и спектрограммы кровотока по ним в норме.
Поколачивание, или вибрация, общей сонной артерии ниже бифуркации является безопасной процедурой (в литературе мы не встретили указаний на осложнения при ее применении), которая может быть использована для дифференциации потоков между ветвями СМА и ЗМА: при регистрации кровотока по ЗМА поколачивание гомолатеральной ОСА не вызывает появления дополнительных сигналов (пиков) на спектрограмме, лоцируемой артерии (при условии, что она отходит от основной). То же поколачивание может привести к появлению дополнительных сигналов при локации отрезка М1 средней мозговой артерии.
Развилка внутренней сонной артерии является достаточно точным ориентиром при ТКД. После выбора надежного окна необходимо приступить к поиску места деления внутренней сонной артерии, идентификацию которой выполняют по трём критериям.
- Допплеровский сигнал от терминального участка ВСА обнаруживают на глубине 55-65 мм в зависимости от диаметра черепа. Датчик необходимо вести сверху вниз, чтобы не спутать рассматриваемый участок с сифоном; при этом, благодаря тупому углу локации, измеряемая величина кровотока может быть ниже, чем от других интракраниальных артерий.
- Одновременная локация кровотока в двух направлениях, для чего необходимо будет произвести дополнительную корректировку глубины и угла зондирующего луча. При выходе на развилку артерии звуковой допплеровский сигнал может иметь типичную характеристику разделенного кровотока с относительно сильными составляющими низкочастотных сдвигов, а качество их слышимости можно определить как «грубое» или «шумное» В некоторых случаях разделенный кровоток может быть ориентирован в разных плоскостях по отношению к ультразвуковому лучу - тогда одномоментное изображение обеих направлений может быть затруднено, но, выполняя легкие движения датчика без изменения глубины локации, легко убедиться в двунаправленности сигнала, исходящего из одной области.
3. Допплерографический сигнал четко реагирует на поколачивание и компрессию гомолатеральной ОСА. Компрессия приводит к возникновению обратного кровотока по ПМА и снижению кровотока по СМА. Если же сигнал идет от участка, расположенного в нижней части развилки ВСА, то пережатие вызывает полное прекращение кровотока (рис 55). Поколачивание общей сонной артерии на шее вызывает появление дополнительных пиков на спектрограммах лоцируемои развилки [31]
Средняя мозговая артерия - самая крупная среди ветвей ВСА, нередко представляет как бы ее продолжение и переносит до 75% объема крови, поступающей в полушарие мозга [31] Диаметр СМА колеблется в пределах 1 5-4,0 мм, диаметр левой чаще больше правой. Надежным ориентиром при поиске СМА является область бифуркации, от которой просто начинать локацию участка М1; при этом надежным дифференциальным признаком СМА будет наличие направления кровотока к датчику.
Сигнал от проксимального участка СМА ровный: с относительно высокой интенсивностью в высокочастотной области спектра и лоцируют его на глубине 50-65 мм, в то время как на глубине 35-45 мм наблюдают сигналы с более широким спектром и более низкочастотными смещениями, на этой глубине кровоток разделяется на 2-4 части, соответственно ветвям СМА. Для локации отрезков М2-М1 необходимо от окончания внутренней сонной артерии провести легкое движение, датчиком вверх, переведя глубину локации в диапазон 30-40 мм.
Для идентификации СМА можно выполнить поколачивание гомолатеральной ОСА на шее, что вызовет появление дополнительных пиков на спектрограмме (рис. 56): компрессия ОСА. Как правило, приводит к ослаблению сигнала (иногда исчезновению), степень выраженности которого зависит от состояния коллатерального кровотока по соединительным артериям.

Рис 55 Спектрограммы кровотока на развилке ВСА - исчезают при пережатии гомолатеральной
ОСА (стрелки).

Рис 56 Спектрограмма кровотока по СМА - появление дополнительных пиков (стрелки) при пробе поколачивания гомолатеральной ОСА.
Передняя мозговая артерия - передняя ветвь ВСА (диаметр ее колеблется от 0,6 до 5 мм, в среднем - 2,5 мм), начинается медиально, затем поворачивает вперед до тех пор, пока не достигнет средней линии мозга и передней соединительной артерии. Локацию ПМА лучше выполнять через заднее височное окно (глубина 60-65 мм), из-за задне-переднего направления участка А1, при этом наиболее чёткий сигнал и спектрограмму получают на расстоянии 2-4 мм от развилки, т. к. дистальная часть сегмента А1 может иметь меняющийся, изогнутый ход. Попытка пройти ультразвуковым лучом по ходу всего отрезка А1 до передней соединительной артерии и далее перейти на контралатеральную артерию иногда может быть затруднена из-за возможной извитости или гипоплазии сосуда. Установлены чёткие критерии идентификации ПМА.
- Допплеровский сигнал от нее можно обнаружить на развилке ВСА и проследить (при известной настойчивости), по мере увеличения глубины локации, до срединной линии мозга и далее до контралатерального участка А1
- Кровоток направлен от датчика. При закупорке или выраженном стенозе сонной артерии направление кровотока может изменяться на обратное, благодаря его вовлечению в коллатеральное кровоснабжение. На практике это приводит к повышению ЛСК в контралатеральной ПМА, которую можно обнаружить при исследовании с обеих сторон.
- Реакция допплеровского сигнала ПМА на сдавливание гомолатеральной ОСА зависит, прежде всего, от анатомо-функционального состояния передней соединительной артерии: если ПСА отсутствует, то при компрессии произойдет исчезновение или выраженное снижение сигнала; если она функционирует хорошо, то кровоток изменится на ретроградный (рис. 57).
Передняя соединительная артерия - небольшой сосуд, связывающий не только передние мозговые артерии (участки А1, но опосредовано и внутренние сонные артерии. Она отличается большим разнообразием строения, размеров и расположения, может быть представлена двумя или несколькими стволами, может иметь вид нити или совсем отсутствовать; в отдельных случаях обе ПМА являются ветвями одной ВСА, от которой отходит вначале один ствол, разделяющийся затем на правую и левую передние мозговые артерии - передняя трифуркация внутренней сонной артерии; при этом проксимальная часть ствола ПМА (А1) на противоположной стороне отсутствует или имеет вид тонкого нитевидного сосуда.

Рис. 57 Спектрограмма кровотока по ПМА. При компрессии (стрелки) гомолатеральной ОСА (ПСА функционирует) возникает ретроградный кровоток по ПМА.
Диаметр передней соединительной артерии колеблется от 0,5 до 4 мм (средний - 1,5 мм). По данным А.Н. Колтовер и др., [13] диаметр передней и задней соединительных артерий при так называемом классическом типе строения артериального круга большого мозга должен быть равен 1-1,5 мм; уменьшение его следует рассматривать как гипоплазию, увеличение - как расширение.
В норме кровоток по ПСА отсутствует и возникает только в случае появления градиента давления в сосудах правого или левого полушарий мозга, вызванного функциональными причинами или развитием окклюзирующего процесса в ВСА на шее. При локации ПСА допплеровский сигнал обнаруживают в срединной зоне, где максимально сближаются обе передние мозговые артерии на глубине 70-80 мм: при наличии коллатерального кровотока по передней соединительной артерии возможно выявление ограниченной области с очень высокой скоростью - место, где узкая струя вливается в более широкий канал, что сопровождается шумовыми сигналами [9].
В повседневной практике мы не проводим прямого лоцирования передней соединительной артерии, а лишь при необходимости оцениваем степень ее функционирования, определяемую при локации ПМА и компрессии контралатеральной ОСА (рис. 58)
Задняя соединительная артерия - сосуд, соединяющий внутреннюю сонную и заднюю мозговую артерии. Строение ЗСА, с помощью которых осуществляется компенсаторный кровоток между системами сонных и задних мозговых артерий, очень вариабельно. Аплазия одной ЗСА отмечена в 6-7%, гипоплазия по данным разных авторов колеблется в пределах 20-40%. В 14-25% случаев [32, 33] имеет место отхождение ЗМА от ВСА - так называемая задняя трифуркация. При этом проксимальная часть ЗМА, отходящая от основной артерии на стороне трифуркации. представлена тонким нитевидным сосудом, который в отдельных случаях может слабо функционировать. На практике ЗСА целесообразно исследовать только в наблюдениях, при которых она вовлечена в коллатеральное кровообращение. Критериями идентификации ЗСА служат следующие признаки.
- Сигнал выявляют сзади и слегка внизу по отношению к концевой ветви ВСА, приблизительно на той же глубине.
- Сигнал возникает при окклюзии или гемодинамически значимом стенозе. Для него характерна высокая скорость, которая может иметь двоякое направление, в зависимости от ориентации артерии к ультразвуковому пучку.
- В области, где ЗСА входит в концевой участок ВСА и ЗМА, отмечают шумовое изменение сигналов.

Рис. 58. Спектрограмма кровотока по ПМА: проба на функционирование ПСА-усиление ЛСК при компрессии (стрелки) контралатеральной ОСА.
Задняя мозговая артерия является конечной ветвью OA (диаметр ее 1- 4 мм, в среднем - 2,6 мм); лучше всего лоцировать ЗМА на участке Р1, который расположен близко к срединной линии мозга между бифуркацией основной и задней соединительной артериями. На участке Р2 направление потока по артерии меняется на противоположное. Поиск ЗМА начинают от концевого участка ВСА с увеличения глубины локации на 5-7 мм и направления датчика кзади (глубина 60-65 мм). Во время поиска иногда возвращаются к исходному ориентиру, чтобы определить пространственное отношение остальных полученных сигналов. При этом критериями для идентификации ЗМА будут следующие признаки.
- Допплеровский сигнал регистрируют при направлении датчика кзади по отношению к направлению кровотока по СМА; в отличие от сигнала от СМА сигнал от ЗМА нельзя обнаружить на глубине менее 55 мм.
- Сигнал от проксимальной части артерии (Р1) направлен к датчику. В более
дистальном сегменте (Р2) кровоток может приобрести обратное направление или даже оба направления одновременно, благодаря извитости этого участка артерии. Кроме того, при локации на глубине, соответствующей срединной линии мозга, можно обнаружить ультразвуковой сигнал, проявляющий «свойства разветвления», с кровотоком в обоих направлениях и возрастанием набора низких частот в спектре. При этом J1CK в норме будет всегда ниже, чем по СМА.
3. Компрессия гомолатеральной ОСА (как и ее поколачивание) либо не дает ответной реакции, либо вызывает усиление ЛСК, указывающее на включение заднего отдела артериального круга в коллатеральное кровообращение.
Диагностические затруднения могут возникнуть при определении ЗМА, отходящей непосредственно от сифона ВСА (задняя трифуркация). По данным морфологических исследований этот вариант разные авторы наблюдали в 1,56-43% случаев [33], R. Aaslid [9] отмечал его приблизительно у 15% больных. О возможности такого строения нужно помнить, т. к. перечисленных выше критериев может быть недостаточно для идентификации артерии. В этих случаях для определения ЗМА используют пробу закрывания-открывания глаз на 30-60 с, что при локации ЗМА приводит к усилению ЛСК на 10-20% и тем самым позволяет дифференцировать ее от СМА независимо от бассейна отхождения.
Идентификация основной и позвоночной артерий может иногда вызывать затруднения, особенно ПА. Локация сигнала из подзатылочной области в медиальной плоскости на глубине от 70 до 100 мм с направлением от датчика обычно не дает оснований сомневаться в том, что он исходит от OA. При возникновении сомнений в источнике сигнала целесообразно выполнить пробу поколачивания ПА (с обеих сторон) в точке выхода из канала на уровне CI позвонка, под сосцевидным отростком (рис. 59).

Рис. 59. Спектрограмма кровотока по OA и появление дополнительных пиков (стрелки) при пробе поколачивания ПА.
Сигнал от ПА лоцируют из латеральной области на глубине 40-60 мм с направлением от датчика. Задняя нижняя артерия мозжечка, лоцируемая в той же зоне, имеет направление к датчику. Однако идентификация сосудов в задней черепной ямке может вызвать затруднения, связанные, в первую очередь, с анатомо-топографическими особенностями их вариантов и наличием аномалий развития. Так, задняя нижняя артерия мозжечка в 20% случаев отходит от OA, в 20% случаев имеет место выраженная асимметрия позвоночных артерий, в 3-10% случаев отмечают их гипоплазию и ПА заканчивается задней нижней артерией мозжечка, т. е. не принимает участия в формировании OA [13, 25].
Таким образом, точная идентификация лоцируемых интракраниальных артерий является первым важным шагом на пути безошибочного выявления поражений в сосудах и позволяет перейти к их диагностике.
3.2. Алгоритмы допплеровской диагностики окклюзирующих поражений артерий основания мозга
В настоящее время метод ТКД получил общее признание и находит применение в повседневной неврологической и ангионейрохирургической практике для диагностики атеросклеротических поражений интракраниальных артерий, появления микроэмболов, выявления аневризм и АВМ, определения спазма мозговых артерий и динамического наблюдения за ним в процессе лечения, для объективной оценки функционального резерва сосудов мозга и др. изменений [6, 8, 11, 34-38].
Диагностику методом ТКД строят на принципах оценки ЛCK в местах поражения артерий с учетом изменений гемодинимики в пре- и постстенотической зоне, изучении анатомо-функционального состояния коллатерального кровообращения и показателей величин скоростей кровотока и их асимметрии в соименных контралатеральных артериях.
Для диагностики методом ТКД важны показатели нормы - значения ЛCK по интракраниальным артериям у здоровых людей. Выход за границы нормального диапазона скоростей кровотока может быть связан с патологическими изменениями в сосудах. При этом необходимо принимать во внимание и возможность изменений, обусловленную возрастом, вязкостью крови, ауторегуляцией. Достаточно полно основные показатели ЛСК по артериям основания мозга у здоровых взрослых людей разных возрастных групп изучены W. Rautenberg [39] и представлены в табл. 10.
Рассмотрим алгоритмы диагностики поражений отдельных интракраниальных артерий.
Окклюзия сифона внутренней сонной артерии имеет место в 1-2% всех наблюдений и чаще носит сегментарный характер. При окклюзии сифона (рис. 60) на стороне поражения выявляют следующие допплерографические изменения: 1) отсутствие кровотока в месте локации сифона; 2) ретроградный кровоток по сегменту А1 гомолатеральной ПМА при отсутствии реакции на компрессию соименной ОСА; 3) усиление ЛСК по контралатеральной ПМА; 4) усиление ЛСК по основной артерии и ЗМА на стороне предполагаемой окклюзии; 5) наличие кровотока по гомолатеральной ЗСА; 6) ретроградный кровоток по ГА (при орбитальном подходе); 7) антеградный кровоток по ГА при локализации окклюзии выше ее устья.
Выявление одного из пяти первых признаков позволяет предположить наличие окклюзии в сифоне или устье ВСА. Наличие признака 7 указывает на окклюзию в сифоне, а признак 6 - на наличие окклюзии ВСА ниже устья глазной артерии. Признаки 4 и 5 могут отсутствовать при разобщении задних отделов артериального круга большого мозга.
Таблица 10. Основные допплерографические показатели кровотока в интракраниальных артериях здоровых людей [39]
|
|
|
|
Допплерографические показатели ЛСК | ||||
|
Артерия |
Глубина |
Возраст, |
Систоличес |
средняя |
диастоли- |
ИР |
ИП |
|
|
(мм) |
годы |
кая (см/с) |
(см/с) |
ческая (см/с) |
|
|
|
СМА |
45-65 |
<40 |
94,5 + 13,6 |
58,4 ± 8,4 |
45,6 ± 6,6 |
0,55 ±0,16 |
0,83 ± 0,21 |
|
|
|
40-60 |
91,0 ± 16,9 |
57,7 ± 11,5 |
44,3 ± 9,5 |
0,50 ±0,17 |
0,86 ±0,14 |
|
|
|
>60 |
78,1 ± 15,0 |
44,7 ± 11,1 |
31,9 ±9,1 |
0,45 ±0,14 |
1,03 ±0,18 |
|
|
|
<40 |
76,4 ± 16,9 |
47,3 ± 13,6 |
36,0 ± 9,0 |
0,53 ±0,18 |
0,85 ± 0,20 |
|
ПМА |
65-75 |
40-60 |
85,4 ± 20,1 |
53,1 ± 10,5 |
41,1 ±7,4 |
0,50 ±0,15 |
0,85 ±0,18 |
|
|
|
>60 |
73,3 ± 20,3 |
45,3 ± 13,5 |
34,2 ± 8,8 |
0,47 ±0,17 |
0,85 ±0,16 |
|
|
|
<40 |
53,2 ± 11,3 |
34,2 ± 7,8 |
25,9 ± 6,5 |
0,55 ±0,16 |
0,79 ± 0,22 |
|
ЗМА |
60-75 |
40-60 |
60,1 ± 20,6 |
36, 6 + 9,8 |
28,7 ± 7,5 |
0,53 ±0,14 |
0,85 ±0,17 |
|
|
|
>60 |
51,0 ± 11,9 |
29,9 ±9,3 |
22,0 ± 6,9 |
0,51 ±0,16 |
0,96 ±0,14 |
|
|
|
<40 |
56,3 ± 7,8 |
34,9 ± 7,8 |
27,0 ±5,3 |
0,52 ±0,16 |
0,83 ± 0,23 |
|
ПА |
45-80 |
40-60 |
59,5 ± 17,0 |
36,4 ±11,7 |
29,2 ± 8,4 |
0,49 ±0,12 |
0,84 ±0,19 |
|
|
|
>60 |
50,9 ±18,7 |
30,5 ± 12,4 |
21,2 ±9,2 |
0,48 ±0,14 |
0,97 ± 0,20 |
|
|
|
<40 |
56,3 ± 7,8 |
34,9 ± 7,8 |
27,0 ± 5,3 |
0,52 ±0,16 |
0,83 ± 0,23 |
|
OA |
80-100 |
40-60 |
59,5 ±17,0 |
36,4 ±11,7 |
29,2 ± 8,4 |
0,49 ±0,12 |
0,84 ±0,19 |
|
|
|
>60 |
50,9 ±18,7 |
30,5 ± 12,4 |
21,2 ±9,2 |
0,48 ±0,14 |
0,97 ± 0,20 |
Стеноз сифона внутренней сонной артерии отмечают в 7-9% наблюдений и обычно носит сегментарный характер. При стенозе сифона >60% на стороне поражения выявляют следующие допплерографические изменения. 1) наличие изменений кровотока, характерных для локального стеноза (снижение ЛСК в предстенотическои зоне усиление скорости кровотока и наличие шума в зоне стеноза; изменение ЛСК в постстенотической области артерии с признаками турбулентности); 2) ретроградный кровоток в сегменте А1 усиливающийся при компрессии гомолатеральной ОСА; 3) усиление ЛСК по глазной артерии (более 40%) за счет сброса «избытка» крови через ГА (при локализации стеноза выше отхождения ГА).
Признак 1 наиболее надежен для диагностики, признак 2 не обязателен и отсутствует при разобщении переднего отдела артериального круга, признак 3 выявляют только при локации ГА Определение стенозирующего процесса в сифоне непростая задача и для её решения целесообразно интегрировать данные ТКД с результатами, полученными при УЗДГ
Окклюзия средней мозговой артерии на участке М, при ТКД может оказаться случайной находкой, так как известно, что до 15% этих поражений протекает бессимптомно, без клинических проявлений. При окклюзии выявляют следующие допплерографические изменения; 1) отсутствие кровотока по СМА или его выраженное снижение; 2) усиление ЛСК по гомолатеральной ПМА; 3) умеренное возрастание ЛСК по гомолатеральной ЗМА, усиливающееся при компрессии ипсилатеральной ОСА; 4) ретроградное направление кровотока на участках М2-М3, не изменяющееся при компрессии гомолатеральной ОСА.
Признак 1 патогномоничен для окклюзии, при условии, что «окно» откры-

Рис. 60. Спектрограммы кровотока по артериям основания мозга у больного К., 54 лет, при окклюзии сифона (белая стрелка) левой ВСА. 1 - ЗСА (va = 116 см/с), 2 - СМА (va = 61 см/с), 3 - ПМА (va = 76 см/с), 4 - ПСА (va = 91 см/с), 5 - ПМА (va = 78 см/с), 6 - СМА (va = 68 см/с), 7 - сифон (va = 48 см/с), 8 - ЗМА (va = 65 см/с), 9 - OA (va = 74 см/с), 10 - ЗМА (va = 79 см/с). Характер гемодинамики показан черными стрелками.
то для ультразвука. Признак 2 показателен лишь при отсутствии поражений в сосудах противоположного полушария. Признак 3 дополняет первые два. Признак 4 выявляют лишь при наличии коллатерального кровотока в бассейне СМА из зоны смежного кровообращения. Дополнительным, но надежным признаком окклюзии может стать выявление высокого РИ при локации ЛСК по гомолатеральной ОСА.
Стеноз средней мозговой артерии на участке М, чаще всего носит сегментарный характер, при этом на стороне поражения выявляют следующие допплерографические изменения: 1) локальное изменение скорости кровотока с признаками турбулентности (рис. 61); 2) умеренное повышение ЛСК по ПМА, значительно возрастающее при компрессии контралатеральной ОСА; 3) усиление ЛСК по ЗМА при компрессии гомолатеральной ОСА.

Рис. 61. Каротидная ангиография: стеноз CIMA > 60% (стрелка) на участке М1; спектрограммы кровотока дистальнее стеноза (1, 2), перед стенозом (3), в месте стеноза (4).
Признак 1 наиболее информативен, но для его выявления необходим опыт и хорошее владение техникой ТКД. Признаки 2 и 3 являются дополнительными, так как проявляются лишь при функционировании соединительных артерий или при окклюзии СМА. Поэтому только комплексный анализ всех признаков обеспечивает точность диагностики стеноза СМА.
Окклюзию или стеноз >60% передней мозговой артерии на участке А1 наблюдают нечасто, для них характерны следующие допплерографические изменения: 1) отсутствие ЛCK на участке А1 или признаки, характерные для локального стеноза интракраниального сосуда; 2) усиление ЛСК по СМА по сравнению с контралатеральной стороной; 3) при окклюзии - не функционирует ПСА.
Выявление истинной окклюзии или выраженного стеноза ПМА при ТКД затруднено, что в первую очередь связано с вариантами и аномалиями развития переднего отдела артериального круга мозга. Так, в 20% случаев может иметь место передняя трифуркация, т. е. отхождение обеих ПМА с одной стороны и соответствующая гипоплазия или аплазия участка А1 с противоположной, что будет имитировать признаки «ультразвуковой» окклюзии или стеноза. Вторая трудность может возникнуть при локации зоны стенозирования по длиннику, т. к. направление и ход артерии на участке А, вариабелен, и возможны чисто технические погрешности при исследовании.
Окклюзия или стеноз >60% задней мозговой артерии на участке Р1 сопровождается следующими допплерографическими изменениями: 1) не регистрируют кровоток по ЗМА; 2) усиление ЛСК по контралатеральной ЗМА; 3) усиление кровотока по ЗСА с направлением от датчика; 4) признаки локального стеноза на участке Р1.
Однако частоту встречаемости поражений ЗМА перекрывает высокая вероятность отхождения ЗМА от внутренней сонной артерии - задняя трифуркация, а незнание этого варианта может приводить к гипердиагностике - выявлению большого числа окклюзий ЗМА [6]. Составленная нами таблица 4 дифференциально-диагностических признаков позволяет отличить окклюзию ЗМА от варианта развития и избежать ошибок (табл. 11.).
Таблица 11. Дифференциальная диагностика окклюзии ЗМА от варианта задней трифуркации [6].
|
Гемодинамика по артериям |
Изменения в сосудах | |
|
Окклюзия ЗМА |
Задняя трифуркация | |
|
Направление кровотока по ЗМА Кровоток по ОСА Кровоток по ВСА Кровоток по СМА Кровоток по ЗСА Кровоток по OA |
Кровоток отсутствует Без асимметрии сторон Без асимметрии сторон Усилен Усилен с дополнительными шумами Возможно усиление в остром периоде |
От датчика Усилен на стороне трифуркации Усилен на стороне трифуркации Без изменений Аналогичен кровотоку по ЗМА Снижен (нижняя граница нормы) |
Окклюзия позвоночной артерии на участке V4 проявляет себя следующими допплерографическими изменениями: 1) отсутствие сигнала с ПА; 2) снижение J1CK по основной артерии; 3) усиление ЛСК по контралатеральной ПА.
Однако постановка диагноза «окклюзия ПА на участке V4, не всегда возможна (даже при помощи ангиографии), что объясняется большой вариабельностью хода и строения этого участка артерии. Возможна гипоплазия или аплазия отрезка V4, связанная как с гипоплазией всей ПА, заканчивающейся задней нижней артерией мозжечка, так и с функциональной аплазией, возникающей при выраженном гемодинамическом преобладании кровотока по контралатеральной ПА [6, 15, 25].
При постановке диагноза окклюзии на участке V4 целесообразно принимать во внимание оценку состояния ЛСК по позвоночным артериям, получаемую при УЗДГ.
Стеноз >60% позвоночной артерии на участке V4 проявляет себя следующими допплерографическими изменениями. 1) наличие признаков сегментарного стеноза; 2) асимметрия кровотока по позвоночным артериям более 50%, при наличии признаков функционирования ЗСА.
Диагностика стеноза может оказаться трудной из-за большой частоты вариантов и аномалий сосудов задней черепной ямки; лишь привлечение данных УЗДГ может облегчить решение этой задачи.
Окклюзия или стеноз >60% основной артерии проявляет себя следующими допплерографическими изменениями: 1) локальные признаки сегментарного стеноза или отсутствие ЛСК при окклюзии; 2) выраженное снижение скорости кровотока по обеим ПА (при окклюзии), умеренное - при стенозе; 3) отсутствие усиления ЛСК по позвоночным артериям при последовательном выполнении компрессии гомолатеральных ОСА; 4) усиление ЛСК по обеим ОСА.
Признаки 1-3 достаточно информативны для окклюзии OA, а признак 4 лишь дополняет их и может отсутствовать. Однако, как и при поражении позвоночных артерий, для постановки диагноза окклюзии или стеноза OA, надежней использовать обе методики ультразвуковой диагностики цереброваскулярных заболеваний.
3.3. Транскраниальная допплерография в диагностике спазма сосудов мозга и артерио-венозных мальформаций
Диагностика спазма сосудов мозга методом ТКД является одним из блестящих достижений современной медицины [8 11, 28]. Спазм церебральных артерий возникает в результате сокращения гладких мышц артерий и может развиваться при инсульте мигрени, травмах мозга, но главное - при субарахноидальных кровоизлияниях.
Спазм артерий головного мозга является осложнением, часто возникающим при субарахноидальном кровоизлиянии Заболевание представляет собой многоступенчатый процесс, развивающийся под влиянием множества различных факторов, что в конечном счете, приводит к структурным изменениям стенок сосудов и сужению их просвета Гемодинамический эффект вазоспазма сходен с тем что имеет место при стенозе: увеличение ЛСК и снижение давления вследствие сужения сегмента артерии. Но в отличие от стеноза повышение скорости кровотока при спазме более распространенно, может отмечаться в одном или нескольких сосудистых бассейнах и на большем протяжении сосудов (табл. 12)
Таблица 12. Дифференциальная диагностика стеноза, ангиоспазма и АВМ [40]
|
Название признака |
Стеноз |
Ангиоспазм |
АВМ |
|
Спектр допплерограммы: |
|
|
|
|
высокочастотный |
Разброс частот |
Гладкий |
Гладкий |
|
низкочастотный |
значительно усилен |
Не изменен |
Венозного типа |
|
Характеристика шума: |
|
|
|
|
высокочастотный |
Выраженный |
Выраженный |
Выраженный |
|
низкочастотный |
Выраженный |
Умеренный |
Отсутствует |
|
Индекс циркуляторного |
|
|
|
|
сопротивления (RI) |
Повышен |
Повышен |
Снижен |
|
Индекс пульсации (PI) |
Повышен |
Повышен |
Снижен |
|
Цереброваскулярная |
|
|
|
|
реактивность (CVR) |
Сохранена(снижена) |
Сохранена (снижена) |
Резко снижена |
|
Ауторегуляторный |
|
|
Резко снижен |
|
ответ |
Сохранен(снижен) |
Сохранен (снижен) |
(отсутствует) |
|
Динамика изменения |
|
|
|
|
кровотока |
Отсутствует |
Меняется во времени |
Отсутствует |
Сравнение клинической картины у больных после субарахноидального кровоизлияния с данными ЛСК в интракраниальных артериях показало, что наличие средних скоростей в пределах 120-140 см/с не сопровождалось тяжелым состоянием пациентов и развитием инфаркта мозга. Скорости более 200см/с сопровождались тяжелым клиническим состоянием больных с тенденцией к развитию инфаркта мозга, хотя у части из них такое увеличение протекало бессимптомно, что видимо, зависело от хорошего развития коллатерального кровообращения и состояния ауторегуляции пораженной области.

Рис. 62. Больной У, 26 лет, клинический диагноз: состояние после субарахноидального кровоизлияния. Каротидная ангиография справа (а). Спазм участков М1-М2 правой СМА (стрелки); спектрограмма кровотока (б) по правой СМА (усиление ЛСК до 200 см/с), то же исследование (в) через 60 дней.
Именно в таких случаях данные ТКД могут стать решающими и приобрести особую ценность при динамическом наблюдении за больными с этим тяжелым, но асимптомным вазоспазмом.
При КТ головы была установлена прямая связь между величиной объёма крови и ее сгустков в субарахноидальном пространстве и развитием тяжести церебрального ангиоспазма при разрыве аневризмы [15, 36, 38, 40].
Основным допплерографическим признаком церебрального вазоспазма, возникающим на 2-3 день после субарахноидального кровоизлияния, является повышение средней ЛСК до 120-140 см/с (на ангиограммах спастические изменения начинают различать лишь при скоростях от 120 см/с и выше). Сравнение между величиной скорости кровотока и развитием клинической картины ишемии показывает, что при симптоматическом вазоспазме увеличение скорости кровотока происходит до появления клинических симптомов или их нарастания, что позволяет использовать значение величины ЛСК в качестве прогностического показателя.
В клинической практике при субарахноидальных кровоизлияниях вазоспазм в артериях основания мозга принято чаще всего оценивать по величине средней ЛСК в СМА, так как она является конечной артерией и более доступна для локации (рис. 62). Установлена корреляция между степенью выраженности вазоспазма и средней величиной ЛСК.
В зависимости от степени увеличения средней ЛСК принято различать три степени тяжести вазоспазма интракраниальных артерий: легкая - до 140 см/с; средняя - от 140 до 200 см/с; тяжелая - более 200 см/с.
По мере нарастания степени выраженности спазма церебральных сосудов изменяется соотношение показателей ЛСК между СМА и ВСА (в норме соотношение скоростей в СМА и ВСА колеблется от 1,2 до 2-2,5), что также позволяет судить о выраженности спазма СМА. легкая степень - 2,6-3.0: средняя - 3,1-6.0: тяжелая - 6,1-6 9.

Рис. 63. Больная М., 23 лет, каротидная ангиография слева. АВМ в левой лобной области (стрелка) до операции (а) и после тотального удаления (Б), Спектрограммы кровотока по левой ПМА до операции (в) и после нее (г).
Мониторинг показателей скорости кровотока у больных с разрывом аневризм позволяет осуществить раннюю диагностику возникновения вазоспазма, вести наблюдение за процессом его изменения под влиянием нимодипина (или других спазмолитических лекарств) и определять у каждого конкретного больного время, когда может быть выполнена операция клипирования аневризмы без риска увеличения ангиоспазма и развития ишемии мозга, так как усиление ангиоспазма (средняя ЛСК>200 см/с) на 24 часа опережает развитие инфаркта мозга и появление клинических симптомов [11, 35 38 41-43].
Артерио-венозная мальфсрмация является аномалией развития, возникает вследствие ненормального формирования сосудистой сети плода, представляет собой в общем виде шунт через который артериальная кровь из приносящей, питающей артерии сбрасывается непосредственно в венозное русло. В зависимости от величины АВМ принято делить на. малые (диаметр до 2 см), средние (от 2 до 4 см) и большие (более 4 см). Основным, окончательным методом диагностики АВМ является церебральная ангиография, которая точно определяет величину и локализацию мальформации, все питающие ее артерии, пути оттока и сброса крови в венозную систему При этом гемодинамичеекая информация, заложенная в серии ангиограмм может быть сложна для интерпретации, особенно при питании АВМ из нескольких сосудистых бассейнов. Поэтому особую важность приобретает методика ТКД, позволяющая достаточно точно регистрировать ЛСК в сосудах, несущих кровь к мальформации, сравнивая эти данные с данными у здоровых людей Диагностические возможности ультразвуковых методик могут выйти на первый план при обследовании пациентов, у которых не произошло субарахноидального кровоизлияния, и прямые показания к церебральной ангиографии отсутствуют [38. 42. 43].
Известно, что АВМ может снабжаться кровью («питается») из одной (рис. 63) или нескольких интракраниальных артерий; большие аневризмы, как правило, получают кровь из нескольких артерий, в то время как малые - из одной Исследование кровотока в артериях, питающих мальформацию у каждого конкретного больного, и правильная его оценка позволяют выделить характерные для АВМ допплерографические признаки: 1) высокая ЛСК в питающей мальформацию артерии;
2) снижение ИП в питающей артерии; 3) четкая асимметрия ИР в сравнении с контралатеральной артерией, 4) выраженное снижение ИР 5) отсутствие ауторегуляторного ответа при компрессии ОСА (подробно в главе 10). 6) снижение показателей цереброваскулярного резерва в питающей артерии при пробах с СО2; 7) повышение ЛСК в гомолатеральной ОСА и ВСА на шее.
Малые АВМ могут оказаться не чувствительными к методу ТКД т. к. показатели ЛСК в «питающих» их артериях попадают в диапазон нормальных отклонений, что накладывает ограничения на возможности метода
Большие АВМ получают кровь из нескольких сосудистых бассейнов, что сопровождается расширением сосудов артериального круга большого мозга, усилением ЛСК по всем интракраниальным артериям (со снижением ИР и ИП), выраженным снижением цереброваскулярного резерва, нарушением ауторегуляции.
Известно, что при АВМ, стенозе интракраниальных артерий, ангиоспазме, как правило, имеет место усиление ЛСК. нередко сопровождающееся включением в процесс коллатерального кровообращения по артериальному кругу большого мозга Однотипность выявляемых изменений ведет к необходимости дифференциальной диагностики, этих патологических состояний, что может оказаться непростым делом (табл. 12)
Итак, были рассмотрены ведущие направления в применении ТКД, прочно вошедшие в клиническую практику. Однако области использования метода значительно шире - к ним можно отнести, массовые профилактические обследования населения с целью выявления ранних цереброваскулярных поражений; выявление интракраниальных поражений артерий у людей с начальными формами недостаточности кровоснабжения мозга, определение стенозирующих процессов в сосудах основания мозга при гриппе и других инфекционных заболеваниях; выяснение причины головной боли (ангиоспазм, повышение внутричерепного давления и др.); выявление ведущего фактора при спазме сосудов у больных с мигренью с целью подбора адекватной терапии; изучение изменений мозгового кровообращения при ревматизме, диабете и других заболеваниях; исследование резервных возможностей мозга под влиянием фармакологических проб; оценка состояния церебральной гемодинамики у больных после пересадки органов и у новорожденных после родовой травмы.
В отдельное направление выделилось мониторирование кровоснабжения мозга при хирургических операциях под наркозом с целью поддержания его на нормальном уровне, обнаружение и изучение микроэмболий в сосудах мозга у больных с ПНМК и ОНМК при операциях на сердечно-сосудистой системе (подробно в главе 6).
Завершая раздел о диагностических возможностях метода ультразвуковой допплерографии при исследовании сосудов дуги аорты и основания мозга у больных в неврологической и ангиохирургической клиниках, ещё раз подчеркнём простую, ясную мысль, которую при изложении материала мы пытались внушить читателю, - совершенное овладение врачом всеми приемами метода ультразвуковой допплерографии (кажущегося на первый взгляд простым - многие остаются при этом заблуждении на долгие годы) и их постоянное совершенствование лежит в основе успешной диагностики сосудистых заболеваний головы.
4. Цветовое дуплексное сканирование артерий дуги аорты и их ветвей на шее
В 1974 г. F. Barber et al. [44] предложили ультразвуковую методику, сочетающую в себе визуализацию сосудов и тканей в В-режиме и допплеровскую оценку показателей линейной скорости кровотока. Метод позволяет одновременно оценивать состояние стенок сосуда и распределение потоков крови в нём (дуплексная сонография) [45-47].
Результат компьютерной обработки допплеровского сдвига частот может быть представлен в виде допплерограммы со спектральным анализом скоростных составляющих кровотока, либо цветовой двухмерно-пространственной картограммой распределения потоков в сосуде. При этом можно кодировать как скоростные, так и «энергетический» параметры кровотока.
Цветовые допплеровские картирования (ЦДК) - это технология визуализации кровотока, основанная на регистрации скоростей движения крови в сосуде, кодирование этих скоростей разными цветами спектра и наложение полученной картины на двухмерное черно-белое изображение сосуда.
Энергетическое допплеровское картирование (ЭДК), получившее ещё название ультразвуковая ангиография (за свою высокую чувствительность и информативность), отображает многочисленные амплитудные значения сигналов от подвижных разнонаправленных целей-эритроцитов и, таким образом картирует энергетические характеристики сигналов (не давая их направления), как от крупных, так и от мелких сосудов, включая капилляры.
Сочетание цветовой картограммы потока, спектрального анализа отражённого допплеровского сигнала и изображения сосуда в В-режиме получило название триплексного сканирования (дуплексное сканирование с цветовым картированием потока) [48]. В англоязычной литературе в последние годы установилось собирательное название ультразвукового исследования на УЗ-приборах 4-го поколения, обозначаемое как цветовое допплеровское сканирование или цветовое дуплексное сканирование, или цветовая допплеровская дуплексная)сонография (ЦДС)
Основными показаниями к применению ЦДС сосудов дуги аорты и их ветвей является наличие признаков нарушения гемодинамики, выявленное методом УЗДГ, хотя отсутствие при этом изменений кровотока не исключает поражения МАГ и применения ДС при наличии клинических признаков острой или хронической цереброваскулярной недостаточности, помимо этого, ЦДС показана зо всех неясных клинических случаях и может быть успешно использована экономический фактор) по тем же показаниям, что и методы УЗДГ и ТКД [37, -19-52]
При сканировании сосудов дуги аорты и их ветвей на шее можно получить изображение: ПГС подключичных и общих сонных артерий, экстракраниальных участков ВСА, проксимальных отделов НСА, сегментов позвоночных артерий на шее подключичных, позвоночных и яремных вен. При этом в стенке артерии выявляют три оболочки внутреннюю (tunica intima), среднюю (tunica media) и наружную (tunica adventicia). Внутренняя оболочка образована слоем эндотелиальных клеток с гладкой поверхностью подлежащей внутренней эластической поверхностью и подлежащей мембраной (субэндотелиальный слой, толщиной около 5 мкм), в сонных артериях эти два слоя имеют толщину около. 0,02 мм и в норме не видны Средняя оболочка образована преимущественно гладкой мышечной тканью и эластической стромой, наружная оболочка - рыхлой соединительной тканью с большим содержанием эластических и коллагеновых волокон.
В зависимости от преобладания в стенках артерий тех или иных морфологических элементов принято различать сосуды эластического, мышечного и смешанных типов. Аорта. ПГС, ОСА и ПА являются сосудами эластического типа. ЗСА до входа в синокаротидный канал является артерией мышечно-зластичного типа, а после входа становится артерией мышечного типа, как и ПА после входа в череп.
4.1. Методика и техника цветового дуплексного сканирования сосудов дуги аорты и их ветвей
Для правильного выполнения техники ЦДС сосудов на шее необходимо соблюдать некоторые общие методические принципы
Перед началом исследования врач должен создать для себя максимально комфортные условия определить наиболее оптимальную высоту своего кресла, кушетки с больным и обеспечить удобный доступ к панели, предварительно проверенного прибора. Больной располагается на спине с тонкой подушкой под головой или на мягком матрасе а при короткой толстой шее больного целесообразно подкладывание под плечи плотного валика (небольшое переразгибание шеи). Лишь после такой простой, но важной подготовки можно переходить к сканированию сосудов шеи.
Врач располагается сбоку от больного и начинает исследование в В-режиме, линейным датчиком с диапазоном частот 7-10 МГц (рис 64). При сканировании плечеголовного ствола голова пациента повёрнута влево, датчик (с предварительно нанесенным гелем) располагают параллельно ключице или под небольшим углом к ней, несколько выше грудиноключичного сочленения, при этом датчик наклоняют вправо так, чтобы медиальная его часть входила в яремную вырезку под углом 30-40о по отношению к горизонтальной плоскости тела что позволяет чётко визуализировать дистальную часть плечеголовного ствола, устья правых общей сонной и подключичной артерий. При смещении датчика в той же плоскости вправо можно получить изображение первой порции правой ПКА и устья (до 80%) позвоночной артерии, а также начало щитошейного и реберношейного стволиков.
Технику сканирования сонных артерий выполняют в трёх плоскостях поперечной, передней и задней (или задне-боковой) продольных. Начинают с обзорного поперечного сканирования правой половины шеи, при повороте головы на 45% влево (можно и без поворота). Датчик располагают перпендикулярно поверхности шеи и начинают от ключицы медленно перемещать по коже правой половины шеи (предварительно обильно наносят гель) к углу нижней челюсти, при этом, по мере передвижения получают изображение поперечных срезов ОСА, наружной и внутренней яремных вен, бифуркации ОСА и её деление на ВСА и НСА. получая обзорное представление о состоянии просвета и хода ОСА и её ветвей. После чего переходят к локации в передней продольной плоскости, при этом неизменённая артерия будет представлена в виде эхонегативного образования, сверху и снизу ограниченного параллельно расположенными эхопозитивными структурами (рис. 65 а, б) Располагают датчик нижним краем в области ключицы по переднему и/или заднему краю грудино-ключично-сосковой мышцы и, медленно изменяя угол его наклона, добиваются получения четкого изображения ОСА затем медленно перемещают датчик подлиннику ОСА при этом прямым продолжением её будет НСА располагающаяся несколько медиальней. Смещение датчика латеральней позволяет наблюдать устье ВСА и её дистальный отдел. При сканировании в задней продольной плоскости датчик располагают перпендикулярно предыдущей плоскости и получают изображение тех же сосудов Исследование сонных артерий во взаимоперпендикулярных областях принципиально важно, т. к расширяет диагностические возможности ЦДС, позволяя определять детали атеросклеротических поражений не выявляемые при сканировании в одной проекции.

Рис. 64. Общий вид исследования левой общей сонной артерии методом цветового дуплексного сканирования.
Начинающим исследователям иногда трудно отличить начальный сегмент ВСА от НСА. В 90% всех наблюдении начальный сегмент ВСА лежит латеральнее НСА но возможны различные варианты деления ОСА, поэтому критерий позиционного расположения не всегда может оказаться верным. Есть ещё четыре дифференциальных признака: 1) диаметр внутренней сонной, как правило, больше, чем наружной; 2) внутренняя сонная не имеет ветвей, а у наружной сонной они почти всегда в наличии; 3) наружная сонная (в отличии от ВСА) чаще всего является линейным продолжением ОСА; 4) четкие различия в аудио, спектральных и скоростных характеристиках кровотока и индексах периферического сопротивления между ВСА и НСА.
Рис. 65. Эхограмма сосудов шеи в В-режиме (а - поперечный, б - продольный срезы): 1 - ВЯВ: 2 - НЯВ; 3 - ОСА, 4-ВСА, 5-НСА.
Локацию позвоночной артерии начинают в режиме ЦДК при положении головы больного в сагиттальной плоскости, датчик устанавливают под углом близким к 90° между трахеей и внутренним краем грудино-ключично-сосковой мышцы. При отсутствии цветового изображения артерии в этой проекции (участков ПА между позвонками) или его плохом качестве поворачивают голову пациента в противоположную сторону и переводят датчик в горизонтальную плоскость, лоцируя артерию непосредственно между поперечными отростками шейных позвонков. Описанная техника предназначена для получения изображения ПА на участках V1-V2. Для локации ПА на участке V3 датчик располагают под сосцевидным отростком, за углом нижней челюсти с направлением плоскости сканирования медиально и книзу. С получением цветового участка ПА включают триплексный режим, устанавливают метку объёма в пределах 2/3 просвета сосуда по его ходу под углом менее 60° и регистрируют показатели ЛСК.
При оценке допплеровских характеристик кровотока по сонным и позвоночным артериям обращают внимание на форму пульсовой волны, спектральное распределение скоростей в потоке и скорость кровотока. Определяют пиковую (максимальную) систолическую скорость кровотока (peak systolic velocity - Vps), оценивают усреднённую по времени максимальную скорость (time average maximum - ТАМХ) и усреднённую по времени среднюю (time average velocity - TAV) скорость кровотока. При этом величина TAV является основной, т. к. даёт представление о скорости кровотока за все фазы сердечного цикла за счёт усреднения всех составляющих спектра, т. е. позволяет достоверно судить об истинной скорости в сосуде, тогда как Vps отображает кровоток в систолу. Показатель TAV является наиболее чувствительным и начинает снижаться при небольшом уменьшении просвета артерии, в то время как Vps изменяется лишь при выращенном стенозе сосуда.
Кроме определения ЛСК в МАГ, метод ЦДС даёт возможность определять объёмную скорость кровотока (Vvol), которую рассчитывают по формуле: Vvol = A.TAV, где А (площадь сечения сосуда) = (ттD2)/4, D - диаметр сосуда в диастолу. Параметры кровотока по МАГ и величины их диаметров в норме представлены в таблице 13 [53].
Таблица 13. Основные показатели кровотока по МАГ у здоровых лиц при ЦДС [53].
|
Артерия |
Диаметр, |
Vps, |
Ved, |
TAV, |
ТАМХ, |
RI |
PI |
SBI |
Vvol, |
|
|
мм |
см/с |
см/с |
см/с |
см/с |
|
|
|
мл/мин. |
|
Общая |
6.3 ±0.9 |
96 ± 2.5 |
26 ±6 |
25.4 ± 5.4 |
40.9 ± 8 |
0.72 ± 0.07 |
1.72 ±0.5 |
0.38 ± 0.06 |
470±120 |
|
сонная |
4.7-9.7 |
50-16 |
6-43 |
10-37 |
15-65 |
0.55-0.9 |
0.91-3.33 |
0.22-0.54 |
267-779 |
|
Внутрен- |
4.8 ±0.7 |
66 ± 16 |
26 ±6 |
24.9 ± 5.2 |
37.5 ± 7.7 |
0.6 ± 0.07 |
1.08±0.29 |
0.33 ± 0.06 |
265 + 82 |
|
няя |
3.3-7.2 |
36-115 |
10-40 |
11-38 |
16-59 |
0.44-0.8 |
0.47-2.09 |
0.19-0.55 |
154-493 |
|
сонная |
|
|
|
|
|
|
|
|
|
|
Наруж- |
4.1 ± 0.6 |
83 ±17 |
17±5 |
19.6 ±4.1 |
30.7 ± 6.6 |
0.79 ± 0.05 |
2.17±0.51 |
0.36 ± 0.09 |
160 ±66 |
|
ная |
2.8-6 |
45-136 |
9-28 |
11-31 |
18-51 |
0.65-0.9 |
1.3-3.46 |
0.17-0.55 |
55-474 |
|
сонная |
|
|
|
|
|
|
|
|
|
|
Позво- |
3.4 ±0.6 |
48 + 10 |
16 + 4 |
15.6 ±3.6 |
24.3 ± 5.2 |
0.66 + 0.07 |
1.35 ±0.4 |
0.35 ±0.11 |
85 ± 33 |
|
ночная |
1.8-4.5 |
28-71 |
8-26 |
9-26 |
14-38 |
0.52-0.83 |
0.8-2.58 |
0.02-0.61 |
21-165 |
При регистрации кровотока в дуплексном и триплексном режимах для получения корректных скоростных параметров гемодинамики необходимо соблюдать некоторые условия: производить выбор угла наклона датчика к продольной оси сосуда, при этом его величина не должна превышать 60; метка контрольного объема должна занимать не менее 2/3 сосуда; устанавливаемая цветовая шкала должна включать весь диапазон скоростей частиц крови внутри сосуда.
4.2. Диагностика окклюзии, стенозов и деформаций МАГ при ЦДС
Основы успешной диагностики поражений сосудов дуги аорты и их ветвей на шее при ЦДС связаны как с точным, правильным выполнением методических приёмов техники сканирования (что приходит только с опытом и постоянным самоусовершенствованием), так и непрерывным процессом, обусловленным поиском и выбором адекватной оценки, выявляемых во время исследования на экране прибора изменений при переходе из В-режима в режимы ЦДК или ЭДК, измерение ЛСК в местах возможного стеноза, изменение технических условий локации и др.
Методом ЦДС можно диагностировать стенозы и окклюзии сосудов дугиаорты и их ветвей на шее, деформации, диссекции, аномалии развития, неспецифический аортоартериит и другие поражения сосудов. Однако, несмотря на разнообразие причин внутрисосудистого поражения экстракраниальных артерий на шее, вызывающих НМК, все они могут приводить к сходным нарушениям гемодинамики, различаясь лишь визуальными данными. Поэтому начнём изложение с измерения атеросклеротических поражений сонных артерий.
В литературе нет консенсуса по количественной оценке степени стеноза. В англоязычных странах используют «дистальную степень стенозирования», когда стенозированный просвет сравнивают с просветом дистального отдела ВСА [54, 55].
В противоположность этому, согласно рекомендациям рабочей группы сосудистой диагностики немецкого Общества Ультразвука в Медицине, стенозы классифицируют согласно «локальной степени стенозирования» [56]. При этом подходе значимость стеноза устанавливают путем сравнения остаточного просвета с истинным, который легко распознают на изображении сосуда в. В-режиме. Стенозы малой и средней степени, в частности, могут быть лучше оценены при этом подходе, что мы и используем в своей практической работе. При использовании другого метода расчета, так называемого «каротидного отношения», когда диаметр в стенозированной ВСА сопоставляют с диаметром ОСА, измеренным в 3 см перед бифуркацией. Для определения степени стеноза в области бифуркации ОСА описаны три различных способа [57, 58].
ECST (European Carotid Surgery Method) - метод, при котором степень стеноза бифуркации общей сонной артерии вычисляется как отношение разности величины максимального и свободного просвета сосуда к величине максимального диаметра сосуда выраженное в процентах;
NASCET (North American Symptomatic Carotid Endarterectomy Trial) - метод, при котором степень стеноза вычисляется как отношение разности величины диаметра внутренней сонной артерии дистальнее места стеноза к величине свободного просвета сосуда, выраженное в процентах;
СС (Common Carotid) - метод, при котором степень стеноза вычисляется как отношение разности величины диаметра общей сонной артерии проксимальнее места стеноза и величины свободного просвета сосуда к величине диаметра общей сонной артерии, выраженное в процентах (рис. 66).
Классификация степеней стенозирования по ультразвуковым допплеровским и морфологическим критериям показана в табл. 14.

1. способ:
(С-А)/Сх100% (ECST-метод)
2. способ:
(B-A)/Bх100% (NASCET-метод)
3.способ:
(D-A)/Dх100% (СС-метод)
Рис. 66. Основные методы измерения степени стеноза сонных артерий по диаметру при дуплексном сканировании (подробно в тексте).
Однако при диагностике стенозов методом цветового дуплексного сканирования не ограничиваются только результатами оценки характеристик кровотока, представленными в таблице 14 а принимают во внимание изменения допплеровского паттерна цветового потока в стенозированном участке и оценивают его особенности.
Таблица 14. Классификация степени стеноза ВСА согласно допплеровским и морфологическим критериям [56].
|
Критерий Морфология |
I. Бляшка без стеноз |
II. Стеноз низкой градации |
III. Умеренный стеноз |
IV. Выраженный стеноз |
V. Стеноз высокой градации (пред-окклюзия) |
|
Локальный процент стеноза |
<40% |
40-50% |
60-70% |
- 80% |
> 90% |
|
Допплеровская сонография | |||||
|
Косвенные критерии по глазной артерии |
|
Поток не изменяется |
|
Сравнение потоков с двух сторон указывает на его снижение, исчезновение или ретроградный поток | |
|
Общая сонная артерия |
|
|
Обычно повышенная пульса- тильность |
Повышенная пульсатильность, сниженная скорость потока | |
|
Прямые критерии в стенози- рованной области |
Норма |
Легкие или незначительные ультразвуковые изменения |
Отчетливое повышение скорости потока (повышение систолической и диастолической максимальной частот) |
Выраженное локальное повышение скорости потока; высокочастотный акустический сигнал, нарушения потока |
Варьирующие стенотические сигналы со сниженной интенсивностью |
|
Спектральный анализ |
Норма |
Легкое спектральное расширение |
Спектральное расширение с повышенной интенсивностью низкочастотных компонентов |
Инверсия частотных компонентов в спектре |
Инверсия частотных компонентов |
|
Прямые критерии в постсте- нотической зоне |
Норма |
Норма |
В некоторых случаях - снижение систолической скорости потока |
Снижение систолической скорости потока |
Выраженное снижение сигнала, сложности детекции |
|
Максимальная систолическая частота в области стеноза |
<4 kHz |
-4 kHz |
4-7 kHz |
>7 kHz |
Изменчива |
|
Максимальная систолическая скорость в области стеноза |
<120 cm/s |
- 120 cm/s |
- 200 cm/s |
- 300 cm/s |
Изменчива |
|
В-режим |
Бляшка без сужения просвета |
Умеренное снижение просвета |
Сужение просвета высокой градации |
Сужение просвета очень высокой градации |
Увеличение допплеровской частоты в стенозированном участке является решающим при оценке степени стеноза. Возрастание допплеровской частоты пропорционально диаметру остаточного просвета вплоть до примерно 90% сужения и характеризуется свистящим акустическим сигналом [59] В случае предокклюзивного («критического») стеноза допплеровская частота снижается, следовательно, должны учитываться, в особенности, косвенные параметры. Максимальная систолическая частота выше 4 кГц считается патологической [56]. Максимальная частота (или при коррекции угла максимальная систолическая скорость кровотока в сантиметрах в секунду) удобный параметр для контрольных динамических исследований, т. к. у каждого пациента этот показатель относительно постоянен (если не меняется рабочая частота датчика) и надежен. В нормальном допплеровском спектре в период систолы преобладают высокочастотные компоненты (концентрирующиеся под максимальными частотами)
Низкочастотные компоненты в спектре обычно отсутствуют - что имеет отношение к так называемому «систолическому окну» (симптом окна). В случае стеноза допплеровский сдвиг увеличивается. В дополнение к этому, количество низкочастотных компонентов спектра также возрастает в результате нарушений ламинарности потока в стенозированном участке, заполняя систолическое окно. Это называется спектральным расширением. Дополнительно к этому, в случае стеноза высокой градации наблюдаются также отрицательные частотные компоненты.
В зависимости от степени стенозирования нарушения потока могут также возникать дистальнее стеноза. Это может обнаруживаться на большом расстоянии в виде отрицательных частотных компонентов. В последующем сегменте сосуда могут быть найдены сниженные скорости кровотока
Благодаря эффекту аляйзинга быстро обнаруживается зона максимального сужения просвета сосуда. Это позволяет прицельно и точно выполнить измерения гемодинамических параметров. В дополнение к этому, в постстенотическом сегменте нарушенный кровоток, который характеризуется низкой частотой, ретроградными компонентами потока или компонентами с различными направлениями потока, легко распознается в связи с изменениями цветового кодирования
Если технические параметры цветового кодирования потока установлены правильно, измерение степени стенозирования может быть выполнено, исходя из частоты при которой появляется аляйзингэффект. Однако определяющим параметром для точной оценки увеличенной вследствие стенозирования скорости кровотока является спектральный анализ после коррекции угла. Только изображение остаточного просвета в режиме цветового кодирования потока может привести к ошибочной интерпретации из-за проекционных артефактов. К тому же, цветовой поток в режиме энергетического картирования не помогает количественной оценке стенозов средней и высокой степени, т к. диаметр изображения просвета с сохраненным кровотоком зависит от выбранной проекции.
При обнаружении стенозов очень высоких градаций (предокклюзивных, критических) или субтотальной окклюзии, которые характеризуются сниженным кровотоком, изображение остаточного просвета в режиме цветового кодирования является чрезвычайно важным. При этом возможности метода ЦДС особенно очевидны в дифференциации предокклюзивного стеноза и окклюзии (рис. 67), что является трудной, но принципиально важной для клиники задачей, т к. должно определять возможность и целесообразность выполнения хирургического вмешательства на сосуде

Рис. 37 Цветовая эхограмма бифуркации левой ВСА (режим ЦДК). Виден черно-белый тромб (стрелки) и цветовое изменение паттерна кровотока перед местом окклюзии.
Методика исследования начинается с установки цветовой шкалы на самую низкую частоту (или низкую скорость кровотока). При этом, в случае предокклюзивного стеноза часто визуализируются только несколько пунктирных цветовых сигналов. Тем не менее, они выявляют место, куда следует поместить контрольный объем, чтобы записать допплеровский спектр. При таком исследовании режим энергетического картирования может дать дополнительную информацию, благодаря высокой чувствительности при обнаружении низких скоростей кровотока [60].
Таблица 15. Ультразвуковые описательные параметры морфоструктуры бляшки [62]
|
Число |
Единичная, множественные | |
|
Размер. |
ширина (см) длина (см) толщина бляшки (мм) |
|
|
Локализация: |
| |
|
Продольный вид: |
Периферическая (медиальная латерально-дорзальная) | |
|
|
Концентрическая |
|
|
Поперечный вид. |
Эксцентрическая (медиальная латеральная, вентральная, дорзальная) | |
|
Локальное сужение просвета |
Процент стеноза |
|
|
|
Редукция диаметра просвета на поперечном срезе | |
|
Поверхность бляшки |
| |
|
Оценка: |
Легкая Достаточно легкая Трудная |
|
|
Отграничение от просвета: |
Поверхность не визуализируется | |
|
Формирование ниши: |
Правильная - граница ровная, протяженная неровная - прерывистая | |
|
|
в контуре (±) |
|
|
|
Размер = толщина х длина в мм | |
|
Структура бляшки: |
Гомогенная Гетерогенная |
|
|
Эхоплотность |
Изоденсные |
Средняя |
|
|
(echogenic) |
Высокая Появление акустических теней (с появлением эхогенных включений) |
|
|
Гиперэхогенные |
|
|
|
Гипоэхогенные |
|
|
|
Внутренние включения визуализируются |
Особенно при дифференциации между нитевидным сужением просвета длинного сегмента сосуда и окклюзией и в особенности, когда дистальный конец стеноза не доступен визуализации, все технические функции системы цветового кодирования должны быть использованы. Результат исследования, однако, в большой степени зависит от опыта исследователя
Применение метода ЦДС с использованием датчиков высокого разрешения позволяет оценивать морфологию атеросклеротических бляшек, развивающихся в артериях Сегодня нет единой всеобъемлющей классификации атеросклеротических бляшек, хотя попытки создать её и предпринимались [52]
В практической работе в соответствии с общепринятой в литературе классификацией характеристик атеросклеротических бляшек (классификация A.Gray-Weale et al [61]) мы используем её упрощённый вариант:
- Гомогенные атеросклеротические бляшки с низким значением ультразвуковой плотности («гиподенсивные», «мягкие»).
- Гетерогенные по строению атеросклеротические бляшки с преобладанием структур низкой ультразвуковой плотности.
- Гетерогенные по строению атеросклеротические бляшки с преобладанием структур высокой ультразвуковой плотности.
- Гомогенные плотные атеросклеротические бляшки (с наличием участков кальциноза или без него).
При анализе бляшки особое внимание уделяют состоянию её поверхности, неровностям, изъязвлениям контура, наличию кровоизлияний и состоянию покрышки бляшки, толщине, подвижности, равномерности пульсации

Рис 68а. Цветовая эхограмма ВСА Гомогенная мягкая бляшке (стрелки) хорошо отображена в режиме ЦДК б. Цветовая эхограмма бифуркации ОСА (АСС). Гетерогенная бляшка ВСА (ACI) умеренной плотности и кальцинатом в режиме ЦДК (показана стрелками).
Цветовое дуплексное сканирование в В-режиме предоставляет важную информацию, касающуюся наличия бляшек, их размеров, морфологии и состава. Для определения их размеров и локализации необходимо изучить несколько продольных и поперечных проекций. В дополнение к размерам и локализации бляшек должны быть изучены поверхность, структура и эхогенность. Два различных типа бляшек могут быть визуализированы: гомогенные (рис. 68 а) и гетерогенные (рис. 68 б). Показатели, которые предлагает использовать Е. Bartels [62] для ультразвукового описания морфологической структуры бляшек, суммированы в таблице 15.
Морфология бляшки зависит от степени развития атеросклеротических изменений сосудистой стенки. В начальной стадии атеросклеротического поражения наблюдается диффузное гомогенное утолщение стенки. По мере развития заболевания бляшка постепенно увеличивается в просвете сосуда и может демонстрировать различные степени эхогенности. Бляшки средней степени эхогенности с гиперэхогенными включениями состоят преимущественно из фиброзной ткани с кальцификатами (рис. 69 а). Эти бляшки менее опасны как источник эмболии интракраниальных артерий, чем гетерогенные бляшки с преобладанием гипоэхогенных зон. Зоны низкой эхогенности представляют собой атероматозный материал, состоящий из холестерола и жировых отложений, клеточных остатков и некротического материала и других компонентов. Кровоизлияния, которые могут развиться внутри бляшки при разрыве мелких сосудов, также имеют низкую эхогенность. Чем ниже степень эхогенности бляшки, тем выше риск разрыва её эпителиальной поверхности с последующим изъязвлением, которое имеет вид ниши или кратера при визуализации в В-режиме (рис. 69 б).
При обнаружении ниши не всегда возможно определить стадию развития атеросклеротической бляшки. Кратеры и язвенные образования могут также обнаруживаться после разрыва интрамурального кровоизлияния. Последующая постепенная «реэндотелизация» этих кратеров с гладкой границей не столько длительна, сколько опасна в той же степени, как опасны гетерогенные гипоэхогенные бляшки с плотными включениями, описанные выше.

Рис. 69. Эхограмма бифуркации ОСА (ССА) в В-режиме.
а. Гетерогенная бляшка ОСА (стрелки) с переходом на устье ВСА (ICA) - кальцинированная покрышка с дорожками и гомогенным плотным телом.
б. Гетерогенная бляшка ВСА (стрелки) с неровным, изъязвленным кратерообразным контуром (эмбологенная).
Нарушения кровотока на поверхности бляшек хорошо визуализируются при цветовом дуплексном сканировании, а ретроградные компоненты потока в нише могут быть легко распознаны благодаря инверсии цветового картирования. Поверхность бляшки дополнительно может быть лучше очерчена в режиме энергетического картирования.
Итак, подводя итоги можно заключить, что гомогенные, с гладкой поверхностью бляшки считаются стабильными и имеют благоприятный прогноз как малоизвестный источник микроэмболии. В противоположность этому, гетерогенные бляшки с зонами разной эхогенности, гипоэхогенные бляшки с плотными включениями и образованиями типа «ниша» считаются нестабильными. Эти бляшки могут привести к эмболии мозга в результате изъязвлений и тромбоза [63-65]. Пациенты с гетерогенными бляшками, содержащими гипоэхогенные зоны, должны регулярно проходить ультразвуковые обследования, чтобы фиксировать стадию поражения и возможность его прогрессирования. Согласно данным М. Hennerici et al. [66] в 19% случаев возможна спонтанная регрессия бляшки.
Диагностика окклюзий артерий дуги аорты и их ветвей при ЦДС может быть связана с ошибками и только в сочетании с методом УЗДГ возможна достоверная постановка диагноза закупорки (подробно в разделе 2.2), хотя в В-режиме можно видеть обрыв контура сосуда, а при ЦДК и ЭДК остановку, обрыв и изменения цветового патерна. Однако достоверный диагноз окклюзии при ЦДС можно точно установить только при окклюзии подключичной артерии в устье, а для выявления закупорки сонных артерий необходимо использовать сочетание методов ЦДС и УЗДГ, поэтому целесообразней начинать обследование сосудов с УЗДГ, а затем при необходимости переходить к другим методам.
Диагностика деформаций МАГ при ЦДС не представляет особых затруднений. Методика их исследования включает выявление их в цветовом и энергетическом режимах, оценку локализации и конфигурации, измерение локальных характеристик кровотока. Во многих клинических случаях деформации (перегибы и извитости) проявляют себя как стенозы, сопровождаясь теми же изменениями гемодинамики. Перед деформаций артерии ЛСК может снижаться, а индекс периферического сопротивления повышаться. В зоне деформации в зависимости от её формы отмечают изменения кровотока, приводящие к возрастанию ЛСК (чаще в случаях перегиба) и/или появлению разнонаправленного турбулентного потока (при петлях). После зоны деформации ЛСК возрастает, индекс сопротивления снижается. В дистальном отделе отмечают нормализацию спектрограмм и показателей кровотока. При этом некоторые деформации могут приводить к снижению ЛСК по гомолатеральным интракраниальным артериям, что вероятно связанно с выраженными энергетическими потерями внутри деформации вследствие турбулентного потока (подробно в главе 7).
5. Транскраниальное цветовое дуплексное сканирование интракраниальных сосудов
Транскраниальное цветовое дуплексное сканирование (ТК ЦДС) является последним достижением среди методов ультразвуковой визуализации сосудов. В 1988 г. М. Shoning et al. [67] первыми описали методику получения изображения различных образований мозга через неповреждённый череп взрослого человека [48, 67, 68]. Метод развевали, совершенствовали и в последние 4 года получил распространение в ангионеврологии.
Методика транскраниального ЦДС включает в себя изучение вещества головного мозга в В-режиме и исследование кровотока по передним, средним и задним мозговым артериям, основной и позвоночным (участок V4) артериям, а также по венам Розенталя вене Галена, прямому синусу. Однако структурное изображение вещества мозга с помощью ультразвука ещё недостаточно совершенно и значительно уступает диагностическим возможностям методов КТ МРТ. Поэтому использовать В-режим можно как вспомогательный, так как получить изображение стенки интракраниальных сосудов в В-режиме принципиально невозможно и всю информацию о них оценивают по характеру изменений цветовой картограммы потока крови в сосудах и показателям ЛСК.

Рис. 70. Общий вид транскраниального дуплексного сканирования артерий основания мозга через височное окно.


Рис. 71. Транскраниальное цветовое дуплексное сканирование артерий основания мозга в режиме ЭЦК (а) и УДК (6). А1 , А2 - участки ПМА; М, М2 - участки СМА Р. - участки ЗМА; OA - основная артерия
Исследование интракраниальных артерий выполняют при положении больного не спине (рис 70) и/или в положении сидя, транскраниальное цветовое дуплексное сканирование выполняют секторным датчиком с частотой 2 МГц из трёх возможных доступов, аналогичных методу ТКД. При транстемпоральном сканировании датчик помещают над чешуёй височной кости спереди, сверху или за ухом, при этом плоскость сканирования должна быть параллельной основанию черепа. В этой проекции можно получить изображение передних, средних и задних мозговым артерий, переднюю и задние соединительные артерии, поперечное сечение основной артерии, вены Розенталя, вену Галена, прямой синус с обеих сторон. Таким образом из этого доступа возможно получить отображение (хотя и не всегда) всех артерий основания мозга, формирующих артериальный круг большого мозга (рис 71) Изображение интракраниальной части ВСА (сифона) может быть получено при повороте датчика вокруг оси на 40-90°.
Таблица 16. Основные показатели кровотока при ТК ЦДС артерий основания мозга
в зависимости от возраста [70]
|
Артерия |
Возрастные группы | |||
|
Параметр |
20-39 лет I 40-59 лет |
60 лет и старше | ||
|
Передняя мозговая |
Vps, см/с Vmean, см/с Ved, см/с PI |
91 (87-95) 60 (57-62) 41 (39-43) 0,82 (0,78-0,85) |
88 (83-93) 61 (57-64) 42 (40-45) 0,76 (0,73-0,79) |
79 (75-84) 51 (48-54) 33 (31-35) 0,92 (0,87-0,97) |
|
Средняя мозговая |
Vps, см/с Vmean, см/с Ved, см/с PI |
113 (109-116) 74 (71-76) 51 (49-53) 0,84 (0,82-0,87) |
106 (101-111) 72 (69-76) 47 (45-50) 0,81 (0,79-0,83) |
92 (88-96) 58 (55-61) 35 (33-37) 0,97 (0,93-1,02) |
|
Задняя мозговая: Р1 |
Vps, см/с Vmean, см/с Ved, см/с PI |
81 (78-84) 53 (51-55) 36 (35-38) 0,84 (0,8-0,88) |
71 (68-74) 49 (48-51) 33 (31-35) 0,78 (0,75-0,82) |
66 (63-69) 42 (40-45) 26 (24-28) 0,97 (0,91-1,02) |
|
Задняя мозговая: Р2 |
Vps, см/с Vmean, см/с Ved, см/с PI |
71 (68-74) 47 (45-49) 32 (31-34) 0,82 (0,79-0,85) |
70 (67-73) 48 (46-51) 32 (30-34) 0,77 (0,75-0,8) |
68 (64-72) 42 (39^15) 26 (24-28) 0,97 (0,91-1,03) |
|
Позвоночная (V4) |
Vps, см/с Vmean, см/с Ved, см/с PI |
66 (63-69) 44 (42-47) 31 (29-32) 0,82 (0,79-0,85) |
59 (55-63) 40 (38-43) 27 (26-29) 0,78 (0,74-0,82) |
52 (48-55) 33 (30-36) 22 (20-24) 0,94 (0,89-0,99) |
|
Основная |
Vps, см/с Vmean, см/с Ved, см/с PI |
74 (70-78) 50 (47-53) 34 (32-36) 0,81 (0,76-0,86) |
63 (56-69) 44 (39-48) 29 (26-32) 0,77 (0,73-0,83) |
54 (49-59) 35 (31-40) 23 (20-26) 0,95 (0,86-1,03) |
Из трансорбитального доступа сканируют участок сифона ВСА и глазную артерию при этом нужно значительно снизить диапазон мощности датчика (менее 100 мВт/см2). Этот доступ используют относительно редко, из-за возможного сложного строения сифона и невозможности в связи с этим исследовать ЛСК с корректным углом сканирования.

Рис. 72. Транскраниальная цветовая допплеровская эхограмма артерий основания мозга в режиме ЭДК.
Окклюзия правом средней мозговой артерии (показано стрелками OCCL. МСА); ПМА - АСА; ЗМА - РМА.
Субокципитальное сканирование, чаще всего, выполняют в положении пациента сидя на стуле, спиной к исследователю Датчик располагают по средней линии (или на 1-3 см латеральней) ниже большого затылочного отверстия а плоскость сканирования составляет от 20° до 70° с поверхностью шеи. При этом голова больного может находиться как вертикального, так и наклонена вперёд и в стороны, а в редких случаях - отклонена слегка назад. При этом надежно можно сканировать интракраниальные участки позвоночных артерий и основную артерию, хотя иногда для этого необходимо переводить датчик в вертикальную плоскость.

Рис. 74 Цветовое дуплексное сканирование сосудов головы
а Большая АВМ в затылочно-теменной области
(режим ЦДК).
б. Церебральная ангиограмма - клубок измененных сосудов АВМ с мощней сбрасывающей сводящей веной (стрелки).
В последние годы для исследования прямого синуса и глубоких вен иногда входит в практику метод трансокципитальной локации (принцип предложен В.А. Шахновичем в 1994 г. [69]) Датчик располагают горизонтально выше или ниже большого затылочного бугра, плоскость сканирования параллельна основанию черепа или составляет с ним угол 20-40°.
Одним из основных ограничений при исследовании сосудов основания мозга методом транскраниального ЦДС является отсутствие или слабая выраженность ультразвуковых окон. По данным разных авторов частота отсутствия ультразвуковых окон колеблется от 1 до 19% возрастая в старших возрастных группах [52, 68].

Рис. 73. а. Транскраниальная цветная допплеровская эхограмма средней мозговой артерии (СМА) в режиме ЭДК, стеноз > 70% (показан стрелками), б. Та же артерия в триплексном режиме Сниженный и турбулентный кровоток перед стенозом (111), усиление ПСК до 250 см/с в месте стеноза (II) и нормализация ЛСК после (I)
Другим ограничением метода является отсутствие стабильности в получении изображения сосудов, по данным P. Martin et al. [70] частота визуализации отдельных интракраниальных артерий колеблется от 55 до 100%, в то время как частота локации этих же артерий методом ТКД значительно выше: от 83 до 100% [38, 39].

Рис. 75. Транскраниальное дуплексное сканирование артерий основания мозга в режиме ЭДК а. Мешотчатая аневризма (показана стрелками AN- EVR) на участке М, средней мозговой артерии
В таблице 16 представлены основные показатели кровотока (параметры ЛCK, индекс пульсации) по артериям основания мозга у здоровых людей в зависимости от возраста, полученные методом транскраниального ЦДС.
Сравнение показателей ЛСК в таблице 16., полученных P. Martin et al. [70] при ТК ЦДС и данных, полученных W. Rautenberg [39] при ТКД в норме в аналогичных возрастных группах практически не отличаются (различия статистически не достоверны), что по нашему мнению делает

б. Тоже изображение в триплексном режиме. Признаки турбулентного кровотока в самой аневризме.
предположение отдельных авторов [70] о преимуществах транскраниального цветового дуплексного сканирования перед методом ТКД за счет точности коррекции угла сомнительным.
Атеросклероз является основным заболеванием, поражающим интракраниальные артерии, однако увидеть атеросклеротические бляшки в В-режиме, как при исследовании сосудов шеи, невозможно - не позволяет сам технический принцип. При транскраниальной локации на экране прибора получают не истинное изображение сосуда, а некий виртуальный образ, сформированный из сигналов потоков крови по этим артериям супермощным компьютером прибора. Поэтому диагностика поражений интракраниальных артерий строится на анализе цветовых картограмм и оценке спектральных характеристик потоков, в сочетании с признаками, указывающими на их поражение, выявляемыми, предварительно при УЗДГ экстракраниальных артерий (подробно раздел 2.2).

Рис. 76. Транскраниальная цветовая допплерограмма спазмированных передней и средней мозговых артерий (показано стрелками) в триплексном режиме. Усиление ЛСК до 180 см/с.
Для окклюзий каждой из интракраниальных артерий существует как бы единый алгоритм: наличие зоны обрыва цветовой картограммы проксимальнее окклюзии, отсутствие кровотока дистальнее места окклюзии, в сочетании с усилением ЛСК по гомолатеральным интракраниальным артериям (рис. 72).
Для стеноза более 60% (стенозы <60%, чаще всего не выявляют) каждой из интракраниальных артерий, может быть, характерно наличие дефекта заполнения цветовой картограммы в проекции предполагаемого поражения в сочетании с локальными изменениями цветовых характеристик картограммы потока крови в зоне стеноза (рис. 73). При этом может быть локальное повышение ЛСК в месте стеноза, что будет надёжным признаком его наличия. При окклюзии или стенозе интракраниальной артерии возможно формирование разных вариантов перетока по соединительным артериям артериального круга большого мозга, усиление и/или снижение ЛСК по гомо- или контралатеральным интракраниальным и экстракраниальным артериям [71]. При этом перебор всех возможных вариантов потребует от врача специальной подготовки по ультразвуковой диагностике. В.Г. Лелюк и С.Э. Лелюк [52] при диагностике атеросклеротических поражений интракраниальных артерий методом ТК ЦДС в сравнении с ангиографией установили, что его чувствительность и специфичность составляет для стенозов (50-70%): 85% и 87% соответственно, стенозов (70-99%): 95% и 90%, а для окклюзии по 95%.

Рис. 77. а. Цветовая допплеровская картограмма кровотока по артериям ЭИКМА получена через трепана- ционное окно в черепе (режим ЦДК). Соединены фронтальная ветвь поверхностной височной артерии с ветвью СМА, стрелкой показана область анастомоза.
б. Тоже исследование в триплексном режиме. Выявлен высокий кровоток в мозг (85см/с) по ЭИКМА.
Методом транскраниального ЦДС может быть выявлено наличие артериовенозных мальформаций (рис. 74), реже артериальных аневризм (рис 75), сосудистых опухолей и установлено наличие вазоспазма в интракраниальных артериях у больных с мигренью (рис. 76) или после субарахноидального кровоизлияния, проведена прямая оценка функционирования экстра-интракраниального анастомоза, путём локации его через послеоперационный костный дефект черепа (рис. 77). Однако большой энтузиазм, возникший у исследователей после появления метода, уменьшился, так как диагностические надежды, возлагавшиеся на него, во многом не оправдалась, хотя методика транскраниального цветового дуплексного сканирования и заняла своё, подобающее ей место в арсенале методов ультразвуковой диагностики сосудистых заболеваний нервной системы.
6. Ультразвуковая диагностика основных цереброваскулярных заболеваний и расслоений
МАГ
6.1. Ультразвуковая диагностика атеросклероза магистральных артерий головы
Атеросклероз - это хроническое заболевание, возникающее в результате нарушения жирового и белкового обмена, характеризующееся поражением артерий эластического и мышечно-эластического типа в виде очагового отложения в интиме липидов и белков и реактивного разрастания соединительной ткани. В связи с образующимися утолщениями уплотняются стенки артерий, суживается их просвет, и нередко образуются тромбы, что в свою очередь приводит к органным и/или общим расстройствам кровообращения.

Рис. 78. Эхограмма ОСА в В-режиме. Измерение уплотненного и расслоенного интима-медиального комплекса ОСА (показано стрелками) с утолщением до 1,5 мм (маркеры).
Обычно атеросклеротические изменения локализуются в устьях артерий, местах их разветвлений и перегибов, чаще всего атеросклеротические поражения возникают в области бифуркации ОСА с переходом на устья ВСА и НСА. В большинстве случаев поражения имеют сегментарный характер, а дистальные отделы артерий остаются проходимыми. Развитие атеросклероза на первых этапах может протекать бессимптомно и начинается с поражения внутренней оболочки артерии (интимы). Первые морфологические проявления атеросклероза тесно связаны с нарушением проницаемости эндотелия интимы артерии и изменением толщины интима-медиального слоя. Комплекс интима-медиа (КИМ) однородной эхоструктуры и эхогенности состоит из двух чётко дифференцированных слоёв - эхопозитивной интимы и эхонегативной медии, поверхность его ровная. В ОСА измерение толщины КИМ производят по задней стенке сосуда на 1,5 см ниже бифуркации, в ВСА и НСА - на 1 см дистальнее области бифуркации. Стандартно принято измерять КИМ только в ОСА (рис. 78), оценку же его во внутренней и наружной сонных артериях проводят лишь при динамическом наблюдении за больным. Среднее значение толщины КИМ общих сонных артерий в различных возрастных группах представлены в таблице 17, составленной В.Г. Лелюк и С.Э. Лелюк [52] по результатам обследования 751 человека.
|
|
Мужчины |
Женщины |
Всего | |||
|
Возраст |
справа |
слева |
справа |
слева |
справа |
слева |
|
<30 |
0,5-0,8 |
0,5-0,8 |
0,5-0,7 |
0,5-0,8 |
0,5-0,8 |
0,5-0,8 |
|
|
0,61 ± 0,06 |
0,63 ± 0,07 |
0,63 ± 0,06 |
0,6 ± 0,07 |
0,6 ± 0,06 |
0,6 ± 0,07 |
|
31-40 |
0,5-1,3 |
0,6-1,0 |
0,4-1,0 |
0,6-1,5 |
0,4-1,3 |
0,6-1,5 |
|
|
0,67 ±0,13 |
0,66 ± 0,09 |
0,63 ± 0,08 |
0,69 ±0,17 |
0,64 ± 0,11 |
0,68 ±0,15 |
|
41-50 |
0,5-1,6 |
0,6-1,7 |
0,5-1,3 |
0,6-1,5 |
0,5-1,6 |
0,6-1,7 |
|
|
0,97 ± 0,24 |
1,03 ±0,26 |
0,72 + 0,17 |
0,72 ±0,17 |
0,82 ± 0,23 |
0,82 ± 0,23 |
|
51-60 |
0,6-1,7 |
0,7-2,0 |
0,5-1,4 |
0,6-1,5 |
0,5-1,7 |
0,6-2,0 |
|
|
1,06 ±0,18 |
1,14 ± 0,21 |
0,92 ±0,2 |
0,96 ±0,21 |
0,99 ± 0,21 |
1,04 ±0,23 |
|
> 60 |
0,7-2,1 |
0,8-2,5 |
0,6-1,5 |
0,6-1,6 |
0,6-2,1 |
0,6-2,5 |
|
|
1,09 ±0,18 |
1,18 ±0,22 |
1,0 ±0,2 |
1,1 ±0,21 |
1,07 ±0,19 |
1,13 ±0,23 |
|
Всего |
0,5-2,1 |
0,5-2,5 |
0,4-1,5 |
0,5-1,6 |
0,4-2,1 |
0,5-2,5 |
|
|
0,99 ± 0,25 |
1,0 ±0,28 |
0,86 ± 0,24 |
0,9 ± 0,25 |
0,91 ± 0,24 |
0,97 ± 0,27 |
Сегодня общепризнано, что получение изображения сосудов при ЦДС в В-режиме является достоверным методом диагностики ранних форм атеросклеротических изменений сонных артерий. В литературе установлена достоверная связь между факторами риска развития атеросклероза и величиной комплекса интима-медиа сонных артерий. Определена выраженная статистическая взаимосвязь между величиной комплекса интима-медиа и такими факторами риска, как гиперхолестеринемия, артериальная гипертензия, курение,
диабет и пол (мужчины) [50, 72-75]. Установлено некоторое уменьшение толщины комплекса интима-медиа после устранения факторов риска и длительной медикаментозной терапии, что должно вселять определённые надежды на успехи в лечении атеросклероза [75-77]
Выделено две основные формы атеросклеротического поражения артерий - нестенозирующая и стенозирующая. Нестенозирующим атеросклеротическим называют поражение, при котором происходит изолированное утолщение комплекса интима-медиа, сопровождающееся изменением его структуры (уплотнение, разрыхление, неровность поверхности и др.), а величина уменьшения просвета артерии не превышает 20% по диаметру и изменения комплекса носят диффузный характер.
Пограничной считают толщину комплекса интима-медиа в пределах 1,0- 1,2 мм наличие локальных изменений в нём позволяет говорить об атеросклеротических бляшках, которые являются объективным проявлением атеросклеротического процесса, вызывая стенозирование артерий.
При анализе бляшки особое внимание уделяют состоянию её поверхности, неровностям изъязвлениям контура и состоянию покрышки.
Детальный анализ бляшек мы провели у 141 больного (средний возраст 60,2 ± 8,9 лет) с нарушением мозгового кровообращения ишемического характера, подтверждённым наличием инфаркта мозга. При ЦДС магистральных артерий головы на шее у всех больных выявлено сочетанное поражение двух сонных артерий у 83 больных, обеих сонных и позвоночных у 50 и всех 4 артерий - у 8 пациентов Выявленные при этом атеросклеротические бляшки, по структуре составили: гомогенные плотные - 8% гомогенные мягкие - 5%, гетерогенные с преобладанием гиподенсивных зон 44%, гетерогенные с преобладанием плотного компонента - 43%. Распространение их по частоте встречаемости в зависимости от формы клинических проявлений НМК приведено в таблице и структуре 18.
Таблица 18. НМК и структура атеросклеротической бляшки.
|
Гомогенные бляшки |
|
Гетерогенные бляшки | ||
|
Вид НМК |
плотные |
мягкие |
с гиподенсивным компонентом |
с плотным компонентом |
|
Преходящее |
1 |
- |
7 |
9 |
|
Острое |
14 |
7 |
73 |
49 |
|
Повторное |
6 |
5 |
35 |
18 |
|
Хроническое |
5 |
2 |
12 |
40 |
Из таблицы 18, ясно, что у больных с хронической недостаточностью мозгового кровообращения в 76% случаев выявляли гомогенные плотные или гетерогенные бляшки с преобладанием плотного компонента (менее эмбологенные). В группах больных с острым НМК и при повторных НМК в сонных артериях в 1.6 раза чаще выявляли гетерогенные бляшки с преобладанием гиподенсивного компонента (более эмбологенные) Установлена прямая корреляционная зависимость между структурой бляшки и степенью стенозирующего поражения каждой из сонных артерий при стенозах от 20 до 50% - гомогенные бляшки выявлены в 62% случаев, гетерогенные - 38%; при стенозах более 50% гомогенные бляшки отмечены в 8% случаев, а гетерогенные - в 92%. Таким образом, цветовое дуплексное сканирование позволяет не только установить наличие атеросклероза МАГ, но и достоверно определять структуру стенозирующего образования, протяжённость, степень выраженности и возможность прогнозировать повторные нарушения мозгового кровообращения.
6.2. Ультразвук при артериальной гипертонии
При регистрации у больного повышенного артериального давления ультразвуковые исследования могут оказать определяющую роль по выявлению причин такого повышения и предупреждению развития возможных грозных осложнений. Известно, что артериальная гипертония является вторым по значимости после атеросклероза фактором развития нарушений мозгового кровообращения различного характера.
Геморрагические НМК при артериальной гипертензии проявляются интра-церебральными и субарахноидальными кровоизлияниями и в виде острой гипертонической энцефалопатии. Кроме того, гипертензия может служить причиной развития смешанных инфарктов мозга, острых НМК ишемического характера, к которым относят лакунарное состояние мозга, развитие хронических ишемических НМК при артериальной гипертензии может приводить к развитию сосудистой деменции подкоркового типа (болезнь Бинсвангера), сосудистому паркинсонизму и др. [1, 78].
В сосудах основания мозга при артериальной гипертензии отмечают увеличение диаметра просвета и резкое расширение, истончение и ригидность стенок, удлинение и извитость артерий. Интракраниальные участки сонных и позвоночных артерий, основная, реже передние, средние и задние мозговые артерии не спадаются, просвет их зияет.
При гипертонической ангиопатии выраженные изменения наблюдают в экстракраниальных отделах МАГ и носят они преимущественно адаптивный характер. В экстракраниальных отделах ВСА и ПА обнаруживают изменения, которые в литературе обозначают как очаговая мышечная или циркуляторная мышечно-эластическая гиперплазия интимы. При стойкой и длительной гипертензии в этих участках развивается фиброз, который сочетается с изменениями внутренней эластической мембраны и средний оболочки, что ведёт к снижению эластичности стенки и расширению просвета сосуда. Все эти процессы при артериальной гипертензии приводят к удлинению и развитию извитостей и перегибов магистральных артерий головы, формированию септальных стенозов, что и определяют при ЦДС [1].
Методом ЦДС и ТК ЦДС В.Г. Лелюк и С.Э. Лелюк [52] детально исследовали гемодинамику по сосудам дуги аорты и основания мозга у 60 больных (средний возраст 58 ± 12,4 года). Показатели кровотока в норме и больных с артериальной гипертонией представлены в таблице 19. У всех больных отмечали утолщение комплекса интима-медиа до 1,24 ± 0,22 мм, у 20% пациентов выявили атеросклеротические бляшки, деформации сонных и позвоночных артерий в виде угловых и петлеобразных изгибов и извитостей выявлены у 35% пациентов. При этом деформация одной артерии отмечена у 5 больных, двух - у 16, трёх - у 18, четыре - у 12.
Количественная оценка параметров кровотока по сонным и позвоночным артериям при ЦДС показала тенденции к снижению средней и объёмной скоростей кровотока у больных с артериальной гипертензией (таблица 18 ). Также отмечено снижение пульсации стенки ОСА.
Таблица 19. Параметры кровотока в общей сонной и позвоночной артериях при артериальной гипертонии и в норме [79].
|
Параметры |
Общая сонная артерия |
Позвоночная артерия | ||
|
норма |
гипертензия |
норма |
гипертензия | |
|
Диаметр, мм |
5,9 + 0,93 |
6,3 ±0,8 |
3,3 ±0,5 |
3,2 ± 0,5 |
|
TAV, см / с |
28,6 ± 6,8 |
22,4 ± 6,9 |
12,1 ±3,6 |
11,4 + 6,9 |
|
PI |
2,04 ± 0,56 |
1,8 ±0,5 |
1,5 ±0,49 |
1,43 + 0,43 |
|
Vvol, мл / мин |
484,7 ± 94 |
408 ±116 |
93 ± 33,3 |
86 ±69 |
При исследовании внутренних яремных вен было отмечено относительное увеличение их диаметров, снижение кровотока по ним, повышение максимальной скорости и псевдопульсации в венах Розенталя [79] При этом клиническая картина определяется степенью выраженности артериального и венозного компонентов гипертонического поражения сосудов, что необходимо учитывать при выработке тактики лечения.
6.3. Ультразвуковая диагностика расслоения (диссекция) стенок МАГ и нарушения мозгового кровообращения
Расслоение стенки артерий дуги аорты и их ветвей, сопровождающееся развитием интрамуральной гематомы, является чрезвычайно опасным, малоизвестным и плохо распознаваемым поражением сосудов и может служить причиной острых НМК ишемического характера возникающих чаще всего, у лиц молодого возраста, что нашло отражение в литературе последних десятилетий [80-84]
Принято различать два основных вида расслаивающих гематом артериальной стенки травматические и спонтанные, хотя по нашему мнению такое деление весьма условно и целесообразней говорить о какой-то генетической несостоятельности сосудистой стенки, выявляющей себя в виде диссекций на фоне мгновенного изменения геометрии потока крови в МАГ, связанного с микро- или макротравмами головы и сосудов. Факторами риска расслоения артериальной стенки могут быть атеросклеротические бляшки, перегибы и извитости, фиброзномышечная дисплазия синдром Марфана, кистозный некроз, артерииты. Наличие в анамнезе мигрени, курения и употребления оральных контрацептивов может повысить риск заболевания [85].
Расслоение артерии на шее обычно сопровождается попаданием крови под интиму, что ведёт к формированию интрамуральной гематомы различной длины Кровоизлияние может прорвать интиму с формированием ложного просвета с признаками кровотока, который отделён от истинного просвета диссекционной мембраной (рис. 79). В случае субадвентициального расслоения происходит аневризматическое расширение сосуда, в результате инкапсуляции паравазальной гематомы формируется псевдоаневризма.
В клинической картине возникновения острого НМК при диссекции сонных артерий у 2/3 больных развивается ишемический инфаркт, а у трети - возникают ПНМК [60, 86, 87]. По нашему мнению, расслойка артерии может протекать почти бессистемно, оказаться нераспознанной и быть случайно обнаружена при УЗ исследовании. При сборе анамнеза обращают внимание на наличие травмы шеи и головы, которая может непосредственно предшествовать инсульту или быть отставленной на срок от одного дня до месяца. Часто НМК могут предшествовать жалобы на боль в лице, вокруг глаза, по задней поверхности шеи или головную боль в затылочной области, обычно на стороне расслоения повреждённой артерии. Развитию клинической картины может предшествовать возникновение шума на шее, синдрома Горнера, одностороннее поражение подъязычного или глазодвигательного нервов. Эти проявления расслоения часто появляются за несколько часов или дней до возникновения ишемии мозга или наступают одновременно с ней.
Классическим методом диагностики расслоений МАГ до последнего времени считалось церебральная ангиография, однако сегодня, наряду с ЦДС в практику входит MP-ангиография, что позволяет обнаружить поражение в области цервикокраниального перехода [62, 85, 88]. Методы ультразвуковой диагностики сегодня являются наиболее доступными и недорогими для выявления диссекций артерий.

Рис. 79. Схематическое изображение расслоения ВСА в устье, на котором показан интракраниальный тромбоз, надрыв интимы, осложненный неоклюзирующим тромбозом, эмболия с дистальной окклюзией СМА (из Warlow С. et al., 1998).
Какие допплерографические признаки диссекции МАГ? При УЗДГ это изменение гемодинамики по сонным и/или позвоночным артериям на стороне поражения с признаками характерными для стеноза или окклюзии сосуда. При цветовой допплеровской сонографии уже можно наблюдать характерные признаки расслоения: неравномерное стенозирование, утолщение стенки артерии с гипоэхогенной интрамуральной гематомой и неравномерное, распространение сужение просвета, заканчивающееся дистально локализованной окклюзией, так называемая конусовидная закупорка, получившая в ангиографии название «симптома струны». Просвет может содержать гипоэхогенные структуры или другие включения различной эхогенности; иногда возможно получить при ЦДС изображение диссекционной мембраны, которая делит про свет на истинный и ложный. При исследовании кровотока выявляют локальное или общее изменение допплеровского спектра частот, характерное для стеноза или окклюзии. ЦДС позволяет в динамике определять длительность антикоагулянтной терапии, так как реканализация при диссекции может наступить только через несколько недель или месяцев [89].
Итак, завершая главу о диагностических возможностях ультразвука при исследовании сосудов шеи и головы, ещё раз подчеркнем и повторим простую и общеизвестную истину, что врач ультразвуковой диагностики, овладев современными методиками УЗИ, не должен останавливаться в развитии и думать, что всё знает, а продолжать каждый день совершенствовать свои навыки и приёмы, впитывая всё новое, что появляется в ультразвуковых исследованиях сосудистой системы, творчески подходить к исследованию каждого больного.
ГЛАВА 4
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА ЦЕРЕБРОВАСКУЛЯРНЫХ НАРУШЕНИЙ У НОВОРОЖДЕННЫХ ДЕТЕЙ
Церебральные повреждения у новорожденных детей нередко бывают не только причиной развития критических состояний в раннем неонатальном периоде и формированием различных синдромов перинатальной энцефалопатии (ПЭП), но и нередко определяют жизненный прогноз. В детской неврологии традиционно считалось, что поражения головного мозга сосудистого генеза крайне редки. Однако в последние годы внедрение в клиническую практику ультразвуковых методов исследования показало, что истоки сосудистой патологии взрослых нередко лежат в детстве, а многие из них в перинатальном периоде. По современным данным, до 70-80% заболеваний нервной системы, приводящих к инвалидизации и дезадаптации детей, обусловлены перинатальными факторами [1-4].
Ранняя нозологическая диагностика поражений головного мозга у новорожденных детей затруднена в связи со сходством клинических неврологических проявлений при различных патологических состояниях, что связано с анатомической и функциональной незрелостью нервной системы и неспецифической ответной реакцией мозга на разнообразные внутриутробные патологические процессы. Среди церебральных поражений, являющихся причиной развития перинатальной энцефалопатии у детей первого года жизни, на сегодняшний день выделяют гипоксически-ишемические нарушения, внутричерепные кровоизлияния и токсико-инфекционные поражения. Ишемия мозга и внутричерепные кровоизлияния могут сочетаться, а инфекционные поражения могут сопровождаться как кровоизлияниями, так и ишемией,
Нейросонография (НСГ) - раздел ультразвуковой диагностики, занимающийся исследованием головного мозга у новорожденных детей, в настоящее время является неотъемлемой частью традиционного обследования в неонатологии и перинатальной неврологии без которого не обходится ни один осмотр детского невролога и/или неонатолога Методика безвредна может применяться многократно, позволяет оценить структуры головного мозга состояние ликворных путей и выявить различные патологические изменения (кровоизлияния и ишемические поражения, врожденные аномалии развития, изменения головного мозга при инфекции) НСГ позволяет определять морфологический субстрат неврологических нарушений, возникающих в перинатальном периоде и в корне изменила мнение неврологов о частоте сосудистой патологии мозга у новорожденных детей [5-9] Нередко при нормальной ультразвуковой картине головного мозга имеет место выраженная неврологическая симптоматика, в основе которой лежат нарушения мозгового кровообращения. Отмечено, что 40-60% детей имеют неврологические расстройства сосудистого генеза
Использование эффекта Допплера позволило проводить неинвазивное исследование кровотока в сосудах головного мозга, так как его нарушения являются основной причиной перинатальных геморрагически-ишемических поражений мозга.
Нейросонографию у новорожденных проводят в родильном доме, в отделениях патологии новорожденных и выхаживания недоношенных детей, при этом используются портативные приборы. Сканирование мозга у детей, которые находятся в тяжелом состоянии (в палате интенсивной терапии или реанимации), проводят в кувезах. Тяжесть состояния не является противопоказанием для проведения НСГ, Специальной медикаментозной подготовки и анестезии не требуется. Если в распоряжении врача имеется только стационарный сканер в детской поликлинике, осмотр проходит в назначенное время в кабинете ультразвуковых методов исследования, в родильном доме только после специальной санитарной обработки помещения и прибора (согласно санэпидрежиму). Скрининговое ультразвуковое исследование необходимо провести каждому ребенку при выписке из родильного дома, далее его повторяют в 1 месяц жизни, когда ребенка впервые приносят в детскую поликлинику на прием к педиатру, детскому неврологу. Следующую НСГ выполняют по показаниям в зависимости от клинической симптоматики или для оценки динамики лечения (табл.20).
Для проведения НСГ у новорожденных и детей раннего возраста используют ультразвуковые аппараты, работающие в режиме реального времени, датчики с частотой сканирования от 3 5 до 14 МГц. Для новорожденных и детей до трех месяцев жизни оптимальным является датчик 7,5 МГц, в возрасте от 3-х месяцев и старше - 3 5-5 МГц, после 9 месяцев, когда большой родничок прикрыт мембранозной структурой и/или полностью закрыт - 2-3,5 МГц. При использовании линейных датчиков 7,5-10 МГц возможна детальная оценка передних отделов субарахноидального пространства.
Таблица 20. Абсолютные показания к проведению нейросонографии.
|
Возраст | |
|
новорожденные |
1 месяц жизни |
|
- гестационный возраст менее 36 недель |
- гестационный возраст менее 36 недель; |
|
- масса тела при рождении менее 2800 г; |
- вес при рождении менее 2800 г |
|
- оценка по шкале Апгар на 5 минуте |
- наличие клинических признаков |
|
менее 7 баллов, |
поражения нервной системы; |
|
- клинические признаки поражения ЦНС |
- множественные стигмы |
|
- множественные стигмы дисэмбрио- |
дисэмбриогенеза; |
|
генеза; |
- указание в анамнезе на хроническую |
|
- синдром дыхательных расстройств. |
внутриутробную гипоксию и/или |
|
- инфекционные заболевания у матери |
асфиксию в родах |
|
и ребенка |
|
|
- ухудшение состояния перевод |
|
|
в отделение реанимации. |
|
Триплексный режим сканирования в реальном времени является оптимальным, поскольку позволяет исследователю вне зависимости от эмоционального состояния ребенка получить за короткий временной отрезок необходимую информацию на экране монитора ультразвукового прибора.
Эталоном гиперэхогенности в нормальной ультразвуковой анатомии головного мозга являются кости черепа, сосудистые сплетения боковых желудочков, анэхогенности - ликворосодержащие структуры (желудочки мозга, цистерны).
1. Методика нейросонографии
Стандартную НСГ проводят через большой (передний) родничок, на котором располагают ультразвуковой датчик для получения изображений во фронтальной (коронарной), сагиттальной и парасагиттальных плоскостях. При расположении датчика строго по коронарному шву получают сечения во фронтальной плоскости, далее, поворачивая датчик на 90°, выводят сечения в сагиттальной и парасагиттальных плоскостях. Путем изменения наклона датчика вперед - назад, вправо - влево, последовательно получают ряд сечений для оценки структур правого и левого полушарий. Аксиальную плоскость (исследование через височную кость) используют в редких случаях, когда необходима более детальная оценка дополнительных патологических образований, в частности опухолей, ее нередко применяют как вариант транскраниального сканирования у детей после закрытия родничка (после 9-12 месяцев (рис. 80). Дополнительные роднички (задний, боковые) используют в единичных случаях, поскольку у здорового доношенного ребенка они в норме уже закрыты. Оценка структур задней черепной ямки через большое затылочное отверстие может быть затруднена из-за тяжести состояния новорожденного ребенка.
При НСГ проводят качественную оценку состояния ликворосодержащих образований (желудочковой системы мозга, цистерн, субарахноидального пространства, полости прозрачной перегородки и полости Верга); перивентрикулярных структур; крупных церебральных сосудов и хориоидальных сплетений; зрительных бугров и базальных ядер; стволовых структур и образований задней черепной ямки (мозжечка), костей черепа.
Для получения их изображения используют серию ультразвуковых сечений во фронтальной (Ф) и сагиттально-парасагиттальной (С) плоскостях.

Рис. 80. Плоскости сканирования и схемы сечений в них:
А-Е коронарная плоскость Ж сагиттальная плоскость 3-K парасагиттальная плоскость Л-Н аксиальная плоскость
а - через лобные доли: б - через передние рога боковых желудочков; в - через межжелудочковое отверстие (Монро) и третий желудочек; г - через тела боковых желудочков; д - через треугольник бокового желудочка; е - через затылочные доли мозга; ж - срединное сагиттальное сечение; з - парасагиттальное сечение через каудоталамическую вырезку; и - парасагиттальное сечение через боковой желудочек; к - парасагиттальное сечение через Рейелев островок; л - на уровне ножек мозга; м - в проекции третьего желудочка и зрительных бугров; н - на уровне тел боковых желудочков.
Ф-1. Сечение через лобные доли. В нем костные образования представлены яркими гиперэхогенными структурами лобной, решетчатой и костями, образующими орбиты. Отчетливо видны межполушарная щель и серповидный отросток в виде гиперэхогенной, срединной структуры, разделяющей мозг на правое и левое полушария. Латеральнее щели, с двух сторон определяют области умеренно повышенной эхогенности - полуовальные центры.
Ф-2. Сечение через передние рога боковых желудочков. По обе стороны от межполушарной щели выявляют тонкие анэхогенные структуры передних рогов боковых желудочков, разделенные прозрачной перегородкой. Серп мозга расположен срединно над мозолистым телом, которое визуализируют в виде гипоэхогенной горизонтальной линии, отграниченной крышей боковых желудочков и прозрачной перегородкой. Над мозолистым телом отмечают пульсацию передних мозговых артерий. Хвостатые ядра имеют несколько повышенную эхогенность и локализуются симметрично под нижними стенками боковых желудочков. Гиперэхогенные костные структуры представлены теменными костями и крыльями клиновидной кости.
Ф-3. Сечение на уровне межжелудочковых отверстий (отверстий Монро) и III желудочка. В этом сечении передние рога боковых желудочков выявляют в виде симметрично расположенных узких анэхогенных структур. При движении датчика вперед и назад визуализируют линеиные анэхогенные межжелудочковые отверстия, связывающие боковые и III желудочек, последний определяется как тонкая вертикально расположенная, анэхогенная полоска между зрительными буграми. Слева и справа под нижней стенкой передних оогов боковых желудочков выявляют эхокомплекс хвостатого ядра (nucleus са- udatus), ниже - покрышку (putamen) и бледный шар (globus palidum). Латеральные борозды визуализируют в виде симметрично расположенных латеральных структур Y-образной формы, в которых при исследовании в режиме реального времени видна пульсация средних мозговых артерий. Над мозолистым телом, перпендикулярно к межполушарной щели, определяют эхопозитивные линейные структуры поясной борозды. В паренхиме правого и левого полушарий мозга отчетливо видны гиперэхогенные изогнутые извилины гиппокампа. Между ними пульсируют сосуды артериального круга большого мозга (виллизиева круга) Костные структуры представлены гиперэхогенными теменными и височными костями.
Ф-4. Сечение через тела боковых желудочков. В этом сечении визуализируют анэхогенные тела боковых желудочков, расположенные по обе стороны от межполушарной щели Мозолистое тело представлено гипоэхогенной структурой по средней линии, над которой определяют пульсацию передних мозговых артерий. На дне боковых желудочков располагаются гиперэхогенные сосудистые сплетения, вертикально визуализируют ствол мозга и IV желудочек. Между извилинами гиппокампа и наметом мозжечка расположены нижние (височные) рога боковых желудочков, просвет которых в норме не виден. Рядом со зрительными буграми определяют хвостатые и базальные ядра (покрышка, бледный шар). Латеральные борозды визуализируют как симметричные Y-образные структуры в средней черепной ямке. В задней черепной ямке выявляют намет и червь мозжечка повышенной эхогенности, гемисферы мозжечка менее эхогенны; большая цистерна мозга, расположенная под мозжечком - анэхогенна.
Ф-5. Сечение через треугольник боковых желудочков. На эхограмме полость боковых желудочков частично или полностью заполнена гиперэхогенными, симметричными сосудистыми (хориоидными) сплетениями, которые в норме однородны, имеют четкий, ровный контур. Вокруг сосудистых сплетений видна небольшая анэхогенная полоска ликвора в боковых желудочках. Допустимая асимметрия сплетений составляет 3-5 мм. Межполушарная щель расположена срединно в виде гиперэхогенной линейной формы структуры. В задней черепной ямке определяют червь и намет мозжечка.
Ф-6. Сечение через затылочные доли. Четко визуализируют гиперэхогенные теменные и затылочные кости. Срединно расположенная тонкая линейная структура представляет межполушарную щель и серповидный отросток твердой мозговой оболочки. В паренхиме затылочных долей мозга виден рисунок извилин и борозд.
Для получения срединносагиттального сечения (С-1) необходимо датчик расположить строго в сагиттальной плоскости. Сечения в парасагиттальной плоскости (С 2-4) получают, последовательно проводя наклон на 10-15° (сечение через каудо-таламическую вырезку), 15-20° (сечение через боковой желудочек) и 20-30° (сечение через «островок») от сагиттальной плоскости сканирования в правом и левом полушариях головного мозга.
С-1. Срединное сагиттальное сечение. Гиперэхогенные костные структуры представлены решетчатой и клиновидной костями, задняя черепная ямка отграничена затылочной костью. Мозолистое тело визуализируется в виде дугообразной структуры пониженной эхогенности и состоит из колена, ствола и валика. В верхнем крае его, по ходу борозды мозолистого тела, определяют пульсацию ветви передней мозговой артерии - перекаллезной артерии. Над мозолистым телом расположена поясная извилина, под ним - анэхогенные полости прозрачной перегородки и Верге, которые могут быть разделены тонкой гиперэхогенной полоской. В большинстве случаев эти анатомические структуры четко видны у недоношенных детей. Ill желудочек - анэхогенный, треугольной формы, обращен верхушкой к гипофизарной ямке. Его форма обусловлена наличием инфундибулярного и супраоптического отростков. Видны основные цистерны мозга: межножковая, четверохолмия, церебромедуллярная. С межножковой цистерной граничит задняя стенка гипоталамического кармана. Высокий уровень эхогенности этой цистерны обусловлен множеством ветвей базилярной артерии и септ сосудистой оболочки мозга. Кзади от межножковой цистерны расположены ножки мозга пониженной эхогенности, в толще которых находится водопровод, последний в норме практически не виден. Ниже и кпереди определяют область моста, представленную зоной повышенной эхогенности. Анэхогенный, треугольной формы IV желудочек находится под мостом, его вершина вдается в гиперэхогенный червь мозжечка. Между нижней поверхностью червя мозжечка, задней поверхностью продолговатого мозга и внутренней поверхностью затылочной кости располагается анэхогенная большая цистерна (cisterna magna). В паренхиме мозга визуализируют поясную, шпорную и затылочно-височную борозды высокой эхогенности. Четко видна пульсация передней, средней, задней и базилярной артерий.
С-2. Сечение через каудо-таламическуто вырезку. На эхограмме видна каудо-тапамическая вырезка, отделяющая головку хвостатого ядра от зрительного бугра.
С-3. Сечение через боковой желудочек мозга. При исследовании визуализируют анэхогенные отделы бокового желудочка передний, задний, нижний рога, тело и треугольник, окружающие зрительный бугор и базальные ядра. В полости бокового желудочка расположено однородное гиперэхогенное сосудистое сплетение, имеющее ровный, овальный контур. В переднем роге сосудистое сплетение отсутствует. В заднем роге нередко отмечают его утолщение («glomus») Вокруг желудочка, в перивентрикулярной области отмечают умеренное повышение эхогенности с обеих сторон
С-4. Сечение через «островок». Срез проходит через анатомическую область «островка», в паренхиме которого видны гиперэхогенные структуры латеральной и мелких борозд.
Особенностью мозга недоношенных детей является визуализация полости прозрачной перегородки и полости Верге. Также у новорожденных, рожденных на 26-28 неделе гестации, визуализируется широкое субарахноидальное пространство. У недоношенных - 26-30 недель гестации - латеральная (Сильвиева) борозда представлена комплексом повышенной эхогенности, напоминающим форму треугольника или «флага» за счет недостаточно сформированных структур мозга, разделяющих лобную и височную доли. У недоношенных до 34-36 недель гестационного возраста в перивентрикулярной области определяют симметричные зоны повышенной эхогенности (перивентрикулярный ореол) что связано с особенностями кровоснабжения данной зоны [10, 11] Из-за различных темпов созревания мозга и желудочковой системы относительные размеры боковых желудочков у недоношенного ребенка. как и у плода, значительно больших размеров, чем у зрелого доношенного новорожденного.
У детей после первого месяца жизни эхографическая характеристика нормальных анатомических структур мозга зависит, прежде всего, от гестационного возраста при его рождении. У детей старше 3-6 месяцев в коронарной плоскости нередко видна «расщепленная» межполушарная щель. Величина большой цистерны после 1 месяца жизни не должна превышать 3-5 мм. Если размеры цистерны с рождения остаются более 5 мм или увеличиваются, необходимо провести МРТ для исключения патологии задней черепной ямки и, прежде всего, гипоплазии мозжечка.
При измерении желудочков мозга (вентрикулометрии) наиболее стабильными являются размеры переднего рога (глубина 1-2 мм) и тела (глубина не более 4 мм) бокового желудочка Передние рога измеряют в коронарной плоскости в сечениях через передние рога, межжелудочковые отверстия, измерение тела проводят в срезе через тела боковых желудочков. Ill желудочек измеряют в коронарной плоскости в срезе через межжелудочковое отверстие и составляет 2-4 (2,0 ± 0,45) мм. Оценка размеров IV желудочка затруднена, обращают внимание на его форму, структуру и эхогенность, которые могут значительно изменяться при аномалиях развития головного мозга
.
2. Технология допплеровского исследования головного мозга у детей
В настоящее время в неонатологии применяют дуплексные допплеровские системы, которые позволяют в ультразвуковом срезе головного мозга визуализировать сосуд, установить в его просвете контрольный объем и получить допплерограмму, отражающую кровоток в данном сосуде. Ультразвуковые приборы с цветовым (энергетическим) допплеровским картированием (ЦДК) позволяют выбрать оптимальную позицию для размещения контрольного объема в крупных мозговых артериях для измерения скорости с минимальной погрешностью, а также получить изображение венозных сосудов мозга. Преимущество технологии цветового допплеровского картирования по энергии (ЭДК) - относительная независимость от угла инсонации, а также от скорости и направления потока. Существенное повышение информационных возможностей имеет метод трехмерной реконструкции, который дает возможность получить представление о пространственном расположении и форме сосудов. Для более качественной характеристики кровотока, особенно при низкоскоростных показателях, применяется метод B-flow [12-15].
В неонатологии наиболее употребим индекс резистентности, который определяет периферическое сосудистое сопротивление. Индекс достаточно информативен, поскольку не зависит от диаметра сосуда и величины угла инсонации. Для обеспечения стандартных условий проведения допплеровского исследования необходимо придерживаться следующих правил:
- Исследование проводить при условии сохранения покоя новорожденного, желательно в состоянии физиологического сна, через 1-1,5 часа после кормления, с сохранением оптимальной температуры тела и режимов вентиляции.
- Использовать фильтр низких частот (100 Гц).
- Размеры контрольного объема составляют 2-3 мм, что позволяет полностью перекрыть просвет сосуда и избежать наложения сигналов от близко расположенных сосудов.
- Исследование проводить при минимальных значениях угла инсонации
- Выбирать наиболее прямолинейные участки сосуда, дальше от бифуркаций для сохранения ламинарного потока крови.
Допплерографическое исследование кровотока проводят в наиболее крупных артериях головного мозга: внутренних сонных, передних, средних, задних и основной, которые определяются в виде пульсирующих эхопозитивных структур. Применение режима ЦДК и/или ЭДК значительно упрощают поиск и визуализацию артерий.
Передняя мозговая артерия. Самая удобная и простая позиция для её обнаружения - сагиттальный срез через большой родничок. Обычно правая и левая передние мозговые артерии расположены очень близко друг к другу, что не позволяет различить их как отдельные сосуды. Раздельно эти артерии можно увидеть, применяя режим ЭДК (рис 81) Для получения показателей кровотока контрольный объем устанавливают перед коленом мозолистого тела или в проксимальной части артерии перед её изгибом вокруг этой структуры, при этом угол между осью сосуда и ультразвуковым лучом минимальный.
Внутренняя сонная артерия (дистальный участок). Для регистрации кровотока используют вертикальную часть сосуда после его выхода из каротидного канала на уровне турецкого седла, так как далее, над уровнем переднего клиновидного отростка, она делится на переднюю и среднюю мозговые артерии.
Основная артерия. Исследуют в срединном сагиттальном срезе на передней поверхности моста или в коронарной плоскости в нескольких миллиметрах за местом обнаружения внутренней сонной артерии.
Средняя мозговая артерия. Основным ориентиром в поиске артерии служит латеральная борозда на границе лобной и височной долей. Наиболее удачный угол её инсонации достигается при аксиальном подходе.
Исследование всех вышеперечисленных артерий у новорожденного ребенка нередко затруднено из-за его беспокойства, плача и/или тяжелого реанимационного состояния ребенка. В качестве скрининга допустимо пользоваться данными, полученными только с передней мозговой артерии, поскольку в норме углонезависимые параметры незначительно отличаются в вышеперечисленных сосудах. У новорожденных в норме не выявляется асимметрия показателей кровотока в магистральных артериях правого и левого полушарий головного мозга.

Рис. 81. Транскраниальное цветовое дуплексное сканирование передней мозговой артерии.

Рис. 82. Трехмерная реконструкция в режиме ЦДК сосудов виллизиева круга.
Используя приборы с функцией ЭДК в коронарной плоскости, можно получить полную картину артериального круга большого мозга, включая средние, задние соединительные, задние артерии и проксимальные части обеих передних мозговых артерий (рис 82). При проведении допплерографического обследования необходимо помнить, что в строении сосудистой системы мозга есть индивидуальные различия. Поэтому не существует абсолютных нормативов показателей линейной скорости кровотока (ЛCK) по интракрани- альным артериям, хотя Н. Bode и дает развернутую таблицу этих показателей у детей от рождения до 18 лет [16]. Индивидуальные особенности имеют также череп и размеры большого родничка. Поэтому абсолютные показатели скоростей рекомендуется сравнивать в динамике у одного ребёнка, полученные одним и тем же исследователем, на одном и том же приборе. Более достоверными оказываются независимые от угла показатели индексов резистентности и пульсации (ИР, ИП).

Рис. 84. Транскраниальное цветовое дуплексное сканирование верхнего сагиттального синуса в режиме B-flow.
Вены мозга. Хотя получение сигналов кровотока по крупным мозговым венозным коммуникациям новорожденных возможно и при использовании спектрального дуплексного сканирования, ЦДК значительно облегчает их обследование. При использовании режима ЭДК можно визуализировать через большой родничок, в сагиттальной плоскости, под мозолистым телом, вдоль крыши III желудочка две большие внутренние мозговые вены, сливающиеся в вену Галена, которая не всегда располагается строго срединно, а отклонена чаще вправо (рис. 83). Далее по средней линии над мозжечком - прямой синус; сразу под костями черепа и большим родничком - верхний сагиттальный синус (рис. 84). Крайне редко обнаруживают нижний сагиттальный и поперечный синусы. Оценка кровотока возможна также в венах головки хвостатого ядра и таламо-стриарных венах, которые визуализируют в парасагиттальной плоскости сканирования.
3. Ультразвуковая семиотика сосудистых нарушений
Среди неврологической патологии у новорожденных значительное место занимают расстройства мозговой гемодинамики в виде геморрагических и ишемических изменений, которые по частоте и локализации зависят от выраженности морфофункциональной незрелости центральной нервной системы и несовершенства механизмов ауторегуляции мозгового кровотока [17-20]. Геморрагические и ишемические поражения головного мозга можно наблюдать в разных комбинациях (таблица 21).

Рис. 83. Транскраниальное цветовое дуплексное сканирование вены Галена.
Из всех перечисленных в таблице 21 геморрагически-ишемических поражений головного мозга наиболее распространенными сосудистыми поражениями, достоверно определяемыми при НСГ, являются периинтравентрикулярные кровоизлияния, перивентрикулярная и субкортикальная лейкомаляции. Они представляют серьезную проблему в неонатологии, поскольку являются одной из главных причин летальных исходов и психоневрологических нарушений у новорожденных, особенно недоношенных детей. Хотя мозг недоношенных новорожденных более устойчив к действию гипоксии, цереброваскулярные повреждения у них встречаются значительно чаще за счет большей уязвимости сосудистой системы, имеющие анатомо-физиологические особенности в разные сроки гестационного возраста.
|
Таблица 21. Нарушения мозгового кровообращения у новорожденных детей. | |
|
Геморрагические |
Ишемические |
|
- Пери-интравентрикулярные |
- перивентрикулярная лейкомаляция |
|
кровоизлияния |
- субкортикальная лейкомаляция |
|
- Субарахноидальное кровоизлияние |
- парасагиттальный некроз |
|
- субдуральное кровоизлияние |
- поражение зрительных бугров и базальных |
|
- внутримозговое (очаговое; |
ганглиев |
|
кровоизлияние |
- инфаркты головного мозга |
|
- кровоизлияние в зрительный бугор |
- очаговые ишемические поражения области |
|
- кровоизлияние в сосудистое |
ствола и мозжечка |
|
сплетение бокового желудочка |
|
|
- кровоизлияние в мозжечок |
|
Известно, что кортикальные и субкортикальные отделы мозга с 24 до 36-37 недель внутриутробного развития хорошо кровоснабжаются лептоменингеальной эмбриональной сосудистой сетью, что и предохраняет эти структуры от повреждений у преждевременно рожденных детей. Набольший дефицит кровоснабжения испытывает перивентрикулярная зона (белое вещество мозга, лежащее выше боковых желудочков на 4-5 см), состоящая из нисходящих кортикальных путей. Глубокие слои перивентрикулярного белого вещества являются зоной смежного кровоснабжения между передней, средней и задней мозговыми артериями. Сосудистые анастомозы в эти сроки гестации слабо развиты, и поэтому нарушение тока крови по глубоким артериям у маловесных новорожденных вызывает снижение перфузии мозговой ткани - перивентрикулярную ишемию и развитие перизентрикулярной лейкомаляции.
Основным источником перивентрикулярных кровоизлияний (ПВК) является терминальный матрикс (ГМ). функционирующий в мозге с эмбрионального периода Максимально эта структура представлена у плодов в 12-16 недель гестации. Усиленно развиваясь до 6-го месяца внутриутробной жизни, она в дальнейшем претерпевает инволюцию и к 32-и неделе гестации практически перестает существовать ГМ расположен ниже и латеральнее эпендимы выстилающей дно бокового желудочка и находится непосредственно над головкой и телом хвостатого ядра. ГМ - важнейшая структура мозга, поставляющая нейрональный и глиальный строительный материал для коры и подкорковых ганглиев в процессе раннего онтогенеза. Эта структура кровоснабжается в основном из бассейна передней мозговой артерии, однако ее незрелые сосуды с широкими просветами не имеют базальной мембраны и мышечных волокон. В этой зоне мало поддерживающей стромы повышена фибрилолитическая активность. Эти факторы способствуют повышенной ранимост и сосудов ГМ, особенно у детей с экстремально низкой массой тела. В основе ПВК лежит срыв ауторегуляторных возможностей мозгового кровотока, т. е. способности поддерживать постоянство кровенаполнения мозга независимо от колебаний системного АД. ПВК могут быть изолированными (субэпендимальными), распространяться в желудочки (внутрижелудочковые) с вовлечением перивентрикулярной паренхимы (перивентрикулярные) головного мозга за счет развития вторичного геморрагического инфаркта в перивентрикулярной области [21, 22].
В основу классификации положены степень распространенности кровоизлияния и реакция (расширение) желудочковой системы. В своей работе мы используем классификацию L. Papille et al. [5], которая подразумевает четыре степени кровоизлияния: I степень - изолированное субэпендимальное кровоизлияние (субэпендимальная гематома), II степень - распространение субэпендимального кровоизлияния в полость бокового желудочка, без его расширения в остром периоде, III степень - массивное внутрижелудочковое кровоизлияние с расширением боковых желудочков, IV степень - сочетание внутрижелудочкового кровоизлияния и геморрагического перивентрикулярного инфаркта.
По нашему мнению, она наиболее точно отражает локализацию и степень распространения кровоизлияния, учитывает изменение размеров желудочков, является наиболее простой и удобной для практического применения.
При динамическом ультразвуковом наблюдении за новорожденными высокого риска отмечено, что подавляющее большинство ПВК возникают и развивается на первой неделе жизни, преимущественно в возрасте от 24 до 72 часов после рождения. Частота выявления ПВК у обследованных нами детей представлены в таблице 22. У маловесных детей в 15% случаев кровоизлияния возникают в более поздние сроки, после второй недели жизни. Если ПВК возникает позже, оно почти всегда имеет доброкачественное течение и возможность осложнений при этом невелика. Отмечают случаи внутриутробной диагностики ПВК.
Таблица 22. Частота выявления ПВК по дням жизни при первичном обследовании
|
Сутки жизни |
ПВК I ст. |
ПВК II ст. |
ПВК III ст. |
ПВК IV ст. |
Итого |
% |
|
1 |
7 |
- |
12 |
1 |
20 |
15 |
|
2 |
13 |
1 |
6 |
2 |
22 |
17 |
|
3 |
8 |
1 |
7 |
- |
15 |
12 |
|
4 |
6 |
1 |
1 |
- |
8 |
6 |
|
5-7 |
12 |
5 |
5 |
3 |
25 |
9 |
|
8-14 |
16 |
3 |
3 |
- |
22 |
17 |
|
после 15 |
13 |
2 |
3 |
- |
18 |
14 |
|
итого |
75 |
12 |
37 |
6 |
130 |
|
|
% |
57,7 |
9,2 |
28,5 |
4,6 |
|
100 |
3.1. Эхографическая характеристика ПВК
ПВК I степени (субэпендимальное кровоизлияние). Субэпендимальную гематому визуализируют в виде гиперэхогенного округлого образования с четкими контурами в области головки хвостатого ядра, каудоталамической вырезки или межжелудочкового отверстия (рис 85). Увеличения размеров бокового желудочка при этом кровоизлиянии не отмечают. Изменение формы бокового желудочка на стороне кровоизлияния возможно при гематоме больших размеров.
ПВК II степени. Наряду с гиперэхогенными участками в области головки хвостатого ядра или межжелудочкового отверстия, в полости еще нерасширенного бокового желудочка, нередко с обеих сторон, определяют дополнительные гиперэхогенные структуры, которые связаны с сосудистыми сплетениями и деформируют их (рис. 86). При этом отмечают исчезновение каудоталамической вырезки за счет дополнительных эхосигналов от сгустка крови. Наличие расширенных, асимметричных, с неровными контурами глыбчатых сосудистых сплетений, позволяет диагностировать ПВК II степени.
ПВК III степени. Гиперэхогенные структуры (сгустки крови) наблюдают в расширенных боковых желудочках, в 85% случаев они могут быть с двух сторон. В наиболее тяжелых случаях образуются сгустки, которые повторяют форму желудочков мозга (тампонада). В III и IV желудочках сгустки выявляют значительно реже (рис. 87).


Рис. 85. ПВК I ст. Субэпендимальная гематома.

Рис. 86. ПВК II ст. Субэпендимальная гематома, исчезновение каудо-таламической вырезки, деформация сплетения и тромб на нем.
ПВК IV степени. Тромб, образовавшийся в боковом желудочке при ПВК III степени, может явиться причиной нарушения венозного оттока через ветви терминальной вены, расположенной перивентрикулярно. Это приводит к венозному инфаркту, что и является основным фактором в развитии перивентрикулярных поражений. Это кровоизлияние характеризуется наличием внутрижелудочкового сгустка крови, расширения желудочков и геморрагического венозного инфаркта в перивентрикулярной зоне, представленного гиперэхогенным участком с округлой формы четкими контурами (рис. 88). Последний может быть расположен над передним рогом, телом или около заднего рога бокового желудочка. ПВК IV степени в 96-98% случаев одностороннее. В 15-23% наблюдений отмечают нарастание кровоизлияния от субэпендимального до паренхиматозного в течение первой недели жизни.
При динамическом сканировании (ежедневно на первой неделе жизни, далее 1 раз в неделю после 7 дня жизни) ПВК I степени сохраняется до двух-трех месяцев жизни, меняясь по структуре и эхогенности и уменьшаясь в размерах. В 52% гематома бесследно исчезает, или на ее месте, в 48% случаев, в течение 2-4 недель, образуется субэпендимальная псевдокиста (СК), особенностью которой является отсутствие субэпендимальной выстилки (рис. 89). Как правило, СК редуцируется к 6-9 месяцам жизни.
Рассасывание внутрижелудочковых сгустков крови после ПВК II и особенно III степени происходит постепенно, чаще в течение 5-6 недель (рис. 90). В области паренхиматозного кровоизлияния при ПВК IV степени в 75-82% случаев на 24-36 сутки жизни образуется порэнцефалическая псевдокиста, связанная с полостью бокового желудочка (рис. 91).


Рис. 89. Субэпендимальная псевдокиста после ПВК I ст.

Рис. 88. ПВК IV ст. Тромбы в расширенных боковых и третьем желудочках, венозный геморрагический инфаркт в перивентрикулярной области над передним рогом.
Наиболее характерным осложнением ПВК III-IV степени является расширение боковых желудочков, выраженность и частота которого определяется тяжестью перенесенного патологического процесса. Субкомпенсированная дилатация развивается в течение 1-3 недель и наблюдается у 48% детей с ПВК III степени. После ПВК II степени в отдельных случаях наблюдают умеренное персистирующее расширение боковых желудочков за счет тел и задних рогов без значительного увеличения в динамике. Обычно к моменту выписки ребенка из стационара можно сказать, было ли расширение желудочков транзиторным, персистирующим или прогрессирующим с развитием внутренней гидроцефалии. О полной или частичной окклюзии судят по расширению вышележащих отделов ликворной системы (рис 92)
Перивентрикулярнал лейкомаляция (ПВЛ) - ишемический инфаркт белого вещества головного мозга вокруг наружных углов боковых желудочков. До недавнего времени диагноз ПВЛ являлся заключением только патоморфологов поскольку клинической симптоматики, указывающей на поражение перивентрикулярной области у детей раннего возраста, не существует. Патоморфологически при ПВЛ обнаруживают мелкие участки размягченного вещества мозга кпереди от передних рогов, вблизи латеральных углов боковых желудочков и латеральнее задних рогов. В одних случаях через несколько недель после ишемического инсульта происходит кальцификация и глиоз, оставляющие «перивентрикулярный шрам», в других образуются единичные или множественные полости (псевдокисты), которые с Бременем могут спадаться и ведут к вторичному расширению желудочков и субарахноидальною пространства. В 25% случаев ПВЛ сочетаемся с очаговыми кровоизлияниями. В 25% наблюдений имеют место вторичные кровоизлияния в область некротизированной ткани с образованием геморрагических инфарктов, а иногда и ПВК [23-25].

Рис. 91. Динамика ПВК IV ст.: декомпенсированная внутренняя гидроцефалия за счет расширения боковых желудочков, порэнцефалическая псевдокиста над передним рогом

Рис 92. Динамика ПВК III ст. выраженное расширение боковых и третьего желудочков мозга.

Рис. 93. Перивентрикулярная лейкомаляция. острая фаза (выраженный ореол повышенной эхогенности вокруг боковых желудочков).
На эхограмме в коронарной и парасагиттальной плоскостях острая (начальная) фаза ПВЛ характеризуется значительным повышением эхогенности перивентрикулярных зон с обеих сторон, более выраженным в области тел и задних рогов боковых желудочков (рис 93), Реже отмечают повышение эхогенности над передними рогами. Нередко пораженный участок изоэхогенен с сосудистым сплетением и отделен от бокового желудочка только полоской ликвора ПВЛ носит симметричный, т. е. всегда двухсторонний характер. Ультразвуковой диагноз на этой стадии сложен, так как повышение эхогенности может быть обусловлено особенностями васкуляризации и неполной миелинизацией перивентрикулярных зон у недоношенных новорожденных. Наиболее вероятно развитие ПВЛ, если при повторном исследовании через 10-14 дней сохраняется выраженная эхогенность в перивентрикулярных областях. В дифференциальной диагностике острой фазы ПВЛ и нормального ореола повышенной эхогенности помогает спектральная допплерография.
Поздней эхографической стадией ПВЛ является кистозная дегенерация, развивающаяся на месте высокой эхогенности. Кисты не имеют эпителиальной выстилки, возможно их слияние и образование более крупных полостей. При этом часто наблюдают минимальное и/или умеренное расширение желудочковой системы, преимущественно боковых желудочков за счет передних рогов и тел (рис. 94). Далее, в течение 6-8 недель, кисты спадаются, замещаются рубцовой тканью и вызывают вторичную атрофию вещества головного мозга. При атрофии боковые желудочки не теряют свои обычные очертания, но становятся более округлыми в области передних рогов и тел. При этом не отмечают эхографических признаков окклюзии ликворных путей.
Субкортикальная лейкомаляция (СКЛ) возникает вследствие нарушения кровоснабжения подкорковых структур лептоменингеальными сосудами в последнем триместре беременности [26, 27]. На эхограммах в начальных стадиях наблюдают отек мозгового вещества, который характеризуется диффузным повышением эхогенности тканей головного мозга и снижением (отсутствием) пульсации мозговых сосудов. В дальнейшем, как правило в течение двух недель, на фоне отека развиваются очаги усиления эхогенности без четких контуров. К концу месяца в веществе головного мозга формируются множественные, мелкие, паренхиматозные кисты. При этом незначительно расширяется желудочковая система и нередко субарахноидальное пространство.
3.2. Изменения гемодинамики мозга, связанные с ростом и развитием ребенка

Рис. 94. Перивентрикулярная лейкомаляция, кистозная фаза (множественные псевдокисты в пери- вентрикулярной области).
Показатели церебрального кровотока здорового новорожденного определяются, прежде всего, гестационным возрастом и наличием (или отсутствием) гемодинамически значимого функционирующего артериального протока. Персистенция последнего сопровождается сбросом крови в малый круг кровообращения с обеднением кровотока в сосудах мозга, что характеризуется низкой диастолической скоростью, а иногда и изменением систолической скорости. В норме с увеличением гестационного, постнатального возраста и веса на протяжении первых месяцев жизни отмечают постепенное повышение показателей ЛСК, снижение ИП и ИР в артериях и повышение средней скорости в крупных венозных коллекторах. Наибольшие изменения происходят на первые 2-4 сутки жизни, что связано с закрытием фетальных коммуникаций и постепенным снижением резистентности мозговых сосудов [28].
Показатели кровотока по интракраниальным артериям, полученные на основании динамического исследования новорожденных на 1-7 сутки жизни при неосложненном течении раннего неонатального периода у доношенных и «условно здоровых» недоношенных детей, в зависимости от гестационного возраста, не выявили каких-либо значимых различий и могут быть приняты за норму (таблица 23).
Таблица 23. ИР в артериях мозга у детей при физиологическом течении неонатального периода.
|
Название артерии |
Группы детей |
Возраст детей | ||||||
|
30 мин. |
2 часа |
1-е сутки |
2-е сутки |
3-е сутки |
4-е сутки |
7-е сутки | ||
|
внутренняя сонная |
1 2 |
0,73 ±0,01 0,78 ± 0,01 |
0,77 ±0,01 0,79 ±0,01 |
0,67 ±0,01 0,79 ± 0,01 |
0,67 ±0,01 0,71 ± 0,02 |
0,68 ±0,01 0,66 + 0,02 |
0,65 ± 0,01 0,68 ± 0,03 |
0,66 ± 0,01 0,68 ± 0,02 |
|
передняя мозговая |
1 2 |
0,69 ±0,01 0,68 ± 0,02 |
0,74 ± 0,02 0,74 ± 0,01 |
0,73 ± 0,03 0,71 ±0,01 |
071 ± 0,02 0,65 ±0,01 |
0,68 ± 0,03 0,65 ±0,02 |
0,66 ± 0,02 0,69 ± 0,02 |
0,66 + 0,01 0,69 ±0,01 |
|
средняя мозговая |
1 2 |
0,74 ±0,01 0,75 ±0,01 |
0,76 ±0,01 0,77 ± 0,01 |
0,67 ± 0,01 0,64 ±0,02 |
0,66 ±0,01 0,66 ±0,01 |
0,67 ± 0,01 0,65 ± 0,02 |
0,66 ±0,01 0,67 ±0,01 |
0,67 ± 0,01 0,68 ± 0,01 |
|
задняя мозговая |
1 2 |
0,75 ± 0,02 0,76 ± 0,02 |
0,76 ± 0,02 0,73 ±0,01 |
0,63 ± 0,02 0,61 ± 0,01 |
0,62 ± 0,02 0,63 ±0,01 |
0,64 ± 0,02 0,64 ± 0,01 |
0,63 ± 0,02 0,65 ± 0,01 |
0,64 ± 0,01 0,65 ± 0,02 |
|
основная |
1 2 |
0,76 ± 0,02 0,80 ± 0,02 |
0,79 ± 0,03 0,79 ±0,01 |
0,67 ± 0,02 0,72 ±0,01 |
0,68 ±0,02 0,67 ±0,01 |
0,65 ± 0,03 0,68 ± 0,02 |
0,68 ± 0,03 0,68 ± 0,02 |
0,68 ±0,01 0,68 ± 0,02 |
1 - здоровые доношенные новорожденные; 2 - «условно здоровые» недоношенные дети
Однако при интерпретации данных допплерографии сосудов основания головного мозга необходимо учитывать не только вес, гестационный и постнатальный возраст ребенка, но и влияние таких факторов, как гематокрит, парциальное давление кислорода и углекислого газа, концентрацию глюкозы в крови, объём циркулирующей крови. Гемодинамически значимый открытый артериальный проток приводит к лево-правому шунтированию крови и обеднению потока к голове, что выражается в резком снижении диастолической скорости (иногда можно отметить даже ретроградный заброс во время диастолы) и высоких значениях ИР [29].
С возрастом отмечают увеличение линейной скорости кровотока по венам и синусам мозга (табл. 24).
При качественной оценке характера допплерограммы необходимо обращать внимание на ее монофазный спектр в вене Галена и таламо-стриарной вене и наличие пульсации (псевдоартериальный характер) в мозговых синусах. Псевдоартериальный характер кровотока в вене Галена может свидетельствовать о наличии признаков венозной дисциркуляции, приводящей в дальнейшем у детей с перинатальной энцефалопатией к развитию в возрасте 3-4 месяцев жизни гипертензионно-гидроцефального синдрома.
|
Таблица 24. Показатели средней ЛСК у здоровых детей по венам и синусу мозга в зависимости от возраста (в см/с). | |||
|
Возраст |
Вена Галена |
Стриарная вена |
Верхний сагиттальный синус |
|
1-7 день |
4-6 |
2-4 |
8-15 |
|
7-30 день |
8-10 |
3-6 |
10-18 |
|
3-6 месяцев |
10-12 |
5-8 |
12-24 |
|
6-12 месяцев |
10-15 |
6-10 |
15-26 |
3.3. Гемодинамика мозга при перинатальных поражениях
3.3.1. Интракраниальный кровоток в остром периоде перинатальной энцефалопатии
Для новорожденных с гипоксически-ишемическим поражением мозга (церебральной ишемией) I-II степени тяжести в целом характерны те же закономерности в изменении церебральной гемодинамики, что и для здоровых новорожденных, однако при более низких линейных скоростях кровотока (в большей степени диастолической). С 3 суток жизни достоверных различий линейных скоростей мозгового кровотока у здоровых новорожденных и детей с ишемией II степени тяжести не отмечали, что отражало обратимость выявленных нарушений, их «функциональный» характер. Нормальная эхографическая характеристика головного мозга при НСГ, а также отсутствие достоверных различий ИР у здоровых детей и новорожденных с ишемией свидетельствуют о сохранности ауторегуляции мозговой гемодинамики.
Анализ показателей церебральной гемодинамики при церебральной ишемии III степени, сопровождающейся формированием внутричерепных кровоизлияний, демонстрирует достоверное снижение всех параметров, характеризующих кровотоку новорожденных (таблица 25).
Степень и скорость изменения церебральной гемодинамики при различных формах кровоизлияний различны. У новорожденных с ПВК I-II степени отмечали низкие скорости как систолического, так и диастолического кровотока, что определялось высокой сосудистой резистентностью Данная тенденция сохраняется на протяжении всего раннего неонатального периода и более характерна для больных с ПВК II степени. АД остаётся низким в течение первых 2 суток жизни и колеблется в основном в пределах от 37,9 ± 1,91 до 44,2 ± 1,90 мм рт. ст. На 3 сутки жизни отмечают подъем АД до 56,0 ± 1,80 мм рт. ст., что чаще наблюдают среди пациентов с ПВК II степени, что сопровождается быстрым прогрессированием кровоизлияния до ПВК III-IV степени. В этом случае допплерограмма чаще имеет флюктуирующий характер [30, 31].
Таким образом, ПВК III-IV степеней чаще развиваются на фоне выраженной артериальной гипотензии, сохраняющейся на протяжении первых 4-6 дней жизни. В случаях с летальным исходом диастолический кровоток (после исключения функционирующего артериального протока) в первые 6-8 часов жизни не определяется. Факт снижения скоростей кровотока при массивных ПВК III степени особенно диастолической, высокие ИР мозговых артерий, флюктуирующий характер кровотока являются неблагоприятными прогностическими признаками - большинство таких детей погибают.
Таблица 25. Показатели кровотока по ПМА и среднего АД у новорожденных с гипоксически-ишемической энцефалопатией III ст. и в формированием ПЗК I-IV ст в раннем неонатальном периоде (М ± т)
|
Возраст |
ПВК I-II степени |
ПВК III-IV степени |
Здоровые новорожденные | |||||||||
|
(сутки) |
Vmax |
Vmin |
ИР |
АД мм |
Vmax |
Vmin |
ИР |
АД мм |
Vmax |
Vmin |
ИР |
АД мм |
|
|
см/с |
см/с |
|
рт. ст. |
см/с |
см/с |
|
рт. ст. |
см/с |
см/с |
|
рт. ст. |
|
0,5 М |
24,8 |
3,9 |
0,84 |
42,3 |
18,2 |
0,93 |
0,95 |
34,5 |
27,1 |
6,0 |
0,78 |
50,5 |
|
m |
±0,28 |
±0,13 |
± 0,02 |
± 1,90 |
±0,37 |
±0,011 |
±0,02 |
±2,0 |
±0,31 |
±0,23 |
±0,02 |
±2,10 |
|
Р |
<0,001 |
<0,001 |
<0,05 |
<0,01 |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
|
|
|
|
|
1 М |
24.6 |
4,9 |
0,80 |
39,8 |
23,2 |
2,1 |
0,90 |
38,3 |
29,0 |
7,8 |
0,73 |
54,4 |
|
m |
±0,39 |
± 0,14 |
±0,02 |
± 1,91 |
±0,41 |
±0,051 |
±0,02 |
±1,40 |
±0,26 |
±0,17 |
± 0,03 |
±2,0 |
|
Р |
<0,001 |
<0,001 |
>0,05 |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
<0,01 |
|
|
|
|
|
2М |
28,9 |
6,1 |
0,79 |
42,5 |
24,5 |
4,5 |
0,81 |
38,9 |
32,5 |
9,5 |
0,71 |
56,4 |
|
m |
±0,23 |
±0,18 |
± 0,02 |
± 1,90 |
±0,48 |
± 0,063 |
± 0,02 |
1,30 |
±0,42 |
±0,25 |
±0,02 |
± 1,70 |
|
Р |
<0,001 |
<0,001 |
<0,05 |
<0,001 |
<0,001 |
<0,001 |
<0,01 |
<0,001 |
|
|
|
|
|
3 М |
29,8 |
6,5 |
0,78 |
56,0 |
26,2 |
4,2 |
0,83 |
39,4 |
33,2 |
10,5 |
0,68 |
58,5 |
|
m |
± 0,26 |
± 0,15 |
±0,02 |
±1,80 |
±0,28 |
±0,056 |
±0,02 |
±1,70 |
±0,35 |
±0,33 |
±0,03 |
± 1,50 |
|
Р |
<0,01 |
<0,001 |
<0,05 |
>0,05 |
<0,001 |
<0,001 |
<0,01 |
<0,001 |
|
|
|
|
|
4-6 М |
31,3 |
8,0 |
0,74 |
62,8 |
31,6 |
5,3 |
0,83 |
40,1 |
35,1 |
12,0 |
0,66 |
65,2 |
|
m |
±0,37 |
±0.29 |
±0,02 |
± 1,22 |
±0,41 |
±0,078 |
±0,02 |
± 1,80 |
±0,49 |
±0,34 |
±0,02 |
± 1,40 |
|
Р |
<0,001 |
<0,001 |
<0,05 |
>0,05 |
0,01 |
<0,001 |
<0,01 |
<0,001 |
|
|
|
|
Р определялся по сравнению с данными здоровых доношенных новорожденных.
Стабилизация показателей допплерограммы служит критерием эффективности проводимой терапии
Перинатальные поражения мозга преимущественно с ишемическими очаговыми поражениями, перивентрикулярной и субкортикальной лейкомалянией характеризуются стабильно высокой резистентностью мозговых сосудоз в течение всего раннего неонатального периода. Максимальное повышение ИР имеет место среди больных с ПВЛ Падение диастолической скорости кровотока свидетельствует о снижении интракраниального кровотока и нарастании ишемии мозга. В дальнейшем ИР снижается незначительно. У детей в возрасте 3-4 недель с повышением перивентрикулярной эхогенности и мелкими псевдокистами (стадия кистозной ПВЛ) отмечается высокий, длительно сохраняющийся вне зависимости от проводимого лечения ИР (0.8-0 ?). Выраженная внутричерепная гипертензия и высокий ИР в этих случаях являются крайне неблагоприятными прогностическими признаками, отражающими тяжесть и необратимость поражений мозга.
У детей с феноменом «физиологической» повышенной перивентрикулярной эхогенности (перивентрикулярным ореолом) отмечаются негрубая гипо-перфузия мозговой паренхимы и артериальная гипотония в 1-4 сутки жизни. Начиная с 4-7 суток АД у этих новорожденных соответствует аналогичным показателям у здоровых детей и даже, в ряде случаев, превышает их значения, что не изменяет уровня церебрального кровотока. Это является убедительным аргументом в пользу сохранности механизмов ауторегуляции церебрального кровотока при феномене повышенной перивентрикулярной эхогенности и свидетельствует об особенностях кровоснабжения перивентрикулярной области у детей данного гестационного возраста (таблица 26).
Таблица 26. Показатели кровотока по ПМА и среднего АД у новорожденных с гипоксически-ишемической энцефалопатией III ст. тяжести преимущественно ишемического характера в раннем неонатальном периоде (М ± т).
|
Воз- |
Перивентрикулярная/ |
|
Повышенная |
|
|
Здоровые |
| |||||
|
раст |
субкортикальная |
|
перивентрикулярная/ |
новорожденные |
| |||||||
|
(сутки) |
|
лейкомаляция |
|
|
эхогенность |
|
|
|
|
| ||
|
|
Vmax |
Vmin |
ИР |
АД мм |
Vmax |
Vmin |
ИР |
АД мм |
Vmax |
Vmin |
ИР |
АД мм |
|
|
см/с |
см/с |
|
рт. ст |
см/с |
см/с |
|
рт. ст |
см/с |
см/с |
|
рт. ст. |
|
0,5 М |
21,2 |
2,5 |
0,88 |
35,5 |
27,2 |
5,0 |
0,82 |
47,2 |
27,1 |
6,0 |
0,78 |
50,5 |
|
m |
±0,35 |
±0,52 |
±0,03 |
±2,10 |
±0,61 |
±0,19 |
±0,03 |
± 1,80 |
+ 0,31 |
±0,23 |
± 0,02 |
±2,10 |
|
Р |
<0,001 |
<0,001 |
<0,05 |
<0,001 |
>0,05 |
<0,05 |
>0,05 |
>0,05 |
|
|
|
|
|
1 М |
26,5 |
3,0 |
0,89 |
36,0 |
31,0 |
7,1 |
0,77 |
53,8 |
29,0 |
7,8 |
0,73 |
54,4 |
|
m |
±0,41 |
±0,49 |
±0,03 |
±1,10 |
±0,52 |
±0,26 |
±0,02 |
± 1,90 |
±0,26 |
±0,17 |
± 0,03 |
±2,0 |
|
Р |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
<0,05 |
<0,05 |
>0,05 |
>0,05 |
|
|
|
|
|
2М |
25,1 |
3,3 |
0,87 |
36,5 |
32,0 |
7,1 |
0,78 |
50,9 |
32,5 |
9,5 |
0,71 |
56,4 |
|
m |
±0,39 |
±0,61 |
±0,02 |
±1,70 |
±0,49 |
±0,24 |
±0,03 |
±2,0 |
±0,42 |
+ 0,25 |
±0,02 |
±1,70 |
|
Р |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
>0,05 |
<0,001 |
>0,05 |
<0,05 |
|
|
|
|
|
3 М |
25,9 |
4,1 |
0,84 |
38,9 |
33,6 |
8,0 |
0,76 |
58,2 |
33,2 |
10,5 |
0,68 |
58,5 |
|
m |
±0,40 |
±0,73 |
±0,02 |
+ 1,50 |
±0,50 |
±0,30 |
± 0,04 |
±1,30 |
±0,35 |
±0,33 |
±0,03 |
±1,50 |
|
Р |
<0,001 |
<0,001 |
<0,001 |
>0,001 |
>0,05 |
<0,001 |
>0,05 |
>0,05 |
|
|
|
|
|
4-6 М |
26,1 |
3,5 |
0,87 |
36,4 |
32,5 |
9,6 |
0,70 |
69,4 |
35,1 |
12,0 |
0,66 |
65,2 |
|
m |
± 0,38 |
± 0,59 |
±0,03 |
± 1,40 |
±0,39 |
±0,38 |
± 0,03 |
± 1,80 |
±0,49 |
± 0,34 |
± 0,02 |
±1,40 |
|
Р |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
<0,01 |
0,001 |
>0,05 |
>0,05 |
|
|
|
|
Р определяется по сравнению с данными у здоровых доношенных новорожденных.
На основании диагностических и прогностических значений ИР в первые сутки жизни новорожденного предложены алгоритмы диагностики и прогноза гипоксически-ишемических поражений мозга. Наиболее неблагоприятным прогностическим признаком является отсутствие диастолического кровотока (ИР = 1,0) в первые 6-8 часов жизни (при условии исключения гемодинамически значимого функционирующего артериального протока), что сопровождается развитием инфаркта или отёка головного мозга (реже) и в 80% случаев завершается летально. Значения ИР от 0,9 и выше в первые трое суток жизни ведут к развитию тяжелой органической патологии головного мозга у ребенка в возрасте 1 года. Полученные данные убедительно свидетельствуют о том, что гипоперфузия мозговой паренхимы в первые сутки жизни ребенка, характеризующаяся высокими значениями ИР, является прогностически более неблагоприятным признаком исхода перинатальной энцефалопатии в 1 год, чем гиперперфузия [31].
3.3.2. Интракраниальный кровоток в восстановительном периоде перинатальной энцефалопатии
При сравнительном анализе интракраниальной гемодинамики у детей старше 1 месяца жизни и детей, перенесших хроническую внутриутробную или острую гипоксию в родах, имеющих клинические проявления перинатальной энцефалопатии (ПЭП) в восстановительном периоде (дети старше 1 месяца жизни), отмечено, что в течение года у здоровых детей ИР в бассейне ПМА стабилен и равен 0,66-0,7 в первом полугодии и 0,65-0,69 во II полугодии.
У детей с клиническими синдромами ПЭП отмечают фазовое изменение показателей ИР в передней мозговой артерии в течение первого года жизни:
- фаза - «спазма» или напряжения - характеризуется повышением ИР в бассейне ПМА (свыше 0,7) и продолжается в среднем до 3-4 месяцев жизни. Далее имеет место «отрицательный вираж» ИР с повышенного на пониженный, т. е. с выше 0,72 до менее 0,65.
- фаза - расслабления сосудов - длится до 6-7 месяцев при острой гипоксии и 8-11 месяцев при хронической внутриутробной гипоксии. ИР снижен.
- фаза - фаза восстановительных явлений длится до возраста 12-15 месяцев, а возможно и старше. В этой фазе можно судить о восстановлении тонуса сосудистого русла. ИР возвращается к значениям 0,65-0,69, что имеет существенное прогностическое значение. По этой фазе можно предположить стойкое резидуальное изменение регуляции тонуса артериального сосудистого русла, если ИР остается сниженным (менее 0,65). Фазы изменений показателей артериального кровотока в течение первого года жизни в нашей работе совпадают с клиническими фазами течения перинатальной энцефалопатии по Ю.А. Барашневу [32].

Рис. 95. Транскраниальное цветовое дуплексное сканирование вены Галена у ребенка с ГГС. с появлением псевдоартериального кровотока.
При исследовании венозного кровотока выявлено, что скорость венозного оттока по вене Галена достоверно выше у детей с гипертензионно-гидроцефальным синдромом (ГГС), чем у детей контрольной группы (р<0,01).0тмечается корреляционная зависимость между клиникой ГГС и появлением псевдоартериального характера венозного оттока в вене Галена (рис. 95). При проведении корреляционного анализа венозного оттока с другими основными неврологическими синдромами первого года жизни (синдром повышения нервно-рефлекторной возбудимости, синдром мышечной дистонии, синдром вегетовисцеральных дисфункций, астеноневротический синдром, задержка психотоморного развития) не было выявлено достоверной зависимости между этими синдромами и скоростью оттока по вене Галена или характером венозной кривой [33]. При сравнении темпов нормализации показателей артериального кровотока и венозного оттока было установлено, что венозный отток восстанавливается достоверно быстрее, чем показатели артериального кровотока (р<0,01).
Выделение группы детей, имеющих только сосудистые нарушения (без структурных поражений мозга при НСГ), является важным для клиницистов. Правильная интерпретация показателей интракраниального кровотока у детей первого года жизни в норме и особенно в сочетании с клиникой перинатального поражения мозга позволяет более индивидуально подобрать корригирующую терапию, направленную на ликвидацию сосудистых нарушений и предотвращение структурных изменений ткани мозга. Применение допплерографии позволяет ответить на вопрос, какое звено интракраниального кровотока затронуто - артериальное или венозное, что и определяет выбор препаратов, применяемых в программах реабилитации детей с перинатальным поражением ЦНС [34, 35].
Комплексное ультразвуковое исследование с применением допплерографии интракраниальных артериальных и венозных сосудов у детей раннего возраста значительно расширяет возможности ранней топической диагностики сосудистой патологии, являющейся причиной возникновения перинатальной энцефалопатии.
ГЛАВА 5
ВЕНОЗНЫЕ ДИСГЕМИИ И ВЕРТЕБРОГЕННАЯ НЕДОСТАТОЧНОСТЬ ЦЕРЕБРАЛЬНОЙ ГЕМОДИНАМИКИ У ДЕТЕЙ
Достижения современной ангионеврологии связаны с изучением физиологии и патологии кровотока по артериям. Исследованию же венозной циркуляции - неразрывного компонента общей гемодинамики - уделяется гораздо меньше внимания. Венозная энцефалопатия впервые описана М.И. Холоденко в 1957 году [1] и трактовалась им как дистрофия мозга, развившаяся при некомпенсированной форме венозного застоя М.Я. Бердичевский в известной монографии «Венозная дисциркуляторная патология головного мозга» [2], кроме застойно-гипоксической венозной энцефалопатии выделяет дистоническую форму заболевания, наиболее часто встречающуюся в клинической практике. Венозные дистонии, по мнению В.М. Трошина и соавт. [3], возникают из-за нарушения центральных регуляторных механизмов сосудистого тонуса. Термин «венозная дисгемия» предполагает системное многоуровневое поражение от варикоза - тромбоза вен голени и анальных вен до церебральных флебопатий [4].
Специальных публикаций, касающихся нарушений венозного кровообращения, у детей практически нет, хотя участие венозных дисгемий доказано при всех ургентных и хронических сосудистых заболеваниях нервной системы. В большинстве руководств по детской неврологии описываются лишь острая венозная гиперемия мозга и синус-тромбозы, другие же формы церебральной венозной патологии, наблюдаемые гораздо чаще, не нашли отражения в литературе [5].
Благодаря «нежной» морфологии и богатому рецепторному аппарату венозное русло является тем тонким местом, которое «рвется» при различных эндогенных и экзогенных воздействиях. По нашим данным, венозные дисгемии являются ведущими в патогенезе сосудистых цефалгии у 20% школьников [6].
Наличие существующего артериовенозного неравноправия И.Д. Стулин [4] объясняет чрезвычайной подвижностью и индивидуальностью анатомии и физиологии венозной системы и связанной с этим трудностью объективизации параметров венозного потока. Известно положение о том, что церебральные вены не имеют клапанов, но полулунные створки в месте впадения вен в синусы могут выполнять их роль. Имеет место чрезвычайная индивидуальность в строении даже венозных синусов. Так, верхний сагиттальный синус у части пациентов имеет трехгранную форму в дупликатуре твердой мозговой оболочки и по структуре напоминает магистральный сосуд, у других больных тот же синус может быть пронизан хордами и трабекулами, иметь большое число пахионовых грануляций и, видимо, иные показатели линейной скорости кровотока (ЛСК). Важными являются и данные о направлении кровотока по глазным венам. В норме у большинства здоровых людей венозная кровь от лица направляется к глазнице и уходит внутрь черепа к кавернозному синусу. В редко встречающемся варианте, когда средняя мозговая и крючковидная вены впадают в синус одновременно, давление крови в нем может повыситься и направление потока будет из полости черепа.
Анализ литературы и наш десятилетний опыт исследований в области нейрофлебологии позволяют предположить, что наиболее оптимальным в диагностике венозных дисгемий является системный подход в оценке этиологии, клиники и патогенеза венозных дисциркуляций, итогом которого может быть назначение адекватного лечения [5, 7]. При этом в этиологии прежде всего нужно обращать внимание на наличие часто протекающей субклинически ме- зенхимальной недостаточности - костные деформации, гипермобильность суставов, множественные грыжи, пролапс митрального клапана и др. Соединительнотканной недостаточности всегда сопутствует флебопатия, часто на фоне наследственно-конституциональной отягощенности по линии матери.
При рассмотрении клинической картины врач должен интересоваться состоянием вен нижних конечностей, варикоцеле, нарушением эректильной функции у мужчин (обусловленной корпоровенозной недостаточностью полового члена) и, естественно, признаками нарушения венозного кровообращения в мозге. Тесная связь флебо- и ликвороциркуляции зачастую приводит к гипертензивным проявлениям, палитра которых разнообразна - от субклинических, в виде изменения венозного рисунка на глазном дне, до тяжелейших венозных кризов. Клиническая картина венозного криза очень напоминает ликвородинамический и характеризуется началом в ночные или утренние часы, стойкими распирающими головными болями (ГБ), пастозностью лица, рвотой, болезненностью движения глазных яблок. У больных наблюдают вялость, апатию, брадипсихию и брадикинезию. В дифференциальной диагностике может помочь только системный подход с анализом этиологии, клиники и патогенеза криза. Примером такого анализа может быть понятие псевдотумор головного мозга, синонимом которого является используемый в современной литературе термин «доброкачественная внутричерепная гипертензия» (ДВЧГ).
Большинство авторов [8-10] определяют ДВЧГ как синдром, удовлетворяющий четырем критериям: 1) повышению внутричерепного давления более 200 мм вод. ст.; 2) нормальному содержанию клеток и белка в ликворе; 3) нормальным или уменьшенным размерам желудочковой системы по данным компьютерной или магнитно-резонансной томографии мозга (КТ и МРТ); 4) наличию застойных дисков зрительных нервов или поражения отводящего нерва при отсутствии других изменений неврологического статуса.
При постановке диагноза ДВЧГ у детей очевидна относительность этих критериев, ибо существует много случаев, когда клинические проявления ДВЧГ не укладываются в «прокрустово ложе» приведенных выше «жестких» критериев.
Учитывая жалобы больных и результаты неврологического обследования, Е.М. Бурцев [8] выделяет следующие клинические критерии ДВЧГ в детском возрасте: доброкачественность течения - резидуальный, преимущественно непрогредиентный характер; гидроцефалия - типичная триада клинических проявлений (головная боль, нарушения зрения, глазодвигательные расстройства); положительный эффект от дегидратационной терапии. В настоящее время вопрос о состоянии желудочковой системы мозга у больных с ДВЧГ представляется нам дискуссионным, так как показатели вентрикулометрии не могут быть сопоставимы без учета стадии и углубленного изучения патогенеза заболевания.
Среди неинвазивных методов диагностики церебральных венозных дисциркуляций информативными являются ультразвуковая допплерография (УЗДГ) и транскраниальная допплерография (ТКД) [6,11,12]. По нашему опыту информативность УЗДГ возрастает, если использует комплексное исследование интракраниальных и экстракраниальных венозных коллекторов в сочетании с оценкой цереброваскулярной реактивности [7,13]. Под наблюдением находились 82 ребенка в возрасте 11-15 лет с жалобами на головные боли. Венозные дисгемии диагностировались на основании критериев, предложенных М.Я. Бердичевским [2] и нами [5,7]. Особенностью головных болей являлось возникновение ГБ в позах и положениях, которые затрудняют венозную гемоциркуляцию; уменьшение после мероприятий, улучшающих венозный отток из полости черепа: умеренной физической нагрузки, массажа головы и шеи, приема чая и мочегонных препаратов. Цефалгии часто сопровождались тошнотой и рвотой. В этиологии оценивали наличие флебопатий и других признаков соединительнотканной недостаточности у родственников, перинатальной патологии, шейного остеохондроза, черепно-мозговых травм. При осмотре обращали внимание на наличие признаков мезенхимальной недостаточности: астеническая конституция, бледность кожных покровов, телеангиоэктазии в области седьмого шейного позвонка, расширение подкожных вен на лице и шее, гипермобильность суставов, различные костные деформации (сколиоз, плоскостопие, короткая шея). В ряде случаев наблюдали характерную триаду: отечность лица в утренние часы, расширение подкожных вен головы и шеи, цианоз кожных покровов лица.
Ведущими причинами венозных дисгемий являлись: наследственно-конституциональная предрасположенность, проявляющаяся недифференцированными соединительнотканными дисплазиями, локализация которых преобладала в опорно-двигательном аппарате (до 62%) и сосудистой системе (56%), последствия перинатальной патологии (81%).
1. Клиника венозных дисгемий
Головная боль (ГБ) являлась ведущим симптомом у 98% обследованных больных. Чаще всего она возникала после ночного и/или дневного сна. Физиологические позы и положения, которые вызывают затруднения венозного оттока, провоцировали возникновение ГБ: работа с наклоном туловища, кашель, ношение тугих воротничков. ГБ была преимущественно диффузной, реже лобно-височной или затылочной локализации. У 5 пациентов она сочеталась с болезненностью глазных яблок с чувством распирания за ними. У 73% больных ГБ была средней интенсивности (4,7 ± 1,3 балла) по данным визуально-аналоговой шкалы дисфункций (ВАШ). У 27% пациентов боли были сильными (8,2 ± 1,2 балла по ВАШ), распирающего характера. Большинство больных испытывали облегчение после мероприятий, которые улучшают венозный отток из полости черепа: умеренной физической нагрузки, контрастного душа, массажа головы и воротниковой области, приема чая, отдыха на высоком изголовье (положительный симптом «высокой подушки»).
83% пациентов на фоне ГБ отмечали головокружение, которое чаще всего носило несистемный характер и у некоторых больных сопровождалось шумом в голове неопределенной локализации. Как правило, головокружение выявляли при активном опросе, дети описывали его как чувство неустойчивости и реже вращения в голове. Шум характеризовали как гудение проводов и шум леса. Головокружение обычно сопровождалось выраженной вегетативной симптоматикой: бледностью кожных покровов, гипергидрозом, тошнотой. Выраженных нарушений равновесия не наблюдали, но многие больные жаловались на ощущения нетвердости земли или пола при ходьбе.
Зрительные расстройства (43%) проявлялись кратковременным снижением остроты зрения, ощущением пелены, мушек перед глазами. Они возникали в период ГБ и не превышали по продолжительности нескольких часов, реже 2-3 суток. Длительное напряжение зрения вызывало головную боль и головокружение. 13% отметили усиление уже имевшей место близорукости, у 9% - ГБ сопровождалась диплопией, в большинстве случаев двоение не носило постоянного характера и возникало лишь на фоне интенсивной ГБ.
Метеозависимость различной степени выявляли у 50% детей. Она выражалась в усилении ГБ, снижении работоспособности, повышенной сонливости, а в выраженных случаях - в вегетативных кризах. Решающее значение принадлежало климатическим факторам (высокая влажность, низкое атмосферное давление), а также загрязнению воздушной среды и пассивному курению. Цефалгии провоцировались также контрастным изменением температуры окружающей среды. Обострения венозных дисгемий имели сезонную зависимость. Чаще всего (49%) они приходились на весенне-осенний период.
У 33% детей ГБ сопровождались тошнотой и рвотой. Рвота обычно возникала после сна, иногда многократно и приносила облегчение. У некоторых больных отмечалась только тошнота без последующей рвоты. У большинства детей после рвоты интенсивность головной боли снижалась.
Часто дети жаловались на ощущение заложенности носа, что связано с расширением вен носа. У 31% пациентов отмечали склонность к носовым кровотечениям, которые могли возникать на высоте ГБ, 29% больных жаловались на нарушения сна: повышенную сонливость, кошмарные сновидения, пробуждение от головной боли.
При объективном исследовании у 60% детей отмечали астеническое телосложение. Вместе с тем у 23% масса тела была избыточной (ожирение II степени) и сопровождалась признаками гипоталамической дисфункции. Она проявлялась жаждой и полидипсией - 11 %, гиперфагией с отсутствием чувства насыщения - 9%, задержкой роста и полового развития - 6%. У 55% испытуемых выявляли гипермобильность в трех и более пар суставов.
Не менее важны и широко освещенные в литературе [12], но трактуемые с разных концептуальных позиций костные деформации. Сколиоз разной степени выраженности отмечали у 52% больных, плоскостопие - у 27%, короткая шея - у 22%, Х- и О-образное искривление ног - у 22%, долихоцефалию - у 18%. 15% больных имели гидроцефальную форму черепа.
Расширение подкожных вен на лице и шее наблюдали у 43% пациентов, но отечность и цианоз кожи лица выявляли только у 11% и то лишь при выраженной венозной недостаточности. Отечность лица увеличивалась в утренние часы и уменьшалась после умеренной физической нагрузки. 35% детей имели повышенную эластичность кожи, у 11% пациентов в положении лежа отмечали систолический шум.
При неврологическом обследовании у 71% пациентов выявляли глазодвигательные нарушения: недостаточность конвергенции, трудность фиксации взора при взгляде в стороны, симптомом Гуревича - Манна, неравномерное стояние глаз при взгляде вверх; недоведение края радужки до наружного угла глаза отмечали у 18% детей, небольшое косоглазие - у 4%, анизокория - у 2% Неврологическая симптоматика была также представлена мышечной гипотонией (65%), повышением сухожильных рефлексов (59%), пошатыванием в позе Ромберга (37%), неуверенностью при выполнении пальценосовой пробы (34%), патологическими знаками: рефлексом Бабинского (27%), стопным рефлексом Россолимо (13%), кистевым рефлексом Россолимо (11%). У 13% детей отмечали нерезко выраженные менингеальные симптомы: болезненность глазных яблок при надавливании; скуловой феномен Бехтерева. Симптом «ликворного толчка» был положительным у 73% больных. Практически у всех детей присутствовала вегетативная симптоматика различной выраженности. Наиболее часто наблюдали изменение окраски кожных покровов (повышенная бледность, акроцианоз, мраморность, пятна Труссо, быстрая смена цвета кожи при эмоциях - «игра вазомоторов»), их влажности (дистальный или общий гипергидроз, повышенная сухость). У 67% пациентов была выявлена артериальная гипотензия, которая была особенно выражена в момент цефалгии. Эндокринно-обменные нарушения (ожирение, задержка роста и полового развития) отмечали у 29% больных.
Таким образом, выявленная неврологическая симптоматика указывала на преимущественное вовлечение в процесс верхнестволовых и гипоталамических структур головного мозга.
2. Ультразвуковая допплерография в диагностике церебральных венозных нарушений
Для изучения венозного оттока из полости черепа проводили допплерогра- фию яремных, глазных и позвоночных вен. Известно, что венозный отток осуществляется как по внутренним яремным венам, так и по позвоночным венам, причем соотношение между ними зависит от положения тела. Кроме того, при декомпенсации венозной циркуляции головного мозга отток из полости черепа может осуществляться по глазным венам [6,11].
В глазных венах кровоток в норме направлен в полость черепа к кавернозному синусу, сигнал характеризовался симметричностью и линейная скорость кровотока составляла 2-3 см/с. Для изучения свойств кровотока по глазной вене мы использовали компрессионный тест Миллера, заключавшийся в двухминутном прижатии лицевой вены у угла нижней челюсти на стороне исследования. У всех пациентов данная проба вызывала усиление кровотока в антероградном направлении.
При нарастании внутричерепной гипертензии интракраниальное венозное давление заметно начинает превосходить экстракраниальное, поэтому кровоток осуществляется из орбиты в наружные венозные коллекторы, то есть ретроградно в зону наименьшего сопротивления.
Для повышения внутричерепного давления мы использовали нитроглицериновую пробу и пробу Квеккенштедта. Действие нитроглицериновой пробы обусловлено фармакологическим влиянием препарата, вызывающего временное снижение тонуса и расширение внутричерепных сосудов, в результате чего повышается внутричерепное давление. У всех испытуемых сублингвальный прием 0,00025 г нитроглицерина и проба Квеккенштедта не меняли характера венозного кровопотока в глазной вене.
Кровоток по позвоночным венам в вертикальном положении зафиксировали у 29 человек из 30, в горизонтальном положении он отсутствовал у всех испытуемых. У здоровых в положении лежа основной венозный отток из полости черепа осуществлялся по внутренним яремным венам с ЛСК =1-2,5 см/с.
Кровоток в глазной вене изучали у 82 детей с симптомами повышения внутричерепного давления (ВЧД), ретроградное направление венозного кровотока было зафиксировано у 69, антеградное - у 13. При проведении нитроглицериновой пробы у пациентов с ретроградным направлением кровотока усиление венозного сигнала отмечали у 42 человек. У 12 больных с антеградным направлением кровотока никаких изменений после проведения пробы не отмечали, у одного пациента после нитроглицеринового теста направление кровотока изменилось на ретроградное. У 7 человек с ретроградным направлением кровотока на второй минуте после приема нитроглицерина возникла головная боль распирающего характера, шум в ушах, головокружение при переходе из горизонтального положения в вертикальное.
Проба Квеккенштедта проведена 10 пациентам, у 3 из них на 2-3 секунде после компрессии амплитуда венозного сигнала возрастала, но к 10-й секунде возвращалась к исходной величине. После окончания пробы амплитуда сигнала вновь возрастала, возвращаясь через 2-3 секунды к исходной. Это было расценено нами как ауторегуляторная стабилизация кровотока. У 7 больных компрессия яремных вен в течение 10 секунд вызывала увеличение ретроградного сброса без тенденции к компенсаторному снижению. Кровоток в позвоночных венах был лоцирован у 71 ребенка с ЛСК 3-4 см/с.
Выделено три степени венозной дисциркуляции в экстракраниальном бассейне.
Первая - характеризовалась ретроградным кровотоком в глазной вене равным 2-3 см/с, положительной пробой Миллера (после двухминутной компрессии лицевой вены направление кровотока в глазной вене менялось на антеградное), повышением пульсации яремных вен на 40-70%. Такое усиление венозного сброса было типичным для латентного течения ангиодистонического синдрома.
При второй степени венозной дисциркуляции отмечали усиление венозного оттока по глазным и позвоночным венам. Причем интенсивность ретроградного кровотока по глазным венам составляла 4—5 см/с, при отрицательной пробе Миллера (т. е. компрессия лицевой вены не позволяла послать объем крови в кавернозный синус). Пульсация яремных вен могла быть повышена или снижена.
Третья степень проявлялась интенсивным венозным сбросом (амплитуда сигнала ЛСК 7-9 см/с) по глазным и позвоночным венам и снижением пульсации в яремных венах. Данная степень венозной дисциркуляции была типичной для гипертензивно-гидроцефального синдрома и ДВЧГ.
Для изучения венозного оттока по глубоким венам мозга была проведена транскраниальная ультразвуковая допплерография базальной вены Розенталя и прямого синуса у 30 здоровых детей. Систолическая скорость кровотока (усредненная) по вене Розенталя составила 17 ± 3,2 см/с, по прямому синусу (ПС) - 22 + 5,7 см/с. Проба с ортостазом вызывала снижение кровотока по прямому синусу на 19 ± 5,5%.
В группе больных с ангиодистоническим синдромом скорость венозного оттока по вене Розенталя была 18 ± 4,3 см/с, по ПС - 23,7 ± 6,8 с м/с, ортостаз вызывал снижение кровотока по прямому синусу на 20 ± 7,1%.
У пациентов с гипертензивно-гидроцефальным синдромом скорость венозного сброса по вене Розенталя составила 22 ± 5,1 см/с, по прямому синусу - 41 ± 6,5 см/с. Ортостаз вызывал снижение кровотока на 45 ± 7,3%.
Венозный сброс в группе больных с ДВЧГ по вене Розенталя был 24 ± 4,3 см/с, по прямому синусу - 50 ± 7,8 см/с, снижение кровотока при ортостатической пробе составляло 50 ± 6,5%.
Таблица 27. Показатели ЛСК по венозным коллекторам мозга и реактивности при ортостатической пробе у пациентов с церебральной патологией.
|
Венозные коллекторы |
Контрольная группа (ЛСК см/с) |
Ангиодисто-нический синдром (ЛСК см/с) |
Гипертензивно гидроцефал ь-ный синдром (ЛСК см/с) |
ДВЧГ (ЛСК см/с) |
Достоверность различий | |||||
|
P1-2 |
P1-3 |
P1-4 |
P2-3 |
P2-4 |
P3-4 | |||||
|
Прямой синус |
22 ± 5.7 |
23.7 ± 6.8 |
41 ± 6.5 |
50 ± 7.8 |
>0.05 |
<0.01 |
<0.05 |
<0.01 |
<0.01 |
<0.05 |
|
Базальная вена Розенталя |
17 ±3.2 |
18±4.3 |
22 ±5.1 |
24 ± 4.3 |
>0.05 |
>0.05 |
<0.01 |
>0.05 |
<0.01 |
>0.05 |
|
Коэффициент ортостаза (прямой синус) |
0.81 + 0.03 |
0.8 ±0.07 |
0.55 ±0.07 |
0.5 ± 0.08 |
>0.05 |
<0.01 |
<0.05 |
<0.01 |
<0.01 |
>0.05 |
Таким образом, имеются достоверные различия (табл. 27) между венозным оттоком по прямому синусу у пациентов с нормальным (контрольная группа и больные с ангиодистоническим синдромом) и повышенным ВЧД (гипертензивно-гидроцефальный синдром и ДВЧГ). Увеличение венозного сброса по прямому синусу при гипертензивном синдроме обычно сочетается с нарушением реактивности на ортостатическую нагрузку, которое проявляется в более значительном по сравнению с нормой увеличении коэффициента ортостаза.
3. Патогенетические варианты формирования венозных дисгемий
Выделены три патогенетических варианта венозных дисгемий: экстракраниально-компенсированный, интракраниально-ликвородинамический и интракраниально-гемодинамический. Экстракраниально-компенсированный вариант отмечали у 51 ребенка с ангиодистоническим синдромом. В основе его, видимо, имеется снижение тонуса церебральных вен, обусловленное флебопатией, что приводит к венозному застою и включению альтернативных путей венозного оттока по глазным и позвоночным венам (рис. 96).
Компенсаторные механизмы приводят к возникновению достаточно устойчивой стабилизации интракраниального венозного давления. Срывы компенсации, проявляющиеся повышением ВЧД, отмечались редко, в основном при экстремальных воздействиях. Ребенок П., 12 лет. В течение 5 лет находился под наблюдением с жалобами на ГБ. Неоднократно выполняемая ТКД выявляла ретроградный кровоток по глазным венам с ЛСК 3-4см/с, и ЛСК по позвоночным венам в горизонтальном положении составила 4 см/с. Венозный отток по прямому синусу был 18 см/с. Поступил в стационар по скорой помощи с жалобами на сильную головную боль распирающего характера, многократную рвоту, искры перед глазами, которые появились после того, как на спор провисел на турнике вниз головой несколько минут. При проведении транскраниальной допплерографии наряду с имеющимися изменениями в экстракраниальной венозной системе, увеличилась ЛСК по прямому синусу до 60
см/с, который нормализовался после курса лечения, включающего венотоники и дегидратацию.
Интракраниально-ликвородинамический вариант нарушений венозного кровообращения отмечали в основном у 16 детей с гипертензивно-гидроцефальным синдромом. Он характеризовался усилением венозного сброса в экстракраниальных венах и по прямому синусу, расширением ликворосодержащих пространств и снижением денситометрической плотности вещества мозга в перивентрикулярной зоне.

Рис. 96. Схема формирования патогенетического экстракраниального-компенсированного варианта венозной дисгемии (Рв - интракраниальное венозное давление).
В основе ликвородинамических нарушений лежало затруднение оттока ликвора на уровне арахноидальных грануляций, обусловленное преимущественно перинатальной патологией, что приводило к повышению ВЧД, «манжеточному» сдавлению мостиковых вен и компенсаторному усилению венозного сброса в глубоких венах мозга (представлено на схеме рис. 97).
Усиления венозного сброса в прямом синусе, выявленные у больных с ангиодистоническим синдромом, отличались от подобных изменений при гипертензивно-гидроцефальном синдроме ортостатической устойчивостью, что свидетельствовало о компенсированном состоянии венозной гемодинамики. Иллюстрацией послужило следующее наблюдение: ребенок М., 15 лет. С 7 лет при перемене погоды отмечает появление головных болей умеренной интенсивности. Поводом обращения к врачу было усиление цефалгии после экзаменов в школе. При осмотре усилен венозный рисунок в височной области, телеангиэктазии в области шеи. В неврологическом статусе глубокие рефлексы равномерно повышены, тремор пальцев рук и век, дистальный гипергидроз. При ТКД отмечается усиление венозного сброса по прямому синусу до 42 см/с, ортостаз вызывает снижение ЛСК до 37 см/с. При КТ ликворосодержащие пространства нормальных размеров, денситометрическая плотность вещества мозга не изменена. Глазное дно в норме. Таким образом, ортостатическая устойчивость венозного оттока является дополнительным признаком компенсированного состояния ВЧД.

Рис. 97. Схема формирования патогенетического интракраниально-ликвородинамического варианта венозной дисгемии (Рл - ликворное давление).
Интракраниально-гемодинамический вариант нарушений венозного кровообращения отметили у 15 детей с ДВЧГ. Возможно, затруднение венозного оттока на уровне мозговых вен и лакун приводило к венозному застою, повышению интракраниального венозного давления и срыву ауторегуляции венозного кровообращения (подробно на рис. 98). Причиной затруднений венозного оттока чаще всего были последствия перинатальной патологии, которую отмечали у всех детей в анамнезе. Интракраниально-гемодинамический вариант характеризовался усилением венозного сброса по прямому синусу, нормальными или уменьшенными размерами ликворосодержащих пространств, увеличенной или нормальной денситометрической плотностью вещества мозга. Вероятнее всего, уменьшение размеров желудочковой системы у больных с ДВЧГ происходит благодаря набуханию мозга. Причиной набухания мозга может быть его отек, а также увеличение церебрального объема крови. Однако кровь имеет большую денситометрическую плотность, чем вода, и поэтому набухание мозга, сочетающееся с повышением его денситометрической плотности, может указывать на увеличение церебрального объема крови [15, 16].
Проведенный нами анализ установил, что ведущим в генезе венозных дистоний является своеобразная мезенхимальная дисплазия, которая приводит к развитию флебопатии. Среди наследственных заболеваний соединительной ткани значительное место занимает группа болезней, в основе которых лежат определенные и хорошо изученные генные дефекты. Эти заболевания проявляются четкой клинической симптоматикой и получили название дифференцированных мезенхимальных или соединительнотканных дисплазий [14]. Наиболее часто встречаемыми заболеваниями генной природы являются синдромы Марфана, Элерса-Данло, несовершенный остеогенез. Важно подчеркнуть, что частота выявления генетически чистых синдромов невелика. Мы наблюдали всего лишь одного больного с синдромом Марфана. В подавляющем же большинстве случаев набор фенотипических признаков у больных, обратившихся к нам, не укладывался ни в один из известных синдромов патологии соединительной ткани. Подобные случаи с полным основанием можно относить к недифференцированным синдромам соединительнотканной недостаточности, констатирующим изменения соединительной ткани вен.
В то время как в основе дифференцированных дефектов соединительной ткани лежит четкий генный дефект с определенным типом наследования, причиной недифференцированных соединительнотканных дисплазий принято считать мультифакториальные воздействия на плод в период его внутриутробного развития, способные вызвать дефекты генетического аппарата [14]. У больных кроме церебральных флебопатий часто отмечали изменения со стороны скелета и кожи, причем наследственно-конституциональная отягощенность была у 56% пациентов.

Рис. 98. Схема формирования патогенетического интракраниально-гемодинамического варианта венозной дисгемии.
Наиболее типичные регионы «венозного неблагополучия» - это диафрагмальные грыжи с расширением вен пищевода, варикоцеле и варикознижних конечностей. В детском возрасте эти проявления встречаются редко, лекомпенсация в этих венозных регионах начинается на третьем десятилетии жизни
Основными причинами венозных расстройств застойно-гипоксического характера при нарушении интракраниальных путей венозного оттока М.Я. Бердиевский [2] считает черепно-мозговые травмы с поражением синусов, мозговые инсульты опухоли головного мозга, мальформации мозговых сосудов недоразвитие сети мозговых вен и эмиссариев. тромбозы вен и синусов твердой мозговой оболочки. По нашим наблюдениям выходит, что основной интракраниальною причиной венозного застоя является гипертензивный синдром перинатального генеза. Повышенное ликворное давление приводит к компрессии мостиковых вен. затруднению венозного оттока по верхнему сагиттальному синусу и подъему венозного давления в глубоких венах мозга. Формируется порочный круг повышение ликворного давления - венозный застой - повышение ликворного давления.
В основе синдрома ДВЧГ, по нашим данным, лежат перинатальные гипоксически-ишемические процессы (КТ маркеры перенесенной ишемии - очаги пониженной плотности определяют в 70% случаев). Кислородная недостаточность и метаболический ацидоз приводят к расширению сосудов и формированию венозного застоя, который в свою очередь повышает ликворное давление. Формируется порочный круг венозный застой - повышение ликворного давления - венозный застой. Указанные изменения ликвородинамики являются компенсаторными и могут быть определены как гемоликворная гипертензия, что меняет тактику лечения этих детей (смещая акцент в терапии с дегидратации на ангиопротекторные и ноотропные препараты).
Проблема внутричерепной гипертензии занимает одно из ведущих мест в структуре заболеваемости детского возраста В последние годы одним из наиболее распространенных синдромов перинатальной патологии стали считать так называемый «гипертензивно-гидроцефальный» синдром Это привело к тому, что 2/3 детей первого года жизни педиатры направляют к неврологу на консультацию с таким синдромальным диагнозом при следующих клинических симптомах, общее беспокойство нарушение сна, тремор, срыгивания напряжение большого родничка, симптом. Грефе быстрый прирост окружности головы. Получается, для того чтобы поставить этот диагноз у ребенка дошкольного и школьного возраста требуется всего лишь наличие жалоб на головные боли, сопровождающиеся тошнотой и рвотой. Однако необходимо отметить что термин «гидроцефальный синдром» является структурным понятием Гидроцефальный синдром диагностируют только с помощью параклинических методов исследования (неиросонография эховентрикулометрия, КТ МРТ) клинические проявления его неспецифичны и в наших исследованиях были обусловлены резидуальной патологией мозга.
Гипертензивныи синдром - неирофизиологическии термин, включающий характеристику ликворного давления с учетом состояния мозговой ткани и объемов крови и ликвора. Определение истинного уровня гипертензии, по мнению детских неврологов [4] возможно только путем люмбальной пункции или оценки величины пульсации М-сигнала при энцефалоскопии. Вместе с тем, по нашим данным, люмбальная пункция проведена только у 1% детей с диагнозом гипертензивный синдром. Эхопульсация желудочков может представлять только относительную величину ВЧД.
По нашему мнению, более информативными неинвазивными методами косвенной оценки внутричерепного давления на сегодняшний день являются определение величины венозного сброса в прямом синусе с помощью ТКД и величины денситометрической плотности вещества мозга (на КТ). При этом мы различаем два варианта повышения ВЧД: ликвородинамический, при котором отмечается феномен «перивентрикулярного свечения» белого вещества головного мозга, и гемодинамический, проявляющийся нормальной или повышенной денситометрической плотностью (по данным КТ).
К экстракраниальным причинам венозного застоя М. Я. Бердичевский [2] относил опухоли средостения и шеи, остеохондроз шейного отдела позвоночника, травматические компрессии грудной клетки и живота, приводящие к компрессии верхней полой, яремных и позвоночных вен. А.Ю. Ратнер [17] у 20% детей, перенесших натальную травму шейного отдела позвоночника, выявил признаки венозной дисгемии, сопровождавшиеся интракраниальной гипертензией. У 3-х больных с ДВЧГ и признаками родовой травмы шейного отдела позвоночника мы не смогли лоцировать одну из позвоночных вен в вертикальном положении, что, вероятно, могло снижать компенсаторные возможности венозной системы.
Из заболеваний, приводящих к застойным явлениям в малом круге кровообращения, преобладала бронхиальная астма (7-8,5%).
Учитывая жалобы больных, результаты общеклинических и неврологических исследований, М.Я. Бердичевский [2] выделил следующие клинические синдромы церебральной дистонической венозной патологии: ангиодистонический, астеноневротический, психопатологический, псевдотуморозный, микроочаговый и беттолепсию. По нашему мнению, неверно относить псевдотуморозный синдром к дистоническим, так как при нем имеет место срыв компенсаторных механизмов венозной гемодинамики, что приводит к выраженному венозному застою, повышению внутричерепного давления, развитию при длительной гипертензии атрофического процесса в головном мозге и, возможно, к формированию клинической картины венозной энцефалопатии. При венозной же дистонии не возникает срыва компенсаторных механизмов, удерживающих ВЧД в норме, и, как отмечает сам М.Я. Бердичевский [2], выявляют лишь функционально-динамические нарушения без симптомов органического поражения головного мозга.
Нами выделены три клинических синдрома венозных дисгемий: ангиодистонический, гипертензивно-гидроцефальный и ДВЧГ (рис. 99), что позволяет более четко определять лечебную тактику и прогноз заболевания.
Клиника гипертензивного синдрома хорошо известна. Клиническая картина ДВЧГ у детей впервые подробно описана Е.М. Бурцевым и соавт. [8], который выделил следующие ее диагностические критерии: доброкачественность течения, резидуальный, преимущественно непрогредиентный характер патологии мозга, и клиническую триаду, проявляющуюся головной болью, нарушениями зрения и глазодвигательными расстройствами. Нам представляется дискуссионным постановка диагноза ДВЧГ только на основании клинических признаков без анализа гемоликвородинамической ситуации ТКД позволят оценить изменение градиентов давления между экстра- и интракраниальной венозной системой, поверхностными и глубокими венами головного мозга количественно оценить недостаточность «артериовенозного автомата». Эта информация помогает сделать вывод о диффузном венозном застое, который возможно, связан с флебопатией церебральных вен, а также с затруднением оттока по мостиковым венам на уровне субарахноидального пространства, первичном или вторичном по типу «манжеточного» сдавления при повышенном ликворном давлении.

Рис. 99. Схема формирования различных клинических форм венозных дисгемий.
В определении лечебной тактики мы ориентировались на клиническую картину и тип гемодинамических венозных нарушений. Допплеровский паттерн венозной дисгемии составляют:
1) включение альтернативных путей венозного оттока в экстракраниальную венозную систему (ретроградный кровоток по глазным венам, венозный сброс по позвоночным венам в горизонтальном положении);
- увеличение венозного сброса по прямому синусу >30 см/с;
- ортостатическая недостаточность регуляции венозного сброса по прямому синусу (уменьшение скорости кровотока при ортостазе >30%).
Это позволяет проводить патогенетически обоснованную терапию нарушений венозной гемодинамики, которые гораздо чаще играют ведущую роль в развитии сосудистых головных болей, внутричерепной гипертензии и дисцир- куляторной энцефалопатии, чем это диагностируют.
4. Вертебрально-базилярная недостаточность кровотока у детей
Несмотря на значительное количество публикаций, вопрос о доминирующем факторе в происхождении и развитии вертеброгенных цефалгии у детей остается актуальным и дискуссионным. Имеются данные о преобладании сосудистых проявлений при натальных повреждениях шейного отдела позвоночника [17-19], нарушениях миогенного характера [20]. По данным литературы, дисциркуляторные расстройства в вертебрально-базилярном бассейне составляют треть всех нарушений и до 70% преходящих нарушений мозгового кровообращения (ПНМК).
Синдром нарушения вертебрально-базилярной артериальной системы представлен в разделе преходящих транзиторных ишемических приступов (Международная классификация болезней, МКБ-Х,1993). Вертебрально-базилярная недостаточность (ВБН) определена как обратимое нарушение функции головного мозга, вызванное уменьшением кровоснабжения области, питаемой позвоночными и/или основной артериями. Предрасполагающими факторами развития ВБН являются стенозы, окклюзии, аномалии, экстравазальные компрессии позвоночных артерий (ПА), аномалии краниовертебрального перехода, деформации позвоночника.
У детей окклюзии ПА выявляют при родовой травме (кровоизлияния в позвоночную артерию). К аномалиям ПА относят аплазии, гипоплазии, патологическую извитость артерий. Редким является атеросклероз у детей старшего возраста, артериальная гипертония с хронической вертебрально-базилярной недостаточностью. Экстравазальные компрессии ПА могут возникнуть при дегенеративно-дистрофических процессах в шейном отделе позвоночника (ранний остеохондроз, деформирующий артроз, спондилез), краниовертебральных аномалиях (базилярная импрессия, дефекты зубовидного отростка второго шейного позвонка (СП), аномалии Арнольда-Киари, аномалии Киммерле). Возможно пережатие ПА нижней косой мышцей головы (при тоническом напряжении с последующей контрактурой), а также передней лестничной мышцей.
Доля родовых повреждений позвоночника, спинного мозга и позвоночных артерий в развитии ВБН у детей колеблется от 20-30% [21-24], однако симптомы декомпенсации церебральной гемодинамики начинают проявляться у детей в школьном возрасте. В наших наблюдениях 68% детей имели различные нарушения акушерского анамнеза, а начало головных болей совпало с усилением школьных нагрузок.
К повреждениям шейного отдела позвоночника (ШОП), ПА и спинного мозга могут привести акушерские пособия как при патологических, так и при нормальных родах (максимальное сгибание, разгибание головки, грубое выведение плечиков, тракция за головку). При операции кесарево сечение у 25-28% детей имели место различные повреждения, травмы головного и спинного мозга составляют 2% и 24% соответственно
Изучение возможных родовых повреждений в экспериментах на животных показало, что травму легкой степени тяжести ШОП вызывает сгибательно-компрессионные манипуляции с нагрузкой, превышающей массу тела в 5-10 раз, средней степени тяжести - в 10-15 раз, к травме тяжелой степени тяжести приводит увеличение нагрузки более чем в 15 раз. Грубые нарушения в ШОП могут возникнуть и при минимальной нагрузке, но при тракции плода с наклоном [25].
Для определения причин возникновения ВБН необходимо учитывать анатомические особенности строения шейного отдела позвоночника и позвоночных артерий. Функциональной единицей позвоночного столба является позвоночно-двигательный сегмент (ПДС), состоящий из двух смежных позвонков. Первый позвонок (CI) - атлант соединен с черепом с помощью атланто-окципитального сустава (образован суставными поверхностями атланта и мыщелками затылочной кости) - это верхний сустав головы. Второй шейный позвонок (СМ) - аксис имеет тело и зубовидный отросток. Два верхних позвонка соединены между собой атланто-аксиальным сочленением (сустав Крювелье). Зубовидный отросток с передней дугой атланта образует нижний сустав головы. Между позвонками CI и СМ межпозвонковый диск отсутствует. Позвонки CIN-CVII соединены межпозвонковыми дисками. Снижение высоты тела позвонка или диска является патологическим состоянием или пороком развития. Крючковидные отростки нижележащего позвонка образуют с телом вышележащего (кроме первого) унко-вертебральные сочленения. В ранней стадии остеохондроза у детей унко-вертебральные сочленения долгое время могут оставаться хрящевыми и рентгенонегативными [26].
Особенности кровоснабжения стволовых отделов мозга исследовались у детей многими авторами [27-29]. Артерии вертебрально-базилярного бассейна снабжают кровью ствол мозга, затылочные и медиобазальные отделы височных долей, лабиринт внутреннего уха [30-32]. Основная и позвоночные артерии (с передними спинальными артериями) на основании продолговатого мозга образуют малый артериальный круг (Захарченко). В первые два месяца внутриутробного развития каротидная и вертебрально-базилярная системы формируются независимо друг от друга, идет развитие множественных анастомозов корковых и глубоких ветвей передней, средней и задней мозговых артерий, образование артериального круга большого мозга (виллизиев круг) завершается на третьем месяце. В онтогенезе первыми васкуляризируются задние, более древние, затем средние и передние структуры головного мозга.
Позвоночная артерия берет свое начало в первой порции подключичной артерии, может начинаться справа от плечеголовного ствола или слева от аорты (3%). Артерия входит в канал позвоночной артерии через отверстия поперечного отростка шестого CVI позвонка (возможно вхождение с седьмого по второй). ПА располагается в канале (пространство вокруг артерии ограничено, с передней и наружной стороны костно-мышечными стенками, с задней и внутренней стороны - костными стенками) в общем фасциальном влагалище с позвоночными венами и симпатическим сплетением. ПА, на верхних поверхностях боковых масс атланта, перед входом в полость черепа под углом в 90°делают два изгиба, амортизирующие пульсовые толчки крови.
Позвоночную артерию L. Fisher [33] условно предложил делить на 4 участка:
V1 (превертебральный) - от устья до входа в поперечный отросток CIV позвонка; V2 (вертебральный) - в канале позвоночной артерии до выхода из СII; V3 (атланто-аксиальный) - участок от выхода из СП до входа в череп; V4 (интракраниальный сегмент) - участок от входа в череп до слияния в основную артерию.
Симптомы вертебрально-базилярной недостаточности могут возникнуть при подвывихе в атланто-осевом суставе, нарушениях в атланто-окципитальном сочленении, псевдоспондилолистезе (натального происхождения) и, возможно, связаны с раздражением синувертебрального нерва Люшка и крупнопетлистой периартериальной нервной сети позвоночной артерии [34].
Венозный отток крови от головного мозга в горизонтальном положении тела обеспечивает система яремных вен, в вертикальном - включаются и позвоночные вены. Строение позвоночных вен отличается разнообразием: в 20-30% случаев может присутствовать одна позвоночная вена, а также вены образуют единый футляр, внутри которого и проходит позвоночная артерия [32]. Позвоночные сплетения выполняют роль предохранительного клапана [35].
4.1. Клиника нарушений мозгового кровообращения в вертебрально-базилярном бассейне
Головная боль - наиболее часто встречающийся симптом, с которым обращаются к неврологу родители ребенка [45]. Характер и локализация головной боли отличаются большим разнообразием. ГБ может быть острая, локализованная, пульсирующего характера или тупая, постоянная, диффузная, в затылочной, височной, глазничной области. Часто дети жалуются и на боли в области шеи. Интенсивность головной боли оценивается по визуально-аналоговой шкале (ВАШ) дисфункций и обычно достигает 4-5 баллов.
Приступы спонтанного головокружения могут провоцироваться поворотами головы в шейном отделе позвоночника.
Боли в шейном отделе позвоночника - 2-4 балла по ВАШ с усилением при поворотах головы, неудобном или вынужденном положении головы, слабость в мышцах шеи и плечевого пояса, напряжение мышц шейно-затылочной области.
Синдром позвоночной артерии - задний шейный симпатический синдром описан Барре в 1925 г. [36], шейная мигрень [37] - это головные боли различного характера и интенсивности, чаще в затылочной области, сопровождающиеся головокружением, тошнотой, обмороками парестезии в зоне иннервации корешков CII-CIII. Длительность головной боли до суток. Нарушение мозгового кровообращения (преходящего характера) в вертебрально-базилярном бассейне проявляется зрительными (боль в глазах, пелена, фотомы, двоение, кратковременная слепота сужение и выпадение полей зрения), слуховыми (снижение с пуха, шум), вестибулярными (головокружения, пошатывания, тошнота, рвота, нистагм), мозжечковыми, проводниковыми (преходящий гемипарез, гипестезии), речевыми (гнусавость, дизартрия) расстройствами; поражением каудальной группы нервов и нижней ветви лицевого нерва. Приступы имеют яркую вегетативную окраску панастенический [38], гиперсомнический [39, 40] синдромы до панических атак (нарушение кровообращения гипоталамическои области).
Цервикальная недостаточность - гипотрофия мышц плечевого пояса, кривошея, ограничение поворотов головы защитное напряжение шеино-затылочных мышц, «крыловидные» лопатки, гипотония мышц рук до рекурвации в суставах.
Синкопальный вертебральный синдром Унтернхарншейдта представлен в двух вариантах в зависимости от глубины и степени ишемических нарушений ретикулярной формации ствола внезапная потеря сознания с общей мышечной гипотонией и синдром «drop-attak» - внезапная, острая слабость в конечностях при резком повороте головы без потери сознания [32 41]
Астеноневротический синдром - общая слабость, быстрая утомляемость ухудшение памяти, раздражительность; депрессивный синдром.
Интеллектуальная недостаточность как следствие хронических ишемических нарушений ретикулярной формации ствола мозга. А.В. Ситель. А.Ю. Нефедов [42] вводят понятие вертебрально-базилярной болезни (ВББ) и предлагают различать три её стадии Первые проявления вертебро-базилярной болезни (I стадия ВББ) обусловлены раздражением синовертебрального нерва Люшка и крупнопетлистой нервной сети ПА которое возникает из-за деградации межпозвонковых дисков с последующим изменением суставно-связочного и мышечного аппарата ШОП и образованием функциональных блокад позвоночных двигательных сегментов. Клиническим проявлением I стадии ВББ является наличие вегеталгических и ангиодистонических проявлений. Жалобы больного на быструю утомляемость, снижение работоспособности рассеянность (низкий тонус ретикулярной формации ствола), диффузные головные боли, не стойкие, частые редко локализуемые в половине головы, иногда легкую дурноту укачивание в транспорте плохую переносимость езды на лифте, эскалаторе, боязнь высоты. Часто жалобы на боли, шум, заложенность, чувство распирания, давления в ушах. Ощущение пелены перед глазами, нарушение сумеречного зрения, цветные вспышки и зигзаги. Локальные невыраженные боли в затылке и шее, за глазами. По данным транскраниальной допплерографии, асимметрия линейной скорости кровотока (ЛСК) по ПА не более 15%, при повороте головы в сторону, противоположную локации, отмечено снижение ЛСК до15%.
Во второй стадии ВББ функциональные блокады регистрируются во всех ПДС шейного отдела позвоночника. В клиническои картине доминирует головная боль, чаще постоянная Усиление головной боли в виде приступов сочетается с обилием вегетативно-сосудистых нарушений: чувство жара сердцебиение, озноб страх, тоска, панические атаки. При ТКД выявляют асимметрию кровотока по ПА от 30-50%, при функциональных пробах - снижение ЛСК по одной или обеим артериям ПА от 30 до 50% В III стадии ВББ функциональные блокады во всех шейных и сопряженных поясничных ПДС. Характерны приступообразные системные и несистемные головокружения, часто тошнота, рвота, головная боль. В этой стадии характерны приступы drop-attack. Частота приступов - 2-4 раза в год. В межприступный период наблюдают симптом Горнера или Пти, неустойчивость или падение в позе Ромберга, дисметрия, адиадохокинез. По ТКД асимметрия кровотока до 100% (спектр ЛСК по одной из артерий не выявляется; возможен только в систолу - феномен «биения», сопровождается характерным звуком). Проявлением ВББ в III стадии является синдром единственной позвоночной артерии и\или синдром гипоплазии позвоночной артерии. Таким образом, клиническим проявлениям острых ишемических нарушений мозгового кровообращения в вертебрально-базилярной системе нередко предшествует синдром позвоночной артерии или задний шейный симпатический синдром, который развивается при дегенеративно-дистрофических изменениях в шейном отделе позвоночника, влияющие на экстракраниальные отделы ПА и ее симпатического сплетения.
Наиболее частая жалоба детей на приеме у педиатра - головная боль. Вертеброгенные нарушения как одна из причин этих жалоб может стать этиологическим фактором развития дисциркуляторных нарушений кровообращения в вертебрально-базилярной системе.
4.2 Вертеброгенные головные боли
Термин «цервикогенные, вертеброгенные головные боли» (ВГБ) и их диагностические критерии до настоящего времени являются предметом дискуссии [46]. Дифференциальную диагностику ВГБ проводят с мигренью, головной болью напряжения. Определены закономерности: ограниченная локализация ГБ, с иррадиацией в лобно-орбитальную область, боль в области шеи, часто сопровождается ограничением движений в ШОП, болевыми ощущениями в руке и плече одноименной стороны. Отдельные авторы [45,46] отмечают локализацию вертеброгенной головной боли, преимущественно с одной стороны, но указывают навсегда имеющуюся с другой стороны головную боль меньшей интенсивности. Различают первичную (идиопатическую) и вторичную (натальная травма, кранио-цервикальные аномалии) вертеброгенную головную боль [47]. J. Jansen [48] связывает головную боль с сосудистой или рубцовой компрессией СИ корешка, ганглия или раздражение нижележащих корешков. Сосудистая компрессия может быть вызвана синусоидальным венозным сплетением, которое окружает корешок и ганглий, как манжетка. При электронной микроскопии выявляется дегенерация нервных фибрилл. Экспериментально установлено, что афферентные волокна от ганглия СП идут к стволу мозга. Этим объясняется распространение боли в лобно-орбитальную область.
Шейный остеохондроз и другие дегенеративные заболевания могут вызывать ГБ посредством других механизмов: компрессия твердой мозговой оболочки, сужение спинального канала, нестабильность, раздражение возвратного нерва Люшка. Е.Р. Щепеткова [49] предложила клинические маркеры при аномалиях ШОП у детей:
аномалия Киммерле - горизонтальный среднеразмашистый нистагм,
снижение слуха на оба уха, динамическая и статическая атаксия, расстройство чувствительности по полинейропатическому типу; асиммиляция атланта - спонтанный клонический нистагм в обе стороны, снижение слуха, гемипарезы, атаксия, афония, снижение глоточного рефлекса; базилярная импрессия - вертикальный мелкоразмашистый нистагм, сходящийся страбизм, снижение слуха, бульбарные растройства, атактический синдром;
при блоках первого и второго шейных позвонков - проводниково-спи- нальный тип расстройств чувствительности; аплазия атланта-атаксия, буль- барный синдром, полинейропатия; хотя такая точность градаций, по мнению Ю.М. Никитина, достаточно условна [44].
Атланто-аксиальные аномалии проявляются клинически при сдавлении спинного мозга [50]. У пациентов могут выявляться: нистагм, пирамидная недостаточность, мозжечковая симтоматика, вестибулярные нарушения. Особенно грубая симптоматика выявляется при сочетании кранио-вертебральных дисплазий с пороками развития головного мозга: аномалия Арнольда-Киари, с различной степенью смещения миндалин мозжечка в большое затылочное отверстие (частое сочетание у детей раннего возраста, со спинно-мозговой грыжей [53], с сирингомиелией или сирингобульией [51]. Отмечено наличие упорных цефалгий при данной патологии и у пациентов со spina bifida [52].
A.M. Вейн и соавт. [39, 40] отмечали, что вертеброгенная головная боль может иметь хроническое течение.
Классификация сосудистых цефалгий с выделением вертеброгенных (цервикогенных) головных болей [19] представляется наиболее патогенетически обоснованной, современной и удобной для врача педиатра.
Выделено 3 варианта цервикогенной цефалгии: 1) компрессионно-ириттивный у больных с признаками натальной травмы ШОП или соединительнотканной дисплазии; 2) гемодинамически значимой асимметрии - головные боли сопровождаются пароксизмальными нарушениями (зрительными, синкопальными, вегетативными кризами), соответствует клинике синдрома позвоночной артерии; 3) региональной ангиодистонии - преобладание ангиодистонических реакций в вертебрально-базилярном бассейне при проведении функциональных проб.
В классификации Казанской вертеброневрологической школы [43] эти нарушения объединены в два варианта: компрессионно-ирритативный и рефлекторно-ангиоспастический. И хотя всё разнообразие классификаций позволяет как-то систематизировать и сочетать изменения ШОП с разнообразием клинических проявлений, но тем не менее хотелось бы предостеречь специалистов от слепого постулирования и упрощения видимых причинно-следственных зависимостей из-за большой сложности исследуемой проблемы [44].
4.3. Вертеброгенные нарушения у детей
Развитие компрессионно-ирритативной формы цервикогенной ГБ у детей чаще всего, видимо, связано с компрессией ПА при остеохондрозе с нарушением ротации соседних позвонков, спондилолистезом, остеофитами, направленными в сторону артерии. Наличие у младших детей незначительных признаков раннего шейного остеохондроза может указывать на дискогенное
происхождение нарушений. У старших детей выраженные остеофиты CII-CVI, возможно, вызывают смещение и ирритацию ПА. При ротационных подвывихах атланта наблюдают напряжение, спазм нижней косой мышцы головы, натяжение крыловидных связок с последующей ирритацией ПА.
Головные боли могут провоцироваться движениями в шейном отделе позвоночника. В клинике преобладают стволовые симптомы (головокружение, тошнота, фотопсии, размытость изображения перед глазами, шум в ушах, свист, снижение слуха, неустойчивость походки, возникающие при форсированных поворотах головы), хруст в шее, болезненность CI-CII позвонков, кривошея, ограничение движений в ШОП, легкая асимметрия лица из-за длительной кривошеи, диффузная мышечная гипотония, дефанс шейных мышц, нарушение осанки. У детей отмечают рассеянность, невнимательность, плохую успеваемость в школе. При исследовании гемодинамических показателей преимущественно регистрируют снижение (более 20%) линейной скорости кровотока в позвоночной артерии.
Синдром позвоночной артерии. При ирритации ПА с гемодинамически значимой асимметрией у пациентов диагносцировали синдром Барре-Льеу (простреливающие гемикрании, боли в точке входа позвоночной артерии в череп, вегетативные кризы, обмороки). Приступообразные боли пульсирующего характера с иррадиацией в область орбит сопровождаются слезотечением, заложенностью носа, зрительными нарушениями (фотопсии, дефекты полей зрения). Но отсутствие семейного анамнеза, межприступного периода, облегчения состояния после антимигренозных препаратов, зависимость ГБ отизменений положения в ШОП, данные рентгенографии позволяют исключить диагноз мигрени или кластерной головной боли [20].
Последовательность возможных нарушений в вертебрально-базилярной системе представлена Н.В. Верещагиным [32]: синдром позвоночной артерии - синдром вертебрально-базилярной недостаточности - вертебро-базилярный инсульт.
Рефлекторно-ангиоспастическая форма. Чаще проявляется у детей младшей школьной группы при нестабильности позвоночника, соединительно-тканной дисплазии, аномалиях развития (аномалия Киммерле, синостозы в 2-х смежных позвонках). Дети жалуются на боли в шее, надплечьях, болезненность CIII-CV позвонков. Головные боли чаще возникают либо при форсированных поворотах, либо при длительной статической нагрузке на шею (при письме, игре на фортепиано, работе за компьютером). При исследовании кровотока в ПА выявлено преимущественное увеличение (более 30%) линейной скорости кровотока по ПА при поворотах головы.
При обследовани 450 детей в возрасте 7-16 лет с жалобами на головные боли у 44% детей определена связь головной боли с вертеброгенными нарушениями натального генеза. Сочетание вертеброгенных ГБ с ангиодистониями - у 16% больных, с венозными дисгемиями (интракраниальный вариант) - у 21% больных (а также 9% - мигрень, 10% - венозные дисгемии). Средний возраст - 11,2 + 2,3 года, частота ГБ - 2 ± 1,3 в неделю, длительность заболевания 5,2 ±2,1 года, интенсивность головной боли - 5,2 ±1,3 балла.
Предложен алгоритм проведения обследований детей в амбулаторных условиях. Наиболее информативными методами для выявления патологии ВББ, контроля за проводимой терапией являются транскраниальная допплерография и ретгенография ШОП с функциональными пробами.
(Рентгенографию шейного отдела позвоночника выполняли в прямой, боковой проекциях и через открытый рот).
У 75% детей отмечены множественные поражения в шейном отделе позвоночника (чаще в сегменте CI-CII): расхождение (до 3-4 мм) остистых отростков - у 41%, смещение зубовидного отростка аксиса - у 52% больных, непараллельность суставных щелей - у 23%, смещение атланта влево или вправо - у 48%, асимметрия суставных щелей - у 34%, выпрямление шейного лордоза - у 75%, патологический кифоз - у 12%, смещение позвонков в стороны, лестничное смещение - у 34%), наличие кривошеи - у 36%. Рентгенологические признаки раннего шейного остеохондроза были отмечены у детей старше 11 лет: уплощение шейного лордоза (синдром «струны» по Я.В. Цивьяну) - 75%, S-образное искривление позвоночника - 12%, задние остеофиты - 65%, уменьшение высоты тел позвонков в нижнешейном отделе (сочетание травматических и дистрофических нарушений) - 56%.
Аномалии развития выявлены у 12%: аномалия Киммерле-8%, Арнольда-Киари - 2%, сращение позвонков (синостоз) - 2%.
При транскраниальной допплерографии позвоночных артерий регистрировали нарушение ЛСК по ним у 85% детей (из них увеличение ЛСК - 97%). Нарушения венозного оттока по позвоночным сплетениям у 55%, из глубоких вен мозга - у 68% (преимущественно увеличение ЛСК по прямому синусу - 82%). При патологии в верхнешейном отделе CI-CII позвонков в 60% случаев регистрировали снижение скорости кровотока по ПА, при патологии среднешейно- го отдела (лестничное смещение, кифоз) отмечали ЛСК по ПА до 100 см/с, с резким уменьшением до 50% при функциональных пробах. Проведение дыхательных нагрузочных проб показало изменения цереброваскулярного резерва кровотока ствола мозга, более выраженное у детей младшего возраста.
Выявлено, что у детей с жалобами на боли в шее, затылке, хруст в шее при поворотах головы, нарушения кровотока в позвоночных артериях соответствовали субкомпенсированной стадии вертебрально-базилярной недостаточности: коэффициент асимметрии по ПА в положении головы прямо более 20%, при повороте - более 15%. Клинике декомпенсации соответствовали кризы с нарушением вегетатики, зрения, обмороками, синдром Унтернхарнштадта - асимметрия ЛСК по ПА от 50% [42].
При функциональных пробах ТКД и рентгенографии у 67% детей определена заинтересованность правой позвоночной артерии, что, возможно, связано с преобладанием первой позиции плода и прорезыванием головки с поворотом вправо, преимущественно правосторонней кривошеи у новорожденных детей, а также с различными родовыми травмами позвоночника. Эти данные представляют интерес для разработки профилактических мероприятий в школе, так как во время занятий (письменных) предполагается большая нагрузка на правую руку и длительная статическая (вынужденная) поза с поворотом головы вправо.
Таким образом, выделение вертеброгенных головных болей в группе сосудистых цефалгий является оправданным. Полученные данные о нарушениях не только в артериальном, но и венозном звене церебральной гемодинамики, глубоких венах мозга и прямом синусе представляют большой клинический интерес и предполагают изменение подхода в выборе терапии для этих детей.
Вертеброгенные цефалгии выделены в отдельную форму сосудистой церебральной патологии, но чаще, видимо, имеют место случаи сочетанных нарушений с венозными дисгемиями, причем не только с экстракраниальным вариантом (при нормальных значениях скорости кровотока в прямом синусе) [5], но и достаточно часто (по нашим данным - у 68% детей) с формированием интракраниального варианта венозных нарушений (82% из них связано с увеличением ЛСК по прямому синусу от 30 до 60 см/с, а 18% - со снижением ЛСК). Очевидно натальная травма у детей играет большую роль в возникновении дисциркуляторных нарушений, а пусковым механизмом заболевания, как правило, являются экстремальные воздействиями на ШОП (кувырки, запрокидывание головы, лазание по канату, длительная статическая нагрузка в неудобной позе, частые падения в школе и на улице). Клиническая картина определяется преобладанием артериальных или венозных нарушений, а также их сочетанием.
Срывы компенсаторных возможностей гемодинамики зависят и от состояния венозной системы, степени выраженности соединительнотканной недостаточности, и от перинатальных повреждений с ликворо- и гемодинамическими нарушениями, которые, являясь вначале следствием, в клинической и ультразвуковой картине нередко занимают главную роль.
Таким образом, нарушение венозного звена церебральной гемодинамики занимает одно из ведущих мест в сосудистой патологии у детей. Анализ причин головных болей у детей показал взаимосвязь нарушений кровотока в вертебрально-базилярном бассейне с поражениями шейного отдела позвоночника (врожденные аномалии и травматические повреждения). При этом назначение патогенетически обоснованной терапии возможно только с учетом анамнеза, особенностей клинической картины и данных инструментальных методов исследования. Транскраниальная ультразвуковая допплерография является простым, неинвазивным, высокоинформативным и доступным методом диагностики нарушений церебральной гемодинамики у детей и может быть рекомендована для широкого применения в педиатрии.
ГЛАВА 6
ТРАНСКРАНИАЛЬНАЯ ДОППЛЕРОГРАФИЯ В ДЕТЕКЦИИ ЦЕРЕБРАЛЬНОЙ ЭМБОЛИИ
Диагностика церебральной эмболии является сложной задачей, поскольку ни один из клинико-инструментальных признаков, связанных как с донорским источником, так и с реципиентной артерией, не является патогномоничным [1]. Только ультразвуковая допплерография обладает уникальной возможностью прямой детекции движения эмболического материала по сосудам головного мозга. Поскольку церебральная макроэмболия является редким событием, то при допплерографии регистрируют, главным образом, церебральные микроэмболы. При прохождении микроэмбола через лоцируемый сосуд возникает так называемый микроэмболический сигнал - МЭС (рис. 100).
Первое сообщение о регистрации эмболов с помощью ультразвука было сделано в 1965 году W.G. Austen и D.H. Howry, которые датчиком 2 МГц во время операции на сердце с использованием искусственного кровообращения зарегистрировали сигналы от эмболов [2]. В 1968 году М.Р. Spencer и S.D. Campbell [3] датчиком 5 МГц детектировали сигналы от воздушных микроэмболов в сосудах при изменении давления у моряков во время декомпрессии. В 70-е годы прошлого века была проведена серия экспериментальных работ по локации микроэмболов у животных с помощью импульсного ультразвука, но только после преодоления R. Aaslid et al. в 1982 году [4] экранирующего эффекта черепа открылась реальная перспектива зарегистрировать появление эмболов в сосудах мозга методом транскраниальной ультразвуковой допплерографии (ТКД). Так, в 1990 году М.Р. Spencer et al. [5] методом ТКД детектировали сигналы от материальных (солидных, твердых) микроэмболов в средней мозговой артерии (СМА) при операции каротидной эндартерэктомии.
В дальнейшем МЭС были обнаружены при целом ряде заболеваний и оказались частым событием. D. Georgiadis et al. [6] опубликовали данные о частоте детекции микроэмболических сигналов у пациентов с потенциальными кардиальными и каротидными источниками эмболии. Потенциальный нативный кардиальный источник (общая частота - 23%); инфекционный эндокардит - 43%; левожелудочковая аневризма - 34%; внутрисердечный тромб - 26%; дилатационная кардиомиопатия - 26%; неклапанная мерцательная аритмия - 21%; поражение клапанов сердца - 15%.

Рис. 100. Допплерограмма СМА. Показан допплеровский микроэмболический сигнал (стрелка).
Искусственные клапаны сердца (55%): механические - 58%; свиные - 43%; гомотрансплантатные - 20%.
Каротидный источник (28%): симптомный - 52%; асимптомный - 7%.
Для детекции церебральной микроэмболии используют длительный транскраниальный допплеровский мониторинг с инсонацией, как правило, одной или обеих средних мозговых артерий датчиком 2 МГц в течение 30-60 минут (или в течение хирургического вмешательства). Выбор СМА для эмболодетекции связан с более высокой вероятностью обнаружения в них микроэмболов. Во-первых, по средним мозговым артериям поступает около 80% крови в полушария мозга. Во-вторых, вследствие анатомических особенностей средние мозговые артерии являются непосредственным продолжением сонных артерий. В-третьих, среди всех интракраниальных артерий СМА лоцируют наиболее легко. Исследование выполняют в положении пациента лежа на спине с небольшой удобной подушкой под головой. После получения устойчивого сигнала от СМА датчик надежно фиксируют на голове пациента с помощью специального устройства (шлема). Производится визуальная оценка допплерограммы и оценка аудиосигнала (on-line), а также запись информации и последующий анализ (off-line) опытным исследователем. Методика является трудоемкой и требует больших временных затрат. Во время хирургических вмешательств осуществляется анализ в режиме реального времени (on-line), и звуковые сигналы при прохождении эмболов должны быть слышны хирургической бригаде.
Базовые критерии идентификации допплеровских микроэмболических сигналов были опубликованы Consensus Committee of the Ninth International Cerebral Hemodynamic Symposium в журнале «Stroke» в 1995 году [7].
- Допплеровский микроэмболический сигнал является транзиторным, длительность его обычно не превышает 300 мс.
- Амплитуда допплеровского микроэмболического сигнала обычно по крайней мере на 3 дБ выше фонового сигнала.
- Допплеровский микроэмболический сигнал располагается внутри допплеровского спектра и не пересекает изолинию.
- Допплеровский микроэмболический сигнал сопровождается звуковым сигналом, который в зависимости от применяемого допплеровского устройства может быть похож на «щелчок», «чириканье» или «стон».
С практической точки зрения одним из наиболее важных является вопрос дифференцировки микроэмболических и артефактных сигналов. Избежать появления артефактов, вызванных смещением датчика, работой диатермокоагулятора во время операции или другими причинами, практически невозможно. В этом случае также генерируются высокоинтенсивные транзиторные сигналы. Известен ряд дифференциально-диагностических признаков - артефакты пересекают изолинию и являются двунаправленными сигналами, максимум интенсивности артефактного сигнала сконцентрирован в области изолинии. При визуальном анализе сигналов опытным исследователем дифференцировка сигналов не вызывает трудностей, но сопряжена с большими временными затратами.
Среди методов автоматической детекции МЭС и их дифференцировки с артефактами в настоящее время наиболее распространен подход, базирующийся на использовании двух мощностных параметров - порога детекции и порога режекции. Порог детекции представляет собой такое относительное увеличение интенсивности сигнала по отношению к фоновому сигналу, которое позволяло бы расценивать его как микроэмболический. В качестве порога детекции рекомендуют значение относительного увеличения интенсивности до 7 дБ [8], поскольку такая величина порога обеспечивает хорошую воспроизводимость результатов детекции. Порог режекции представляет собой разницу интенсивности сигналов, обнаруженных вблизи изолинии по разные стороны от нее. Он позволяет исключать сигналы, пересекающие изолинию и, таким образом, являющиеся артефактными. Целесообразно выбирать близкие значения порогов детекции и режекции, то есть около 7 дБ. Такой метод детекции, к сожалению, не обладает высокой специфичностью. Необходимо учитывать, что газовые и крупные материальные микроэмболы могут продуцировать сигналы, превышающие по своей интенсивности динамический диапазон воспринимающего устройства, что ведет к его перегрузке. В этом случае МЭС могут выходить за пределы допплеровского спектра и пересекать изолинию, принимая артефактный вид [9]. Кроме того, массивная эмболизация может продуцировать серию микроэмболических сигналов, сгруппированных в кластер, что также затрудняет дифференцировку и корректный подсчет количества сигналов [10].
Новым подходом к автоматической дифференцировке микроэмболических и артефактных сигналов является многоглубинная транскраниальная допплерография. С помощью специального датчика обеспечивается локация одной церебральной артерии на нескольких глубинах. При этом микроэмболический сигнал регистрируется сначала в более проксимальных сегментах артерии, а затем - в более дистальных, с определенной временной задержкой, тогда как артефакт появляется одновременно во всех лоцируемых сегментах. Обычно используют двухглубинную инсонацию средней мозговой артерии с разницей глубин 10 мм при размере объема локации 5 мм. В этом случае получают временной порог, позволяющий автоматически отдифференцировать микроэмболические сигналы и артефакты (1 или 2 мс). При использовании многоглубинного мощностного М-режима продвижение микроэмбола по церебральной артерии вызывает появление тренда, направленного под углом к изолинии, тогда как артефакт характеризуется появлением вертикальной полосы. Специфичность многоглубинного метода детекции микроэмболии близка к 100%. Только многоглубинный метод позволяет достоверно детектировать высокоинтенсивные МЭС, вызывающие зашкаливание регистрирующего устройства, отличая их от истинных артефактов [11-13].
В отдельных случаях могут иметь место курьезные регистрации. Так, МЭС может появиться только в дистальном объеме локации или наоборот, что объясняют особенностями геометрии СМА. Такие парадоксальные регистрации снижают чувствительность метода [14]. К снижению чувствительности метода ведет также наличие в кровотоке МЭС с низким относительным увеличением интенсивности, вследствие чего такие МЭС могут быть автоматически не детектированы. Метод частотной фильтрации увеличивает чувствительность детекции [15].
В последнее время предложен ряд новых подходов, направленных на автоматическую дифференцировку МЭС и артефактов (оценка комплекса временных, частотных и энергетических параметров сигналов [16], оценка постэмболических спектральных паттернов [17] и другие). Однако по-прежнему «золотым стандартом» остается дифференцировка МЭС и артефактов опытным исследователем.
Определение состава и размеров эмболического материала на сегодняшний день остается предметом дискуссии и научно-технического поиска. Различают газовые (воздушные) и материальные (твердые, солидные) микроэмболы. Они обладают разным акустическим импедансом. Импеданс газовых микроэмболов значительно отличается от импеданса форменных элементов крови, а импеданс материальных микроэмболов близок к импедансу окружающей крови. В связи с разницей в импедансе газовые и материальные микроэмболы продуцируют допплеровские сигналы с различными характеристиками, и в первую очередь, это касается интенсивности сигнала. В экспериментальных и клинических исследованиях показано, что газовые микроэмболы продуцируют сигналы с большим относительным увеличением интенсивности, чем материальные микроэмболы. Однако такие взаимоотношения могут нарушаться вследствие различий и неопределенности их размеров. В то же время тенденция к большим значениям интенсивности сигналов при газовой микроэмболии существует, и многие авторы предпринимали попытки определения порога интенсивности МЭС, который позволил бы проводить дифференцировку состава микроэмболов. Были получены весьма противоречивые результаты, а в отдельных случаях заведомо нереальные пороговые значения при существующем динамическом диапазоне допплеровских устройств [9, 18].
D.W. Droste et al. [19] предложили новый оригинальный способ дифференцировки газовой и материальной микроэмболии, заключающийся в дыхании 100%-ным кислородом, что приводит к значительному снижению числа МЭС, связанных с газовыми микропузырьками, и не влияет на материальные микрочастицы.
Другим многообещающим решением стало использование многочастотного датчика, одномоментно инсонирующего артерию на двух ультразвуковых частотах - 2 МГц и 2,5 МГц. Показано, что газовые микроэмболы продуцируют разные по интенсивности сигналы при локации на двух частотах, а материальные частицы - сигналы с одинаковой интенсивностью [20].
Появились и другие методы дифференцировки газовых и материальных МЭС. Большинство из них использует альтернативные (не по Фурье) методы обработки сигнала (Wigner-Ville, wavelet) [21-23]. В 2002 году появились сообщения об испытаниях допплеровского датчика, инсонирующего сосуд одномоментно в широком диапазоне частот (от 50 КГц до 20 МГц). Экспериментальные исследования показали, что с помощью такого датчика можно не только дифференцировать газовые и материальные микроэмболы, но и определять размеры газовых микроэмболов. Исследователи признают, что для подтверждения полученных результатов необходимы более широкие экспериментальные и клинические испытания [24].
Состав материальных микроэмболов может быть весьма разнообразен: агрегаты тромбоцитов; фрагменты тромбов вегетаций и опухолей; атероматозные массы и жир; кальцинаты; синтетические материалы. Многие авторы сообщают что большинство материальных МЭС представляют собой агрегаты тромбоцитов и что назначение антитромбоцитарных средств вызывает их редукцию; в некоторых других случаях антитромбоцитарные средства оказываются неэффективными, что говорит о нетромбоцитарной природе МЭС в этих клинических ситуациях [25-27]
Проблема определения состава и размеров материальных микроэмболов на сегодняшний день не решена. В экспериментах показано, что увеличение размера эмбола ведет к увеличению интенсивности и продолжительности МЭС, однако структура эмболического материала (тромбы, агрегаты тромбоцитов, атероматозный материал, жир) также влияет на эти параметры (тромбоцитарные эмболы дают меньшую амплитуду и меньшую продолжительность сигнала, чем атероматозные эмболы такого же размера) поэтому оценить размер эмбола, исходя из характеристик сигнала возможно только при точном знании его состава, и наоборот. В реальной практике возникает задача с двумя неизвестными (невозможно различить сигнал от большого тромбоцитарного эмбола и сигнал от маленького атероматозного эмбола) [28]
Мы также предприняли попытку в эксперименте определить критерии дифференцировки структуры эмболического материала базируясь на мощностных и временных параметрах МЭС На специальном стенде производили допплеровскую детекцию воздушных пузырьков (диаметр 600-1000 мкм), жировых микрочастиц (диаметр около 600 мкм), микросвертков крови (диаметр 200-600 мкм) датчиком 2 МГц Не было получено достоверных различий в мощностных характеристиках и длительности МЭС при различной структуре эмболического материала (р>0,05) Лишь при визуальном анализе имелись некоторые различия - воздушные МЭС занимали широкую частотную полосу и имели вид вертикальных «полосок» а материальные МЭС располагались в узкой частотной полосе и по своей форме приближались к «овалу» или «кругу» [29].
Существует еще одна техническая проблема в допплеровской детекции церебральной микроэмболии - это несоответствие результатов, полученных разными исследователями на разной допплеровской аппаратуре. Приводимые в литературе цифры частоты обнаружения МЭС при одной и той же патологии существенно различаются, что ведет к дискредитации метода. Были предприняты крупные внутрицентровые и межцентровые международные исследования этой проблемы Результатом стало появление в 1998 году в журнале «Stroke» статьи «Consensus on microembolus detection by TCD», подготовленной International Consensus Group on Microembolus Detection [9] В ней обобщены технические параметры, влияющие на детектабельность МЭС.
1. Соотношение между энергией обратного рассеивания от эмболов и от крови (относительное увеличение интенсивности) может принимать различные значения для одного и того же эмболического сигнала при использовании различных способов измерения интенсивности.
2 Порог детекции (в настоящее время обычно используются пороги от 3 до 12 дБ) позволяет отдифференцировать МЭС от общего фонового шума и от спонтанных «пятнообразных» флюктуации интенсивности физиологических допплеровских сигналов потока. Установление низкого порога повышает чувствительность, но снижает специфичность детекции, а выбор высокого порога, наоборот, повышает специфичность, но снижает чувствительность детекции МЭС. Как было указано выше, целесообразно использовать порог 7 дБ.
- Размер объема локации существенно влияет на величину относительного увеличения интенсивности. Необходимо стремиться к использованию максимально малого объема локации.
- Частотное разрешение быстрого преобразования Фурье (БПФ). Обычно применяется частотная полоса 5 кГц.
- Временное разрешение БПФ находится в реципрокных отношениях с частотным разрешением и имеет большее значение для корректной регистрации МЭС, имеющих продолжительность от 10 до 100 мс. Обычно применяется временная развертка 6,4 с.
- Временное перекрытие при БПФ. При отсутствии перекрытия смежных временных окон (в старых системах) часть микроэмболов, попадающая в промежуток между окнами, может быть слышимой, но не визуализируемой на экране. В том случае, когда используются непрямоугольные окна и наложение окон составляет менее 50%, может происходить значительное снижение относительного увеличения интенсивности той части микроэмболов, которая приходится на область наложения окон.
- Динамический диапазон устройства.
- Передающая ультразвуковая частота в большинстве случаев - 2 МГц.
- Установки фильтров. Целесообразно пользоваться фильтрацией минимально.
- Время записи. 30-минутная регистрация достаточна при искусственных клапанах сердца. При других видах патологии регистрация должна продолжаться не менее 60 минут. Известны колебания интенсивности микроэмболии в течение часов, суток, дней. Поэтому необходимо либо еще увеличить время мониторинга, либо проводить повторные регистрации в течение одного дня или нескольких дней.
Таким образом, для того чтобы избежать дискредитации метода, необходимо хорошо представлять его ограничения и проблемы допплеровской детекции церебральной микроэмболии. В связи с этим рекомендовано придерживаться стандартных параметров регистрации или по крайней мере сообщать свои индивидуальные параметры по следующей схеме: 1) ультразвуковое устройство; 2) тип и размер датчика; 3) инсонируемая артерия; 4) глубина инсонации; 5) алгоритм для оценки интенсивности сигнала; 6) установки частотной шкалы; 7) порог детекции; 8) аксиальный размер объема локации; 9) БПФ размер (используемое число точек); 10) БПФ длина (время); 11) БПФ перекрытие; 12) передающая ультразвуковая частота; 13) установки высокочастотного фильтра; 14) время записи.
Главным в допплеровской детекции церебральной эмболии было и остается клиническое значение обнаруженных микроэмболических сигналов. По мере клинической оценки метода сложилось представление, что микроэмболы, лоцируемые с помощью ТКД, обычно не вызывают появления клинических симптомов но являются маркерами и предикторами опасной для головного мозга макроэмболизации [25. 30-34]. Одновременно в отдельных клинических наблюдениях обнаружился диссонанс. В одних случаях массивная эмболизация; например при операциях с использованием искусственного кровообращения или при наличии искусственных клапанов сердца, не вызывала отчетливого клинического эквивалента, в других - при явных клинико-инструментальных признаках церебральной эмболии МЭС не обнаруживали, например при инсульте на фоне мерцательной аритмии. Причинами такого несоответствия являются вышеназванные технические проблемы, а также гетерогенность эмболического материала. Так, красные тромбоэмболы не ассоциируются с появлением МЭС, хотя представляют собой наибольшую угрозу для головного мозга в связи с их крупными размерами [29] а газовые пузырьки, продуцирующие МЭС высокой интенсивности, наименее опасны. Они неустойчивы в потоке крови, могут растворяться а также проходить через микроциркуляторное русло [35, 36]. В то же время установлено, что длительная массивная микро-эмболизация обладает кумулятивным эффектом с развитием диффузной энцефалопатии и сосудистой деменции [25, 33].
Мы также изучали церебральные эффекты газовой эмболии в эксперименте на собаках [37]. Воздушные пузырьки диаметром 600-1000 мкм вводили в общую сонную артерию с помощью дозатора со скоростью 1 микроэмбол каждые три секунды, то есть 1 мл воздуха в минуту. Ультразвуковую регистрацию воздушных микроэмболов производили в интракраниальном сегменте внутренней сонной артерии. Параллельно осуществляли запись электроэнцефалограммы (ЭЭГ) с помощью игольчатых электродов.
Эмболизация бассейна левой внутренней сонной артерии на первых минутах не приводила к изменениям биоэлектрической активности головного мозга. Только на 25-30-й минуте от начала введения (25-30 мл воздуха, 1500- 1800 микроэмболов) появлялись электроэнцефалографические изменения в виде постепенного снижения вольтажа ЭЭГ, появления среднеамплитудной дельта-активности в передних отделах правого полушария. Впоследствии наступало полное угнетение всех видов активности и регистрировалась «плоская» кривая Таким образом массивная воздушная эмболия церебральных артерий вызывает выраженное ишемическое повреждение головного мозга. Однако требуется достаточно большой объем вводимого воздуха для развития тяжелых необратимых изменений, и патологические изменения появляются не сразу.
Во время эксперимента мы зарегистрировали микроэмболические сигналы в яремных венах, а также обнаружили воздушные пузырьки в сосудах практически всех внутренних органов на аутопсии Постепенное накопление критической массы микроэмболов в циркуляции, вероятно, и обуславливает отсроченность поражения а также его системность.
Наиболее глубоко микроэмболизация изучена у больных с искусственными клапанами сердца (ИКС). В последние годы доминирует представление о газовой природе эмболов. Появление пузырьков связывают с образованием областей низкого давления (областей кавитации) во время работы механического протеза, что провоцирует выход газов крови из раствора. Появление этой теории непосредственно связано с внедрением транскраниальной допплерографии в диагностический процесс, когда возможности допплеровской детекции церебральной эмболии были использованы для обследования пациентов с искусственными клапанами сердца. В результате была выявлена высокая частота детекции МЭС и их большое количество у данной группы пациентов, что не согласуется с частотой клинически манифестных церебральных ишемических событий. D. Georgiadis et al. [38-40] приводят множество аргументов в пользу газовой природы микроэмболов у больных с механическими ИКС: 1) отсутствие корреляции МЭС с интенсивностью антикоагулянтной терапии и показателями свертывания крови; 2) мощность МЭС значительно (примерно в 5 раз) выше у пациентов с механическими клапанами, чем у пациентов с биологическими клапанами или атеросклеротическим поражением сонных артерий; 3) количество МЭС остается стабильным с течением времени; 4) значительно большее количество МЭС детектируют в общей сонной артерии, чем в средней мозговой артерии; 5) МЭС детектируют в яремных венах; 6) количество МЭС уменьшается в экспоненциальной зависимости или они полностью элиминируются при ингаляции 100% кислорода; 7) гипербарическая компрессия влияет на количество МЭС.
Показано более высокое число МЭС у детей с механическими ИКС, что авторы объясняют меньшим расстоянием от сердца до средней мозговой артерии, вследствие чего меньшее количество пузырьков успевает раствориться, а также более высокой частотой сердечных сокращений у детей, что ведет к образованию большего количества пузырьков [41].
Установлено также отсутствие связи частоты встречаемости и количества МЭС с размером клапана, давностью протезирования, наличием нарушения ритма сердца, возрастом пациента, а также с наличием церебральных ишемических расстройств, что поставило под сомнение клиническую значимость детекции МЭС. Была выявлена лишь связь с типом искусственного клапана сердца [39, 42, 43].
Сторонники газовой природы микроэмболов, отрицающие их роль в развитии церебральных ишемических событий, вместе с тем показали связь длительной микроэмболизации с развитием когнитивных нарушений [44, 45].
В настоящее время увеличилось число работ, в которых, наряду с признанием возможности образования микропузырьков, авторы указывают на очевидное присутствие материальных микроэмболов (главным образом, агрегатов тромбоцитов) у пациентов с механическими ИКС, которые и обладают (в отличие от газовых микроэмболов) клинической значимостью, предопределяя развитие клинической манифестации, а также могут контролироваться антитромбоцитарными препаратами [20, 46-48].
Мы также изучали церебральную эмболию у пациентов с механическими ИКС [29] и получили следующие результаты: 1) МЭС зарегистрированы у 22,7% пациентов; 2) эмболическая нагрузка на головной мозг составляла от 2 до 15 МЭС за 30 минут, в среднем - 6,9 ± 4,3 МЭС; 3) относительное увеличение мощности МЭС составляло от 7 до 22 дБ (большинство менее 15 дБ), в среднем - 13,2 ± 4,0 дБ; 4) позиция клапанного протеза и давность протезирования не влияли на частоту обнаружения и количество МЭС (р>0,05); 5) интенсивность пероральной антикоагулянтной терапии и величина протромбинового индекса не коррелировали с МЭС (р>0,05); 6) выявлена сильная корреляционная связь наличия (р<0,001) и числа (р<0,001) МЭС с дисфункцией ИКС; 7) в результате антитромбоцитарной терапии происходило снижение количества МЭС (р<0,05): у 50% пациентов МЭС исчезли, у 25% - их количество уменьшилось, у 25% - количество МЭС не изменилось или увеличилось, при этом имелась тенденция к увеличению мощности МЭС или она была исходно высокой; 8) частота регистрации МЭС среди пациентов с ишемическими НМК составила 35,3%, она значительно превышала частоту детекции МЭС у пациентов без НМК(19,4%), хотя различия не достигли уровня статистической значимости (р>0,05); 9) у большинства пациентов (66,7%) церебральные ишемические нарушения возникали при нарушении режима антикоагулянтной терапии; 10) МЭС не регистрировали у 64,7% больных с ишемическими НМК в анамнезе; 11) у пациентов с МЭС и церебральными ишемическими нарушениями в анамнезе, развившимися при адекватной антикоагулянтной терапии, назначение антитромбоцитарных средств приводило к редукции МЭС; 12) у пациентов с МЭС, но без церебральных ишемических НМК в анамнезе, назначение антитромбоцитарных средств в большинстве случаев не приводило к редукции МЭС.
Анализ полученных данных показал, что эмболический материал при ИКС гетерогенен. Он может состоять из красных (фибрин-зависимых богатых эритроцитами) тромбов, белых (фибрин-тромбоцитарных) тромбов (или агрегатов тромбоцитов), газа. Красные тромбы вследствие больших размеров представляют главную угрозу для головного мозга и требуют назначения непрямых антикоагулянтов, они не ассоциируются с МЭС. Белые тромбы также опасны для головного мозга, они ассоциируются с МЭС и требуют назначения антитромбоцитарных препаратов. Кавитационные пузырьки также ассоциируются с МЭС, но не представляют серьезной угрозы для головного мозга.
При изучении микроэмболизации у пациентов с мерцательной аритмией с помощью ТКД-мониторинга D.G. Nabavi et al. [26] обнаружили МЭС у 30% пациентов с неклапанной мерцательной аритмией, D. Georgiadis et al. [6] - у 21%, а М. Cullinane et al. [49] - у 15,1%. В то же время МЭС не были обнаружены у пациентов с идиопатической мерцательной аритмией [50]. Кроме того, установлена корреляция МЭС с показателями активности тромбоцитов у пациентов с мерцательной аритмией [26], а как известно, при мерцательной аритмии в основе образования красного тромба лежит активация коагуляционных каскадов, а не активация тромбоцитов. Все это ставит под сомнение самостоятельную роль мерцательной аритмии в генерации микроэмболов. По всей видимости, появление МЭС при мерцательной аритмии связано не с образованием красного тромба, а с наличием дополнительных источников эмболии (возможно, клапанных) [29].
Общепризнано, что ТКД является незаменимым методом детекции артерио-артериальной микроэмболизации. Установлено, что при стенозах церебральных артерий частота детекции МЭС и их количество выше в бассейне сосуда с симптомным стенозом [51-53]. Кроме того, частота микроэмболии и количество микроэмболических сигналов прямо коррелирует со степенью стеноза [51, 53-57]. Также выявлена корреляция частоты и количества МЭС с наличием изъязвленной атеросклеротической бляшки, даже в отсутствие гемодинамически значимого стенозирования сонной артерии, а также с внутрипросветным тромбом [31, 56-58]. Появились сообщения о более высокой частоте детекции и количестве МЭС при эхонегативных бляшках [59-61], хотя другие исследователи не обнаружили связь между эхогенностью атеросклеротической бляшки и наличием и количеством МЭС [55].
Мы изучали артерио-артериальную эмболизацию у пациентов со случайно зарегистрированными МЭС при компрессионных каротидных пробах. При последующем дуплексном сканировании во всех случаях обнаружили морфологически нестабильные атеросклеротические каротидные бляшки. Спонтанные МЭС при 60-минутном ТКД-мониторинге были обнаружены лишь у 20,9% пациентов этой группы. У 45,9% пациентов в анамнезе указание на ПНМК из них в 94,1% случаев латерализация МЭС и бассейна ишемического НМК совпадала (при повторных ишемических нарушениях в 100% случаев). Очаговая неврологическая симптоматика (постинсультная и на фоне дисциркуляторной энцефалопатии без анамнестических церебральных ишемических событий), ипсилатеральная к МЭС, обнаружена у 59,5% пациентов, контралатеральная - только у 5,4%. Мы проанализировали связь между латерализацией МЭС, с одной стороны, и латерализацией ПНМК и наличием очаговой неврологической симптоматики, с другой. Обнаружена умеренная корреляционная связь между латерализацией МЭС и латерализацией ПНМК (р<0,001), а также латерализацией очаговой неврологической симптоматики (р<0,001). При этом не обнаружена связь между степенью стенозирования сонной артерии, содержащей эмбологенную бляшку, с одной стороны, и ПНМК и очаговой неврологической симптоматикой, с другой (р>0,05). То есть артерио-артериальная эмболия у пациентов с атеросклеротическим поражением сонных артерий является независимым и ведущим фактором в развитии ишемического повреждения головного мозга [29].
Установлено, что количество детектируемых микроэмболических сигналов существенно возрастает во время развития церебральной ишемии (в первую очередь, в бассейне симптомной артерии) и затем постепенно снижается с течением времени, соответственно микроэмболические сигналы более часты у пациентов с острым развитием неврологической симптоматики, обусловленной ишемией мозга [31, 53, 55, 62-64].
Цветовая допплеровская сонография магистральных артерий головы и ТКД-мониторинг интракраниальных артерий показали, что атеросклеротическая бляшка, являясь потенциальным источником эмболии, становится активной, то есть продуцирующей эмболы, только в ограниченные промежутки времени, лишь тогда она может стать опасной в развитии эмбологенной ишемии мозга [62, 64].
Во многих проспективных исследованиях показано, что пациенты со значительным числом регистрируемых асимптомных микроэмболических сигналов с большей вероятностью претерпевают клинически значимую церебральную ишемию, в том числе повторную [30-32, 34].
Транскраниальный допплеровский мониторинг демонстрирует снижение частоты и количества МЭС при антиагрегантной терапии (аспирин, тиклопидин, клопидогрель), что указывает на тромбоцитарную природу микроэмболов, и позволяет рассматривать допплеровскую детекцию церебральной микроэмболии в качестве метода оценки эффективности проводимой антитромбоцитарной терапии [54, 65-67].
Основными периоперационными неврологическими осложнениями каротидной эндартерэктомии являются цереброваскулярные расстройства, причиной которых в большинстве случаев является эмболия [68]. Микроэмболы регистрируют почти при каждой каротидной эндартерэктомии [68-70]. Микроэмболия может возникнуть на любом из этапов операции. Во время доступа появление материальных микроэмболов связано с наличием внутрипросветного белого тромба, ульцерации каротидной атеросклеротической бляшки, а также с транзиторными ишемическими атаками или инсультом в анамнезе и, соответственно, чаще наблюдается у симптомных пациентов [5, 29, 71] (рис. 101). Материальная и газовая микроэмболизация возникает при постановке и открытии шунта, а во время шунтирования регистрируют материальные микроэмболы. Значительное число как материальных, так и газовых микроэмболов фиксируют при освобождении сонной артерии от пережатия с финальным возобновлением кровотока [5, 29, 68, 69, 72] (рис. 102).
Количество микроэмболов во время операции имеет статистически значимую связь с периоперационными церебральными ишемическими нарушениями [68, 71, 73, 74]. Появление более 10 микроэмболов во время доступа статистически значимо связано с периоперационными церебральными осложнениями и появлением новых ишемических изменений на КТ и МРТ головного мозга, как правило, это мелкие очаги измененного сигнала [71, 73, 74]. Микроэмболия во время шунтирования ассоциируется с интраоперационными церебральными осложнениями [68, 73, 75], хотя C.R. Levi et al. [70] не нашли ассоциации между интраоперационными микроэмболическими сигналами и клиническим исходом.
Предотвращение эмболических осложнений зависит, главным образом, от качества выполнения хирургических манипуляций [68, 72]; иногда необходимо увеличить количество вводимого гепарина или использовать декстран [68].

Рис. 101. Допплерограмма СМА. МЭС во время пробного пережатия ипсилатеральной оперируемой сонной артерии (показан стрелкой).

Рис. 102. Допплерограмма СМА. Множественные МЭС при снятии зажима (момент снятия указан стрелкой) с ипсилатеральной оперируемой сонной артерии.
Исследования, сравнивающие частоту и интенсивность микроэмболизации при различных видах каротидной эндартерэктомии, показали, что послеоперационная микро-эмболизация при эверсионной эндартерэктомии ниже, чем при стандартной операции [69]. После операции поступление микроэмболов в мозг может сохраняться в течение некоторого времени, достигая у отдельных пациентов 50 и более МЭС в час, хотя количество их достаточно быстро снижается. Массивная послеоперационная эмболизация является предиктором ипсилатеральной фокальной церебральной ишемии [5, 70, 76], а в случаях отсутствия послеоперационного снижения интенсивности микроэмболии или ее нарастании ставится вопрос о ревизии сосуда и, возможно о повторной операции [5, 77].
Проведенное нами исследование показало, что длительно сохраняющаяся послеоперационная микроэмболизация являлась одним из ведущих факторов риска развития периоперационных ишемических НМК. Наиболее устойчивая микроэмболизация наблюдалась после операций на сосудах мозга с использованием шунтов или заплат из искусственного материала. МЭС не регистрировали после эверсионной эндартерэктомии, вероятно, вследствие турбулентности в оперированной артерии [29].
Проведение допплеровского мониторинга способствовало снижению частоты и тяжести неврологических осложнений в тех центрах, которые в течение многих лет его используют. Хирурги под влиянием звуковых сигналов, слышимых во время операции, могут модифицировать технику манипуляций для прекращения или уменьшения поступления микроэмболов в сосуды головного мозга [68, 72, 73] Послеоперационный ТКД-мониторинг позволяет также оценить результат каротиднои эндартерэктомии с точки зрения устранения источника церебральной эмболии. Продолжение микроэмболизации требует ревизии оперированной артерии или поиска другого потенциального источника церебральной эмболии [77].
В последние годы в клиническую практику активно входит ангиопластика со стентированием. Если при стенозах подключичной артерии эту манипуляцию используют давно и успешно, то для коррекции поражений сонной артерии основным препятствием к ее широкому использованию является интраоперационная эмболизация церебральных сосудов [78]. Такая эмболизация, по данным ТКД-мониторинга, имеет место у подавляющего большинства пациентов в момент раздувания баллона и в течение нескольких минут после его сдувания, при установке стента, а также при введении катетера в сонную артерию и его извлечении. В то же время в большинстве случаев она остается асимптомной [79. 80]. Сообщают об отсутствии МЭС в отдаленном периоде после стентирования [81].
Поскольку в составе эмболического материала, образующегося при ангиопластике, присутствует нетромботический материал (кристаллы холестерина, жир, кальцинаты), проведение только антитромботической терапии не предотвращает эмболизацию [27]. Для снижения микроэмболизации во время ангиопластики и стентирования в последнее время применяют различные протективные технологии. Например, используют системы с временной окклюзией дистального участка сонной артерии с последующим промыванием и аспирацией эмболического материала через аспирационныи катетер [27, 82], применяют специальный фильтр-ловушку, размещаемый в дистальном участке сонной артерии [78] или стентирование до раздувания баллона [83] Нельзя исключить газовый характер эмболии при выполнении процедур баллонной ангиопластики или вальвулопластики Возможной причиной образования пузырьков может быть эффект кавитации [84], а также дефект стенки баллона со стравливанием воздуха в сосудистое русло [85].
С первых лет клинического применения метода ТКД изучались возможности ее использования в качестве инструмента для мониторинга церебральной гемодинамики во время операций на сердце. Padayac-hee et al. [86] использовали транскраниальную допплерографию для детекции газовых микроэмболов в СМА пациентов, перенесших искусственное кровообращение с пузырьковым оксигенатором без фильтрации на артериальной линии. При мониторировании ЛСК в средней мозговой артерии во время искусственного кровообращения они отметили «прерывания» допплеровского сигнала и сделали вывод, что эти высокоамплитудные сигналы нарушения потока являлись результатом прохождения микропузырьков, генерируемых в пузырьковых оксигенаторах. Последующие экспериментальные исследования подтвердили эту концепцию.
Ряд исследователей, использовавших ТКД СМА во время искусственного кровообращения, обнаружили, что постановка аортальной канюли ассоциировалась с газовой микроэмболией (рис. 103). Пузырьковые оксигенаторы являлись источниками газовых микроэмболов на протяжении всей операции. При использовании мембранных оксигенаторов микроэмболы фиксировали во время запуска искусственного кровообращения и не детектировали во время полного искусственного кровообращения [86, 87]. Georgiadis D. et al. [88] выявляли наличие микроэмболов и при использовании мембранных оксигенаторов. Мы также обнаруживали микроэмболизацию СМА при использовании мембранных оксигенаторов (рис. 104). В отдельных случаях она имела массивный характер и, вероятно, была связана с нарушением герметичности контура циркуляции в месте соединения артериальной линии аппарата искусственного кровообращения с аортой (рис. 105) [29].

Рис. 103. Допплерограмма СМА. МЭС при канюля- ции аорты (показаны стрелками).

Рис. 104. Допплерограмма СМА. МЭС во время полного искусственного кровообращения (показаны стрелками).

Рис. 105. Допплерограмма СМА. Массивная микроэмболизация во время полного искусственного кровообращения (до 10 МЭС за одну секунду).
Установлено, что артериальная фильтрация снижает количество МЭС. Использование 25-микронного фильтра сопровождается меньшим числом МЭС, чем при использовании 40-микронного фильтра [89]. Также выявлена зависимость количества МЭС от применяемого метода кардиоплегии. Число МЭС выше при ретроградной теплой кардиоплегии, чем при антеградной теплой и холодной кардиоплегии [90].
Существенно большее число МЭС детектируют во время протезирования клапанов сердца (в среднем - 1000-3000), чем во время аорто-коронарного шунтирования (в среднем - 100-300) [88. 91]. Во время протезирования большое число МЭС (85%) регистрируют во время восстановления сердечной деятельности (рис 106) тогда как при аорто-коронарном шунтировании - при пережатии аорты (18%) и снятии зажима с аорты (13%) (рис. 107) Во время полного искусственного кровообращения количество детектированных МЭС одинаково при этих двух видах вмешательств [87 91, 92] В некоторых случаях мы регистрировали массивную микроэмболизацию («ливень» микроэмболов) во время снятия венозных линий аппарата искусственного кровообращения, что также обусловлено нарушением герметичности контура циркуляции (рис. 108) [29].
WR Brown et al, [93] показали, что с увеличением длительности искусственного кровообращения количество МЭС прогрессивно увеличивается, поскольку микроэмболы фрагментируются, становятся более мелкими и проходят через капиллярную сеть, вновь поступая в системную циркуляцию.
В последнее время операции аорто-коронарного шунтирования все чаще выполняют на бьющемся сердце без использования искусственного кровообращения, Интраоперационный ТКД-мониторинг показал, что такие операции сопровождаются значительно менее интенсивной церебральной эмболизацией, чем операции с использованием искусственного кровообращения, но при этом возрастает риск развития интраоперационных аритмий и неустойчивости церебрального перфузионного давления [94].
Интраоперационный ТКД-мониторинг играет чрезвычайно важную роль в ходе кардиохирургического вмешательства поскольку он информирует хирургическую бригаду о появлении микроэмболов, что позволяет принять своевременные превентивные меры [91].

Рис. 106 Допплерограмма СМА. Регистрация большого числа МЭС при восстановлении сердечной деятельности

Рис. 107. Допплерограмма СМА Регистрация большого числа МЭС после снятия зажима с аорты (момент снятия указан стрелкой).

Рис 108. Допплерограмма СМА. «Ливень» МЭС при снятии венозных линии аппарата искусственного кровообращения
Установлена связь между количеством регистрируемых МЭС и тяжелыми неврологическими осложнениями, а также нейропсихологическим дефицитом после операций на сердце с искусственным кровообращением [37, 88, 95].
Таким образом, метод допплеровской детекции церебральной эмболии уже занял свое прочное место в клинике. Его возможности продолжают активно изучаться, в том числе и отечественными исследователями [29, 37, 59, 96-99] Преодоление ряда технических и клинических проблем позволит обеспечить широкое и эффективное использование данного метода в повседневной медицинской практике.
ГЛАВА 7
ЦВЕТОВОЕ ДУПЛЕКСНОЕ СКАНИРОВАНИЕ В ДИАГНОСТИКЕ ПАТОЛОГИЧЕСКОЙ ИЗВИТОСТИ ВНУТРЕННИХ СОННЫХ АРТЕРИЙ
В связи с развитием ультразвуковой диагностики сосудистых заболеваний головы изменились представления о распространенности и значимости патологической извитости сонных артерий в качестве причины нарушений мозгового кровообращения. Среди взрослых с нарушениями мозгового кровообращения патологическая извитость (ПИ) внутренних сонных артерий (ВСА) по распространенности уступает только атеросклеротическому поражению [1]. Еще чаще ПИ ВСА наблюдали у детей с клиническими признаками нарушения мозгового кровообращения [2]
Особенностью диагностики патологической извитости ВСА является то, что эти изменения выявляют обычно при ультразвуковом обследовании, что требует хорошей подготовленности и информированности о сущности данной патологии специалистов по ультразвуковой диагностике. Не менее важной задачей является разработка четких ультразвуковых критериев ПИ ВСА, стандартизация техники исследования и заключения
В настоящее время не существует общепринятой терминологии для обозначения нарушения прямолинейности хода внутренних сонных артерий, В англо-американской литературе с этой целью преимущественно используются термины - tortuous (извитость) [3 4]; elongation (удлинение) [5 6], kinking (загиб, перегиб, изгиб) [7-10]; coiling (петлеобразование) [11]. Итальянские и французские авторы, наряду с вышеописанными, используют такие термины, как loops (петли) [12]; angulation (углообразование; [6], dolichoarteriopathies, dolicho-carotide (патологическое удлинение) [13-16]
В отечественной литературе наибольшее распространение получил термин «патологическая извитость сонных артерии», предложенный Е.В. Шмидтом [17]. Такое обозначение нарушений прямолинейности хода ВСА имеет глубокую клиническую и патофизиологическую основу, поскольку характеризует различные варианты деформации ВСА с позиции их клинической значимости. Использование этого термина предусматривает не только обозначение нарушенной геометрии ВСА, но и значения неправильного хода ВСА в формировании расстройств мозговой гемодинамики с определенной клинической картиной.
Общепринятой классификации ПИ ВСА не существует. Наибольшее распространение получила классификация патологических форм ВСА, предложенная. J. Weibel и W Fields [18, 19] Авторы выделяют три типа деформации ВСА, обозначая их как извитость (tortuosity), петлеобразование (coiling) и перегиб артерии (kinking) Под извитостью (toriuosity) понимается S-, С- или волнообразная деформация ВСА без острых углов и
видимых нарушений кровотока. Авторы считают этот тип деформации ВСА врожденным и гемодинамически незначимым. Петлеобразование (coiling) характеризуется врожденной круговой деформацией артерии с образованием петли, которая может приводить к нарушению мозгового кровообращения. Под перегибом (kinking) понимается приобретенное, гемодинамически значимое углообразование ВСА со стенозированием ее просвета. Существует множество аналогичных классификаций [20-23], содержащих в своей основе также визуальную характеристику деформации ВСА. без претензий на количественную оценку нарушения гемодинамики Отдельно следует упомянуть классификацию патологической формы ВСА, основанную на количественной оценке остроты угла деформации артерии, которая была предложена Н. Metz et ai. [24]. В этой работе впервые предложена гипотеза о влиянии размера угла изгиба на снижение перфузионного давления дистальнее деформации.
Приведенные выше классификации были разработаны преимущественно на основе двухмерного рентгеноконтрастного изображения сосуда полученного во фронтальной проекции, и клинической картины мозговой дисциркуляции. Их основным недостатком было отсутствие количественных характеристик гемодинамических нарушений в бассейне поврежденной артерии. Современные ультразвуковые технологии, прежде всего цветовое дуплексное сканирование (ЦДС), позволяют оценить не только форму извитой сонной артерии, но и детально охарактеризовать состояние гемодинамики, как локально - в зоне извитости, так и на интракраниальном уровне - в бассейне поврежденной артерии. Учитывая роль гемодинамического фактора в патогенезе расстройств мозгового кровообращения при ПИ ВСА. создаются предпосылки для оценки существующих классификаций с позиции приоритета гемодинамической значимости поражения сонных артерий.
В соответствии с этим все виды нарушения прямолинеиности хода ВСА могут быть обозначены родовым термином «деформации» внутренней сонной артерии и подразделены на «гемодинамически незначимые» и «гемодинамически значимые» [1] Гемодинамически незначимые деформации, форма которых не может быть однозначно интерпретирована, целесообразно обозначать термином «нарушение хода внутренней сонной артерии», который можно использовать в качестве синонима «гемодинамически незначимой деформации ВСА». Гемодинамически незначимые деформации определенной формы могут быть обозначены термином «гемодинамически незначимая извитость» ВСА с указанием формы извитости. Предпочтительность термина «извитость» в данном случае обусловлена его аналогичностью термину «tortuosity» в распространенной классификации J. Weibei и W Fields [18, 19]. под которым понимается S- С- или волнообразная деформация ВСА без острых углов и видимых нарушений кровотока. С учетом терминологии, распространенной в отечественной литературе, гемодинамически значимые деформации ВСА целесообразно обозначать термином «патологическая извитость» внутренней сонной артерии с указанием формы извитости.
1. Клиника патологической извитости внутренних сонных артерий
Патологическая извитость внутренней сонной артерии по своим клиническим проявлениям напоминает симптомы атеросклеротического стеноза ВСА и проявляется признаками нарушения мозгового кровообращения [22, 25, 26]. В целом клинические проявления ПИ ВСА малоспецифичны. Некоторую специфичность имеют локальные признаки патологической извитости. Среди них отмечают патологическую пульсацию на шее, признаки сдавления подъязычного, добавочного и блуждающего нервов [3, 5, 27].
Однако подавляющее большинство симптомов и синдромов при ПИ ВСА носят неспецифичный характер. Наиболее часто при этой патологии отмечают преходящие или постоянные контрлатеральные моторные симптомы [12, 28-31], ухудшение зрения [7, 12, 29, 32-35], головные боли [11, 31, 33, 36], нарушения речи, афазия) [7, 29, 31, 34, 36], головокружения [7, 29, 33, 34] (дизартрия эпизодическая потеря сознания [7, 29-34], боли в области шеи и плеча [27, 35] эпилептиформные припадки [12, 27, 28, 35], шум и звон в ушах [32, 34, 35], изменение личности [29], прогрессирующая психическая деградация [5, 32]. Деформация ВСА у детей чаще всего проявляется симптомами быстрой утомляемости, плохой успеваемостью в школе, нарушением нервно-психического развития и эпилептиформными припадками [6, 12, 27, 37]. М. Huemeretal. [10] сообщали о случае инфаркта мозга у ребенка 3-х лет, причиной которого была патологическая деформация ВСА. ПИ ВСА увеличивает риск послеоперационного инсульта во время проведения анестезии у пациентов, оперированных на мозге, а также вероятность тромбоза ВСА у кардиохирургических больных во время искусственного кровообращения [9].
Наиболее часто деформация сонных артерий сочетается с артериальной гипертонией, атеросклерозом и атеросклеротической деформацией подвздошных артерий [39], аневризмой брюшного отдела аорты [40]. Описаны сочетания деформации ВСА с синдромом Марфана [41], фибромускулярной дисплазией и гипоплазией ВСА [38].
Приведенные данные литературы свидетельствуют об отсутствии специфичных клинических признаков ПИ ВСА. что существенно затрудняет выявление этой патологии по результатам клинического обследования и демонстрирует приоритетное значение в выявлении этой патологии ультразвуковой диагностики. Мы проанализировали клинические диагнозы, выставленные врачами-неврологами в условиях амбулаторного приема, пациентам с патологической извитостью ВСА (239 человек), установленной впоследствии по данным цветового дуплексного сканирования [1]. В большинстве случаев (20,9%) этим пациентам был выставлен диагноз хронические нарушения мозгового кровообращения. Острые нарушения мозгового кровообращения были диагностированы в 7,5% случаев. 15,1% пациентов имели диагноз церебральной ангиодистонии, а 9,6% - шейный остеохондроз. В значительном числе случаев (5,4%) была установлена эпилепсия. В группу пациентов с прочей патологией (12,2%) были включены больные с последствиями черепно-мозговой травмы, доброкачественной внутричерепной гипертензией, поражениями анализаторов, цефальгиями, гипертонической болезнью и др. Пациенты, направленные на обследование без предварительного клинического диагноза, у которых при проведении ЦДС была обнаружена патологическая извитость сонных артерий, составили 29,3%.
По нашим данным [2], все дети (42 ребенка от 7 до 14 лет) с выявленной при ультразвуковом исследовании ПИ ВСА имели клинические признаки недостаточности мозгового кровообращения. В большинстве случаев (88%) у этих детей была диагностирована хроническая цереброваскулярная недостаточность (ХЦВН), В остальных случаях имели место ПНМК, сочетавшиеся с петлеобразной ПИ ВСА на шее.
Таким образом, клинические проявления патологической извитости ВСА малоспецифичны. Выявление этой патологии возможно только при помощи специализированных инструментальных методов диагностики. Учитывая ограничения для проведения рентгенконтрастной ангиографии и магнито-резонансной ангиографии основным методов выявления ПИ ВСА являются современные ультразвуковые технологии, прежде всего цветовое дуплексное сканирование.
2. Распространенность патологической извитости ВСА
Первые попытки изучения распространенности деформаций сонных артерий были предприняты в 30-40-х годах XX столетия на основании данных вскрытия больных, умерших от разных причин. Случаи извитости ВСА обнаруживали у детей и взрослых с частотой от 3,3% до 14,3% [42].
Широкое внедрение в клиническую практику церебральной ангиографии позволило значительно чаще (16,0-25,1% случаев) обнаруживать извитость сонных артерий при обследовании больных с церебральной патологией. По данным Е.А. Долматова и А.А. Дюжикова [43], деформация ВСА наблюдали в 1,5 раза чаще у мужчин, чем у женщин. Считалось, что число детей и лиц молодого возраста среди больных с деформациями сонных артерий невелико [12, 37], что, видимо, объяснимо ограниченностью использования церебральной ангиографии при обследовании пациентов молодого возраста. В то же время, G.D. Perdue et al. [6] сообщали, что, по данным 282 церебральных ангиографий, случаи патологической деформации ВСА у детей с цереброваскулярной патологией наблюдали в 43% случаев.
Существенные изменения в представлениях о распространенности и медико-социальной значимости ПИ ВСА связаны с внедрением в клинику цветового дуплексного сканирования - метода, сочетающего в себе возможности визуализации сосудов и кровотока в них с исследованием характера и количественных параметров потока крови. Анализ литературы свидетельствует, что использование ЦДС обеспечивает значительно более частое, чем считалось ранее, выявление патологической извитости сонных артерий у больных с нарушениями мозгового кровообращения. Так, G. Ghilardi et al. [44] при обследовании методом ЦДС 1386 человек с артериальной гипертензией в 19,2% случаев выявили патологическую извитость сонных артерий. В.И. Булынин и соав. [45] обследовали 2500 пациентов с мозговой сосудистой недостаточностью методами ЦДС и ангиографии и диагностировали 18,6% патологических извитостей внутренних сонных артерий. Поданным F.Koskas et al. [46], извитый ход сонных артерий встречается от 10 до 43% наблюдений у пациентов с нарушениями мозгового кровообращения. L. Del Corso и соав. [47] установили, что данная патология встречается у 58% обследуемых. В.Г. Лелюк и С.Э. Лелюк [48], исследовав 751 пациента в режиме ЦДС, обнаружили увеличение частоты деформации магистральных артерий с возрастом. С этими данными согласуются результаты исследования 3300 больных группой Р. Рапсега [49].
По нашим данным [1], патологическая извитость ВСА имела место в 12,9% случаев среди 2788 пациентов, имевших клинические признаки нарушения мозгового кровообращения по результатам амбулаторного приема врачом-неврологом. Достаточно широкий разброс частоты встречаемости ПИ ВСА в цитируемых работах, вероятно, обусловлен особенностями отбора больных для ультразвукового обследования. Важным представляется тот факт, что частота встречаемости этой патологии у взрослых, по нашим данным, занимала второе место после атеросклероза сонных артерий (22,1%). При этом атеросклеротические стенозы и окклюзии сонных артерий были выявлены только у 5% обследованных. 17,1% пациентов, включенных в группу с атеросклеротиче- ским поражением сонных артерий, имела в качестве признаков атеросклероза наличие мелких атером, не стенозирующих просвет артерии, или утолщение слоя интима-медиа на уровне дистального сантиметра от бифуркации общей сонной артерии более 1 мм. Среди пациентов, у которых по результатам ЦДС была выявлена патологическая извитость сонных артерий, женщин было несколько больше (56,1%), чем мужчин (43,9%). Чаще диагностировали патологическую извитость правой ВСА (42,3%) по сравнению с левой (25,1%), в 32,6% случаев была выявлена двухсторонняя извитость. Эти результаты указывают на высокую распространенность патологической извитости сонных артерий, уступающей по этому показателю только атеросклеротическому поражению сонных артерий.
Еще в большем проценте случаев (26,9%) ПИ ВСА диагностируют у детей с клиническими признаками нарушения мозгового кровообращения [2]. В отличие от взрослых патологическую извитость ВСА чаще обнаруживали у мальчиков (79%) по отношению к девочкам (21%). В большинстве случаев (88%) у детей регистрировали S-образную ПИ, петлеобразная извитость была обнаружена в 12% случаев. При этом ни в одном из случаев патологической извитости ВСА не была выявлена распространенная среди взрослых С-образная извитость. Это может свидетельствовать в пользу представлений о врожденном генезе ПИ у детей. Двухстороннюю извитость ВСА наблюдали более чем в трети случаев (43%).
Таким образом, патологическая извитость ВСА является распространенной патологией сонных артерий у больных с клиническими признаками нарушения мозгового кровообращения, занимающей у взрослых второе место после их атеросклеротического поражения. Чаще патологический процесс поражает правую ВСА. Двухстороннее поражение ВСА наблюдают примерно в трети случаев этой патологии. Эволюция методов исследований от секционного изучения сонных артерий до анализа прижизненно выполненных MP- ангиограмм и неинвазивной сонографической цветовой допплеровской визуализации позволяет повысить частоту выявления ПИ ВСА и судить о широком распространении этой патологии не только у больных, но и в популяции.
3. Этиология и патогенез патологической извитости внутренней сонной артерии
Этиология патологической извитости внутренних сонных артерий окончательно не установлена. Сегодня существуют две точки зрения на причины возникновения ПИ ВСА - как на врожденную и приобретенную патологию.
В пользу врожденного генеза ПИ ВСА свидетельствует обнаружение деформированных сонных артерий у пациентов молодого возраста [30], при отсутствии атеросклеротического процесса в сосудах [26, 35], частое двухстороннее поражение сонных артерий [18, 50], сочетание ПИ ВСА с дисплазиями соединительной ткани и другими сосудистыми аномалиями. Показано, что деформация сонных артерий сочетается с коарктацией аорты [51], синдром Марфана, аневризмами интракраниальных артерий [40], гипоплазией ВСА [52]. По нашим данным [2], ПИ ВСА у детей в более чем 80% случаев сочетается с различными проявлениями мезенхимальной дисплазии со стороны сердечно-сосудистой, пищеварительной, мочевыделительной систем и опорно-двигательного аппарата.
Можно предположить, что формирование врожденной извитости ВСА происходит следующим образом. ВСА берет начало от третьей жаберной дуги и дорзальной аорты. На стыке этих двух формирований образуется отчетливый перегиб, проявляющийся у 5-недельного эмбриона. Через этот перегиб проходит IX пара черепно-мозговых нервов. При дальнейшем развитии плода в связи с опусканием сердца в грудную полость и разворотом его по оси сонная артерия выпрямляется. В ряде случаев это выпрямление или разворот сонной артерии оказывается неполным, что ведет к образованию различной степени выраженности изгибов, перегибов и петель. Другим фактором, способствующим деформации ВСА, может быть более выраженный рост артерий дуги аорты по сравнению с ростом шеи. Это находит подтверждение в обнаружении извитости ВСА у эмбрионов и взрослых на уровне расположения языкоглоточного нерва. Дизэмбриогенетическая теория происхождения ПИ ВСА имеет морфологические подтверждения в виде обнаружения многочисленных фиброзных перемычек [6, 12, 25, 27, 33, 36, 37], спаек [33] или аневризматических истончений и выпячиваний стенки артерии [53]. Существование такой фиброзной перетяжки или спайки способствует возникновению перегиба сонной артерии [12, 37]. Систолические пульсовые волны могут вызывать перерастяжение и удлинение артерии с возрастом, что сопровождается увеличением выраженности перегиба [7, 30].
В пользу приобретенного характера патологической деформации ВСА могут свидетельствовать большая частота встречаемости этой патологии с возрастом [48] и зависимость выраженности изгиба сонной артерии от возраста и уровня артериального давления. Считают, что возрастные дегенеративно-дистрофические и атеросклеротические изменения артерий приводят к дезорганизации соединительнотканного каркаса сосудистой стенки, что способствует удлинению сосудов [6, 8, 26, 27, 35, 50]. При этом сонная артерия, имеющая две основные точки фиксации (аорта и костный каротидный канал), изгибается с формированием угла различной степени выраженности. Повышение кровяного давления ускоряет процесс деформации, что увеличивает удлинение и выраженность изгибов ВСА с формированием септальных стенозов [20, 54].
Предполагают, что различные по виду деформации внутренних сонных артерий могут иметь различное происхождение [18, 19]. Согласно этой точке зрения волнообразная деформация ВСА без острых углов (tortuosity) и петлеобразование (coiling) являются врожденными, а перегиб артерии (kinking) приобретенным. [18].
Существует мнение, что приобретенный изгиб ВСА формируется как один из механизмов защиты интракраниальных артерий при артериальной гипертензии [54, 55]. Предполагают, что этот адаптивный изгиб сосуда выполняет функцию дополнительного сифона ВСА и формируется как защитная реакция в ответ на гипертензию.
В области патологической извитости сонной артерии выявляют выраженные морфологические изменения. На проксимальных участках изгиба ВСА у взрослых обнаруживают скопления гладкомышечных клеток, отложение липидов и фиброзные бляшки [18, 19], что говорит о сопутствующем атеросклерозе артерий. Микроскопические исследования зоны изгиба в большинстве случаев выявили слабо выраженный атеросклероз [54]. В отличие от проксимальных участков извитости, в области перегибов ярких признаков атеросклероза сосудов найти не удается, однако обнаружены тяжелые поражения дегенеративного характера [54]. Предполагают, что гемодинамическая перегрузка артериальной стенки приводит к усилению патологической пульсации и возникновению ангиита vasa vasorum [53, 56]. Это ведет к нарушению питания с последующей дегенерацией сосудистой стенки и формированием извитости ВСА.
Большой материал по макро- и микроскопическому исследованию деформированных ВСА накоплен П.А. Паулюкасом и соавт. [53]. В изгибах сосудов, особенно под острым углом, они отмечали сужение его просвета за счет выпячивания дупликатуры сосудистой стенки. В зоне изгиба сосудистая стенка значительно утолщена за счет всех ее слоев, а по большой кривизне изгиба, напротив, истончена. В патологический процесс вовлекаются все слои сосудистой стенки по большой и малой кривизне изгиба. В адвентиции, как правило, обнаруживают фиброз, более выраженный по малой кривизне изгиба, который фиксирует артерию в изогнутом положении. Исходя из этих данных, авторами сделано предположение, что маятникообразные движения при пульсации изгиба артерии травмируют близлежащие ткани и ведут к травматическому воспалению vasa vasorum и соединительной ткани.
Постоянная фиксация артерии в изогнутом состоянии ведет не только к сужению просвета, но и перестройке самой стенки артерии в виде подушкообразного утолщения. В таких утолщениях обнаружен коллаген IV типа. В медии также выявляется очаговое мозаичное перераспределение гликозаминогликанов, пикринофилия, фуксинофилия, картина неоколлагеноза (в основном коллаген III типа). Указанные изменения могут быть расценены как активный процесс фиброзирования медии изогнутой артерии. В интиме наблюдают неравномерное гиперплазирование и фиброзирование с отложением липидов. Внутренняя эластическая мембрана расщепляется, становится многослойной, прерывистой, фрагментированной. Эти дегенеративные изменения внутренней эластической мембраны и самой интимы являются причиной необычной хрупкости и предрасположенности к отслоению интимы во время хирургических манипуляций. Большинство изменений артериальной стенки при наличии петель ВСА напоминает описанные при изгибах. В области полюсов изгибов петли часто встречаются микроаневризмы, иногда с пристеночными тромбами [57].
Начало изучения извитости внутренних сонных артерий как возможной причины развития недостаточности мозгового кровообращения положено сообщением М.М. Riser et al. [13] о больной с приступами «каротидной недостаточности» и полном ее выздоровлении после хирургической коррекции «свернувшейся кольцом» внутренней сонной артерии.
Величина угла деформации влияет на объем кровотока в сосуде. J. Derrick et al. [32, 58] интраоперационно измеряли объем и давление крови ниже и выше изгиба артерии у больных с ПИ ВСА, перенесших инсульт. Было показано, что для патологической извитости характерно наличие градиента давления крови (20-30 мм рт. ст.) между проксимальным и дистальным по отношению к извитости участками сонной артерии. Авторы установили обратную зависимость между величиной угла и градиентом давления ниже и выше изгиба и пришли к выводу, что чем острее угол, тем меньше протекает крови в артерии. Оперативное устранение извитости сопровождалось ликвидацией указанного градиента кровяного давления и улучшением клинической картины, в частности, исчезновением синкопальных состояний.
Патологоанатомические исследования трупов с извитостью сонных артерий выявили грубые поражения ткани мозга. Е.В. Шмидт и соавт. [59] обнаружили очаговые изменения в мозгу в виде старых и свежих ишемических инфарктов, крупных очагов красного размягчения. Авторы считают, что причиной ишемии мозга послужило снижение или прекращение кровотока по патологически извитому сосуду. По их мнению, в случае восстановления кровотока в этой артерии повышается давление крови в артериях ишемизированного участка мозга. Так как артерии в участках ишемии обладают повышенной проницаемостью, то образуются очаги красного размягчения. В случае восстановления артериального давления до прежнего уровня может возникнуть кровоизлияние.
На основании данных церебральной ангиографии показана возможность резкого уменьшения кровотока в удлиненном и извитом сосуде, вплоть до полного прекращения в связи с усилением перегиба при изменении положения головы. Резкое замедление кровотока или его остановка могут стать причиной развития тромбоза средней мозговой артерии и внутричерепных отделов внутренних сонных артерий [20]. Механизм нарушения гемодинамики в этих случаях связывают с периодическим частичным или полным закрытием просвета артерии в области перегибов, что приводит к уменьшению, замедлению или остановке кровотока в участках артерии дистальнее перегиба и появлению турбулентного течения крови, образованию вихревых потоков или даже возникновению обратного тока крови. В результате ограничения, неравномерности, инверсии кровотока и столкновения потоков крови в зонах стыка стенотического и ретроградного кровотока создаются условия, способствующие тромбообразованию. Об этом свидетельствовало выявление особого вида «стагнированных» тромбов структура которых, а также отсутствие атероматозных бляшек в месте их развития давали основание полагать, что тромбы здесь не являлись осложнением атеросклеротического повреждения сосудов а возникли в результате гемодинамических нарушений [20].
При моделировании ишемии мозга путем перегиба внутренних сонных артерии у собак М К. Юсубалиевым и соавт [60] было показано снижение дистальнее места перегиба линейной скорости кровотока.
Е В Шмидт и соавт. [17, 59] е патогенезе нарушений мозгового кровообращения придают важное значение градиенту давления: считая его причиной усиления перегибов сонных артерий. Это, в свою очередь является причиной повышения давления крови в артерии проксимальнее перегиба приводит к раздражению барорецепторов каротидного синуса и снижению системного артериального давления, усугубляющего нарушение мозгового кровообращения Гемодинамическая значимость патологической извитости сонных артерий подтверждается результатами ее хирургической коррекции [61, 62], Показано, что после хирургической коррекции кровоток по ВСА увеличивается, улучшается перфузия соответствующего полушария мозга [63]
По данным церебральной ангиографии [64], у больных с извитостью сонных артерий могут возникать местные нарушения кровотока в деформированном сосуде в виде неравномерного контрастирования, пристеночной задержки контраста, замедления кровотока и феномена ложной окклюзии. Местные нарушения кровотока в извитом сосуде на шее связаны с изменением прямолинейности кровотока образованием завихрений.
По данным ультразвуковой допплерографии ПИ ВСА сопровождается нарушениями гемодинамики в пораженном сосуде [22, 65]. Авторы выделяют два варианта изменения гемодинамики при извитости сонных артерий. При первом, гемодинамически незначимом, варианте в области изгиба пиковая систолическая и объемная скорости кровотока существенно не изменяются, однако регистрируют спектральное расширение допплеровских сигналов. При втором, гемодинамически значимом, варианте, требующем хирургического лечения, в области изгиба регистрируют повышение частоты пикового систолического сигнала, сочетающееся со спектральным расширением под систолическим пиком Дистальнее извитости отмечают снижение этих показателей. Объемная скорость кровотока по ОСА также снижена.
Методом цветового допплеровского картирования в 78% случаев у больных с ПИ ВСА были выявлены местные нарушения гемодинамики в зоне извитости [66]. При петлеобразной извитости сонных артерий часто выявляется элайзинг-эффект, что указывает на наличие высоких скоростей потока крови на локальном участке сосуда [67]. С Macchi et al. [68] показали, что пиковая систолическая скорость кровотока в месте ангуляции составляет более 1 м/с А. И. Болдырев [69] сообщает о возможности возникновения эписиндрома при петлеобразовании внутренней сонной артерии Автор считает, что повторные ишемические состояния вследствие нарушений кровотока, а также недостаточность коллатерального кровообращения могут привести к образованию микрокист, а перифокальная зона вокруг них является источником образования эпилептического очага.
Важным критерием гемодинамической значимости патологии сонных артерий является нарушение функционального состояния нейронов головного мозга. Анализ литературы показал, что имеются единичные сведения о влиянии патологической извитости внутренних сонных артерий на функциональное состояние головного мозга у взрослых пациентов [70]. Электроэнцефалографическое исследование у больных с данной патологией выявило, что в случае тяжелого клинического течения инсульта (7 из 39 пациентов) в остром периоде регистрировали очаг патологической медленноволновой активности в височной или в лобной области на стороне извитой артерии. У больных с более легкой клинической картиной инсульта и положительной динамикой в постинсультном периоде (28 пациентов), а также у больных с ПНМК (4 пациента), в большинстве случаев были отмечены умеренно выраженные либо легкие диффузные изменения. Однако у некоторых больных на ЭЭГ регистрировали пароксизмальную активность. В четверти случаев электроэнцефалограмма не представляла отклонений от нормы.
4. Ультразвуковые критерии гемодинамической значимости патологической извитости ВСА
Нарушения гемодинамики при патологической извитости ВСА регистрируются допплерографическими методами локально - в зоне извитости сосуда и на региональном уровне - в интракраниальных артериях. Эти нарушения могут быть зарегистрированы при помощи разных вариантов цветового допплеровского картирования и в импульсном допплеровском режиме.

Рис. 109. С-образная патологическая извитость ВСА в режиме цветового допплеровского картирования.
Типичная картина патологической извитости ВСА различной формы в режиме цветового допплеровского картирования (ЦДК) и их ангиографическое изображение показаны на рисунках 109-114. ЦДК позволяет детально охарактеризовать форму извитости, ее локализацию и выявить дезорганизацию потока крови. В месте извитости сосуда нарушается ламинарность кровотока. Поток крови становится дезорганизованным, турбулентным. В режиме ЦДК это проявляется в виде нарушения равномерности окрашивания кровотока. В случае выраженного ускорения кровотока в зоне ангуляции регистрируется элайзинг - эффект (рис. 115). В отличие от изменения цветовой карты потока крови (с красного на синий и наоборот), связанного с изменением его направления в месте извитости, для которого характерен переход от одного цвета к другому через темные оттенки, элайзинг - эффект характеризуется появлением красного на синем фоне и синего на красном, но переход между цветами идет через светлые оттенки.

Рис. 111 Петлеобразная патологическая извитость ВСА в режиме цветового допплеровского картирования.
Благодаря относительной независимости окрашивания кровотока от угла сканирования некоторое улучшение визуализации извитости в одном скане по сравнению с ЦДК может давать режим энергетического картирования [71].

Рис. 110. S-образная патологическая извитость ВСА в режиме цветового допплеровского картирования.

Рис. 112. Ангиограмма больного с С-образной патологической извитостью ВСА (показано стрелкой).

Рис. 113. Ангиограмма больного с S-образной патологической извитостью ВСА.
Наиболее характерным гемодинамическим проявлением ПИ ВСА является изменение пиковой систолической скорости кровотока в зоне извитости [1] (рис. 116). В месте наиболее выраженной деформации артерии (ангуляции) пиковая скорость возрастает по отношению к проксимальному сегменту в среднем от 30,1 ± 7,2% (р<0,05) при С-образной извитости ВСА до 65,2 ± 7,1% (р<0,05) при S-образной извитости. В этом участке по данным спектрального анализа отмечают наибольшую дезорганизацию кровотока, что проявляется увеличением спектрального расширения (рис. 117). В дистальном по отношению к месту извитости участке ВСА наблюдают частичную стабилизацию потока со снижением величины спектрального расширения и пиковой скорости кровотока. Причем пиковая скорость кровотока в дистальном участке сосуда в среднем на 22,4%, 33,1% и 40,1% меньше по сравнению с проксимальным участком при С-, S- и петлеобразной извитости, соответственно.

Рис. 114. Ангиограмма больного с петлеобразной патологической извитостью ВСА.

Рис. 115. Отображение дезорганизации кровотока и элайзинг - эффект при патологической извитости ВСА в режиме цветового допплеровского картирования.
Важно отметить, что в дистальном участке ВСА возникает асимметрия пиковой ЛСК по сравнению с непораженной контрлатеральной ВСА от 26,3% при С-образной извитости до 40,1% при петлеобразной. В месте наибольшей деформации извитой артерии отмечается также примерно одинаковое при всех формах извитости возрастание индекса резистентности, в среднем на 7% по отношению к проксимальному участку сосуда.
Таким образом, типичные изменения гемодинамики в зоне патологической извитости ВСА представлены: градиентом скорости кровотока подлиннику извитой артерии с ее увеличением на 30 и более процентов в зоне наибольшей деформации сосуда и снижением в дистальном направлении более чем на 20% по отношению к проксимальному участку, дезорганизацией потока крови в зоне ангуляции в виде увеличения спектрального расширения; наличием асимметрии пиковой скорости кровотока в дистальном участке извитой артерии по сравнению с аналогичным участком неизмененной контрлатеральной ВСА.

Рис. 116. Пиковая систолическая скорость кровотока (см/с) в зоне патологической извитости ВСА.
С - С-образная извитость; S - S-образная извитость; К - петлеобразная извитость; N - интактная ВСА.

Рис. 117. Увеличение спектрального расширения в зоне патологической извитости ВСА.
По данным транскраниального исследования наиболее типичным для односторонних ПИ ВСА является наличие межполушарной асимметрии по пиковой скорости кровотока в СМА (в среднем 18,3%) и снижение перфузионного резерва мозгового кровообращения на стороне поражения при проведении пробы с гиперкапнией. По нашим данным [1], средний прирост пиковой систолической скорости кровотока в СМА на стороне поражения в ответ на гиперкапнию (6-7% СО,) составлял от 11,1 ± 0,9% при петлеобразной извитости до 13,0 ± 1,1% при С-образной извитости, что было существенно меньше по сравнению с интактной стороной (20,5 ± 0,9%, р<0,05) и со здоровыми пациентами (21,7 ± 4,6%, р<0,05).
При двухсторонних избитостях межполушарную асимметрию скорости кровотока по СМА не отмечали, а реактивность мозговых сосудов на гиперкапнию снижалась в обоих полушариях. Кроме того, особенностью двухсторонних извитостей по отношению к односторонним является снижение коллатерального резерва мозгового кровообращения по данным компрессионной пробы.
Локальные нарушения гемодинамики в зоне извитости могут явиться одной из непосредственных причин описанных выше нарушений кровотока в интракраниальных артериях [1]. На это указывают данные корреляционного анализа. Так, осевой градиент пиковой скорости кровотока в извитой ВСА отрицательно коррелятивно связан с величиной этой скорости в СМА и ее приростом при гиперкапнии (г = -0,63, р<0,05) и положительно с величиной падения пиковой скорости в СМА при компрессии ОСА (г = +0,58, р<0,05). Прирост пиковой ЛСК в месте наибольшей деформации ВСА положительно коррелятивно связан с величиной межполушарной асимметрии этой скорости в СМА (г = +0,48, р<0,05). Эти данные указывают на непосредственную связь локальных нарушений гемодинамики в извитой артерии и особенно величины снижения пиковой ЛСК подлиннику извитого сосуда с нарушениями мозгового кровообращения в виде межполушарной асимметрии скорости кровотока, снижения функционального и коллатерального резервов мозгового кровообращения.
Следовательно, локальные нарушения гемодинамики в зоне извитой ВСА могут вызывать изменения интракраниального кровообращения, наиболее типичными среди которых являются снижение реактивности мозговых сосудов на гиперкапнию на стороне поражения и наличие межполушарной асимметрии скорости кровотока в СМА со снижением на стороне поражения. Особенностью двухсторонних извитостей было снижение функционального и коллатерального резервов мозгового кровообращения в обоих полушариях. Кроме того, при патологической извитости ВСА нарушается ауторегуляция мозгового кровообращения по артериальному давлению [72].
Критериями локальной гемодинамической значимости ПИ ВСА являются: градиент пиковой систолической скорости кровотока между проксимальным и дистальным участками сосуда по отношению к месту извитости со снижением скорости в дистальном направлении на 20% и более; прирост пиковой скорости в месте ангуляции по сравнению с проксимальным участком ВСА на 30% и более; дезорганизация кровотока в зоне извитости, проявляющаяся увеличением спектрального расширения и нарушением цветового паттерна кровотока в режиме ЦДК Критериями региональной гемодинамической значимости ПИ ВСА являются: наличие межполушарной асимметрии пиковой ЛСК по СМА на 15% и более со снижением на стороне поражения; снижение прироста пиковой ЛСК по СМА (менее 20%) на стороне поражения при пробе с гиперкапнией и наличие межполушарной асимметрии реактивности мозговых сосудов на CO2. Особенностью двухсторонних ПИ ВСА является отсутствие межполушарной асимметрии скорости кровотока со значимым снижением функционального и коллатерального резервов мозгового кровообращения в обоих полушариях.
Таким образом, из представленных выше данных следует, что одним из звеньев патогенеза нарушений мозгового кровообращения при ПИ ВСА является локальное нарушение гемодинамики в зоне извитости в виде турбуленции и градиента кровотока со снижением в дистальном направлении. Возможно, этим можно объяснить региональные нарушения кровотока, снижение перфузионного и коллатерального резервов мозгового кровообращения на стороне поражения и нарушение ауторегуляции мозговой гемодинамики.
5. Функциональное значение патологической извитости ВСА
Нарушения мозгового кровообращения при ПИ ВСА являются причиной различных нарушений функций головного мозга. Комплексное нейрофизиологическое исследование выявило выраженные нарушения функционального состояния мозга у детей при ПИ ВСА [73]. По данным ЭЭГ, у пациентов с ПИ ВСА биоэлектрическая активность мозга была изменена в 83% случаев. Преобладающим вариантом этих нарушений были диффузные изменения биоэлектрической активности мозга различной степени выраженности (рис. 118). Умеренные проявления доминировали и отмечены в 60%, легкие диффузные изменения регистрировали в 25%, а выраженные - в 15% случаев Часто диффузные изменения биоэлектрической активности принимали характер, свидетельствующий о снижении порога судорожной готовности мозга и функциональной незрелости коры. В 17% случаев на ЭЭГ детей с ПИ ВСА была зарегистрирована эпилептиформная активность (рис. 118). При двухсторонней патологии она носила билатерально-синхронный и генерализованный характер. Особенностью односторонней ПИ ВСА была регистрация очаговой патологической и очаговой эпилептиформной активности на стороне пораженной артерии. Во всех случаях регистрации эпилептиформной активности на ЭЭГ имели место клинические проявления эписиндрома. Гемодинамически незначимые деформации ВСА сопровождались изменениями биоэлектрической активности в меньшем числе случаев (17%) в виде легких диффузных изменений.
Исследование состояния пирамидного тракта методом магнитной стимуляции выявило у половины детей с ПИ ВСА увеличение времени центрального моторного проведения (ВЦМП) в среднем на 10%, что свидетельствовало о замедлении проведения возбуждения по пирамидному тракту. При односторонней ПИ ВСА эти изменения носили преимущественно латерализованный характер на контрлатеральной стороне по отношению к пораженной артерии.
В процессе проведения магнитной стимуляции в проекции моторной коры для появления вызванного моторного ответа у детей с ПИ ВСА необходимо увеличение мощности магнитного стимула до максимальных значений (рис. 119). Однако при стимуляции аксонов корешков спинного мозга мощность магнитного стимула не отличалась от таковой у здоровых детей.

Рис. 118. Электроэнцефалограмма при патологической извитости ВСА
Примечание. Слева - диффузные изменения биоэлектрическои активности мозга у ребенка С. 12 лет с двухсторонней ПИ ВСА. Справа - очаг эпилептиформной активности в центрально-теменной области правого полушария у девочки Т. 9 лет с поавостороннеи ПИ ВСА. с 1 по 16 - каналы регистрации электроэнцефалограммы при биполярном отведении по мездународнои системе «10-20».

Рис, 119 Кривые вызванного моторного ответа при магнитнои стимуляции
Примечание. Слева - ребенок С. 12 лет с двухсторонней ПИ ВСА справа - ребенок Л. этого же возраста с гемодинамически незначимой деформацией ВСА 1 - кривая моторного ответа m. flexor digiti minimi brevis при магнитной стимуляции в пооекции моторной коры зарегистрированная справа 2. - то же слева: 3 - кривая моторного ответа m. flexor digiti minimi brevis при магнитнои стимуляции в проекции аксонов корешков CVI-CVII, зарегистрированная справа 4 - то же слева, справа цифрами обозначена величина мощности магнитного стимула в Т.
Это свидетельствуют об увеличении порога возбудимости мотонейронов коры головного мозга у детей с ПИ ВСА в среднем на 30% по сравнению со здоровыми детьми. Снижение возбудимости корковых мотонейронов было характерно для большинства детей (83%) с ПИ ВСА. Гемодинамически незначимые деформации ВСА не сопровождались изменениями функционального состояния пирамидного тракта.
При оценке состояния зрительного анализатора методом вызванных зрительных потенциалов у детей с ПИ ВСА было выявлено увеличение латентного периода пика Р100 в среднем на 10% и снижение амплитуды позитивного пика в среднем на 60% на стороне пораженной артерии по сравнению со здоровыми детьми. При двухсторонней патологии эти изменения регистрировали с двух сторон, что свидетельствовало о билатеральной дисфункции зрительных путей. На рис. 120 представлены кривые зрительных вызванных потенциалов при односторонней ПИ ВСА. Эти изменения были характерны для большинства пациентов (79%) с ПИ ВСА. Гемодинамически незначимые деформации ВСА не сопровождались изменениями показателей вызванных зрительных потенциалов.
Объективная оценка когнитивных функций мозга методом эндогенных вызванных потенциалов показала, что у детей с ПИ ВСА имело место снижение амплитуды и увеличение латентного периода пика Р300 по сравнению с группой здоровых. Эти данные свидетельствуют о снижении объёма оперативной памяти у детей при патологической извитости ВСА. Нарушение когнитивных функций мозга было выявлено у 81% пациентов с ПИ ВСА. Во всех случаях зарегистрированных изменений имело место клиническое подтверждение в виде различных когнитивных расстройств. Гемодинамически незначимые деформации ВСА не сопровождались изменением параметров пика Р300.

Рис.120. Кривые вызванных зрительных потенциалов на реверсивный шахматмый паттерн пациента Ц. 10 лет с правосторонней ПИ ВСА
Примечание. 1 - кривая зрительного вызванного потенциала, зарегистрированная при стимуляции левого глаза при отведении от O1-Fz; 2 - то же при отведении от О2-Fz; 3 - кривая зрительного вызванного потенциала, зарегистрированная при стимуляции правого глаза при отведении от O1-Fz 4 - то же при отведении от О2-Fz; пик N75 - результат генерации в 17 поле коры по Бродману; пик Р100 - главный компонент в оценке ЗВПШП, является результатом генерации в 17-18 полях коры по Бродману, пик N145 - результат генерации в 18-19 полях коры по Бродману.
Корреляционный анализ выявил наличие связи между функциональным состоянием мозга и нарушениями церебральной гемодинамики у детей с ПИ ВСА. Показатель ВЦМП по пирамидному тракту, величина асимметрии ВЦМП, латентный период пика Р300 при ПИ ВСА были связаны обратной коррелятивной связью средней силы с величиной пиковой систолической скорости кровотока по СМА. Амплитуда пика Р300 имела положительную коррелятивную связь средней силы с величиной пиковой систолической скорости кровотока в СМА.
Таким образом, закономерными нарушениями функционального состояния мозга при ПИ ВСА могут быть умеренные или выраженные диффузные изменения корковой ритмики, наличие эпилептиформной активности, снижение возбудимости мотонейронов коры головного мозга, замедление проведения возбуждения по пирамидному тракту дисфункция зрительного анализатора и снижение объема оперативной памяти. В подавляющем большинстве случаев при ПИ ВСА наблюдают различные сочетания перечисленных выше нарушений функционального состояния мозга. Нарушения функционального состояния мозга при ПИ ВСА связаны с изменениями мозговой гемодинамики Гемодинамические нарушения являются определяющим фактором изменений функционального состояния головного мозга при ПИ ВСА.
Из представленных выше данных следует, что важным звеном патогенеза НМК при ПИ ВСА может быть ишемия нейронов в бассейне ВСА, которая проявляется снижением возбудимости корковых мотонейронов и нарушением биоэлектрической активности мозга. Деформации ВСА без локальных нарушений гемодинамики не сопровождаются нарушением функционального состояния мозга 6. ЦДС в оценке эффективности хирургического лечения патологической извитости ВСА.
Принято считать, что транзиторные неврологические симптомы, проявляющиеся при поворотах головы являются абсолютным показанием для хирургического лечения ПИ ВСА [6 11, 25 29 35]. Отдельные авторы рекомендуют хирургическое лечение и в случае асимптомных извитостей при условии ангиографического доказательства частичной обструкции просвета артерии [26, 31, 56] и наличии нарушений гемодинамики [56]. При решении вопроса об оперативном лечении ПИ ВСА у детей необходимо учитывать отсутствие эффективности от консервативной терапии. При этом целью оперативного лечения ПИ ВСА является профилактика развития острых нарушений мозгового кровообращения и снижение выраженности возможной ишемии мозга.
Для хирургического лечения ПИ ВСА используются 5 основных видов операций [74]. Наиболее часто используют резекцию ВСА с анастомозом «конец-в-конец» (рис, 121) Низведение ВСА с реимплантацией в ОСА применяют реже, как правило, при наличии атеросклеротического поражения развилки сонной артерии Транспозицию ВСА выполняют при гемодинамически значимых С- и S-образных избитостях, но она неприемлема для лечения петлеобразной извитости ВСА Аутовенозную пластику ВСА (рис. 122) рекомендуют как операцию выбора при интраоперационном повреждении сосуда Наличие единичной спайки или мембранной перетяжки, которые формируют С- или S-образную ПИ ВСА с острым углом и небольшим удлинением ВСА требует проведения операции артериолиза [74] При этом выполняют ещё рассечение спайки или перетяжки, и артерия принимает прямолинейный ход. В отличие от транспозиции дополнительную фиксацию сосуда к кивательной мышце не производят
Данные об эффективности хирургического лечения ПИ ВСА немногочисленны и противоречивы. Большинство авторов отмечают положительный эффект от проведенных операций в ближайший послеоперационный период, более чем в половине случаев [4 23 43 51 53], есть сведения о положительном эффекте операции в отдаленном периоде [38] По нашим данным [74] хирургическое устранение ПИ ВСА приводит к уменьшению выраженности общемозговых симптомов у 84 5% больных, к улучшению зрения - у 45,5%, к уменьшению расстройств координации движений - у 26,3% в ближайшем послеоперационном периоде. В отдаленном периоде уменьшение выраженности общемозговых симптомов наблюдалось у 78 8% прооперированных, расстройств зрения - у 75%. Лучшие клинические результаты операции получены у детей до 16 лет, у 95% пациентов этой возрастной группы в ближайшем послеоперационном периоде и у 80% в отдаленном периоде отмечено уменьшение или исчезновение общемозговой симптоматики. У взрослых клинический эффект оперативного лечения ПИ ВСА выражен в меньшей степени.
Цветовое дуплексное сканирование является основным методом в оценке гемодинамической эффективности хирургического лечения ПИ ВСА. Критериями гемодинамической эффективности операции является восстановление прямолинейного хода артерии (рис. 123) с отсутствием признаков дезорганизации кровотока в режимах ЦДК и импульсной допплерографии, исчезновение асимметрии пиковой скорости кровотока в СМА при устранении односторонней извитости и восстановление реактивности мозговой гемодинамики на пробу с гиперкапнией на стороне операции. Оптимальный срок для оценки эффективности оперативного лечения - 7-10 суток после операции, хотя показана и динамическая оценка в отдалённом послеоперационном периоде.

Рис. 121. Схема операции резекции проксимального сегмента внутренней сонной артерии с анастомозом «конец-в-конец»,
а) пересечение ВСА выше бифуркации ОСА б) пересечение ВСА мистальнее ПИ ВСА в) анастомоз «конец-в-конец».

Рис. 122. Схема операции аутовенозного протезирования внутренней сонной артерии, а) линии пересечения ВСА проксимальнее и дистальнее зоны S-образной ПИ ВСА; б) зона ПИ ВСА иссечена в) место забора аутовенозного протеза (2), ОСА и ВСА после аутовенозного протезирования (1).
Для оценки информативности ЦДС в диагностике патологической извитости внутренних сонных артерий были проанализированы истории болезни 27 пациентов которым проводили церебральную ангиографию и оперативное лечение [1] Совпадение заключений ЦДС и ангиографии о наличии ПИ ВСА было отмечено в 100% случаев Интраоперационная верификация также подтвердила наличие ПИ ВСА у всех пациентов. Однако были обнаружены существенные расхождения в оценке формы и локализации извитости. Так, полное совпадение заключений по форме ПИ ВСА между ЦДС и ангиографией было только в 10 случаях (37%), а по локализации - в 23 случаях (85,2), алогичные данные были получены при сопоставлении результатов ЦДС с интраоперационной верификацией. При этом важно отметить, что ангиографическая оценка формы и локализации извитости также имела существенные расхождения с результатами интраоперационного наблюдения. Полное совпадение ангиографического и интраоперационного заключений о форме извитости наблюдали в 40,7%, а по локализации - в 63% случаев.
Очевидно что причина столь существенных расхождений в трактовке формы и локализации ПИ ВСА между ЦДС, ангиографией и интраоперационным наблюдением заключается в отсутствии общепринятой классификации ПИ ВСА, четких оценочных критериев как формы, так и локализации извитости и стандартизации самих исследований (стандартное положение пациента проекции). Например. S-образная извитость в проекции, при которой изображения ее колен накладываются друг на друга, может восприниматься как петлеобразная. К сожалению, эти вопросы в настоящее времени не решены Тем не менее можно констатировать, что современное ультразвуковое исследование с применением цветового допплеровского картирования и импульсной допплерографии является основным методом диагностики деформаций внутренних сонных артерий и оценки эффективности их хирургического лечения.

Рис. 123. Гемодинамика в ВСА по данным цветового допплеровского картирования у больного М. 7 лет. а - до операции; б - после операции
Резюмируя все вышеизложенное, нужно еще раз отметить, что в настоящее время патологическая извитость ВСА может быть причиной преходящих и стойких НМК с развитием инфаркта мозга. При наличии современной УЗ-аппаратуры диагностика патологических деформаций ВСА методом ЦДС не представляет технической сложности, тем не менее в своем заключении врач должен нести полную ответственность за определение патологической значимости выявляемой им извитости ВСА в патогенезе возникающего в каждом конкретном случае нарушения мозгового кровообращения.
ГЛАВА 8
ЦВЕТОВОЕ ДУПЛЕКСНОЕ СКАНИРОВАНИЕ И ТРАНСКРАНИАЛЬНАЯ ДОППЛЕРОГРАФИЯ ПРИ ОБСТРУКТИВНЫХ НАРУШЕНИЯХ ЦЕРЕБРАЛЬНОГО ВЕНОЗНОГО КРОВООБРАЩЕНИЯ
Одной из форм нарушения мозгового кровообращения является венозная энцефалопатия, медленно прогрессирующая, развивающаяся на фоне венозного застоя вследствие поражения венул, начиная от коры и белого вещества мозга до сужения или закупорки просвета магистральных вен на уровне шеи и верхнего средостения [1-5]. Синдром внутричерепной гипертензии [4-7], развивающийся как следствие повышения венозного и далее, ликворного давления, имеет в литературе такие синонимы, как: псевдотуморозный синдром [8-11], идиопатическая интракраниальная гипертензия [11, 12], доброкачественная внутричерепная гипертензия [8]. Доброкачественная внутричерепная гипертензия характеризуется застойными явлениями без наличия объемного процесса в полости черепа [13, 14]. Венозная энцефалопатия впервые была описана в 1957 году М.И. Холоденко [15] и трактовалась как дистрофия мозга при некомпенсированной форме венозного застоя, как нозологическую единицу ее выделяют отдельно от дисциркуляторной энцефалопатии [3, 16]. При этом большинство исследователей, занимающихся изучением венозного кровообращения, сходятся во мнении, что определить, на каком уровне венозной системы мозга происходит затруднение оттока крови, принципиально важно, но практически невозможно [17].
Поэтому появление в последнее десятилетие новых высокотехнологичных методов неинвазивного изучения венозной гемодинамики головы вывело проблему ее объективной оценки на новый клинико-диагностический уровень.
1. Анатомия и физиология системы церебрального венозного кровообращения
При нарушении оттока крови по венозным магистралям головы коллатеральное кровообращение обеспечивается расширением и перестройкой межвенозных анастомозов [18, 19]. Степень компенсации нарушенного венозного оттока может быть различной, что зависит от уровня поражения венозной системы, индивидуальных особенностей анастомозов и быстроты развития застойных явлений. Венозное русло головы включает в себя интра- и экстракраниальную (рис. 124, 125) сеть, функционируя как единая сосудистая система [3, 18, 20, 21].
Поверхностные вены мозга (vv. cerebri superficialis superiores et inferiors) собирают кровь с поверхностей полушарий мозга и впадают в верхний сагиттальный, поперечный, каменистый и пещеристый синусы [16]. На выпуклой поверхности мозга две крупные вены, играющие роль анастомозов: v. Trolard - соединяет среднюю поверхностную вену с верхним сагиттальным синусом, v. Labbe - соединяет ту же вену с поперечным синусом [15]. Передняя вена мозга (v. cerebri anterior), лежащая на медиальной поверхности полушарий мозга, впадает в вену основания (v. basalis Rosental). Последняя является парной и образуется из слияния вен подкорковых узлов, серого бугра и передней вены мозга.

Рис. 124 а. Нормальная МР-ангиограмма венозных сосудов головного мозга в сагиттальной проекции: 1)верхний сагиттальный синус; 2)сток синусов; 3) поперечные синусы; 4) сигмовидные синусы; 5) внутренние яремные вены; 6) внутренние вены мозга; 7) нижний сагиттальный синус; 8) вена Галена; 9) прямой синус; 10) кавернозные синусы; 11) нижние каменистые синусы; 12) верхние каменистые синусы; 13) вена Троларда; 14) крыло-теменной синус; 15) эмиссарии затылочной области.

Рис. 124 б. МР-ангиограмма венозных синусов головного мозга в коронарной проекции: 1-15 (см. рис. 124 а); 16) базальные вены Розенталя; 17) вена Лаббе.

Рис. 124 в. МР-ангиограмма венозных синусов головного мозга в аксиальной проекции: 1-17 (см. рис. 124 а, 124 б); 18) верхние глазные вены; 19) вены намета мозжечка.
Мозжечковые вены (v.cerebelli superio- res et inferiores) впадают в большую вену мозга (v. cerebri magna Galeni) и в прямую, поперечную и наружную каменистые пазухи. Глубокие вены мозга собирают кровь из его центральных отделов, стенок боковых желудочков и сосудистых сплетений, ядер основания, белого вещества лобных, теменных и затылочных областей мозга. Все глубокие вены мозга впадают в более крупные вены: внутренние и большую вену (Галена). Внутренняя вена расположена в области межжелудочкового отверстия и сосудистой покрышки III желудочка. Вена Галена впадает в прямой синус (sinus rectus) под углом, выпуклым кверху. В задней части большого серповидного отростка вблизи мозжечкового намета располагается передний венозный сток - место слияния крови от глубоких отделов мозга [15].
Поверхностные и глубокие вены мозга вливаются в венозные пазухи (синусы) твердой мозговой оболочки которые в отличие от вен имеют туго натянутые стенки, состоящие из фиброзной ткани. Венозные пазухи тесно связаны с оболочечными и диплоическими венами, а также внечерепной венозной системой. Верхняя сагиттальная (стреловидная) пазуха (smus sagittaiis superior) идет вдоль верхнего края большого серповидного отростка твердой мозговой оболочки. Нижняя сагиттальная пазуха (sinus sagittaiis inferior) проходит по нижнему краю большого серповидного отростка и сзади впадает в прямую пазуху Последняя, направляясь к внутреннему затылочному бугру, соединяется с поперечной пазухой (sinus transverus) Поперечная пазуха - парная, правая обычно больше левой [15] Располагаясь вдоль заднего края намета мозжечка, она у пирамиды височной кости переходит в сигмовидную пазуху (sinus sigmoideus), лежащую в одноименной борозде височной кости. Кровь из нее поступает в верхнюю луковицу внутренней яремной вены.
В наблюдениях Д. Б. Бекова [22, 231 выделяются две крайние формы строения синусного стока. Первая характеризуется преимущественным переходом верхнего сагиттального синуса в правый поперечный, а прямого синуса - в левый поперечный (79%) Отток крови из синусного стока у этих людей осуществляется по правому поперечному и сигмовидному синусам далее по правой внутренней яремной вене которая почти по прямой пинии переходит в правую плечеголовную (безымянную) и верхнюю полую вены.

Рис. 125. Нормальная МР-ангиограмма брахиоцефальных вен: а. «сырой» срез шеи;

б. реконструированная коронарная МР-ангиограмма; 1) верхняя полая вена, 2) безымянные вены; 3) внутренние яремные вены; 4) наружная яремная вена: 51 вены позвоночного сплетения 6) подключичные вены 7) передняя яремная вена.
Отток крови из прямого синуса проходит по значительно меньшему левому поперечному синусу сигмовидному синусу и далее в левую яремную вену которая переходит в левую плечеголовную вену образуя угол приближающийся к прямому. Лишь миновав левую плечеголовную вену, впадающую под значительным углом, иногда даже приближающимся к прямому (у брахиморфных), к прямому кровь впадает в верхнюю полую вену. Таким образом, путь движения крови слева оказывается значительно длиннее и имеет препятствия в виде углов, приводящих к затруднениям движения крови. Следовательно, у большинства людей кровь от коры головного мозга оттекает к сердцу наиболее коротким путем, а от прямого синуса, несущего кровь от белого вещества и подкорковых образований, - несколько более длинным путем.
Вторая крайняя форма строения синусного стока характеризуется переходом верхнего сагиттального синуса в левый поперечный и далее в левую яремную вену, а прямого синуса - в правый поперечный (21%). Отмечают, что в этих случаях отток крови от головного мозга оказывался более сложным. Правый поперечный синус, как правило, также был больше левого за счет того, что часть крови верхнего сагиттального синуса течет в него через сообщительный канал [23].
Пещеристая пазуха (sinus cavernosus) - парная, находится по бокам от турецкого седла, вблизи основной и височной костей. Пещеристые пазухи соединяют между собой передняя (sinus intercavernosus anterior), задняя (sinus intercavernosus posterior), а иногда и нижняя (sinus intercavernosus inferior) межпещеристые пазухи, образуя циркулярный синус (sinus circularis) Ридлея [15]. В пещеристые пазухи впадают верхние и нижние глазные вены (vv. орhtalmica superiores et inferiores). Верхняя каменистая пазуха (sinus petrosus superior) - парная, залегает в верхней каменистой борозде височной кости и связывает сигмовидную пазуху с пещеристой. Нижняя каменистая пазуха (sinus petrosus inferior) - парная, расположена в нижней каменистой борозде височной кости и впадает в верхнюю луковицу внутренней яремной вены. Клиновидно-теменная (sinus sphenoparietalis) пазуха (или крыло-теменная [24, 25]) - парная, располагается вдоль малого крыла основной кости и соединяет пещеристый и верхний сагиттальный синусы. Затылочная пазуха (sinus occipitalis) обычно непарная, но может быть парной и тройной. Идет из поперечной пазухи, начинаясь возле стока, делится на две ветви краевого синуса и обходит полукольцом большое затылочное отверстие. Впадает в сигмовидную пазуху или верхнюю луковицу внутренней яремной вены.
Существуют полярные мнения о статистике наличия затылочного синуса. Д.Б. Беков отмечает его наличие в 4% [22, 23]. М.И. Холоденко, напротив, в 8% случаев отмечает его отсутствие [15]. К добавочным путям венозного оттока относятся выпускники (vv. emissariae), диплоические вены (vv. diploicae) и вены твердой мозговой оболочки. Венозные выпускники, расположенные в костях черепа, соединяют венозные пазухи с диплоическими венами и с наружными венами головы. Самым крупным венозным выпускником является сосцевидный (v. emissaria mastoidea), соединяющий сигмовидную пазуху с затылочными венами. Диплоические вены разделяются на лобные, височные и затылочные. Вены твердой мозговой оболочки (vv. durales) имеют многочисленные анастомозы и впадают в верхний сагиттальный синус или в экстракраниальные вены [3].
Внутренние яремные вены (vv. jugularis internae), являясь продолжением сигмовидных венозных синусов головного мозга, начинаются от яремных отверстий основания черепа [26, 27], направляются вниз в составе сосудисто- нервного пучка с двух сторон почти параллельно. Обе внутренние яремные вены имеют верхнюю и нижнюю луковицы (веретенообразные расширения). В луковицах в большинстве случаев расположено по одному клапану (иногда отсутствуют) Обычно правая внутренняя яремная вена (ВЯВ) шире левой [24] Сливаясь с подключичными под углом, близким к прямому, внутренние яремные вены образуют безымянные (плечеголовные) вены (vv. brachioceph- alicae).
Левая безымянная вена (протяженность ее около 6 см) сливается с правой (протяженность около 2,5 см), образуя верхнюю полую вену (протяженность 6- 7 см) [27]. Наибольшая концентрация венозных притоков среднего диаметра наблюдается чаще в области венозного угла. Правая безымянная вена начинается за правым грудино-ключичным сочленением, идет вертикально [27] или косо [26] вниз и несколько медиально Обычно правая безымянная вена шире левой. Ранее описано [26] два различных варианта венозного угла слияния безымянных вен в верхнюю полую: У- и Ч-образные типы строения представленные в зеркальном отражении. При У-образном варианте левая безымянная вена идет косо вниз и слева направо, и сливается с правой безымянной под острым углом. При Ч-образном варианте угол слияния приближается к прямому Отмечено, что У-образный вариант встречается чаще. Верхняя полая вена (ВПВ) имеет ствол чаще прямой, реже изогнутый выпуклостью вправо. Иногда наблюдается S-образное искривление [26] Левостороннее расположение ВПВ встречается в 0,5% в общей популяции и от 3 до 10% - у больных с пороками сердца [28]
Внутренние яремные вены - основной, но не единственный путь оттока крови от мозга. В яремную вену оттекает 2/3 крови от своей стороны [18]. Позвоночные вены (в 25% случаев только одна вена) - дополнительный путь оттока венозной крови от головы [18 29 30] Они формируются на уровне атланто-окципитального синуса, анастомозируя с венами головы, внутренними яремными венами венами грудной полости и забрюшинного пространства. На уровне окципитального синуса и подзатылочных венозных сплетений происходит активация венозного кровотока за счет передачи энергии пульсации с позвоночной артерии. Таким образом, богатая анастомотическая сеть между бассейнами внутренних яремных и позвоночных вен обеспечивает коллатеральный отток венозной крови из полости черепа в условиях окклюзии (компрессии) яремных вен или верхней полой вены [18].
Наряду с присасывающим действием сердца немаловажную роль в гемодинамике брахиоцефальных вен играют дыхательные движения [27, 31]. В течение первой трети вдоха венозное давление в яремной вене падает до нуля, затем, несмотря на увеличение отрицательного давления в грудной полости, несколько повышается Тем не менее скорость кровотока во время вдоха, несмотря на частичный коллапс вен, остается большей, чем во время выдоха. Понижение давления в венах верхней апертуры грудной клетки указывает на «истощение» периферических вен (увеличение притока крови к правому предсердию) Повышение венозного давления свидетельствует об увеличении сопротивления и, следовательно, об уменьшении кровотока При значительном повышении венозного давления просвет вен становится не овальным, а круглым [32]. При отсутствии отдельных вен и синусов происходит компенсаторное развитие анастомотической сети, но несмотря на это, возможны глубокие нарушения мозговой венозной гемоциркуляции [33]. В литературе описано немало случаев отсутствия внутренних яремных вен при сохранении достаточного венозного оттока, однако есть сообщения и о летальных исходах после перевязки внутренних яремных вен на шее [18]. В норме отток осуществляется в основном по внутренним яремным венам, а позвоночные вены и венозные сплетения функционируют лишь в качестве «предохранительного клапана». Позвоночные сплетения защищают головной мозг от перегрузки венозной кровью, дренируя большую часть оттекающей крови, когда возникает препятствие на путях оттока в грудной клетке [3, 15, 18].
2. Лучевые методы диагностики нарушений церебрального венозного кровообращения
В настоящее время для уточнения причин и степени нарушения венозного оттока из полости черепа используют новые современные методы диагностики: цветовое дуплексное сканирование (ЦДС), транскраниальная допплерография (ТКД), транскраниальное цветовое дуплексное сканирование (ТК ЦДС), рентгенконтрастная ангиография (РА), радионуклидная синусосцинтиграфия (РССГ), компьютерная томография (КТ), спиральная компьютерно-томографическая ангиография (СКТА), магнитно-резонансная томография (МРТ) и магнитно-резонансная ангиография (МРА).
Метод ЦДС позволяет с определенной степенью достоверности оценить диаметр, площадь поперечного сечения вен, определить линейную скорость кровотока, вычислить объемную скорость кровотока по внутренним яремным венам [34], хотя исследования могут быть ограничены доступностью сравнительно небольшого участка брахиоцефальных вен [35]. Отмечена возможность использования цветового дуплексного сканирования в диагностике обструкции брахиоцефальных вен опухолями и увеличенными лимфоузлами [36-38]. Определено [39], что гемодинамически значимая экстравазальная компрессия яремной вены характеризуется монофазностью кровотока проксимальнее места сдавления. Когда внутричерепное давление превышало артериальное, имел место двухфазный кровоток как проявление феномена внутричерепного диастолического обратного кровотока [8]. ЦДС позволяет достоверно оценить диаметр, площадь сечения вен, линейную скорость кровотока, объемную скорость кровотока по внутренним яремным венам [41, 42]. Однако в связи с тем, что венозный кровоток имеет низкую скорость, в отличие от артериального, и не является пульсирующим, «типичные для артериального стеноза нарушения гемодинамики для венозного тромбоза не характерны» [8]. Высказано мнение, что закон Пуазейля, используемый для объяснения характеристик артериальной гемодинамики, малоприемлем для венозных сосудов из-за значительно большей способности вен к растяжению и спадению [37]. Ch. Kondo et al. [42] установили, что чувствительность ЦДС в диагностике тромбоза брахиоцефальных вен в сравнении с MP-ангиографией составляет 91%, специфичность в 93% дает информацию в реальном масштабе времени о потоке и окружающих тканях [43, 44]. Кроме того, отмечено, что локация вен шеи значительно сложнее, чем локация артерий, так как при давлении датчиком вероятна деформация исследуемой вены [36].
Изучить показатели гемодинамики в прямом синусе и базальных венах Розенталя дает возможность метод ТКД [45, 46], недостатком ТКД является то, что она позволяет изучить показатели гемодинамики интракраниальных венозных сосудов только в прямом синусе и базальных венах Розенталя [8], но без визуализации стенки и определения размеров сосудов [47]. Основными гемодинамическими признаками доброкачественной внутричерепной гипертензии при ТКД считается повышение максимальной скорости и усиление псевдопульсации кровотока в церебральных венах и синусах [8] (венах Розенталя >15 см/с вене Галена >20 см/с и прямом синусе >30 см/с) [32, 47, 48]. Предполагают, что при хронически текущих процессах в полости черепа венозное кровообращение страдает значительнее. Отмечается, что, несмотря на доступность ТКД и возможность его широкого применения, допплерографические параметры лишь частично отражают картину нарушения венозного кровообращения [17]. Показанием к проведению ТКД считают также необходимость «изучения характеристик кровотока в сосудах орбиты» [49]. Отмечено, что резкое усиление венозного сигнала изменение физиологического направления кровотока по верхней глазной вене на ретроградное выявляют на стороне «очага» поражения мозга при нарушениях мозгового кровообращения черепно-мозговой травме, сопровождаемых повышением внутричерепного давления. Одним из механизмов компенсации при затруднении венозного оттока в случаях дисциркуляторной энцефалопатии I-II ст. считают ускорение кровотока по базальным венам Розенталя (до 33 см/с). В поздних стадиях хронической цереброваскулярной недостаточности возможности компенсации исчерпываются, что выражается в снижении индекса пульсации и отсутствии нарастания скорости [50]. Отмечают снижение скорости кровотока в прямом синусе и венах Розенталя, как признаки внутричерепной гипертензии [51].
Получать точный «внутренний слепок» внутричерепных венозных пазух и вен, брахиоцефальных вен позволяет рентгеноконтрастная ангиография, являющаяся «золотым стандартом» в ангиологии [52-58]. Типичным РА-признаком является отсутствие визуализации синуса или вены [59] В клинической практике к контрастной флебографии прибегают, в основном, только в случаях тромбоза верхней полой вены [55], верхнего сагиттального и поперечного синусов и глубоких вен [59]. так как манипуляция связана с риском, часто неоправданным при умеренно выраженных неспецифичных явлениях венозного застоя [8, 56]
Конвенциальная КТ дает возможность судить об объеме деструктивных изменений височной кости [60] и распространенности процесса на близлежащие участки мозга при отогенных внутричерепных осложнениях, визуализировать участки кровоизлияний при геморрагических инсультах, зоны отека при венозных тромбозах, оценить диаметр шейных вен и их взаимоотношения с окружающими структурами [61 62], но не отображает характеристик потока крови и сопровождается лучевой нагрузкой [63]. Прямыми доказательствами тромбоза верхнего сагиттального синуса считают «дельта-признак», чувствительность КТ при тромбозах внутричерепных синусов 80% [59]. Визуализировать сосуды во взаимоотношениях с окружающими тканями [64-66], диагностировать поражения верхнего сагиттального, нижнего сагиттального, сигмовидных, поперечных и прямого синусов, вены Галена и внутренних вен мозга также хорошо, как и контрастная ангиография позволяет СКТА [67]. Определить степень нарушения венозного оттока при количественной оценке асимметрии распределения радионуклидов по магистральным венозным коллекторам позволяет РССГ [17, 57, 68-70]. При конвенциальной МРТ установление диагноза тромбоза ограничено небольшим периодом заболевания, что связано с особенностями MP-визуализации кровяного сгустка [59].
Получать изображения сосудов без введения контрастных веществ и лучевой нагрузки позволяет метод магнитно-резонансной ангиографии. Отсутствие кровотока проявляется отсутствием МР-сигнала [71, 72]. Отмечено, что МРА при венозной обструкции брахиоцефальных вен более точна (99%), а также чувствительнее (96%) и специфичнее (100%) других методов. Те же параметры для РА [73] составили - 95%, 92% и 95% соответственно; при КТ - 90%, 71% и 98%, соответственно [74]. В диагностике тромбоза брахиоцефальных вен точность метода ЦДС составила 92%, чувствительность - 91% и специфичность 93% [75]. К недостаткам МРА относят [76, 77] продолжительность исследования, необходимость для пациентов сохранять неподвижное положение, «выпадение» сигнала от кровотока из-за артефактов турбулентности [78], малого калибра сосудов, медленного тока крови [79].
Наряду с развитием высоких технологий в диагностике, до настоящего времени остаются недостаточно освещенными вопросы закономерностей церебральной венозной гемодинамики в норме и патологии, в особенности неинвазивной лучевой визуализации брахиоцефальных вен, внутричерепных вен и венозных синусов. Нередко исследователи эмпирически отмечают выраженную асимметрию калибра и скорости кровотока внутренних яремных вен, необычные визуальные эффекты кровотока в проекции церебральных венозных структур. В большинстве случаев расширение обследования пациентов с такими проявлениями приводит к диагностике нарушений церебрального венозного кровообращения вследствие тромбоза или экстравазальной компрессии венозных коллекторов головного мозга. Оценка результатов каждого из перечисленных методов в отдельности не дает целостного представления о причинах и степени нарушения церебрального венозного кровотока, компенсаторных изменениях, происходящих в результате обструкции венозных структур мозга.
2.1. Методики ультразвукового исследования венозного кровообращения головы и шеи
Ультразвуковое исследование венозной системы головы было проведено у 215 пациентов (возраст 18-75 лет, средний 43,48 + 13,89) с клиническими признаками внутричерепного застоя.
По классификации М.Я. Бердичевского [18] пациентов разделили на 3 группы: 1) с латентной (доклинической) формой церебральной венозной дисциркуляции (65 пациентов - 30,2%); 2) с церебральной венозной дистонией (118 пациентов - 54,9%); 3) с венозной энцефалопатией (32 пациента - 14,9%).
Для исследования были отобраны пациенты, направляемые лечащими врачами из лечебных учреждений с диагнозами «внутричерепной венозный.
застой» и/или «венозная энцефалопатия», у которых при КТ или МРТ головного мозга не было диагностировано объемных образований мозга, церебрального арахноидита, каротидно-кавернозных соустий, артериальных и артерио-венозных аневризм.
Контрольная группа (104 человека) была сформирована из здоровых добровольцев (70 человек) и пациентов без каких-либо признаков внутричерепного венозного застоя (34 пациента) в возрасте от 18 до 63 лет, в среднем 42,04 ± 8,99 (Р<0.001).
Цветовое дуплексное сканирование яремных вен с цветовым картированием кровотока проводили в положении пациента на спине на сонографе Sonos 2500 фирмы «Hewlett Packard». Вначале определяли площадь сечения и среднюю линейную скорость кровотока по общим сонным артериям и позвоночным артериям по общепринятым стандартным методикам с последующим подсчетом совокупного объема притока крови к голове. Для ЦДС внутренних яремных вен линейный ультразвуковой датчик с частотой 5 МГц располагали поочередно на каждой из боковых сторон шеи (в области грудино-ключично-сосцевидной мышцы) Исследование проводили в двух плоскостях сканирования - поперечной и продольной. Сканирование вен выполняли через нанесенную на кожу «гелевую подушку», погружая в нее датчик, но не входя при этом в соприкосновение с кожей. Начинали сканирование в поперечной плоскости от ключицы, измеряли площадь сечения вен (см2) в области нижней луковицы, затем вены сканировали в продольной плоскости, что позволяло исследовать просвет вены в В-режиме и визуализировать тромб в случае тромбоза, уточняя детали и особенности кровотока в режиме цветового допплеровского картирования (ЦДК). Вычисление средней скорости кровотока производили по спектру допплеровского сдвига частот в ограниченной зоне, выделенной рамкой ROI (Region of Interest). Верхнюю и нижнюю границы рамки располагали на одинаковом расстоянии от стенок сосуда. Угол ROI ориентировали соответственно направлению кровотока. Расчет средней линейной скорости кровотока (см/с) осуществляли путем окаймления спектра средних значений скорости в течение пяти сердечных циклов. Объемную скорость кровотока (см3/с или мл/с) вычисляли, получая произведение площади сечения вены на среднюю линейную скорость кровотока.
На ультразвуковом допплеровском аппарате Angiodyne фирмы DMS (ФРГ) векторным датчиком 2 МГц проводили транскраниальную допплерографию (ТКД) в горизонтальном положении пациента на спине. Из транстемпорального доступа производили лоцирование базальных вен Розенталя с двух сторон, вены Галена и прямого синуса. Датчик помещали в области чешуи височной кости кпереди от ушной раковины (заднее транстемпоральное окно), в области угла глаза (переднее транстемпоральное окно) и между ними (среднее транстемпоральное окно). Определяли пиковую систолическую скорость (см/с) после обнаружения венозного шума в проекции венозных структур.
Из трансорбитального доступа лоцировали верхние глазные вены. Ультразвуковой датчик устанавливали на верхнее веко закрытого глаза под углом 10° к верхнему краю орбиты, предварительно предложив пациенту смотреть вниз, на ноги и уменьшив мощность прибора до минимума (10-15%
нормы). Путем легких покачиваний датчика проводили поиск и распознавание сигнала от глазной вены. Локацию вены обеспечивали предварительным определением сигнала от надблоковой артерии, располагающейся в непосредственной близости от глазной вены [17]. Определяли линейную скорость и направление кровотока, асимметрию этих показателей.
Параллельно, с целью верификации диагноза, мы проводили анализ результатов МРТ головного мозга и МРА церебральных венозных сосудов (выполненных во всех случаях, в том числе в 55 случаях с контрастным усилением), конвенциальной КГ в 70 случаях, СКТА в 55 случаях, РССГ у 11 пациентов с уточненными причинами и локализацией затруднения венозного кровотока головного мозга и у 13 пациентов без признаков интракраниального венозного застоя из контрольной группы, РА в 2 случаях, а также протоколы операций на внутреннем ухе с ревизией пораженных сигмовидных синусов в 9 и патологоанатомических секций в 2 случаях.
2.2. Показатели нормы при УЗИ венозной системы головы и шеи
При транскраниальной допплерографии у лиц контрольной группы показатели максимальной скорости кровотока по интракраниальным венозным структурам (вена Галена, базальные вены Розенталя и прямой синус) не отличались от аналогичных показателей других исследователей [8, 47]. Максимальная скорость кровотока колебалась по венам Розенталя от 7 до 19 см/с (в среднем 12,36 см/с), по вене Галена - от 12 до 32 см/с (в среднем 24,47 см/с), по прямому синусу - от 14 до 35 см/с (в среднем 26,52 см/с). При локации кровотока в норме по верхним глазным венам кровоток антеградный, в 5% кровоток лоцировался с клапанным эффектом. Максимальная скорость колебалась в диапазоне от 5 до 34 см/с (в среднем 10,46 см/с).
При цветовом допплеровском сканировании внутренних яремных вен в норме было установлено, что показатели кровотока зависят от анатомического варианта венозного угла бифуркации безымянных вен. Выделено три типа строения венозного угла (рис. 126) бифуркации безымянных вен: ![]() (мю)-тип (обнаружен в 30,8% случаев),
(мю)-тип (обнаружен в 30,8% случаев), ![]() (гамма)-тип (59,6%) и Y (ипсилон)-тип (9,6%).
(гамма)-тип (59,6%) и Y (ипсилон)-тип (9,6%).
Данное разделение вариантов анатомического строения венозного угла бифуркации безымянных вен оправдано значительными различиями в их гемодинамике, оказавшейся в непосредственной зависимости от значений углов, под которым безымянные вены сливались в верхнюю полую вену. Использование в обозначении типов венозных углов строчных букв греческого алфавита мы сочли возможным благодаря полному конструктивному сходству этих букв и анатомии трех различных типов венозных углов, а также с целью унификации медицинских наименований на греческом языке.
При р-типе бифуркации безымянных вен во всех случаях отмечали более низкие показатели (табл. 28) линейной и объемной скорости кровотока по левой внутренней яремной вене по сравнению с правой, вследствие анатомически обусловленного затруднения кровотока. Асимметрия объемной скорости кровотока (соотношение показателей справа и слева) составила в среднем 60% (или в 2,5 раза).
Таблица 28. Показатели гемодинамики внутренних яремных вен при ![]() -типе венозного угла (п=32, р<0.05).
-типе венозного угла (п=32, р<0.05).
|
Показатели гемодинамики по внутренним яремным венам |
Правая |
Левая | ||
|
Диапазон |
М ± m |
Диапазон |
М ± m | |
|
Средняя ЛСК (см/с) |
12.4-65.6 |
33.34 ± 11.01 |
8.8-45.5 |
19.49 ±6.76 |
|
Площадь сечения (см2) |
0.61-2 |
1.2 ±0.34 |
0.32-1.6 |
0.79 ±0.28 |
|
Объемная скорость кровотока (см3/с) |
14.01-81.6 |
36.78 ± 13.1 |
5.58-29.12 |
14.42 ±5.65 |

Рис. 126. МР-ангиограммы брахиоцефальных вен в норме: а. ![]() - (мю) тип венозного угла бифуркации безымянных вен; б.
- (мю) тип венозного угла бифуркации безымянных вен; б. ![]() - (гамма) тип; в. Y- (ипсилон) тип.
- (гамма) тип; в. Y- (ипсилон) тип.
При ![]() -образном варианте венозного угла (табл. 29) ЛСК по левой внутренней яремной вене ниже, чем по правой, в среднем не более чем в 1,5 раза. Асимметрия объемной скорости кровотока (соотношение показателей справа и слева) составила в среднем 36% (или в 1,5 раза). Такая относительно небольшая, в сравнении с
-образном варианте венозного угла (табл. 29) ЛСК по левой внутренней яремной вене ниже, чем по правой, в среднем не более чем в 1,5 раза. Асимметрия объемной скорости кровотока (соотношение показателей справа и слева) составила в среднем 36% (или в 1,5 раза). Такая относительно небольшая, в сравнении с ![]() -типом, разница обусловлена отсутствием значительного препятствия венозному кровотоку. В случаях Y-варианта венозного угла разница линейной скорости по внутренним яремным венам справа и слева не превышает 18%. Асимметрия объемной скорости кровотока составила в среднем лишь 6% (табл. 30).
-типом, разница обусловлена отсутствием значительного препятствия венозному кровотоку. В случаях Y-варианта венозного угла разница линейной скорости по внутренним яремным венам справа и слева не превышает 18%. Асимметрия объемной скорости кровотока составила в среднем лишь 6% (табл. 30).
Таблица 29. Показатели гемодинамики внутренних яремных вен при ![]() -типе венозного угла (n=62 р<0.05).
-типе венозного угла (n=62 р<0.05).
|
Показатели гемодинамики по внутренним яремным венам |
Правая |
Левая | ||
|
Диапазон |
М ± m |
Диапазон |
М ± m | |
|
Средняя ЛСК (см/с) |
9.4-114 |
31.11 ± 13.32 |
9.7-59 |
20.26 ± 9.32 |
|
Площадь сечения (см2) |
0.3-1.82 |
0.81 ± 0.2 |
0.43-1.81 |
0.78 ± 0.27 |
|
Объемная скорость кровотока (cm3/c) |
5.83-43.32 |
23.84 ± 5.71 |
8.13-53.1 |
5.21 ± 7.64 |
Таблица 30. Показатели гемодинамики внутренних яремных вен при Y-типе венозного угла (n=10, р<0.05)
|
Показатели гемодинамики по |
Правая |
Левая | ||
|
внутренним яремным венам |
Диапазон |
М ± m |
Диапазон |
М ± m |
|
Средняя ЛСК (см/с) |
15-51.5 |
33.39 ± 8.86 |
14.3-37.47 |
28.08 + 7.56 |
|
Площадь сечения (см2) |
0.26-0.55 |
0.49 ± 0.08 |
0.3-1.2 |
0.65 ± 0.24 |
|
Объемная скорость кровотока |
7.8-25.75 |
16.04 ± 4.85 |
9.58-25.8 |
17.08 + 5.00 |
|
(см3/с) |
|
|
|
|
Небольшое число случаев, когда левая внутренняя яремная вена была в норме шире правой (всего в 21,15% случаев) наблюдали при Y-типе (5 случаев) и при ![]() -типе (15 случаев), тогда как на
-типе (15 случаев), тогда как на ![]() -тип пришлось всего 2 таких случая.
-тип пришлось всего 2 таких случая.
Таким образом, отмечено, что ЛСК и объемная скорость кровотока по правой и левой внутренним яремным венам в норме различны и, видимо, зависят от анатомического типа строения венозного угла бифуркации безымянных вен (рис. 127). В большинстве (совокупность случаев с р-типом и у-типом угла брахиоцефальных вен - 90.38%) наблюдений кровоток в основных церебральных венозных коллекторах слева был достоверно ниже, чем справа
Помимо этого было установлено, что в распределении кровотока большую роль играет анатомическое строение стока синусов (рис. 128).
В случаях, когда сток был не разделен, противоположные поперечные синусы, как правило, отходили от него под разными углами. Справа значения угла между верхним сагиттальным и поперечным синусами составляли в среднем 113 05е, слева - 108 7°. Таким образом, правый поперечный синус отходил под более пологим, гидродинамически «удобным» для потока углом.
3. Аномалии и патологические изменения церебральной венозной системы
Было установлено, что причинами развития внутричерепного венозного застоя в нашем исследовании послужили, в 37.5% - экстравазальная компрессия брахиоцефальных вен, в 53% - церебральный венозный тромбоз, в 1,5% - перевязка или удаление одной из внутренних яремных вен, в 8% - гипоплазия венозных сосудов.

Рис. 127. Различия объемной скорости кровотока по внутренним яремным венам справа и слева в норме при ЦДС, в среднем (мл/с, р<0.05).
Для выявления закономерностей и особенностей гемодинамики и визуализации венозного кровотока его условно разделили на три автономных дренажных бассейна оттока крови от головного мозга.
- Система основных церебральных венозных коллекторов, дренирующих большую часть коры большого и малого мозга (верхний сагиттальный, поперечный и сигмовидный синусы, брахиоцефальные вены).
- Венозная дренажная система промежуточного, среднего и, отчасти, заднего мозга (базальные вены Розенталя, вена Галена, прямой синус).
- Система венозного дренажа лобных и височных базальных отделов мозга и орбит (кавернозные синусы, глазные вены).
Такое разделение всех венозных структур головного мозга на три условно автономные системы связано с некоторыми особенностями гемодинамики этих систем, закономерностями компенсаторного перераспределения кровотока по коллатералям и анастомозам.
Цветовое дуплексное сканирование позволяет получить наиболее точные количественные показатели при гипоплазии внутренних яремных вен в результате возможности измерения калибра сосудов не по границам потока, как при МРА, а с учетом визуализируемых стенок сосудов. Кроме того, измерение скорости кровотока непосредственно в изучаемых сосудах делает метод ЦДС незаменимым в диагностике этих состояний.

Рис. 128. МР-ангиограммы синусов головы, варианты строения стока синусов:
а. правый поперечный синус является продолжением верхнего сагиттального синуса, а левый поперечный является продолжением прямого с небольшим сообщительным каналом (указано стрелкой);
б. сток синусов без сообщительного канала между правым и левым поперечным синусами (указано стрелкой).
Гипоплазированные внутренние яремные вены имели площадь сечения от 0,1 до 0 24 см2 (рис. 129), в среднем 0 17 см2. В нашем исследовании заключение о гипоплазии внутренней яремной вены основывалось на критерии меньшей площади сечения вены по отношению к площади сечения ипсилатеральной общей сонной артерии. Аналогичный критерий гипоплазии использовали Л.А. Бокерия с соавт. [51] в опубликованном в 2003 г. исследовании. Среднюю линейную скорость кровотока регистрировали в диапазоне от 12,4 до 51,3 см/с, в среднем 36,4 см/с. Асимметрия кровотока по средним значениям объема кровотока при гипоплазии слева 70% (или в 3,3 раза), при гипоплазии справа 86% (или в 7 раз). При гипоплазии поперечных синусов площадь сечения ипсилатеральной внутренней яремной вены во всех случаях была также меньше обычной (от 0,37 до 0,66 см2), скорость кровотока по ней была невысокой - от 10,2 до 23 см/с, в среднем 15,5 см/с, при этом объемная скорость кровотока была меньше, чем по контралатеральной вене в среднем в 3 раза. Дополнительные стволы на стороне гипоплазированных внутренних яремных вен имели значительно меньшую площадь сечения (от 0,05 до 0,1 см2) и относительно высокую линейную скорость кровотока (от 20 до 41 см/с).

Рис. 129. Гипоплазия внутренней яремной вены (кодирована синим) на поперечной эхограмме в режиме ЦДК. Красным цветом кодирован кровоток по общей сонной артерии.
Транскраниальная допплерография позволяет определить закономерности гемодинамики по доступным для исследования интракраниальным венозным коллекторам, которые имели общую тенденцию к повышению максимальных скоростей как в случаях гемодинамически значимой экстравазальной компрессии брахиоцефальных вен, так и в случаях тромботической окклюзии основных церебральных венозных структур различной локализации (табл. 31). Отличия проявлялись в этих группах в связи с тем, что они были неоднородны по степени выраженности внутричерепного венозного застоя. Так, в группе из 55 случаев гемодинамически значимой экстравазальной компрессии брахиоцефальных вен в 30 (54,5%) наблюдали клинические признаки венозного застоя с общемозговыми и/или очаговыми неврологическими расстройствами и в 25 случаях (45,5%) - латентные проявления. Тогда как при тромботической окклюзии почти все пациенты (98,8%) имели клинические общемозговые проявления венозного застоя и/или очаговый неврологический дефицит и только у одного пациента из 83-х отмечали латентные проявления венозного застоя.
Таблица 31. Показатели максимальной ЛСК при ТКД по венозным коллекторам
головного мозга.
|
Венозные коллекторы |
При экстравазальной компрессии, n=55 (диапазон и средние значения, см/с) |
При тромботической окклюзии, n=83 (диапазон и средние значения, см/с) |
|
Базальные вены Розенталя |
10-18/14,33±2,32 |
11-58/30,03 ± 13,57 |
|
Вена Галена |
17-43 / 27.94 ± 7.93 |
21-45/34,5 + 7,7 |
|
Прямой синус |
15-47 /29.08 ± 11.3 |
30-66/47,5 ± 11,65 |
Частота локации венозных сосудов при ТКД в целом по этим группам пациентов составила 68%. Наблюдаемое увеличение скорости кровотока в 2-3 раза, в сравнении с нормальными показателями [8, 47], является одним из характерных признаков затруднения венозного оттока из полости черепа и зарегистрировано в подавляющем большинстве случаев. Полученные данные сходны с результатами других исследователей [80], отмечавших при затруднении венозного оттока увеличение скорости при ТКД в базальных венах до 26-52 см/с, в прямом синусе до 32-50 см/с. В большинстве случаев наблюдали усиление псевдопульсации. Однако в случаях длительно существующего внутричерепного венозного застоя у пожилых пациентов (старше 65 лет) регистрировали нормальные показатели ЛСК, что может быть связано с истощением компенсаторных миогенных механизмов церебральной сосудистой ауторегуляции и снижением сосудистой реактивности. При латентных формах венозного застоя, наблюдаемых почти в половине случаев гемодинамически значимой экстравазальной компрессии брахиоцефальных вен повышение максимальных скоростей по интракраниальным венозным сосудам не столь выражено, как у пациентов с венозным застоем, сопровождающимся общемозговыми и очаговыми неврологическими проявлениями [81, 82].
4. Цветовое дуплексное сканирование внутренних яремных вен в диагностике обструкции основных церебральных венозных коллекторов.
При нарушении оттока по одной из внутренних яремных вен площадь ее сечения и объемная скорость кровотока по ней могут прогрессивно снижаться в зависимости от длительности и выраженности компрессии. Исследованы показатели кровотока по внутренним яремным венам в двух случаях острой компрессии брахиоцефальных вен слева (сдавление флегмоной левой внутренней яремной вены и сдавление левой безымянной вены костным фрагментом грудины при ее переломе). В обоих случаях правая внутренняя яремная вена была шире левой, но объемный кровоток с двух сторон был почти одинаков за счет значительного увеличения (до 60 см/с) средней ЛСК по вене на стороне компрессии. Небольшое увеличение скорости (до 46 см/с) наблюдали в обоих случаях и с противоположной стороны. При этом обе внутренние яремные вены имели поперечный профиль, близкий к круглому (вне места компрессии), что свидетельствовало о повышении давления в венозной системе [32]. Такие проявления ауторегуляции кровотока характерны для острого периода и соответствуют II степени расстройства венозного кровообращения [15].
При длительно существующей гемодинамически значимой компрессии(53 наблюдения) механизмы компенсации кровотока, по-видимому, изменяются, происходит перераспределение оттока венозной крови в здоровую сторону и уменьшение площади сечения вены на стороне поражения (табл. 32, 33).

Рис. 130 Поперечные эхограммы шеи при хронической гемодинамически значимой компрессии левой внутренней яремной вены гипертрофированной мышцей: а. на стороне компрессии (V - левая внутренняя яремная вена, А - общая сонная артерия М - гипертрофированная мышца); б. с противоположной стороны: RJV - правая внутренняя яремная веча ССА - общая сонная артерия (показаны стрелками).
Площадь сечения компремированной вены в среднем была в 2 раза меньше контралатеральной (рис.130). В месте наибольшей компрессии просвет вены может быть щелевидным. Снижение показателей ЛСК и объемной скорости кровотока на пораженной стороне наблюдали как в месте компрессии, так и проксимальнее на протяжении (рис.131) Образно говоря, происходит «запустевание» вены. В контралатеральной внутренней яремной вене, напротив происходит увеличение объемной скорости кровотока с коэффициентом от 78% (или 4,4 раза) при левосторонней компрессии и до 91% (или в 11 раз) при правосторонней компрессии. Лишь в одном наблюдении двухсторонней хронической гемодинамически значимой компрессии внутренних яремных вен опухолью тела позвонка гемодинамические показатели с обеих сторон были очень низкими и практически одинаковыми.
Таблица 32. Показатели гемодинамики по внутренним яремным венам при хронической гемодинамически значимой компрессии слева (n=39 р<0 05)
|
Показатели гемодинамики по внутренним яремным венам |
Правая |
Левая | ||
|
Диапазон |
М ± m |
Диапазон |
М ± m | |
|
Средняя линейная скорость (см/с) |
16.6-63.5 |
30.5 ± 9.82 |
1.0-25.6 |
12.51 ± 6.01 |
|
Площадь сечения (см2) |
0.42-3.03 |
1.4 ± 0.56 |
0.32-2.1 |
0.78 ±0.39 |
|
Объемная скорость кровотока (см3/с) |
13.61-60.0 |
39.25 ± 10.11 |
0.45-19.42 |
8.78 ±4.34 |
Таблица 33. Показатели гемодинамики внутренних яремных вен при хронической гемодинамически значимой компрессии справа (n=13, р<0 05).
|
Показатели кровотока |
Справа |
Слева | ||
|
Диапазон |
М ± m |
Диапазон |
М ± m | |
|
Средняя линейная скорость (см/с) |
1.0-9 89 |
7.23 ± 3.0 |
16.8-35.4 |
23.5 ± 4.97 |
|
Площадь сечения (см2) |
0.08-0.63 |
0.38 ±0.15 |
1.02-3 09 |
1.44 ±0.51 |
|
Объем кровотока (см3/с) |
0.08-4.34 |
3.0 ± 1.36 |
18.8-60.87 |
33.49 ± 10.7 |

Рис. 131. Продольные эхограммы внутренних яремных вен шеи в триплексном режиме: а. выраженное снижение ЛСК по компремированной вене; б. усиление кровотока по контралатеральной (подробно в тексте).
Определена [81, 82] совокупность ультразвуковых признаков хронической гемодинамически значимой обструкции при экстравазальной компрессии брахиоцефальных вен:
- Локальное значительное уменьшение площади сечения вены (в 3-4 раза) с деформацией ее поперечного профиля в месте наибольшей компрессии.
- Уменьшение площади сечения компремированной вены на протяжении, проксимальнее уровня компрессии.
- Значительное расширение контралатеральной внутренней яремной вены в сравнении с компремированной веной (более чем в 3 раза).
- Снижение объемного кровотока в компремированной вене (предстенотическое «запустевание») в сравнении с компенсаторно расширенной контралатеральной веной с асимметрией средних значений не менее чем в 4 раза.
Таким образом, при хронической гемодинамически значимой компрессии брахиоцефальных вен происходят процессы ауторегуляции мозгового кровотока, которые направлены на глубокую и долговременную перестройку дренажного кровотока. Такая перестройка необходима вследствие того, что миогенные механизмы ауторегуляции острого периода не могут длительно действовать и истощаются [8, 83].
Гемодинамически незначимую экстравазальную компрессию брахиоцефальных вен наблюдали в 20 случаях (17 случаев слева, 1 - справа, 2-сдвух сторон). Признаками гемодинамически незначимой экстравазальной компрессии (табл. 34) могут служить: локальное уменьшение площади сечения вены (в среднем не более чем в 1,5 раза) с незначительной деформацией ее поперечного профиля и небольшим увеличением линейной скорости (в среднем не более чем в 1,5 раза) на уровне компрессии (во всех случаях, когда участок максимальной компрессии был доступен для исследования).
Таблица 34. Показатели гемодинамики по внутренним яремным венам при гемодинамически незначимой экстравазальной компрессии слева (n=17, р<0.01).
|
Показатели гемодинамики по внутренним яремным венам |
Справа |
Слева | ||
|
Диапазон М ± m |
Диапазон J М ± m | |||
|
Средняя линейная скорость (см/с) |
17.9-39.9 |
24.7 ± 5.27 |
14.6-29.74 |
19.76 ± 3.58 |
|
Площадь сечения (см2) |
0.81-2.08 |
1.36 ±0.31 |
0.67-1.25 |
0.87 ±0.17 |
|
Объемная скорость кровотока (см3/с) |
14.5-47.8 |
33.29 ± 7.9 |
10.88-27.0 |
17.25 ±4.36 |
При этом показатели кровотока по внутренним яремным венам при гемодинамически незначимой компрессии практически не отличаются от таковых в норме (рис. 132). Хотя отмечено, что объемная скорость кровотока слева меньше, чем справа, до двух раз при гемодинамически незначимой компрессии брахиоцефальных вен слева только в случаях с ![]() -образным строением венозного угла бифуркации безымянных вен что, видимо, обусловлено исходно неблагоприятными условиями кровотока слева. Хотя запустевания проксимальных отделов пораженной вены, турбулентности потока в дистальном отрезке, а также значительного расширения венозных коллатералей не отмечали.
-образным строением венозного угла бифуркации безымянных вен что, видимо, обусловлено исходно неблагоприятными условиями кровотока слева. Хотя запустевания проксимальных отделов пораженной вены, турбулентности потока в дистальном отрезке, а также значительного расширения венозных коллатералей не отмечали.
В трех случаях экстравазальной компрессии левой безымянной вены расширенной дугой аорты и ее ветвями в просвете внутренней яремной вены со стороны поражения наблюдали эффект псевдо-контрастирования (рис. 133). Этот эффект был представлен в виде пульсирующих поступательно-колебательных движений эхопозитивных сигналов по току крови в В-режиме и наблюдали только слева в условиях увеличения площади сечения внутренней яремной вены не менее чем 1,28-2,7 см2 и низкой средней ЛСК 1,03-13 см/с (во всех случаях это были пожилые пациенты с сопутствующей патологией, сопровождающейся повышенной вязкостью и сгущением крови). Подобный эффект известен [84, 85] для левого предсердия и считается предиктором тромбоэмболических осложнений.

Рис. 132. Отличия объема кровотока внутренних яремных вен справа и слева при значимой и незначимой компрессии (р<0.01).

Рис. 133. Ультразвуковой эффект псевдоконтрастирования в В-режиме во внутренней яремной вене: а. на поперечной сонограмме (стрелка); б. на продольной сонограмме.
В первом случае компрессии левой безымянной вены дугой аорты во внутренней яремной вене наблюдали эффект разнонаправленности кровотока (рис. 134) в виде перемежающегося цветового допплеровского картирования.
Этот эффект наблюдали также и при тромбозе основных парных церебральных венозных коллекторов в непораженных отделах внутренней яремной вены, что будет подробнее освещено в соответствующем разделе. Обнаруживался он только слева при средней ЛСК 3-29 6 см/с и вариабельной площади сечения.

Рис. 135. Продольная эхограмма внутренней яремной вены в триплексном режиме - эффект монофазности допплеровского спектра кровотока.
Наиболее распространенным признаком низкого кровотока при экстравазальной компрессии брахиоцефальных вен явился симптом монофазности допплеровского спектра кровотока (рис 135) по внутренней яремной вене [39] Этот симптом выявлен нами в 34 случаях (31 слева, 3 справа) при средней ЛСК от 3 82 до 23 3 см/с и вариабельной площади сечения.
4.1. Окклюзия внутренних яремных вен и основных церебральных венозных коллекторов
Методом ЦДС исследовали двух пациентов, вскоре после перевязки (острый период) одной из внутренних яремных вен, и в обоих случаях отмечена высокая скорость по противоположной яремной вене - 41,23 см2 с и 35.7 см/с. Площадь сечения сохранившихся внутренних яремных вен была - 1,4 см2 и 1,3 см2, объемная скорость кровотока – 57.7 см3/с и 46.41 см3/с соответственно. Эти показатели превышали показатели нормы в среднем в 2 раза. На протяжении 1,5- и 2-летнего наблюдения за этими пациентами указанные показатели практически не изменились. В третьем случае 5-летнего наблюдения после удаления одной из внутренних яремных вен зарегистрировано компенсаторное развитие трех крупных венозных стволов на месте противоположной вены Площади поперечного сечения стволов составили: 0.3 см2; 0.07 см2 и 0,11 см2. ЛСК 33,5 см/с; 20.5 см/с: 48.3см/с соответственно. Совокупная суммарная объемная скорость кровотока по трем венам была 16 79см3/с, что не превышало обычных показателей объемного кровотока по одной внутренней яремной вене.

Рис. 134 Цветовая картограмма кровотока по внутренней яремной вене: эффект разнонаправленности кровотока в режиме ЦДК.
Такая нормализация объемной скорости кровотока произошла через 5 лет, тогда как в остром периоде наблюдения регистрировали высокие линейную и объемную скорость кровотока, как и в других аналогичных случаях Уменьшение объемной скорости кровотока произошло на фоне визуализируемого при МРА расширения позвоночных вен и сплетений, развития множественных коллатералей и шунтов (рис. 136).
Тромботическая окклюзия основных церебральных венозных коллекторов была установлена при МРА в 79 наблюдениях. Тромбоз основных парных церебральных венозных коллекторов (латеральных синусов и брахиоцефальных вен) был диагностирован в 65 случаях (82,3%) - слева, 12 (15,2%)- справа, 2 (2,5%) - с двух сторон (в том числе в одном случае - с распространением на верхнюю полую вену). В том числе тромбоз внутренних яремных вен (в сочетании с поражением других венозных сосудов, и без такового) диагностирован в 14 случаях слева, в двух случаях с 2-х сторон. В шести случаях тромбоз был острым, в шести - подострым, в четырех - хроническим.
Методом прямой визуализации тромба, а, следовательно, верификации диагноза, явилась ЦДС в случаях тромбоза внутренних яремных вен.

Рис. 136. Состояние после удаления правой внутренней яремной вены (3 месяца после операции): а. «сырой» аксиальный срез; б. MP - ангиограмма вен шеи.

Рис. 137. Частичный тромбоз внутренней яремной вены: а. продольная эхограмма; б. поперечная эхограмма.
При неполном тромбозе просвет вены частично заполнен эхопозитивной массой тромба, расположенной обычно вдоль одной из стенок, имеющей ровные четкие контуры на границе с сохраненным потоком (рис. 137).

Рис. 138. а. полная тромботическая окклюзия внутренней яремной вены на продольной сонограмме; б. частичная циркулярная тромботическая окклюзия внутренней яремной вены на поперечной сонограмме.
При полном тромбозе в просвете вены выявляют однородное фиксированное эхопозитивное образование (рис. 138 а), при цветовом допплеровском картировании кровоток не лоцируется. Наблюдали и циркулярное расположение тромба в сосуде (рис. 138 б) при неполной окклюзии. В зависимости от стадии процесса изменялись характеристики самого тромба. Если в хронических случаях сформированный тромб имел высокую плотность (рис. 138 а), то в острых случаях он был неплотным, «рыхлым» (рис. 138 б). В сохранившемся просвете вены скорость была от 0,6 до 11 см/с. В противоположной внутренней яремной вене ЛСК при этом достигала 70 см/с, а площадь ее сечения увеличивалась до 3 см2.
В случаях, когда был диагностирован односторонний тромбоз сигмовидного и/или поперечного синусов, в ипсилатеральной нетромбированной внутренней яремной вене кровоток либо «практически отсутствовал» (средняя ЛСК не более 3 см/с) - 8 случаев, либо (в остальных случаях, независимо от ширины просвета вены) скорость достигала значений не более 17,8 см/с. Кровоток в нетромбированных внутренних яремных венах при поражении поперечного и сигмовидного синусов этой же стороны поддерживался за счет притока крови из нижнего каменистого синуса (система венозного дренажа базальных отделов лобных и височных долей мозга) и эмиссарных вен основания и затылочной области и при цветовом картировании не кодировался цветом (рис. 139).
В 2-х случаях тромбоза латеральных синусов во внутренней яремной вене на стороне поражения наблюдали эффект псевдоконтрастирования (рис. 133), в 3-х случаях эффект разнонаправленности кровотока (рис. 134). В 21-м случае наблюдался эффект монофазности допплеровского спектра кровотока в ипсилатеральной внутренней яремной вене (рис. 12) при тромбозе латеральных синусов слева. При правостороннем тромбозе латеральных синусов этот эффект не наблюдали. В 15-ти случаях (20%) тромбоз основных парных венозных коллекторов диагностирован через 0,5-4 года динамического наблюдения после первичного обнаружения двух и более визуальных эффектов низкого кровотока. В 10-ти случаях (13%) тромбоз произошел на стороне гемодинамически значимой экстравазальной компрессии и в 2-х случаях (3%) - на стороне гипоплазии
брахиоцефальных вен у пациентов с клинически выраженной церебральной венозной дистонией. В 3-х случаях (4%) тромбоз диагностирован при динамическом наблюдении пациентов с латентным внутричерепным застоем.
Отмечено несколько закономерностей изменения скорости кровотока по внутренним яремным венам при поражении латеральных синусов с одной стороны в случаях, когда внутренние яремные вены не поражены. В острых случаях скорость кровотока на пораженной стороне имеет относительно высокие значения (до 23,3 см/с), тогда как в хронических случаях скорость уменьшается до «практического отсутствия». Вероятно, это связано с перераспределением кровотока на уровне стока синусов при истощении миогенных механизмов ауторегуляции кровотока. В то же время скорость кровотока в противоположной внутренней яремной вене тем более высокая, чем дольше анамнез тромбоза. Также отмечено, что, чем длительнее существует тромбоз латеральных синусов, тем более значительной становится разница в площади сечения внутренних яремных вен. Противоположная вена тем шире, чем дольше существует тромбоз латеральных синусов. В острых случаях площадь сечения противоположной вены либо незначимо превышает площадь вены с пораженной стороны, либо даже может быть меньше. В хронических случаях почти всегда наблюдают большую площадь сечения внутренней яремной вены на противоположной поражению стороне, лишь в одном наблюдении отметили увеличение площади сечения внутренней яремной вены на стороне тромбоза латерального синуса в хронической стадии.
Нельзя не отметить, что при тромбозе основных венозных коллекторов слева объемный кровоток внутренней яремной вены справа больше, чем слева, в среднем на 84% (или в 6,3 раза) (табл. 35, рис. 140). Тогда как при тромбозе справа объемный кровоток внутренней яремной вены слева превышает таковой справа с асимметрией 60% (или в 2,5 раза) (табл. 36, рис. 140).

Рис. 139. Поперечная эхограмма с цветовым картированием кровотока. В просвете внутренней яремной вены кровоток не кодирован цветом (указано стрелкой).

Рис. 140. Объемная скорость кровотока по внутренним яремным венам справа и слева при тромбозе парных венозных коллекторов (р<0 05).
По нашему мнению, такой коэффициент асимметрии, а следовательно значительные отличия в возможностях компенсации кровотока, вероятнее, так же, как в норме и при экстравазальной компрессии, связаны с исходно худшими условиями кровотока в основных венозных коллекторах слева из-за особенностей анатомического строения угла брахиоцефальных вен и стока синусов В двух случаях двусторонней тромботической окклюзии гемодинамические показатели с обеих сторон были очень низкими и почти не отличались.
Таблица 35. Показатели гемодинамики внутренних яремных вен при тромботической окклюзии основных парных церебральных венозных коллекторов слева (n=65. р<0.05).
|
Показатели гемодинамики по внутренним яремным венам |
Правая |
Левая | ||
|
Диапазон |
М ± m |
Диапазон |
М ± m | |
|
Средняя ЛСК (см/с) |
8.98-80.7 |
33.61 ± 13.86 |
0.0-23.3 |
10.11 ±5.06 |
|
Площадь поперечного сечения (см2) |
0.35-3.8 |
1.54 ± 0.73 |
0.17-2.0 |
0.82 ± 0.36 |
|
Объемная скорость кровотока (см3/с) |
11.2-140.8 |
48.11 ±24.23 |
0.0-14.5 |
7.64 ± 3.8 |
Таблица 36. Показатели гемодинамики внутренних яремных вен при тромботической окклюзии основных парных церебральных венозных коллекторов справа
(n=12, р<0.05).
|
Показатели гемодинамики по внутренним яремным венам |
Правая |
Левая | ||
|
Диапазон |
М ± m |
Диапазон |
М ± m | |
|
Средняя ЛСК (см/с) |
3.0-20.7 |
11.64 ±4.88 |
14.5-68.1 |
30.87 ±14.1 |
|
Площадь поперечного сечения (см2) |
0.4-1.1 |
0.84±0.2 |
0.4-15 |
0.86±0,31 |
|
Объемная скорость кровотока (см3/с) |
1.26 - 16,2 |
10.09±4.49 |
6-35,7 |
24,7±7,95 |
В 82,3% случаев были тромбированы основные венозные коллекторы головного мозга слева (в 48 1 % - при ![]() -типе в 27 9% - при
-типе в 27 9% - при ![]() -типе: в 6,3% - при Y-типе угла брахиоцефальных вен) Справа поражение зарегистрировано только в 15,2% случаев (в 13,9% - при
-типе: в 6,3% - при Y-типе угла брахиоцефальных вен) Справа поражение зарегистрировано только в 15,2% случаев (в 13,9% - при ![]() -типе, в 1,3% - при
-типе, в 1,3% - при ![]() -типе) Таким образом, наиболее редкий, «симметричный» анатомо-физиологический Y-тип венозного угла брахиоцефальных вен явился наименее предрасполагающим к тромбозу. По нашему мнению, такая статистика распределения стороны поражения (рис. 141) связана с исходно худшими условиями кровотока в этих венозных структурах слева, вследствие «конструктивных особенностей» анатомического строения угла брахиоцефальных вен.
-типе) Таким образом, наиболее редкий, «симметричный» анатомо-физиологический Y-тип венозного угла брахиоцефальных вен явился наименее предрасполагающим к тромбозу. По нашему мнению, такая статистика распределения стороны поражения (рис. 141) связана с исходно худшими условиями кровотока в этих венозных структурах слева, вследствие «конструктивных особенностей» анатомического строения угла брахиоцефальных вен.
4.2. Транскраниальная допплерография в диагностике тромбоза в системе венозного дренажа
промежуточного и среднего мозга

Рис 141 Частота тромбоза в зависимости от анатомических типов бифуркации брахиоцефальных вен в %.
Тромбоз в системе венозного дренажа глубоких вен и синусов в нашем исследовании диагностирован в 14 случаях (1 случаи - тромбоз нижнего сагиттального синуса, 1 случай-тромбоз нижнего сагиттального и прямого синусов, 12 случаев - тромбоз базальных вен Розенталя). Чувствительность метода ТКД при исследовании кровотока в базальных венах оценивают от 84 до 100% [47]. В нашем единственном наблюдении тромбоза прямого синуса кровоток в нем при ТКД не лоцировали. Базальные вены Розенталя на непораженной стороне не лоцировали в 2-х случаях, учитывая попытки локации с двух сторон у каждого пациента. На стороне поражения отсутствие кровотока в базальной вене Розенталя подтвердилось в 10-ти случаях, в двух случаях кровоток не лоцировали ни на здоровой, ни на пораженной стороне. Таким образом, частота локации непораженных базальных вен составила 91,7%. При тромбозе левой базальной вены максимальная скорость кровотока в правой колебалась от 11 до 37 см/с, в среднем 26,6 см/с. При тромбозе правой базальной вены максимальная скорость кровотока в левой была от 21 до 31 см/с, в среднем 24,6 см/с, тогда как в норме, по данным отдельных авторов [47], в базальных венах Розенталя кровоток имеет максимальную скорость от 11 до 13,7 ± 4,7 см/с. В нашем исследовании только в одном случае максимальная скорость по вене Розенталя на здоровой стороне была в пределах нормы. Следовательно, можно считать, что повышение скорости в противоположной базальной вене является компенсаторным, а также может служить косвенным подтверждением гетерола-терального тромбоза базальной вены Розенталя. Кроме того, в 6 из 8 случаев (75%) при локации вены Галена (частота локации 66,6%) отмечено увеличение максимальной скорости кровотока в вене Галена от 24 до 40 см/с (в среднем 28,25 см/с) при тромбозе вен Розенталя, тогда как в норме она не превышает 20 см/с [32, 47]. И только в двух случаях (25%) скорость кровотока в вене Галена не была увеличена.
Тромбоз в системе дренажа кавернозных синусов и орбит в нашем исследовании был диагностирован в 9 наблюдениях (5 - слева, 4 - справа). При трансорбитальной локации верхних глазных вен кровоток во всех случаях был антеградным, хотя в литературе [84, 85] есть указания на возможность ретроградного кровотока при гомолатеральном синдроме Толоза-Ханта, который сходен с тромбозом своими патофизиологическими механизмами нарушения кровотока. Скорость кровотока в верхних глазных венах колебалась от 5 до 90 см/с. При тромбозе кавернозного синуса слева скорость по верхним глазным венам слева в среднем была 21,25 см/с, справа - 36,6 см/с. При тромбозе кавернозного синуса справа скорость по верхним глазным венам слева в среднем была 33,25 см/с, справа - 18,25 см/с. Таким образом, очевидно, что скорость кровотока по верхним глазным венам повышена с обеих сторон, но на стороне тромбоза кавернозного синуса меньше, чем на контралатеральной стороне.
Значительного отклонения от нормы показателей кровотока по другим венозным структурам головного мозга при патологии системы кавернозных синусов не отмечено.
Если реканализация тромбированных венозных структур не происходит, то организованный тромб претерпевает характерные изменения [37, 86]. Мы наблюдали 2 случая хронического тромбоза внутренней яремной вены на протяжении 2-х и 4-х лет. В обоих случаях развился фиброз и затем склероз организованного тромба. Склерозирование в просвете тромбированного сосуда происходило не равномерно, «слоями». При МРТ и ЦДС на месте тромба одновременно можно видеть участки фиброза и склероза (рис. 142).
В 4 из 79 случаев (5%) тромбоза основных парных церебральных венозных коллекторов мы наблюдали реканализацию. В 2 случаях реканализация при остром тромбозе произошла в течение 1 месяца (1 случай тромбоза левого поперечного синуса, 1 случай циркулярного тромбоза левой внутренней яремной вены) после активной тромболитической терапии. В 2 случаях хронического тромбоза левого сигмовидного синуса реканализация синуса зарегистрирована через 1 год. При контрольном ЦДС в случае реканализации внутренней яремной вены, на уровне ранее диагностированного острого циркулярного тромбоза патологических изменений выявлено не было.
Необходимо отметить, что в случае быстрой (в течение 1 месяца)реканализации циркулярно тромбированной внутренней яремной вены у 20-летнего пациента при ЦДС не отметили каких-либо отличий в стенках реканализованного сосуда от стенок нормального сосуда, что позволяет предположить отсутствие потери эластичности в реканализованных венах при быстром восстановлении кровотока по ним.
На основании проведенных исследований была определена диагностическая эффективность гемодинамически значимой обструкции церебрального венозного кровотока методами ЦДС и ТКД. Под обобщающим термином гемодинамически значимой обструкции церебрального венозного кровотока мы подразумевали гемодинамически значимую компрессию брахиоцефальных вен, а также церебральный венозный тромбоз любой локализации, как частичный, так и полный.
Диагностическая эффективность ЦДС для гемодинамически значимой обструкции церебрального венозного кровотока рассчитывали с использованием критерия асимметрии объемного кровотока по внутренним яремным венам (с асимметрией не менее 75% или в 4 раза при обструкции слева; с асимметрией 60% или в 2,5 раза при обструкции справа). Эффективность ЦДС в диагностике обструкции основных парных венозных коллекторов выше, чем МРТ и МРА: чувствительность - 79%, специфичность - 92,5%, диагностическая точность - 85%.

Рис. 142. Визуализация тромба в просвете левой внутренней яремной вены при хроническом тромбозе: а. при МРТ в T1 взв.; б. при ЦДС в просвете вены (между метками) визуализируются как участки фиброза, так и участки склероза.
Диагностическая эффективность ТКД для гемодинамически значимой обструкции церебрального венозного кровотока рассчитывали с использованием критериев отсутствия локации и/или значительного повышения скорости кровотока в интракраниальных венозных структурах. Для базальных вен Розенталя и верхних глазных вен считали повышенной скорость более 15 см/с. для вены Галена и прямого синуса - более 30 см/с. Диагностическая эффективность ТКД в сравнении с МРТ, МРА и ЦДС оказалась ниже: чувствительность - 63,7%, специфичность - 63,7%, диагностическая точность - 65%.
Таким образом, завершая главу о поражениях венозного кровотока в основных венозных коллекторах головы и шеи, мы прекрасно понимаем, что лишь приоткрываем природные «сундуки Гобсека», делая лишь очередной новый шаг на пути клинического изучения и ультразвукового познания венозной системы головы и шеи.
ГЛАВА 9
РЕГУЛЯЦИЯ МОЗГОВОГО КРОВООБРАЩЕНИЯ И УЛЬТРАЗВУКОВЫЕ МЕТОДЫ ЕЕ ОЦЕНКИ
Система гемоликвородинамики в полости черепа по своим биофизическим свойствам характеризуется постоянством объема сред, ее заполняющих, и возможностью перемещения некоторого объема ликвора из черепа в менее ригидную спинальную полость, что играет существенную роль в обеспечении кровоснабжения головного мозга. Сам же головной мозг, с одной стороны, требует интенсивного кровообращения, с другой - лишен депо окисляемого субстрата. Так, головной мозг человека, занимающий не более 2% веса тела, ежеминутно требует притока 13% минутного объема крови. Удельный мозговой кровоток составляет 50-60 мл/100 г/мин., причем в коре он более интенсивен (70-110 мл/100 г/мин.), чем в белом веществе (20-40 мл/100 г/мин.).
Основные задачи системы мозгового кровообращения заключаются в минимизации отклонения циркуляторного и химического гомеостаза головного мозга при различных функциональных состояниях, что предполагает сложную структурно-функциональную организацию процесса регулирования мозгового кровотока. В настоящее время общепризнано взаимодействие трех основных механизмов регуляции мозгового кровотока - миогенного, метаболического и нейрогенного [1, 2].
Миогенный механизм основан на эффекте Остроумова-Бейлиса: дополнительное растяжение артериальных стенок вызывает сокращение мышечных клеток и наоборот.
Нейрогенный механизм базируется на наличии в стенках мозговых сосудов симпатических и парасимпатических волокон и короткого латентного периода некоторых реакций мозговых сосудов, наблюдаемых в экспериментальных и клинических исследованиях. Подтверждение наличия нейрогенного механизма регуляции мозгового кровотока было получено с помощью различных адрено- и холинергических блокад. Показано воздействие последних на ауторегуляцию. В последние годы с помощью современных неинвазивных методов оценки мозгового кровотока у человека получены новые данные, подтверждающие существование внутримозговой холинергической вазодилатации во время психической нагрузки [3-8].
Метаболический механизм осуществляется посредством изменения тканевого рН: при снижении системного артериального давления уменьшается мозговой кровоток и увеличивается рСО2, что приводит к снижению рН. Ацидоз вызывает расширение мозговых сосудов для обеспечения исходного мозгового кровотока при сниженном перфузионном давлении. В то же время до сих пор остается неясным, посредством чего Н+ расширяет церебральные сосуды. В ряде исследований было продемонстрировано, что блокада синтеза NO способна истощать или нивелировать цереброваскулярный ответ на гиперкапнию 19].
Ауторегуляция - одно из фундаментальных свойств мозгового кровообращения. Она имеет принципиальное значение для адекватного кровоснабжения головного мозга и характеризуется способностью мозговых сосудов сохранять относительно неизменной объемную скорость мозгового кровотока при изменении перфузионного давления (разницы между системным артериальным и внутричерепным) в широких пределах (от 50 до 170 мм рт. ст.). При выходе перфузионного давления за эти пределы происходит «срыв» ауторегуляции, и мозговой кровоток начинает линейно следовать за изменениями давления. В пределах диапазона ауторегуляции интенсивность мозгового кровотока остается относительно постоянной, изменяясь незначительно (рис. 143). Ширина диапазона давления, в пределах которого кровоток остается стабильным, свидетельствует о количественном состоянии ауторегуляции, а изменения кровотока в пределах этого диапазона - о качественных характеристиках ауторегуляции [10, 11].
В течение 50 лет с момента открытия феномена ауторегуляции мозгового кровотока до настоящего времени исследование ее механизмов проводили прежде всего в эксперименте на животных или при обследовании здоровых добровольцев с использованием малоинвазивных дискретных методов оценки мозгового кровотока. В то же время проведение фундаментальных исследований механизмов ауторегуляции мозгового кровотока у человека возможно только при использовании неинвазивного метода непрерывной регистрации мозгового кровотока.

Рис. 143. График зависимости общего мозгового кровотока (ОМК) от перфузионного давления (ПД). 1,2- соответственно нижний и верхний пределы ауторегуляции мозгового кровотока.
В последнее время большое внимание уделяется газообразному NO, образованному из аргинина под действием конституитивного фермента NO-синтетазы, обнаруженного в эндотелии. В экспериментальных работах с помощью лазер-допплер-флоуметрии и различных модификаций радиографических методов многими авторами показано, что блокирование NO-синтеза приводит к достоверному снижению реакции мозгового кровотока на одно и то же воздействие. Нарастает число доказательств, что мозговые сосуды иннервируются NO, что обеспечивает нейрональные процессы на всех уровнях сосудистой системы от артериального круга большого мозга и основных церебральных артерий до пиальных артерий, внутримозговых артериол. Аналоги аргинина, которые широко использовались для исследования роли NO в регуляции кровотока, недостаточно специфичны по месту их действия и, по-видимому, в равной степени ингибируют эндотелиальный и нейрональный NO-синтез. При использовании нового ингибитора NO-синтеза (7-NI - 7-нитроиндозола), относительно специфичного для нейрональной изоформы фермента, было показано значительное снижение - до 60% - регионарного мозгового кровотока в отдельных частях таламуса и гипокампа. [9, 12-14].
У нейрохирургических больных в послеоперационном периоде часто наблюдают изменения перфузионного давления в результате колебаний артериального и внутричерепного давлений. При нарушении ауторегуляции мозгового кровотока эти колебания вызывают гипоксию и отек головного мозга. Ауторегуляция мозгового кровотока нарушается при ишемических и геморрагических инсультах, черепно-мозговой травме, опухолях мозга, составляя основное звено патогенеза нарушений мозгового кровообращения при патологии головного мозга. Анализ состояния механизмов ауторегуляции имеет большое практическое значение, ибо знание их необходимо при решении таких важных вопросов, как поддержание оптимального уровня артериального и внутричерепного давлений во время операций и в послеоперационном периоде, а также для обеспечения оптимальной вазоактивной терапии [4, 15-17].
У больных с артериальной гипертонией верхняя граница перфузионного давления, при которой сохраняется ауторегуляция мозгового кровотока, смещается в сторону более высокого давления до 175-180 мм рт. ст. Авторы предполагают, что это происходит за счет структурной адаптации сосудов к гипертонии путем утолщения их стенок и сужения просвета с ограничением способности сосудов к расширению [18].
Если при внезапном повышении артериального давления компенсаторного сужения артерий не происходит, то говорят о нарушении ауторегуляции мозгового кровотока. Этот механизм лежит в основе патогенеза острой гипертонической энцефалопатии. Растяжение мозговых сосудов повышенным внутрисосудистым давлением нарушает соединение эндотелиоцитов и повышает проницаемость гематоэнцефалического барьера. Высокое внутрисосудистое давление, в частности в капиллярах, ведет к экссудации плазмы и без нарушения гемато-энцефалического барьера. Риск фильтрационного отека нарастает в условиях гиперкапнии [19, 20].
Внезапная окклюзия внутренней сонной артерии тоже может нарушить ауторегуляцию и уменьшить кровоток в гомолатеральном полушарии. При окклюзии магистральной артерии в течение 10-15 мин. возникают физико-химические изменения в крови, микроэмболии, постишемический отек эндотелия мелких сосудов, расстройства их регуляции, что при восстановлении проходимости артерии обусловливает феномен «невозобновления перфузии» в 50% объема мозгового вещества [21].
При повышении внутричерепного давления сниженное до 40-60 мм рт. ст. перфузионное давление приводит к снижению мозгового кровотока. Повышение внутричерепного давления приводит к механическому сдавливанию мозговых (мостиковых) вен, что вызывает дилатацию мозговых артерий для поддержания мозгового кровотока, что в свою очередь вызывает увеличение объема крови в мозге. В результате возникает порочный круг, когда увеличение объема крови в мозге создает дополнительную массу внутри черепа и приводит к увеличению внутричерепного давления. Таким образом, возникает обратная связь, которая приводит к постепенному сдавливанию вен, препятствующему поддержанию кровотока на нормальном уровне. При перфузионном давлении ниже 30 мм рт. ст. регионарный кровоток уменьшается до 10-20 мл/100 г/мин., напряжение кислорода падает до 20 мм рт. ст., наступает инфаркт мозга [22-23].
Непрерывная регистрация внутричерепного давления и мозгового кровотока у больных в коме вследствие церебрального поражения свидетельствует о том что ликворная гипертензия может оказаться решающим фактором в порочном круге: повышение внутричерепного давления - ишемия мозга - отек мозга - повышение внутричерепного давления - прекращение кровотока - смерть мозга [24].
При высоком внутричерепном давлении и отеке мозга увеличение системного артериального давления, как спонтанное, так и вызванное введением фармакологических средств, не увеличивает мозговой кровоток - феномен «ложной ауторегуляции» В этих условиях повышение системного артериального давления может привести к вклинению ствола мозга Феномен «ложной ауторегуляции» наблюдается при черепно-мозговой травме и очаговых нарушениях мозгового кровообращения [25].
При локальных нарушениях ауторегуляции мозгового кровотока в случае очаговых церебральных поражений регионарный кровоток зависит от отношения внутрисосудистого давления и величины локального тканевого давления. Поскольку это внутрисосудистое давление и в норме составляет лишь несколько миллиметров ртутного столба даже небольшое повышение тканевого давления резко уменьшает тканевой кровоток. Неравномерность тканевого давления при очаговых поражениях обусловливает неравномерную (негомогенную) перфузию мозга, что усугубляет дезорганизацию мозгового кровообращения. Некоторые авторы полагают что негомогенная мозговая циркуляция представляет собой физиологическую особенность локального мозгового кровотока [26].
Полагают, что ауторегуляция мозгового кровотока может длительно сохраняться при медленном повышении внутричерепного давления до 60-75 мм рт. ст. При дальнейшем его увеличении наступают необратимые нарушения ауторегуляции. Острая и тем более неравномерная внутричерепная гипертензия нарушает ауторегуляцию мозгового кровотока и уменьшает его интенсивность и при менее высоком внутричерепном давлении [27].
Увеличение содержания лактата в ликворе при очаговых поражениях мозга нарушает ауторегуляцию мозгового кровотока. При этом отмечается корреляция между степенью повышения уровня лактата и других показателей метаболического ацидоза тяжестью церебрального поражения и глубиной нарушения сознания [281.
Развитие общих представлений о реактивности сосудистой системы головного мозга шло в направлении изучения взаимосвязи существующих представлений о функциональной устойчивости системы мозгового кровообращения и ее реактивности. Было показано что в основе функциональной устойчивости системы мозгового кровообращения, проявляющейся в ее способности противостоять внешним воздействиям и выполнять свою функциональную задачу на фоне этих воздействий, лежит свойство мозговых сосудов быстро и адекватно реагировать на стимулы различной природы т е. реактивность сосудов. Клинические направления исследования реактивности системы мозгового кровообращения доказывают, что данный подход к оценке цереброваскулярной патологии уже сейчас эффективен для прогнозирования действия ряда лекарственных препаратов и оценки состояния больного. Феномен «внутримозгового обкрадывания» может возникнуть при ингаляции двуокиси углерода или при использовании эффективных вазодилататоров, когда увеличение кровотока в сосудах отвлекает часть поступающей в мозг крови от очага, в котором сосуды утратили реактивность. У больных с очаговыми ишемическими цереброваскулярными поражениями ингаляция смеси воздуха и 5% CO2 увеличивает кровоток в очаге на 24%, а в остальных участках мозга - на 33%. Уменьшение кровотока в зоне очага наступило у 25% больных. Эти данные опровергают мнение о неизбежности «внутримозгового обкрадывания» в случае вазодилататорных воздействий при очаговой ишемии головного мозга. При вазоконстрикторном воздействии (гипервентиляция) сужение сосудов, сохраняющих реактивность, приводит к перераспределению кровотока в участки ишемического очага - феномен «обратного внутримозгового обкрадывания» (феномен «Робин Гуда») [29-31].
Таким образом, приведенные особенности структурно-функциональной организации системы мозгового кровообращения головного мозга во многом определяют информационную значимость тех или иных показателей ее функционирования при различной нейрохирургической патологии. Уточнение функциональных задач системы регуляции мозгового кровообращения по виду входных возмущений обеспечивает концептуальную базу для разработки и внедрения в клиническую практику методов контроля системы регуляции церебрального кровообращения.
В настоящее время сосудисто-мозговая реактивность рассматривается в качестве интегрального показателя адаптационных возможностей системы мозгового кровообращения, способности сосудов мозга реагировать на изменяющиеся условия функционирования и оптимизировать кровоток соответственно этим условиям.
Суть понятия «реактивность сосудов мозга» заключается в возможности объективизации деятельности регуляторных механизмов, лежащих в основе управления мозговым кровообращением и обеспечивающих его функциональную устойчивость, что достигается применением специальных воздействий. Они должны быть дозируемыми по интенсивности и продолжительности, быстро предъявляемыми и снимаемыми, имитирующими естественные возмущения, испытываемые системой мозгового кровообращения в физиологических условиях, не обладать кумулятивным влиянием.
Тест-воздействия направлены либо на изменение условий притока-оттока крови от мозга, либо на изменение газового состава крови. При нагрузках первого типа система регуляции стремится уменьшить отклонение кровотока через мозг от исходных величин - явление ауторегуляции. При рассогласовании метаболических потребностей мозга с доставкой энергетических продуктов или удалением продуктов обмена соответствие этих показателей достигается отклонением уровня мозгового кровотока, которое может быть местным (при активации отдельных участков мозга) - явление функциональной гиперемии, или общим (при изменениях газового состава крови).
Изучение регуляции системы мозгового кровообращения в клинике имеет существенное значение, определяющееся тем, что состояние регуляторных механизмов, или, как их принято называть в последнее время, гемодинамических резервов мозга, во многом определяет закономерности патогенетического процесса при ишемическом поражении мозга. Состояние реактивности и ауторегуляции свидетельствует об уровне компенсации патологических процессов при ишемическом инсульте, внутричерепных кровоизлияниях различной этиологии, артериовенозных мальформациях, черепно-мозговой травме.
С учетом того, что для оценки показателей реактивности используются относительные параметры (колебания мозгового кровотока), для ее определения не обязательно использовать методы измерения объемных характеристик кровотока, и транскраниальная допплерография (ТКД) вполне может служить надежным методом косвенной оценки церебральной гемодинамики (подробно в главе 3).
Применение ТКД для оценки реактивности и ауторегуляции мозгового кровотока основано на том факте, что просвет артерий основания мозга при физиологических тест-нагрузках изменяется незначительно по сравнению с диаметром артерий малого калибра. Так, в ходе исследования изменений диаметра мозговых сосудов была выявлена четкая констрикция в ответ на снижение и дилятация артерий в ответ на повышение напряжения углекислого газа в выдыхаемом воздухе. При этом отмечено, что изменение сегментов базальных артерий составляют всего 4-8%, тогда как сосудов диаметром 1 мм и менее - 12-20% [32]. Таким образом, изменения просвета и сопротивления потоку артерий большого диаметра являются пренебрежительно малыми по сравнению с изменениями на уровне резистивных сосудов (артериол), а динамика линейной скорости кровотока (ЛСК) в базальных сегментах отражает изменения объемного кровотока в бассейнах соответствующих артерий.
В клинической практике для оценки реактивности системы мозгового кровообращения используют функциональные тесты химической природы: гиперкапнические (ингаляция 4-8% карбогена, произвольная задержка дыхания, дыхание в замкнутом контуре, индуцированная гиповентиляция, апноэтическая оксигенация); гипокапнические (спонтанная индуцированная гипервентиляция).
Для оценки ауторегуляции мозгового кровотока применяют тесты физической природы: тест компрессии общей сонной артерии, тест индуцированной нефармакологической гипотензии. Реже используют ортостатическую, антиортостатическую нагрузки, пробу Вальсальва. В клинике применяют и фармакологические тесты с внутривенным введением 1г диамокса/ацетазоламида, сублингвальным - 0,25 мг нитроглицерина.
Гиперкапнические тесты приводят к реализации резерва дилатации резистивных сосудов, вследствие чего в сосудистом бассейне снижается циркуляторное сопротивление, возрастает объемный кровоток, линейная скорость кровотока в артериях основания мозга. Для создания гиперкапнии используются разные методики. Ингаляция 4-8% СО2 до последнего времени считалась «золотым стандартом» для оценки реактивности. В качестве альтернативы ингаляционной нагрузке применяют методику «дыхания в замкнутом контуре» с постоянным введением кислорода со скоростью 1 л/мин. Основным преимуществом этих нагрузок является то, что СО2 - естественный информационный переносчик в сосудистой системе мозга, тест кратковременный, насыщение крови газом наступает быстро, реакция сосудов детерминирована. Недостатки состоят в том, что по достижении состояния гиперкапнии обследуемый начинает испытывать неприятные ощущения нехватки воздуха, прилива крови к голове; возникают неспецифические реакции дыхательной и сердечно-сосудистой систем, что может маскировать реакцию.
В связи с необходимостью технического обеспечения ингаляционной нагрузки в последнее время для оценки реакции резистивных сосудов на гиперкапнию используют пробу с произвольной задержкой дыхания (на обычном вдохе, на глубоком вдохе, на выдохе, после интенсивного вдоха-выдоха) или гиповентиляцией. Сосудистая реакция наступает в течение 20-30 секунд апноэ за счет накопления эндогенного углекислого газа в условиях временного прекращения вентиляции. Тест имеет ограничения у больных с хроническими заболеваниями сердечно-сосудистой и дыхательной систем, имеющих ограничение резервов основных систем жизнеобеспечения. У пациентов, находящихся на искусственной вентиляции легких (ИВЛ), гиперкапническая нагрузка может быть создана путем временного отключения от аппарата, уменьшением частоты дыхательных движений. Наиболее безопасным, но технически трудоемким является тест апноэтической оксигенации: отключение аппарата ИВЛ в условиях постоянного введения в трахею кислорода со скоростью 30 л/мин.
По данным Т.М. Markwalder et al [33], имеет место экспоненциальная зависимость линейной скорости кровотока в средней мозговой артерии (СМА) от напряжения СО2. Зависимость выражается формулой v = 25,7 е0,035х, где v - средняя максимальная скорость кровотока, х - рCO2 в выдыхаемом воздухе. В пределах физиологически достижимых изменений содержания СО2 (4,0 об.% / 30 мм рт. ст. - нормокапния; 2,0 об.% / 15 мм рт. ст. - гипокапния; 6,0 об.% / 45 мм рт. ст. - гиперкапния) изменения ЛСК близки к линейной зависимости от напряжения CO2, что позволяет рассчитывать индексы реактивности как коэффициенты линейной функции. В этом диапазоне на 1 мм рт. ст. рСО2 в выдыхаемом воздухе ЛСК изменяется на 2,5-3,5%, или на 1 об.% СО2 - на 22-25%.
Так как при изменении рCO2 изменяется тонус и сопротивление периферических артерий, то в наибольшей степени изменяются значения конечной диастолической скорости кровотока. В связи с этим использование значений максимальной систолической скорости кровотока для расчета индексов реактивности нецелесообразно. Мы рекомендуем использовать для оценки реактивности изменения средней максимальной скорости кровотока. При наличии технических возможностей определения объемного кровотока в артериях основания мозга изменения его значений можно использовать для расчета индексов реактивности.
При оценке реактивности первоначально проводят регистрацию ЛСК в покое в интересующих артериях (в положении обследуемого лежа). После предъявления нагрузки проводят повторную регистрацию максимальных значений средней ЛСК, достигнутых в ходе нагрузки. В том случае, когда для расчета индекса реактивности необходима информация о конкретном уровне насыщения CO2, используют капнографы для оценки напряжения CO2 в выдыхаемом воздухе, которое коррелирует с рCO2 в крови.
Простой в исполнении, позволяющей получить сопоставимые данные, является проба с внутривенным введением 1 г ацетазоламида. Являясь ингибитором карбоангидразы эритроцитов, препарат приводит к нарушению равновесия буферной системы CO2 и накоплению эндогенного углекислого газа. Побочные эффекты препарата и его влияние на сердечно-сосудистую систему минимальны. Эффективная концентрация CO2, по-видимому, достигается на 15-20-й минуте после введения, когда отмечаются максимальные значения мозгового кровотока. Действие ацетазоламида не уступает по эффективности углекислому газу и вызывает повышение ЛСК в артериях мозга на 35-42% [34]. Основными недостатками теста являются необходимость внутривенной инъекции и отсроченный на 15-20 минут пик реакции.
Приведенные функциональные нагрузочные стимулы хорошо воспроизводимы и сопоставимы между собой, что позволяет каждому исследователю выбрать оптимальный тип нагрузки, исходя из потребностей.
Гипокапния, достигаемая путем спонтанной или индуцированной гипервентиляции, приводит к сужению резистивных сосудов, повышению сосудистого сопротивления, снижению мозгового кровотока и ЛСК в базальных артериях на 40-55%. Зависимость ЛСК от рCO2, также как и при гиперкапнии, имеет экспоненциальную зависимость, и для расчета индекса реактивности необходимо использовать минимальное стационарное значение ЛСК. Средняя продолжительность гипервентиляции, достаточная для выявления реакции, составляет 25-30 сек. с частотой дыхательных движений 60 в мин-1.
По результатам функциональных проб рассчитывают индексы реактивности - количественные характеристики оценки состояния и возможностей системы регуляции мозгового кровообращения.
Введем следующие обозначения:
V0 - средняя максимальная ЛСК в покое (см/с);
V - средняя максимальная ЛСК на фоне гиперкапнической нагрузки (ингаляции CO2, апноэ, введения ацетазоламида) (см/с);
![]() - средняя максимальная ЛСК на фоне гипокапнической нагрузки (см/с);
- средняя максимальная ЛСК на фоне гипокапнической нагрузки (см/с);
![]() - напряжение CO2 в выдыхаемом воздухе в покое (мм рт. ст.);
- напряжение CO2 в выдыхаемом воздухе в покое (мм рт. ст.);
![]() напряжение CO2 в выдыхаемом воздухе на фоне гиперкапнической нагрузки (мм рт. ст.);
напряжение CO2 в выдыхаемом воздухе на фоне гиперкапнической нагрузки (мм рт. ст.);
![]() - напряжение CO2 в выдыхаемом воздухе на фоне гипокапнической нагрузки (мм рт. ст.);
- напряжение CO2 в выдыхаемом воздухе на фоне гипокапнической нагрузки (мм рт. ст.);
![]() - концентрация CO2 в выдыхаемом воздухе в покое (%);
- концентрация CO2 в выдыхаемом воздухе в покое (%);
![]() - концентрация CO2 в выдыхаемом воздухе на фоне гиперкапнической нагрузки (%).
- концентрация CO2 в выдыхаемом воздухе на фоне гиперкапнической нагрузки (%).
По результатам гиперкапнической нагрузки рассчитывают: Коэффициент реактивности на гиперкапническую нагрузку (рассчитывается по результатам любых тестов с ингаляцией CO2, задержкой дыхания, введением ацетазоламида:
![]()
Индекс реактивности на гиперкапническую нагрузку:
![]()
Нормализованным ауторегуляторный ответ
![]()
По результатам гипокапнической нагрузки рассчитывают коэффициент реактивности на гипокапническую нагрузку.
![]()
Индекс реактивности на гипокапническую нагрузку:
![]()
Колебания линейной скорости кровотока от минимальных на фоне гипокапнии до максимальных на фоне гиперкапнии косвенно отражают ширину гомеостатического диапазона, в пределах которого функционирует система мозгового кровообращения. Весь диапазон «подвижности» системы в ответ на изменение химизма притекающей к мозгу крови отражается индексом вазомоторной реактивности:
![]()
Нормальные значения основных коэффициентов реактивности получены у здоровых испытуемых в возрасте до и после 40 лет и представлены в таблице 37.
Таблица 37. Показатели реактивности системы мозгового кровообращения (M+SD).
|
|
+ со2 |
|
-со2 |
+ со2 | ||||||||
|
Кр+ |
ИР+ |
НАО |
Кр- |
Ир- |
ИВМР | |||||||
|
Возраст |
<40 |
>40 |
<40 |
>40 |
<40 |
>40 |
<40 |
>40 |
<40 |
>40 |
<40 |
>40 |
|
СМА |
43 + 4 |
37 ± 6 |
3.1 ± 0.1 |
2.6 ± 0.2 |
24.6 ± 2.3 |
17.1 ± 1.9 |
55 + 4 |
42м 2 |
-3.4 ± 0.1 |
-2.6 ± 0.2 |
96.8 ± 10.1 |
79.8 ± 11.3 |
|
ПМА |
36 + 3 |
29 + 6 |
2.7 ± 0.1 |
2.5 ± 0.1 |
21.4 ± 3.6 |
16.6 ± 2.7 |
44 ± 9 |
42 ± 11 |
-3.2 ± 0.1 |
-2.9 + 0.2 |
80.1 + 9.4 |
71.6 ± 10.4 |
|
ЗМА |
51 ± 7 |
38 + 12 |
3.2 ± 0.1 |
2.4 ± 0.2 |
26.7 ± 4.1 |
19.0 ± 2.2 |
59 ± 11 |
50 ± 8 |
-3.4 ± 0.1 |
-2.8 ± 0.1 |
90.6 ± 12.4 |
88.6 ± 11.7 |
Изменение показателей реактивности может служить как диагностическим признаком, так и характеризовать функциональное состояние системы мозгового кровообращения. В большинстве случаев при острой и хронической ишемии мозга происходит снижение показателей реактивности на гиперкапническую нагрузку, отражающее ограничение функционального резерва Снижение последних в два и более раза, как правило, свидетельствует об органическом поражении мозга или его сосудистои системы Снижение реакции на гипокапническую нагрузку отмечается при патологическом артериовенозном шунтировании, характерном для артериовенозных мальформаций головного мозга. Примерное равенство амплитуды реакций на гипер- и гипокапническую нагрузку свидетельствует о нейтральном нормальном тонусе резистивных сосудов Церебральная ангиодистония характеризуется нарушением соотношения амплитуд реакций; при дистонии по гипотоническому типу доминирует реакция на гипокапнию, при дистонии по гипертоническому типу - на гиперкапнию. При этом суммарный диапазон реакции, отражаемый значением ИВМР, остается нормальным. Сужение гомеостатического диапазона (снижение ИВМР до 50%) свидетельствует о значимом снижении реактивности, как правило обусловленном органическим поражением мозга и его сосудистой системы.
Состояние ауторегуляции мозгового кровотока может быть оценено по выраженности гиперемических изменений после более или менее длительного периода регионарной гипотензии, вызванной временной окклюзией магистрального сосуда. Компрессия общей сонной артерии на шее вызывает снижение перфузионного давления во внутренней сонной и средней мозговой артериях на 52 ± 11,4% и 32.2 ± 16.3% соответственно. По прекращении компрессии отмечается преходящее повышение кровотока вследствие компенсаторной вазодилатации, которое может быть использовано в качестве индикатора ауторегуляции
ТКД обеспечивает быструю и неинвазивную регистрацию ЛСК в базальных артериях мозга Преходящий гиперемический ответ в СМА, проявляющийся кратковременным повышением ЛСК, позволяет рассчитать индекс, характеризующий вазодилатацию в ответ на временное снижение перфузионного давления
Для оценки результатов компрессионного теста в покое проводят запись фоновой ЛСК в СМА. Затем, на протяжении 5-ти сердечных циклов выполняют бережную компрессию ипсилатеральной общей сонной артерии, в ходе чего ЛСК снижается до 57 ± 11 % от исходной Компрессию прекращают в диастолу 5-го комплекса после чего регистрируют ЛСК на протяжении 3-5-ти сердечных циклов. В норме по завершении компрессии отмечается выраженный подъем ЛСК - овершут Он возникает на фоне стабильных показателей центральной гемодинамики, т. е. реализуется только церебральными механизмами. С учетом того что показатели периферического сопротивления во время овершута достоверно ниже исходных, можно предполагать, что он является следствием снижения циркуляторного сопротивления в бассейне СМА в ответ на снижение перфузионного давления (рис 144).
Рассчитывают коэффициент овершута (КО):
![]()

Рис. 144. Спектрограмма кровотока по СМА во время выполнения компрессионного теста. V1 - средняя ЛСК в покое, V2 - средняя ЛСК первого пика после прекращения компрессии.
Нормальное значение КО в условиях нормокапнии составляет 1,39 ± 0,11. Диапазон «нормальных» значений КО, свидетельствующих о сохраненной ауторегуляции, лежит в пределах от 1,23 до 1.54. Уровень КО выше 1.5 свидетельствует о повышении тонуса резистивных сосудов и характерен для артериальной гипертензии. При КО менее 1 2 тонус резистивных сосудов снижен, что характерно для большинства патологических состояний (ишемия мозга, внутричерепная гипертензия, сосудистыи спазм, артериовенозное шунтирование). При значениях КО близких к 1 0 следует констатировать нарушение ауторегуляции, что является прогностически неблагоприятным признаком. При тяжелых поражениях мозга, крупных мальформациях, выраженной недостаточности кровообращения уровень ЛСК по прекращении компрессии может оказаться ниже исходных (инвертированный ответ) что свидетельствует об отсутствии/срыве ауторегуляции мозгового кровотока в данном сосудистом бассейне. Такая форма реакции свидетельствует об исчерпании резерва вазодилятации в ответ на дополнительное снижение перфузионного давления, что корреспондирует с высоким риском повторных эпизодов гемодинамического ишемического повреждения. Так же она отражает феномен внутримозгового обкрадывания ишемизированных участков мозга за счет сегментов сосудистого русла, реагирующих нормально Средние значения КО при органическом поражении сосудистой системы мозга (артериовенозная мальформация, сосудистый спазм окклюзирующие поражения) составляют 1,01-1,10, что значительно ниже нормальных значений.
Относительным ограничением применения описанной методики является ее приемлемость только для бассейна СМА (у большинства обследуемых), хотя в отдельных случаях (разобщение артериального круга большого мозга, варианты его строения в виде три- и квадрифуркаций) позволяет проводить аналогичную оценку функционального состояния бассейнов передней и задней мозговых артерий.
Тест-нагрузка с нитроглицерином обладает двунаправленным влиянием на систему регуляции мозгового кровообращения. С одной стороны, за счет своего влияния на центральную гемодинамику (уменьшение венозного возврата к сердцу, уменьшение сердечного выброса), а с другой - за счет прямого эндотелий-независимого сосудорасширяющего действия на артерии среднего калибра. Для системы мозгового кровообращения следствием этого влияния является повышение объемного мозгового кровотока на фоне снижения ЛСК в магистральных артериях за счет их дилатации. В норме через 3 минуты после применения препарата допплерографически регистрируется снижение средней ЛСК на 10-12%, возрастание объемного кровотока на 70 ± 35 мл/мин, увеличение диаметра СМА на 37 ± 12% (по данным транскраниальной цветовой допплеровской сонографии с регистрацией допплеровского спектра), что считается адекватной реакцией [39].
Сочетание компрессионного теста и теста с нитроглицерином позволяет раздельно оценить состояние тонуса, как магистральных артерий головного мозга, так и периферического русла.
В настоящее время стало возможно проводить фундаментальные исследования по изучению механизмов ауторегуляции мозгового кровотока у человека с использованием адекватных функциональных нагрузок. Первые публикации о механизмах ауторегуляции, основанные на результатах, полученных у здоровых добровольцев с использованием ТКД, были представлены R Aasnd et al. [40].
Суть теста состоит в сравнительном анализе изменений системного артериального давления и ЛСК в сосудах мозга в ответ на острое снижение артериального давления (на 20-25%), что в авторском варианте обеспечивали постишемической гиперемией в нижних конечностях после компрессии бедер пневматическими манжетами.

Рис. 145. Изменения системного артериального давления (АД), ЛСК и внутричерепного давления (ВЧД) при проведении манжетного теста.
В процессе мониторинга артериального давления и ЛСК определяют относительные изменения этих параметров. Восстановление ЛСК в норме происходит раньше, чем артериального давления, что обусловлено снижением цереброваскулярного сопротивления, определяемого как отношение ![]() АД и
АД и ![]() ЛCK. R. Aaslid et al. [40] убедительно показали, что быстрый компонент ауторегуляции с латентным периодом 1-3 с существует как в артериальном, так и в венозном русле, что подтвердило ранние результаты экспериментальных исследований.
ЛCK. R. Aaslid et al. [40] убедительно показали, что быстрый компонент ауторегуляции с латентным периодом 1-3 с существует как в артериальном, так и в венозном русле, что подтвердило ранние результаты экспериментальных исследований.
Разница скоростей восстановления значений артериального давления и ЛСК указывает на выраженность ауторегуляции. При отсутствии ее тренд ЛСК когерентен тренду артериального давления, при наличии - ЛСК восстанавливается значительно быстрее. Скорость ауторегуляции мозгового кровотока (RoR) вычисляли по формуле;
![]()
где ![]() CVR - относительное изменение цереброваскулярного сопротивления после снижения давления в манжетах,
CVR - относительное изменение цереброваскулярного сопротивления после снижения давления в манжетах,
![]() Т50 - время, в течение которого ЛСК после своего максимального снижения во время манжетного теста восстанавливается до 50% от исходного значения,
Т50 - время, в течение которого ЛСК после своего максимального снижения во время манжетного теста восстанавливается до 50% от исходного значения,
![]() СРР - относительное изменение ПД после снижения давления в манжетах.
СРР - относительное изменение ПД после снижения давления в манжетах.
Рассчитываемое значение RoR в норме составляет 20 ± 3% сек.-1. RoR в норме зависит от напряжения CO2, снижаясь при гиперкапнии (11 ± 2), возрастая при гипокапнии (38 + 4) (рис. 145) Чем ниже значение RoR, тем в более плачевном состоянии находится ауторегуляция. Грубые нарушения ауторегуляции обнаруживают при тяжелой черепно-мозговой травме, внутричерепных кровоизлияниях, сосудистом спазме (рис. 148). Недостатком этого теста является необходимость использования специальных систем для мониторинга ТКД артериального и внутричерепного давлений, а также специального программного обеспечения.
Так или иначе, но большинство тестов подразумевает пускай безвредное но воздействие на организм испытуемого, что неизбежно влечет некоторые искажения реакций, которые в естественном состоянии могут протекать по-иному. В связи с этим возникли представления о необходимости оценки состояния ауторегуляции на основе длительного мониторинга параметров мозгового кровотока, системного артериального давления, напряжения углекислого газа без каких бы то ни было внешних возмущений. Такой мониторинг позволяет выявить т.н. медленные колебания физиологических параметров и на основе расчета коэффициентов когерентности определять степень подобия колебаний кровотока давления и насыщения крови углекислым газом. Являясь поистине неинвазивным, подобный метод позволяет оценивать состояние регуляторных контуров in situ, что и обуславливает его ценность для клиники.
С учетом анатомо-функционапьной целостности сосудистой системы мозга оптимальным следует признать тест, позволяющий оценивать реакцию не изолированного сосудистого бассейна, а по меньшей мере двух симметричных бассейнов здорового и пораженного полушарий. Это условие может быть реализовано при помощи билатеральной регистрации ЛСК на фоне проведения нагрузки. Фиксация датчиков осуществляется при помощи специального мониторного шлема, обеспечивающего закрепление их в произвольном положении в проекции ультразвукового окна.
Билатеральный ТКД-мониторинг обеспечивает возможность симультанной регистрации показателей потока в симметричных или соседних внутричерепных магистралях, их изменения в ответ на функциональные тесты, значимость которых оказывается идентичной для обоих бассейнов.
В норме тренды скорости кровотока в парных артериях характеризуются высокой степенью подобия, повторяя одна другую (рис 147).

Рис.146а. Результаты манжетного теста у больного в компенсированном состоянии. Показатели
скорости ауторегуляции мозгового кровотока соответствуют нормальным величинам (объяснения в тексте).
б. Результаты манжетного теста у больного со спазмом левой СМА в остром периоде субарахноидального кровоизлияния. Показатели скорости ауторегуляции существенно снижены на стороне спазма (нарушение ауторегуляции - объяснение в тексте)
При односторонней недостаточности кровообращения отмечается выраженное отличие реакции ЛСК на нагрузку на стороне поражения (рис. 148).
По результатам реакции на функциональные нагрузочные тесты выделяют следующие типы [39]:
- однонаправленная положительная реакция - симметричный адекватный ответ на нагрузку;
- разнонаправленная - положительная реакция на одной, сниженная или парадоксальная на противоположной стороне;
- однонаправленная отрицательная - двусторонний сниженный или инвертированный ответ.

Рис. 148. Тренды средней ЛСК по обеим СМА при односторонней окклюзии внутренней сонной артерии: А - на здоровой стороне, Б - на стороне окклюзии. По оси ординат - средняя ЛСК (см/с), по оси абсцисс - время (мин).
В течение последних лет ТКД активно используют для оценки метаболической регуляции мозгового кровотока, которая осуществляется по закону:
![]()
и обуславливает явление «функциональной» или «рабочей» гиперемии. Оценка индуцированного функцией повышения кровотока позволяет изучать функциональную организацию мозгового кровотока, локализовать положение функциональных центров, оценить состояние метаболического контура регуляции мозгового кровотока. Изучение функционально-зависимого возрастания линейной скорости кровотока в артериях мозга осуществляется по принципам, схожим с методикой вызванных потенциалов, в связи с чем получило название «вызванного кровотока». Проводят мониторинг ЛСК, как правило, в парных одноименных артериях. В качестве референтной используют ЛСК в СМА на здоровой стороне. После 10-20 с регистрации предъявляют функциональную нагрузку на протяжении 10-30 с. Для накопления данных циклы повторяют 5-10 раз. В качестве нагрузки используют различные психические, двигательные, зрительные тесты, вызывающие активацию отдельных зон двигательного, зрительного, слухового анализаторов. Описано возрастание ЛСК в задней мозговой артерии при фотостимуляции на 15-30%, СМА при психической, звуковой и двигательной нагрузках на 15-20% [8, 41, 42]. Методика «вызванного кровотока» позволяет оценивать состояние контуров регуляции у больных с органическими поражениями функционально-значимых зон мозга.

Рис. 147. Тренды средней ЛСК по обеим СМА в норме (А, Б) совпадают: в покое, на фоне гипер- и гипокапнической нагрузок. По оси ординат - средняя ЛСК (см/с), по оси абсцисс - время (мин).
В настоящее время ТКД является основным методом изучения регуляции мозгового кровотока в клинике. Использование функциональных нагрузок при ультразвуковой допплеровской диагностике позволяет оценить состояние сосудисто-мозгового резерва, что нередко является определяющим фактором при определении показаний к хирургическому вмешательству при сосудистых заболеваниях мозга (операции создания микрососудистого анастомоза, вмешательства при артериовенозных мальформациях), терапии острой внутричерепной гипертензии, назначении вазоактивных препаратов. В повседневной практике наиболее применимы тесты, позволяющие оценивать реакцию сосудов на CO2 (тесты с задержкой дыхания и гипервентиляцией), ауторегуляцию (компрессионный тест). Исследование, проведенное без оценки функционального состояния системы мозгового кровообращения, сегодня не может быть признано полноценным.
ГЛАВА10
КЛИНИКО-ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА СМЕРТИ МОЗГА
Авторитетный знаток проблемы А.Э. Уолкер [1] в монографии «Смерть мозга» приводит такое определение, ставшее международным стандартом: «смерть мозга - это полная утрата всех его функций, ятрогенное состояние, обусловленное развитием методов оживления и поддержания жизни, при непоступлении крови в сосуды мозга, т. е. погибший индивидуум с бьющимся сердцем и ИВЛ». Подобные ситуации, к сожалению, нередки в неотложной медицине при интенсивном лечении в нейрореанимационных отделениях больных с тяжелыми черепно-мозговыми травмами или спонтанными кровоизлияниями в мозг. В этих случаях в полость черепа изливается значительный дополнительный объем крови, возникает прогрессирующий отек-тампонада мозга. При этом внутричерепное давление возрастает настолько, что начинает превышать системное артериальное. В таких наблюдениях регистрируют патогномоничную для смерти мозга модель, так называемого прецеребрального реверберирующего кровотока [2, 3]. Кровь из сердца поступает в аорту, затем в общие сонные артерии, замедляясь, доходит до бифуркаций, а затем, будучи не в состоянии «пробиться» в мозг через внутренние сонные артерии, движется «взад-вперед» и частично сбрасывается в наружные сонные артерии. Иными словами, все внутренние органы продолжают получать свою порцию гемоглобина, а мозг обескровливается. Доказано [1, 4], что если подобное непоступление крови в мозг продолжается более 30 минут, то наступают необратимые повреждения различных систем мозга и, в первую очередь, таких важнейших структур, как кора и подкорковые узлы.
Быстрая и точная регистрация прекращения мозговой перфузии необходима для прекращения бесполезной реанимации и имеет большой экономический эффект. Но проблема экспресс-диагностики становится значительно важнее, если обследуемого пациента рассматривают в качестве потенциального донора. В таком случае неизмеримо возрастает моральная и юридическая ответственность консилиума врачей, диагностирующих остановку мозгового кровотока и, следовательно, смерть мозга [1, 5].
Итак, чтобы убедиться, стоит ли больному с комой IV стадии продолжать реанимацию, нужно знать, сохранен ли кровоток по интракраниальным сосудам мозга.
Какие диагностические методы могут ответить на этот вопрос? Оказалось, что очень немногие. Причем наиболее популярные и современные методы изучения внутричерепных поражений КТ, МРТ в этих ситуациях малоприемлимы [6]. Они дороги, требуют транспортировки больного к аппарату и отражают, главным образом, морфологию мозга, но не состояние его кровотока.
До 80-х годов основными параклиническими методами диагностики смерти мозга (СМ) согласно критериям ВОЗ (The Corincil for intenationale Organizetions of Medical Sciences 1988) являлись электроэнцефалография (ЭЭГ) и церебральная ангиография ЭЭГ при осмотре пациентов с углубляющейся комой в динамике показывает т. н. изолинию (т.е. исчезновение признаков биоэлектрической активности мозга) По протоколу электрическое молчание коры должно сохраняться в течение 30 минут непрерывной регистрации. Несмотря на указание о возможности получения до 14% ложноположительных для диагностики смерти мозга результатов [7] ЭЭГ и в настоящее время особенно при использовании таких новейших технологий, как компрессионный спектральный анализ и Brain-Mapping ЭЭГ, довольно широко используют в диагностике смерти мозга, Еще более информативным считается сочетание ЭЭГ мониторинга с различными модификациями вызванных потенциалов (ВП) [8, 9], что в подавляющем большинстве наблюдений позволяет верифицировать смерть как полушарий, так и ствола мозга.
Наиболее же информативной до последнего времени считалась церебральная ангиография (ЦАГ) всех магистральных сосудов - панангиография Признаками прекращения мозгового кровотока полагали наличие «стоп-феномена» (рис. 149 а, б) - остановки контраста на уровне бифуркации и незаполнения основной артерии [10, 11]

Рис, 149 а. Больной Н., 19 лет
а. катетеризационная аортография - получено контрастирование аорты, плечеголовного ствола, подключичных и сонных артерий - остановка контрастного вещества в обеих внутренних сонных артериях на уровне сифонов («стоп-феномен»)
б. допплерограмма кровотока по левой СМА: снижение ЛСК до 19 см/с реверберирующий тип кровотока

Рис. 149 б. Тот же больной
а. на ангиограмме правой позвоночной артерии остановка контрастного вещества перед входом в череп («стоп-феномен»):
б. допплерограмма реверберирующего кровотока по основной артерии.
Понятно, что по этическим и техническим соображениям осуществление премортальному больному инвазивной и не всегда безопасной диагностической процедуры - малореально. Более того, следует помнить, что наличие высокой внутричерепной гипертензии у пациентов с комой III-IV ст. создает чисто механическое препятствие продвижению контрастного вещества (KB), что принуждает ангиолога вводить KB под значительно большим, чем в обычных условиях, давлением. Так, если при плановой каротидной ЦАГ 10 мл KB вводят за 1,2 с, то при подозрении на смерть мозга то же его количество инъецируют за 0,4 с, т. е. под усиленным в 3 раза давлением [10]. Если же принять во внимание возможную «спазмогенность» KB при его контакте с интимой сосудов церебрального русла [10,12], становится ясным возможный повреждающий эффект и в связи с этим значительные трудности в интерпретации ангиограмм - то ли это истинный «стоп-феномен» из-за прекращения внутричерепной перфузии, то ли функциональный спазм на уровне сифона или V3 сегмента позвоночной артерии. Поэтому для окончательной уверенности в безошибочной диагностике смерти мозга предлагалось панангиографию повторить через 40 мин., что в условиях нейрореанимационных отделений даже лучших московских клиник становится маловероятным.
Кроме того, существенным минусом ЦАГ является то обстоятельство, что это одномоментное исследование, когда в течение всего нескольких секунд ангиолог получает информацию о прохождении или остановке KB в сосудах головы. В то же время известно, насколько изменчив мозговой кровоток умирающего больного. Следовательно, было бы желательным дискретное наблюдение, еще лучше - мониторинг интракраниального кровотока.
Поэтому разработанный и широко внедренный в мировую практику R. Aaslid [13] метод транскраниальной допплерографии (ТКД) показался едва ли не идеальным для подобного рода исследований. В частности, работами F. Kirkham, A. Ropper, 1987 [14,15] и G. Petty et al. [16], осуществившими корреляционные наблюдения за больными с подозрением на смерть мозга с использованием ТКД, ЭЭГ, ВП, КТ, МРТ, убедительно показана высокая информативность ТКД в регистрации прекращения кровотока по сосудам основания мозга. Указанные исследователи считают ТКД более удобным, быстрым, а главное, информативным методом регистрации остановки церебрального кровотока, чем ЭЭГ и ЦАГ, и рекомендуют включить ТКД как необходимый диагностический прием при составлении официального протокола смерти мозга. Они полагают, в частности, патогномоничными для данного состояния показатели ЛСК по СМА ниже 10 см/с и/или реверберирующий поток и/или прекращение регистрации кровотока, длящееся более 25 минут. К такому же заключению пришел в 1990 г. комитет по инструментальным методам исследования Американской академии неврологии [17].
Интереснейшим исследованием в разработке неинвазивной диагностики прогредиентной комы является публикация D. Payen et al. [18], где параллельно с ЭЭГ, регистрацией газового состава крови и ЦАГ показана 100% точность диагностики смерти мозга при регистрации объемного кровотока по общим сонным артериям (ОСА) менее 31 мл/мин; иными словами, демонстрируется возможность установления смерти мозга при дуплексном сканировании экстракраниальных сегментов сонных артерий, несущих кровь к мозгу.
Итак, ряд ученых за рубежом, а в России И.Д. Стулин с сотрудниками [19- 25] и Б.В. Гайдар с сотр. [12], пытались применить и/или разработать неинвазивные, быстроосуществимые, информативные и экономичные методы оценки кровотока в мозге, альтернативные ЦАГ.
Анализ результатов многолетних собственных исследований, сначала на животных, с моделированием двух вариантов смерти - «экстрацеребральной» вследствие остановки-запуска сердечной деятельности и «внутримозговой» - путем создания прогредиентной внутричерепной гипертензии, а затем динамическое клинико-инструментальное наблюдение 72 больных с нарастающей церебральной комой, позволил разработать алгоритм комплексной неинвазивной диагностики смерти мозга.
Этот алгоритм лег в основу созданной по инициативе Московского департамента здравоохранения мобильной нейродиагностической бригады (МНДБ). В состав МНДБ располагающейся на базе кафедры неврологии и нейрохирургии МГМСУ и Научно-методического центра «Ультразвуковые и тепловизионные методы диагностики в плановой и неотложной неврологии» Минздрава России в ГКБ № 6 входят 7 клиницистов нейрореаниматологов, владеющих современными инструментальными методами диагностики и обеспечивающих ежедневные суточные дежурства.
Основной задачей МНДБ является немедленный выезд для консультации и кпинико-инструментального мониторинга больных с прогредиентной церебральной комой, поступающих в нейрореанимационные отделения московских клиник.
Осуществляется длительное почасовое или мониторное наблюдение от 6 до 24 часов включающее: клинический осмотр, ЭЭГ и ВП - приборы «Brain-Quick» и «Sentmel-4» (Италия), эхоэнцефало- и эхопульсографию желудочковой системы мозга, разработанный при нашем участии «ЭхоЭДГ-Комплекс М» (Россия), экстра- и транскраниальную допплерографию на УЗ-аппаратах («Би-осс» - Россия, «Pioneer-TC 40-40», «ТС 2-64» - Австрия), дуплексное сканирование («Ultraplex-Н» - США. «Aloka 5500» - Япония), телетермографию («Адета 340» - Швеция), двухполушарную церебральную оксиметрию «Invos 3100» (Somanetics - США) газо-анализатор крови («Ciba-corning 238» - Австрия)
Анализ клинико-инструментальных данных с обязательной регистрацией и распечаткой трех копий исследований (одна - в историю болезни, одна - в протокол установления смерти мозга и последняя - в архив МНДБ) осуществляют на базе персональных компьютеров «Note-Book».
За период с декабря 1995 по январь 2002 года МНДБ выполнила 626 выездов Вызов бригады осуществляли дежурные врачи больниц при обязательном согласовании с заведующим нейрореанимационного отделения в случаях углубляющейся церебральной комы.
В результате тщательного всестороннего анализа каждого наблюдения абсолютно точно документировать смерть мозга, при продолжающемся сердцебиении, ИВЛ и показателями АД не ниже 90 мм рт ст., удалось у 103 из 626 обследованных, причем у 88 из 103 комплексный клинико-инструментальный анализ позволил подтвердить СМ уже при первичном осмотре, в 15-ти наблюдениях для окончательной верификации СМ возникла необходимость в инструментальном мониторинге, продолжавшемся от 10 до 23 часов. Именно эти 103 больные и проанализированы в данной работе.
Из 103 больных со смертью мозга 92 пациента имели тяжелую черепно-мозговую травму (ЧМТ), у 11 больных диагностировано кровоизлияние в мозг.
Все больные с ЧМТ были моложе 30 лет (за исключением 22-х).
При обследовании, кроме типичной тетрады симптомов смерти мозга: отсутствие роговичного рефлекса, стойкий мидриаз >5 мм с отсутствием фотореакции, исчезновение глоточного и трахеального рефлексов, стойкое отсутствие самостоятельного дыхания (до и после теста апноэтической оксигенации), с особенной тщательностью изучали окуло-вестибулярный рефлекс. Для этого совместно с сотрудниками инженерного центра «Комплекс М» было разработано устройство для дозированной «пошаговой» электростимуляции вестибулярного рефлекса, поскольку некоторые исследователи считают информативность этого феномена сравнимой или даже превосходящей данные ЭЭГ. У наших пациентов, большинство из которых имели ЧМТ, сопровождавшуюся переломом основания черепа с отоликвореей, при этом не могло быть и речи о проведении вестибулярной пробы с введением в слуховой проход холодной воды, поэтому электростимуляция области сосцевидного отростка оказалась методом выбора еще и более физиологичным и дозированным.
У 12 больных, несмотря на стойкое отсутствие всех цефалических и стволовых рефлексов, при максимально допустимом усилении силы тока до 10 мА отмечали нистагмоидные движения глазных яблок.
Уже первая запись ЭЭГ у 92 из 103 больных с подозрением на СМ зарегистрировала непрерывное (не менее 6 часов) биоэлектрическое молчание. У шести больных исходная ЭЭГ регистрировала низкоамплитудную полиморфную активность, чередующуюся с периодами «молчания», которая исчезла у двух больных уже через 20-25 мин. непрерывной записи. У одного пациента бета-подобная активность амплитудой до 5 мкВ сохранялась в двух отведениях в течение 2 часов с момента первоначальной регистрации ЭЭГ. В то же время данные ВП, в основном совпадавшие с результатами ЭЭГ, у одного пациента с «молчащей» ЭЭГ зарегистрировали ослабленный, но, несомненно, присутствующий паттерн, позволявший говорить о функционировании стволовых структур. Важно при этом, что вышеизложенные данные ВП отмечены у больного с положительной электроокуловестибулярной реакцией.
Эхоэнцефалография у 82 из 103 больных зарегистрировала смещение срединных структур от 4 до 12 мм в сторону «непораженного» полушария (в 21 из оставшихся наблюдений объемный очаг, вероятно, уменьшился в результате нейрохирургических вмешательств); у большинства пациентов также определяли выраженную асимметричную гидроцефалию (в 45 случаях совпадала с данными КТ). Но для диагностики собственно СМ наиболее информативным было динамическое исследование амплитуды пульсации М-эха. Если у 56 из 103 больных эхопульсации III желудочка сразу не определяли, то у 47 пациентов выявляли изначально ослабленные до 10% колебания М-эха, исчезавшие в процессе динамического наблюдения.
Важная информация была получена при обследовании магистральных артерий головы и мозга методами ультразвуковой допплерографии (УЗДГ) и транскраниальной допплерографии (ТКД). Наиболее измененной у всех 103 пациентов оказалась диастолическая составляющая циркуляции - она резко снижалась. Первое же лоцирование общих сонных артерий у всех 103 пациентов зарегистрировало несомненные признаки реверберации, степень которой оказалась неоднозначной. Так, у 90 из 103 пациентов движения кровяного столба «взад-вперед» было настолько выраженным, что допплерограмма напоминала по структуре спектр периферической артерии с почти соизмеримыми систолическими и отрицательными диастолическими пиками. Индекс циркуляторного (периферического) сопротивления у этих пациентов составлял единицу. У 44-х из них был зарегистрирован ослабленный по амплитуде (-6 см/с) кровоток по глазной артерии, причем у троих из этих пациентов отмечали смешанный артериовенозный шум. У остальных 13-ти пациентов не было выраженного феномена реверберации ЛСК по ОСА, но индекс циркуляторного сопротивления был равен единице.
Показательны данные метода ТКД. Именно он позволил в условиях «молчащей ЭЭГ» и всех клинических (кроме электроокуловестибулярного рефлекса) признаках СМ у 56 из 103 пациентов при первичном обследовании определить наличие ослабленного кровотока по внутричерепным сосудам. Так, показатели линейной скорости кровотока (ЛСК) по средней мозговой артерии составили 14-25 см/с и были асимметричны; у 31 больного (включая 11 пациентов с сохранившимся окуловестибулярным рефлексом и ВП) на глубине 80-95 мм регистрировали кровоток по основной артерии (OA) в пределах 12-22 см/с. При этом отмечали значительные изменения допплерограмм: снижение показателей систолической скорости, реверберация кровотока, при практически равных по мощности систолических и диастолических составляющих его компонентов, нивелирование диастолической составляющей и, как следствие, изменение индексов пульсации и циркуляторного сопротивления.
Динамический ТКД-мониторинг у этих пациентов показал прогрессирующее падение ЛСК по внутричерепным артериям вплоть до полного исчезновения регистрации кровотока через 4-20 часов после первичного осмотра. В остальных 47 наблюдениях изначально не удавалось определить кровоток по сосудам артериального круга большого мозга
Телетермография (ТТГ) у 91 из 103 больных при первичном осмотре обнаружила гипотермию обеих орбит (32°С При этом у 46 из 103 указанных пациентов, наряду с выраженной гипотермией внутренних углов глазницы (которые в норме на 0 6-1.2°С теплее наружных в результате кровотока по глазной ветви ВСА), регистрировали относительный «разогрев» наружных сегментов лица. Это соответствует описанному нами в 1986 г. феномену обратного термального орбитального градиента
Инфракрасная церебральная оксиметрия (ЦО) - относительно новый метод неинвазивного определения оксигенации мозга одновременно в обоих полушариях - у большинства больных с СМ показала прогрессирующее снижение сатурации до 30-40% (против 60-70% в норме). При этом в 12 наблюдениях уровень оксигенации в течение 2-х минут упал до 15% во время осуществления теста апноэтической оксигенации, который проводился у всех пациентов.
Впервые мы провели тщательное сопоставление данных вышеуказанного комплексного обследования 9 больных с предполагаемым диагнозом СМ с результатами ЦАГ. Во всех 9 наблюдениях основанием к проведению контрастного исследования послужило «несоответствие» клинико-нейрофизиологических данных с показателями УЗ-мониторинга. Так при стойком отсутствии всех цефалических и стволовых рефлексов и «молчащей» ЭЭГ у больных отмечали реверберирующий кровоток по СМА с ЛСК до 17см/с и по OA до 25 см/с еще в течение 45-58 минут. Важно при этом, что у 2 из 9 больных сохранялась активность ствола по данным ВП. ЦАГ проводили независимые нейроангиологи в 3-х клиниках Москвы и Санкт-Петербурга. В результате церебральной панангиографии у всех 9 больных с клинико-электроэнцефалографическими признаками смерти мозга зафиксирован «стоп-феномен» на уровне бифуркации ВСА и V3 сегментов ПА при наличии хоть и редуцированной, но чётко определявшейся циркуляции крови по сосудам артериального круга большого мозга по данным ТКД.
Таким образом, неинвазивные, быстроосуществляемые экономичные и безопасные для больного УЗ- методы, позволяющие мониторировать гемо-ликвороциркуляцию мозга, могут и должны явиться альтернативой ЦАГ. По нашему мнению, ЦАГ недопустима в подобных ситуациях и по следующим резонам:
- Трудно получить согласие нейрорадиолога на осуществление ЦАГ столь тяжелому пациенту.
- Невероятно сложна процедура перемещения премортального больного в ангиографический кабинет - для этого необходимо участие не менее трех сотрудников: врача-реаниматолога, осуществляющего ручное пособие ИВЛ; фельдшера, контролирующего капельницу с лекарственными препаратами; санитара, перемещающего постель пациента.
- Одним из наиболее ответственных моментов является перекладывание больного на ангиографический стол - в 3-х из 9 наблюдений произошла остановка сердца, потребовавшая дефибриляции.
- Опасности облучения подвергаются не только больные, но и реаниматологи, вынужденные непрерывно осуществлять «ручную» ИВЛ.
- Необходимость введения контраста под избыточно высоким давлением из-за выраженного отека-тампонады мозга у больных с церебральной комой III-IV ст. повышает спазмогенность, реализуясь в так называемую ложную каротидную псевдоокклюзию.
- Существенным минусом ЦАГ по сравнению с УЗИ, ТТГ и ЭЭГ является то, что это одномоментное исследование, когда ангиолог получает информацию о нескольких секундах циркуляции крови внутри черепа. В то же время известно, насколько различен и изменчив мозговой кровоток умирающего больного. Поэтому именно УЗ-мониторинг, а не краткосрочное представление о прохождении или остановке контраста - наиболее информативен в диагностике СМ.
- Экономические затраты - значительно выше при ЦАГ.
- Проведение умирающему больному агрессивной ЦАГ противоречит основному принципу врачевания - «Noli nocerel».
Все это, по нашему мнению, позволяет не только минимизировать применение ЦАГ для диагностики смерти мозга, но и отказаться от её использования, как это уже постулировано в ряде стран (Аргентина, Испания, Грузия).
Собственный опыт [19-25], а также публикации коллег из Израиля [26], позволяют опровергнуть последний из контрдоводов наших оппонентов о якобы отсутствующем в 15% случаев «височном окне» при ТКД.
Во-первых, модернизация современных датчиков практически преодолела эти явно завышенные данные; во-вторых, в тех единичных наблюдениях где действительно сложно получить сигнал из височной области, переход на технику трансорбитальной локации может решить проблему.
Наши предложения, основанные на уникальном и многолетнем опыте по совершенствованию диагностики смерти мозга, были изложены в докладе «Диагностика смерти мозга в России» на III Международной конференции «Смерть и кома» в Гаване в 2000 году и получили полную поддержку зарубежных коллег.
Суть предлагаемого нами алгоритма, изложенного в методических рекомендациях «Диагностика смерти мозга» [25] демонстрирует приведенная последовательность:
- прекращение пульсации М-Эхо
- падение до 30 мл в мин. объемного потока по ОСА + реверберация ЛСК;
- снижение до 10-15 см/с ЛСК в виде пикообразных всплесков по СМА реверберация или прекращение регистрации сигнала
- возможно усиление ЛСК - шунтирующий поток по НСА до 20-30 см/с;
- падение температуры орбит менее 32СС;
- выявление «разогрева» наружных сегментов лица из-за сброса крови в систему НСА;
- изоэлектрическая ЭЭГ;
- падение оксигенации по кислороду до 20-30%.
В качестве иллюстрации приводим историю болезни больного Н.
Больной Н. 19 л., поступил 10.06,96 г. в 20 ч. 35 мин. в реанимационное отделение ГКБ № 7 г. Москвы с диагнозом открытая черепно-мозговая травма, перелом свода и основания черепа, ушиб головного мозга. Травма произошла в результате падения на пациента автомобиля с домкрата во время ремонтных работ. Через 20 мин, после травмы доставлен реанимационной бригадой скорой медицинской помощи в приемное отделение ГКБ № 7 в коматозном состоянии. При транспортировке развились расстройства внешнего дыхания, интубирован начата ИВЛ.
При поступлении состояние крайне тяжелое. Следы множественных ушибов, размозжения мягких тканей головы, конечностей. Спонтанное дыхание неадекватное, при отключении от аппарата ИВЛ появляется цианоз. Тоны сердца глухие ЧСС - 58 в мин., АД - 100/50 мм рт. ст. Диагноз вдавленный перелом костей свода черепа правой височно-теменной области. Ликворея из носа правого уха Кома III ст. На осмотр и болевые раздражители не реагирует Анизокория D>S, фотореакция справа отсутствует, слева - вялая. Глазные яблоки фиксированы по средней линии, Корнеальные рефлексы отсутствуют. Сохранен трахеальныи рефлекс. Поднятые конечности вяло падают. Тонус мышц низкий, S>D. Сухожильные рефлексы низкие S>D Синдром Бабинского слева.
Произведена нейрохирургическая операция: удалены костные отломки, мозговой детрит остановлено кровотечение. Рана ушита, установлен дренаж.
Состояние больного продолжало ухудшаться, нарастала гипертермия, брадикардия, нестабильность гемодинамики, с 22:00 10.06 зарегистрирована атоническая кома в связи с чем 11 06 96 была вызвана нейродиагностическая бри гада.

Рис. 150. Больной Н., 19 лет
а. эхоэнцефалограммы правого и левого полушарий: расширение III желудочка до 6 мм; смещение М-эха до 7 мм;
б. эхопульсограмма - регистрация амплитуды пульсации III желудочка при первичном осмотре в 09:25 - ослабленная, но сохраненная кривая ликворной пульсации;
в. эхопульсограмма при осмотре в 13:10 - отсутствие пульсации III желудочка.
При клиническом осмотре в 9:10 выявлено отсутствие зрачковых и корнеальных рефлексов, фиксированный мидриаз с шириной зрачков более 5 мм с двух сторон, отрицательный окулоцефалический рефлекс, отсутствие глоточного, кашлевого, вестибулоокулярного рефлексов, подтверждена тотальная атония, арефлексия, отсутствие спонтанного дыхания, атропиновая проба - отрицательная.

Рис. 151. Больной Н., 19 лет.
Дуплексное сканирование левой ВСА в 14:10: - в неизмененном просвете артерии установлен измерительный объем под углом 48°: реверберирующий тип кровотока по ВСА, Vs=24 см/с, при объемном потоке 32 мл/мин. (подробно в тексте).
С 9:10 до 13:50 проводили ЭЭГ, Эхо-ЭГ, ЦО, ТТГ, УЗДГ, ТКД, дуплексное сканирование. При Эхо-ЭГ выявлено смещение срединных структур на 7 мм вправо (рис. 150 а), асимметричная гидроцефалия S>D, слабая пульсация III желудочка до 5% с тенденцией к падению (рис. 150 б). ТТГ выявила гипотермию орбит 31°С; в динамике - снижение температуры внутренних углов орбит до 30,5-30°С с «разогревом» наружных сегментов лица.

Рис. 152 а. Больной Н. 19 лет ЭЭГ в 09:15 - минимальная полиморфная низкоамплитудная активность в левых центральном и среднем височном отведениях, напоминающая биоэлектрическую амплитудой до 5 мкВ.

Рис. 152 6. Тот же больной
ЭЭГ - дискретное наблюдение 11:00-12:00-13:45 - электрическое молчание мозга (изоэлектрическая линия)
УЗДГ - реверберирующий кровоток по ОСА с практически равными систоло-диастолическими пиками, напоминающими кровоток по бедренной артерии Дуплексное сканирование - объемный кровоток по ВСА=32 мл/мин (рис 151) ЭЭГ - в 9:15 отмечена минимальная полиморфная низкоамплитудная активность в левых центральном и среднем височном отведениях, напоминающая биоэлектрическую, амплитудой до 5 мкВ, а с 11:00 - электрическое молчание мозга (рис. 152 а и 152 б). Церебральная оксиметрия - rSO2=15%. ТКД - измененный, без диастолической составляющей, кровоток по артериям основания мозга, Vs=15 см/с (рис. 153). Электростимуляция области сосцевидного отростка с нарастающей силой тока от 2 до 10 мА, при максимальных значениях получена минимальная реакция слева в виде отсроченного отведения левого глазного яблока кнаружи.
В процессе проведения мониторинга картина ЭЭГ оставалась прежней, в течение 1 часа исчезла реакция на электростимуляцию сосцевидного отростка, а при ТКД выявляли минимальный кровоток по обеим СМА с пикообразной систолой Vs=10 см/с и реверсированием в диастолу (рис, 154).

Рис. 153. Больной Н. 19 лет
Допплерограмма кровотока по левой СМА в 9:30 - резко измененные, одиночные систолические пики, Vs = 15 см/с.
В 12:10 проведена каротидная ЦАГ, зарегистрирован стоп-феномен на уровне бифуркации ВСА. После проведения ЦАГ, еще в течение часа регистрировали вышеописанную картину при ТКД. При попытке проведения теста апноэтической оксигенации. в течение 4 минут от начала теста появилась частая политопная экстрасистолия, падение АД, не корригируемое вазопрессорами, в связи с чем тест прерван
На основании клиническом картины, данных мониторинга и ангиографии, 11.06.96 в 13:50 установлен диагноз смерти мозга.
Биологическая смерть больного наступила 11.06.96 в 15:35, При патолого-анатомическом исследовании выявлен обширный участок ушиба левого полушария головного мозга, состоящий, в основном, из мозгового детрита, множественные очаги кровоизлияний в левом полушарии головного мозга, субарахноидальном пространстве, боковых и III желудочках, признаки тенториального и затылочного вклинения с множественными очагами геморрагии в области моста и продолговатого мозга.
По А.Э Уолкеру [1] все критерии СМ можно условно разделить на 3 группы
- Выпадение мозговых функций - это данные клинико-неврологического ЭЭГ и ВП исследований,
- Остановка внутримозгового кровотока - это ЦАГ, УЗИ и др.
- Определение жизнеспособности мозга путем изучения его метаболизма в частности, насыщения и потребления мозгом кислорода.
В данном исследовании, по-видимому отражены все 3 перечисленных компонента. При этом предоставившаяся уникальная возможность произвести независимый беспристрастный осмотр пациентов в различных клиниках Москвы, известных высоким уровнем нейрореанимационной службы, делает наш материал безусловно репрезентативным. Ведь до вызова МНДБ опытнейшие врачи делали все возможное для спасения больных, и только наличие несовместимого с жизнью заболевания и прогредиентность комы заставили их прибегнуть к нашей помощи.
Понятно что нельзя еще говорить о полном решении вопросов диагностики СМ. Это сложная и многогранная проблема, имеющая не только медицинский, но и юридический, социальный, деонтологический и религиозный аспект. Однако целесообразно обсудить некоторые итоги проведенных исследований.
Первое что представляется нам безусловным, это тот факт что ни один из клинических признаков смерти человека в действительности ее не отражает. Без сочетания современных инструментальных методов диагностики аргументированно доказать смерть мозга невозможно. Создается впечатление, что исчезновение окуловестибулярного рефлекса является наиболее грозным симптомом приближающейся или уже возникшей СМ.

Рис. 154. Больной Н. 19 лет
Допплерограмма кровотока по левой СМА в 10:20 и 11:50 - появился реверберирующий тип циркуляции с падением Vs до 10 см/с (подробно в тексте).
Второе, по нашим предварительным данным можно составить такой табель о рангах информативности инструментальных методов диагностики СМ. Наиболее чувствителен и специфичен - комплекс УЗ методов: ТКД, УЗДГ МАГ, эхопульсография III желудочка. Если к этому добавить и дуплексное сканирование артерий на шее с измерением объемного кровотока по ОСА, то, по данным D Payen. et al. [18] (и нашим аналогичным исследованиям) проблему.
100% диагностики прекращения кровотока по внутричерепным артериям можно считать практически решенной.
Подтверждением высокой ценности метода ТКД послужили 9 наблюдений с ЦАГ, когда при всех клинико-ЭЭГ признаках СМ контрастное исследование, казалось бы, подтвердило предполагавшийся «стоп-феномен», но метод ТКД убедительно показал наличие слабого кровотока по СМА, длившегося еще 50 минут после ЦАГ (рис. 154). Важность этих наблюдений трудно переоценить, их результаты сопоставимы сданными, полученными в Военно-медицинской академии, в клинике профессора Б.В. Гайдара [12], где также установлена более высокая чувствительность ТКД по сравнению с ЦАГ.
Результаты наших исследований и данные литературы дают основание полагать, что методы ультразвуковой диагностики могут успешно заменить ЦАГ в диагностике СМ, при соблюдении одного из основных постулатов ургентной медицины - «не больного к аппарату, а прибор - к пациенту».
На второе по информативности место мы поставили биоэлектрический, комплекс, а именно: сочетание ЭЭГ с ВП. Если ЭЭГ без ВП [7, 9, 22] может регистрировать биоэлектрическое молчание у вполне курбельных больных с барбитуратовой комой, когда, по нашим данным (приведенным выше), изолинию в 4-х случаях регистрировали при еще сохраненном мозговом кровотоке, то комбинация методик ЭЭГ+ВП значительно уменьшает вероятность диагностической ошибки, показывая разобщение полушарий и ствола и прекращение их функционирования.
Третью позицию занимают такие подтверждающие, но не констатирующие СМ методики, как телетермография и церебральная оксиметрия. В отличие от УЗ методов, отражающих состояние кровотока по интракраниальным сосудам, и ЭЭГ+ВП, показывающих степень нарушения функциональной способности нейронов, термография и ЦО несут косвенную информацию об уровне и особенностях экстра-интракраниального кровообращения и о некоторых параметрах метаболизма мозга.
Так, у всех 46 больных с возникшим по мере усугубления комы феноменом «разогрева» наружных сегментов лица, при прогрессирующей гипотермии внутренних углов орбит, он оказался связанным с шунтированием крови из бифуркации в НСА при непоступлении ее в гомолатеральную ВСА. Таким образом, описанный нами [27] «обратный термальный градиент» у пациентов с комой IV ст., реверберирующим кровотоком по ОСА, отражает наличие прецеребрального типа кровотока, патогномоничного для тампонады мозга.
Прогрессирующее падение показателей оксигинации мозга <30%, в основном отражающих оксигенацию корково-подкорковых областей у больных с прогрессирующей церебральной комой, вероятно, свидетельствует о критических уровнях сатурации «мозгового плаща» и гибели, в первую очередь, наиболее гипоксически чувствительных корково-подкорковых образований.
Именно подобный комплексный подход к проблеме экспресс-диагностики СМ с использованием неинвазивных, экономичных и информативных методов значительно приближает решение этой сложнейшей задачи нейрореаниматологии.
Если дальнейшие исследования подтвердят информативность указанного комплекса, то в ближайшем будущем можно будет ожидать включение ТКД, а возможно, и других перечисленных методик в официальный протокол СМ [9, 15, 16, 25].
Что получит практическое здравоохранение?
- Аргументированное решение вопроса о нецелесообразности и прекращении дальнейшей реанимации - это огромная экономия материальных, физических и духовных затрат.
- Значительное облегчение морально-юридической ответственности врачей, подписывающих протокол о смерти и, возможно, санкционирующих забор органов от умершего для пересадки.
- Реальная перспектива сокращения времени на установление абсолютно доказанной смерти мозга.
Все это может позволить во много раз улучшить приживление таких гипоксически чувствительных органов как печень, легкие и сердце, при их трансплантации.
ГЛАВА 11
ЦВЕТОВОЕ ДУПЛЕКСНОЕ СКАНИРОВАНИЕ В ОФТАЛЬМОЛОГИИ
Применение ультразвука в офтальмологии с диагностической целью обусловлено прежде всего его свойством отражаться от границ различных тканевых структур и, что особенно важно, нести информацию о неоднородностях в исследуемой среде, независимо от их светопрозрачности.
Первые эхограммы глазного яблока были опубликованы в 1956 году, и с тех пор ультразвуковая диагностика в офтальмологии оформилась в самостоятельную дисциплину, используя одномерный (А) и двухмерный (В) режимы исследования в реальном масштабе времени, различные цветовые допплеровские методики, в том числе - с использованием контрастных веществ, а в последние годы методика трёхмерного изображения структур глазного яблока и орбиты. Ультразвуковые исследования (УЗИ) при патологии глаза и орбиты применяются чрезвычайно широко, так как в большинстве случаев единственным противопоказанием к их проведению является лишь свежее обширное проникающее ранение глаза [1-5].
А-режим характеризуется получением серии вертикальных отклонений электронного луча от горизонтальной линии (одномерная эхограмма) с последующим измерением времени появления интересующего сигнала от начала зондирующего импульса и амплитуды эхосигнала. Поскольку А-режим не обладает достаточной наглядностью и судить о патологических изменениях глаза и орбиты на основании одномерных эхограмм по сравнению с двухмерными значительно труднее, предпочтение в исследовании внутриглазных и ретробульбарных структур было отдано двухмерному изображению, в то время как А-режим используют, в основном, для проведения ультразвуковой биометрии и денситометрии. Сканирование в В-режиме имеет значительное преимущество, так как воссоздаёт реальную двухмерную картину глазного яблока за счёт формирования изображения пикселями (светящимися точками) различной яркости вследствие амплитудной градации эхосигналов [1, 4, 6].
Использование эффекта Допплера в ультразвуковой аппаратуре позволило дополнить информацию о структурных изменениях в глазу и орбите показателями гемодинамики. В первых допплеровских приборах диагностика основывалась только на непрерывных ультразвуковых волнах, и это обусловливало ее недостаток, так как не позволяло дифференцировать сигналы, одновременно исходящие от нескольких сосудов, расположенных на разной глубине. Импульсно-волновая допплерография дала возможность судить о скорости и направлении кровотока уже в конкретном сосуде. Чаще всего ультразвуковая допплерография, не совмещенная с серошкальным изображением, используется в офтальмологии [5] для оценки гемодинамики в сонных артериях и их ветвях (глазной, надблоковой и супраорбитальной). Сочетание в приборах импульсной допплерографии и В-режима способствовало появлению ультразвукового дуплексного исследования, при котором одновременно оценивается как состояние сосудистой стенки, так и зарегистрированные гемодинамические показатели [6].
В середине 80-х годов дуплексное сканирование было дополнено цветовым допплеровским картированием (ЦДК) потоков крови, появилась возможность получить объективную информацию о состоянии не только крупных и средних, но даже мелких, в том числе внутриорганных сосудов. С этого момента начался новый этап в диагностике сосудистой и другой патологии, а наиболее распространённые до зтого ангиографические и реографические методики отошли на второй план. В литературе сочетание В-режима, ЦДК и импульсно-волновой допплерографии получило название триплексного, а метод - цветового дуплексного сканирования (ЦДС). Так как стала доступной для оценки ангиоархитектоника новых регионов и гемодинамика в сосудах диаметром менее 1 мм, триплексное исследование начали использовать в офтальмологии. Публикации по результатам ЦДК а позже и энергетического допплеровского картирования (ЭДК) в данной сфере медицины пришлись на 90-е годы XX века и проводились при разной сосудистой патологии и при подозрении на новообразования органа зрения [1,4,7-25]
Поскольку в некоторых орбитальных и внутриглазных опухолях с помощью ЦДК выявить сосудистую сеть не удавалось из-за очень медленных потоков крови, в середине 90-х годов были сделаны попытки исследовать васкуляризацию с применением эхоконтрастных веществ. В частности, отметили, что при метастатической хориоидальной карциноме контрастирование вызвало лишь небольшое увеличение интенсивности допплеровского сигнала. Использование эхоконтрастных препаратов при меланомах размерами менее 3 мм значительных изменений не вызвало, а при размерах меланом более 3 мм происходило заметное усиление сигнала и выявление новых и более мелких сосудов по всему объему опухоли. В случаях когда после брахитерапии при помощи ЦДК кровоток не регистрировался введение контрастного вещества не давало каких-либо значительных результатов. В орбитальных карциномах и лимфомах при применении эхоконтраста отмечено отчетливое или умеренное усиление скорости кровотока и выявление новых сосудов. Улучшилась дифференциация опухоли сосудистой оболочки от субретинального кровоизлияния. Предполагается, что цветовое дуплексное сканирование сосудов с применением эхоконтрастных веществ будет способствовать более совершенному изучению кровоснабжения опухолей и, вероятно во многом заменит рентгено-контрастную ангиографию. Однако эти препараты пока дороги и не получили широкого распространения [26-28].
Дальнейшее усовершенствование диагностических возможностей ультразвука отчасти связывают с трехмерными изображениями (Д-режим) структур органа зрения. В настоящее время признано, что востребованность объемной реконструкции существует в офтальмоонкологии, в частности, для определения объема и «геометрии» увеальных меланом с целью последующей экспертизы, например, для оценки эффективности проведенного органосохранного лечения [29, 30].
Для получения изображения сосудов глаза D-режим мало пригоден. Для решения данной проблемы используется цветовое и энергетическое кодирование потоков крови с последующей оценкой цветовой карты и спектра допплеровского сдвига частот (СДСЧ), полученного в режиме импульсной допплерографии.
При картировании потоков органа зрения в большинстве случаев используют кодирование артериального русла в красный цвет, так как кровоток в нем направлен в сторону датчика, а венозного - в синий вследствие оттока венозной крови в глубь орбиты и далее - в полость черепа (кавернозный синус). Исключение составляют вены глазницы, анастомозирующие с венами лица.
Для проведения УЗИ у больных офтальмологического профиля используют датчики с рабочей частотой 7,5-13 МГц, электронного линейного и микроконвексного, а в аппаратуре более раннего выпуска также механического секторного сканирования (с водной насадкой), позволяющие получать достаточно чёткое изображение поверхностно расположенных структур. Укладку обследуемого производят таким образом, чтобы врач находился у изголовья больного (как при УЗИ щитовидной и слюнных желез). Исследование выполняется через нижнее или закрытое верхнее веко (транскутанный, транспальпебральный метод сканирования).
При исследовании глаза, его придаточного аппарата и орбиты соблюдают определенную последовательность постановки датчика и направления взгляда пациента для осуществления всеобъемлющего посегментарного осмотра внутриглазных структур с учетом переднего и заднего его отрезков, а также деления на 4 квадранта (сегмента) глазного яблока и наличия центральной зоны глазного дна. В орбите различают верхний, нижний, внутренний и наружный отделы, выделяют область вершины глазницы [4].
Для выявления изменений в области придаточного аппарата глаза (веки, слёзная железа, слёзный мешок) проводят обзорное сканирование в поперечной, продольной и косых плоскостях.
Устанавливая датчик на закрытое верхнее веко над роговицей (поперечное сканирование), получают срез глазного яблока через его переднезаднюю ось, позволяющий оценивать состояние центральной зоны глазного дна и находящихся в поле УЗ луча передней камеры, радужки, хрусталика и части стекловидного тела, а также центральный отдел ретробульбарного пространства (зрительный нерв и жировая клетчатка).
В дальнейшем для посегментарного осмотра глаза последовательно косо устанавливают датчик:
- снаружи на закрытое верхнее веко, при этом пациента просят перевести взгляд книзу кнутри, направление сканирования - туда же; таким образом для осмотра становится доступным нижневнутренний сегмент глазного яблока и аналогичный отдел ретробульбарного пространства;
- на внутреннюю часть закрытого верхнего века (направление взгляда пациента и УЗ луча вниз кнаружи) - осматривают нижненаружный сегмент глаза и орбиты;

Рис. 155 а. Артерии глазницы и их истоки (по R. Quain. 1986). I - ВСА перед входом в сонный канал II - OA и ее ветви- III - верхний отрезок НСА- IV - верхнечелюстная артерия. 1 - глазная артерия 2 - сифон ВСА. 3 - задние соединительные артерии 4 - СМА 5 - височная артерия, 6 - ПМА, 7 - подглазничная артерия, 8 - конечная ветвь верхнечелюстной артерии. 9 - надглазничная артерия, 10 - носовая артерия, анастомо-зирующая с угловой (11) Вид справа.
- на внутреннюю часть нижнего века при открытых глазах (направление взгляда и сканирования кверху кнаружи) - оценивают верхненаружный сегмент глазного яблока и орбиты;
- на наружную часть нижнего века при открытых глазах (направление взгляда и сканирования кверху кнутри) - достигается визуализация верхневнутреннего сегмента глаза и орбиты
- Для получения изображения прямых мышц глаза в ретробульбарном пространстве датчик устанавливают следующим образом
- для визуализации нижней прямой мышцы - на закрытое верхнее веко (направление взгляда и УЗ луча вниз; поперечное сканирование);
- верхней прямой мышцы - на нижнее веко при открытых глазах (направление взгляда и УЗ луча вверх; поперечное сканирование);
- наружной прямой мышцы - при закрытых глазах у внутреннего угла глазной щели (направление взгляда и УЗ луча кнаружи; продольное сканирование);
- внутренней прямой мышцы - при закрытых глазах у наружного угла глазной щели (направление взгляда и УЗ луча кнутри; продольное сканирование).
При этом последовательно соответственно видны внутриглазные структуры на границе нижних сегментов, верхних сегментов, наружных сегментов, внутренних сегментов глаза. Как и при осмотре других органов, во время исследования необходимо постоянно изменять угол наклона датчика [4].
Для органа зрения наибольшую роль играют гемодинамически значимые изменения кровотока по глазной артерии, верхней глазной вене, центральных артерии и вене сетчатки, задних коротких цилиарных артериях, а также в новообразованных сосудах опухолей и опухоле-подобных очагов.
Для идентификации наиболее важных сосудов органа зрения используют определенные ориентиры [4].
Глазная артерия (ГА) - главный и самый крупный артериальный сосуд в орбите, отходящий от сифона внутренней сонной артерии, дающий начало обширной разветвленной сети, кровоснабжаю- щей мягкие ткани ретробульбарного пространства, в том числе мышцы, глазное яблоко, слезную железу. Ее проксимальная (начальная) часть визуализируется глубоко в центральной части глазницы, пересекается со зрительным нервом и далее распространяется в верхнемедиальный отдел орбиты. Непосредственным продолжением ГА является надблоковая артерия, выходящая из периорбитальной области на поверхность лобной части черепа медиальнее надглазничной артерии (рис. 155). При делении ГА на множество ветвей сразу при входе в орбиту («рассыпной», а не «магистральный» тип сосуда) могут возникнуть трудности в ее идентификации, но встречаются такие варианты сравнительно редко. Наиболее просто идентифицируют ГА в орбите при постановке датчика по вышеописанной методике для визуализации нижневнутреннего отдела.

Рис. 155 б. Глазная артерия и ее ветви. А-глазная артерия; Н - зрительный нерв; 1 - центральная артерия сетчатки; 2 - цилиарная задняя длинная медиальная артерия; 3 - цилиарная задняя длинная латеральная артерия; 4 - слезная артерия; 5 - надглазничная артерия; 6 - верхненаружный и нижневнутренний (7) мышечные стволы; х - место отхождения коротких задних цилиарных артерий от основной магистрали; Ан - анастомоз между слезной и средней менингиальной артериями. Правая глазница. Вид сверху.
Верхняя глазная вена (ВГВ) - наиболее крупный сосуд венозного русла орбиты, достаточно просто выявляется в верхнемедиальном отделе при соответствующем расположении датчика по предложенной методике. Направляется ВГВ спереди-назад, сверху-вниз, отчасти с S-образным изгибом (рис. 156). Совместно с нижней глазничной веной, которая в части случаев может отсутствовать, отводит в кавернозный синус венозную кровь.

Рис. 156. Эхограмма глаза в режиме ЦДК. Глазная артерия (стрелка 1) и верхняя глазная вена .стрелки 2)

Рис. 157. Эхограмма глаза в режиме ЦДК Центральная артерия сетчатки (стрелка 1) и задняя короткая цилиарная артерия (стрелка 2).

Рис. 158. Эхограмма глаза в режиме ЦДК. Центоальная артерия сетчатки (стрелка 2), определяющаяся в составе зрительного нерва (указан маркерами), задняя короткая цилиарная артерия (стрелка 3) и кровоток в хориоидальном слое О. D. в режиме ЭДК Кровоток в хориоидальном слое (стрелка 1).

Рис. 159. Эхограмма глаза в режиме ЦДК Центральная вена сетчатки (указана стрелкой) в составе зрительного нерва по обе стороны которого - задние короткие цилиарные артерии в режиме ЦДК и кровоток в хориоретинальном слое О. D.
Центральная артерия сетчатки (ЦАС) - ветвь ГА, наиболее легко идентифицирующаяся в составе зрительного нерва на протяжении около 1 см от места его выхода из глазного яблока. Располагается совместно с веной. При картировании отличается от последней по прокрашиванию в красный цвет и артериальному типу кровотока (рис. 157, 158). Дает начало ретинальным сосудам, разветвляясь на поверхности диска зрительного нерва
Таблица 38. Показатели кровотока у взрослых по сосудам здорового глаза.
|
Показатели гемодинамики (M±m) |
Исследуемые артерии | ||
|
ГА |
ЦАС |
ЗКЦА | |
|
Максимальная систолическая скорость Vmax, см/с |
43,60 ± 0,67 |
14,79 ± 0,29 |
15,58 ± 0,33 |
|
Конечная диастолическая скорость Vmin, см/с |
12,98 ± 0,47 |
5,00 ± 0,17 |
5,88 ± 0,18 |
|
Средняя скорость V med, см/с |
20,91 ± 0,53 |
7,68 ± 0,21 |
8,99 ± 0,24 |
|
Индекс резистентности RI (ИР) |
0,704 ± 0,008 |
0,661 ± 0,009 |
0,618 ± 0,009 |
|
Индекс пульсации PI (ИП) |
1,52 ± 0,48 |
1,34 ± 0,05 |
1,17 ± 0,06 |
|
Систоло-диастолическое отношение Ratio |
3,61 ± 0,14 |
3,26 ± 0,14 |
2,84 ± 0,09 |
|
Время ускорения Тасс, мс |
62,58 ±2,51 |
70,83 ± 1,93 |
72,21 ± 2,09 |
Центральная вена сетчатки (ЦВС) - важное для глаза анатомическое образование образуется от слияния ретинальных вен, видна в составе зрительного нерва у заднего полюса глазного яблока рядом с ЦАС. прокрашивается в синий цвет с регистрацией венозного кровотока (рис. 159).
Задние короткие цилиарные артерии (ЗКЦА) - несколько ветвей ГА, (числом до 12), расположенных вокруг зрительного нерва в непосредственной близости от него прободающие склеру, участвующие в кровоснабжении его диска.
Кнаружи от ЗКЦА с обеих сторон можно выделить задние длинные цилиарные артерии, отличающиеся несколько более высокими показателями скорости кровотока: в области экватора глазного яблока с некоторыми техническими трудностями - четыре вортикозные вены (по две с каждой стороны). В латеральном отделе орбиты легко визуализируют одну из крупных ветвей ГА - слезную артерию направляющуюся к слезной железе и делящуюся там, на более мелкие ветви.
С учетом спектральных характеристик кровотока артерии глаза и орбиты относятся к сосудам условно периферического типа Кровоток в них моно- или бифазный, среднерезистентныи. с острыми систолическими пиками, но с диастолической составляющей в норме никогда не опускается ниже изолинии (рис. 160 табл. 38). У лиц старше 50 лет отмечается некоторая сглаженность пиков из-за уменьшения эластичности сосудистой стенки

Рис. 160. Эхограмма таза в триплексном режиме с регистрацией спектрограммы кровотока по глазной артерии (а), центральной артерии сетчатки (б), задней короткой цилиарной артерии (в).
Венозный спектр кровотока (в ВГВ и ЦВС) иногда приближен к линейной форме, а чаще - бифазный, за счет колебаний, связанных с сердечным циклом. СДСЧ в ЦВС обычно регистрируют совместно с артериальным кровотоком в ЦАС, но располагается ниже изолинии Максимальная скорость достаточно вариабельна в среднем от 4 до 8 см/с в ЦВС и от 4 до 14 см/с в ВГВ (рис 161).

Рис. 161. Эхограмма глаза в триплексном режиме с регистрацией спектрограммы кровотока по верхней глазной вене (а) и центральной вене сетчатки (6).
Показатели гемодинамики в норме используют для сопоставления с аналогичными параметрами у пациентов с разными сосудистыми, воспалительными, неопластическими и др. заболеваниями органа зрения как в существующем, так и в новообразованном сосудистом русле.
Наибольшая информативность допплеровских методик выявлена при следующих патологических процессах:
- передней ишемической нейрооптикопатии;
- гемодинамически значимом стенозе или окклюзии внутренней сонной артерии, вызывающих изменение направления кровотока в бассейне ГА (подробно в главе 3);
- спазме или окклюзии ЦАС;
- тромбозе ЦВС, ВГВ и кавернозного синуса;
- ретинопатии недоношенных;
- псевдотуморозных поражениях глазного дна и орбиты;
- опухолях глаза, его придаточного аппарата и глазницы;
- отслойке сетчатки на фоне фиброзных изменений стекловидного тела и пролиферативной стадии диабетической ангиоретинопатии;
- аневризме глазной артерии и варикозном расширении вен орбиты;
- каротидно-кавернозном соустье [4].
Экстраорбитальные сосудистые заболевания, такие как атеросклероз сосудов и гипертоническая болезнь, вызывающие увеличение ригидности сосудистой стенки, приводят к уплощению и закруглению систолического пика допплерограммы, его отклонению, появлению дополнительного пика в систолу, выраженному спектральному расширению.
При окклюзии ВСА на шее (если она не закрывает устье ГА) по ГА регистрируют ретроградный кровоток, она становится как бы мостом, по которому реализуется путь коллатерального кровотока в мозг (подробно в главе 3).
При стенозе внутренней сонной артерии линейная скорость кровотока (ЛСК) снижается на стороне поражения как в ГА, так и в ее ветвях. На фоне глаукомы с повышенным внутриглазным давлением увеличивается периферическое сосудистое сопротивление в бассейне ЗКЦА и ЦАС, могут снижаться скорости в ГА. Снижение скоростей в ЦАС и ЗКЦА происходит при пролиферативной
стадии диабетической ангиоретинопатии. Выраженные отек ретробульбарной клетчатки и утолщение экстраокулярных мышц при аутоиммунной офтальмопатии могут вызвать затруднение оттока венозной крови из орбиты и ЛСК в ВГВ становится ниже нормы. Многие патологические состояния, развивающиеся в сосудах, непосредственно кровоснабжающих глаз, при несвоевременном лечении быстро приводят к потере зрения, и ранняя их диагностика достаточно актуальна. К этой группе можно отнести спазм или окклюзию ЦАС, тромбоз ЦВС и переднюю ишемическую нейрооптикопатию. При последнем состоянии в первые сутки заболевания наблюдают обеднение или отсутствие сосудистого рисунка вокруг диска зрительного нерва из-за резкого снижения скоростных показателей в ЗКЦА. Попытки регистрации в них СДСЧ бывают не всегда успешными. На фоне лечения, обычно в течение первой недели, в бассейне данных артерий происходит реперфузия с восстановлением кровотока.
Спазм или окклюзия ЦАС проявляется отсутствием прокрашивания этого сосуда в области диска и ретробульбарной части зрительного нерва, сетчатка в перипапиллярной области отечна. При сохранении частичной проходимости артерии спектрограмма становится низкоамплитудной за счет снижения ЛСК.
Тромбоз ЦВС приводит к выраженному изменению внутриглазной гемодинамики. Кровоток по вене не регистрируют или отмечают значительное уменьшение их скорости. Переполнение кровью венозного русла сетчатой оболочки вызывает увеличение сосудистого сопротивления в бассейне ЦАС, диастолическая составляющая кровотока по артерии выражена плохо или отсутствует, компенсаторно снижается скорость кровотока в ГА на стороне поражения. Гемодинамические изменения сопровождаются характерной картиной в В-режиме: проминируют отечный диск зрительного нерва и макулярная зона, утолщаются внутренние оболочки глаза.
Тромбоз кавернозного синуса, иногда в сочетании с тромбозом ВГВ, вызывает увеличение диаметра данной вены, при картировании она не прокрашивается, если движение крови в ней отсутствует, ЛСК не регистрируют. При проходимости части ВГВ кровоток может быть направлен в сторону лицевых вен, венозный тип спектра сохранен. В В-режиме отмечают отек ретробульбарной жировой клетчатки, расширение периневрального пространства в орбите и проминенция отечного диска зрительного нерва.

Рис. 162. Эхограмма глаза в режиме ЦДК. а) расширенная верхняя глазная вена с ретроградным высокоскоростным кровотоком (желтые оттенки цвета) с турбулентными завихрениями (голубой цвет);
Выраженные гемодинамические изменения в глазу и орбите возникают при образовании каротидно-кавернозного соустья (ККС). С учетом того, что классическая триада этого заболевания (экзофтальм, пульсация глазного яблока и дующий шум в области виска и глазницы на стороне поражения) отсутствует примерно у 25-30% больных, правильный диагноз в этой группе пациентов впервые устанавливают при ультразвуковом офтальмологическом исследовании с использованием допплеровских методик.
При проведении параллелей с клинической триадой ККС можно выделить классическую «ультразвуковую триаду» данного заболевания (рис. 162):
- расширение, иногда очень значительное, ВГВ, которая видна в В-режиме на достаточно большом протяжении как дополнительная изогнутая анэхогенная трубчатая структура;
- ретроградный кровоток в ВГВ в режиме картирования (происходит смена цвета с синих оттенков на красно-оранжево-желтые);
- артериализация венозного кровотока в ВГВ (увеличиваются линейные скорости, ретроградное направление кровотока, формируются острые систолические пики на допплерограмме).
Переполнение артериальной кровью венозного русла орбиты сказывается на гемодинамике в ретинальных сосудах и хориоидальном слое: нарушение венозного оттока от внутриглазных структур приводит к значительному увеличению периферического сопротивления в бассейне ЦАС и несколько менее выражено в ЗКЦА. В ЦАС диастолическая скорость может снижаться вплоть до появления реверсивных потоков с регистрацией трехфазной допплерограммы, в ЗКЦА RI приближается к единице. В-режим демонстрирует при этом отек ретробульбарной клетчатки, диска зрительного нерва, внутренних оболочек глаза, расширение периневрального пространства в орбите.
Дифференциально-диагностический характер допплерография имеет при выявлении на фоне выраженных помутнений в стекловидном теле и фиброзных тяжей отслоенной сетчатой и сосудистой оболочек, функционирующей артерии стекловидного тела у детей с Рубцовыми стадиями ретинопатии недоношенных (рис. 163, 164).

Рис. 163. Эхограмма глаза. Диагностика функционирующей артерии стекловидного тела у ребенка в рубцовой стадии ретинопатии недоношенных:
а. Фиксированные помутнения в стекловидном теле O.D. в В-режиме - ретролентальная фиброплазия (стрелки II) и грубый тяж, идущий от диска зрительного нерва в сторону переднего отрезка глаза (стрелки - -);
б. В проекции упомянутого тяжа в режиме ЦДК регистрируется артериальный кровоток - признак наличия функционирующей артерии стекловидного тела (указана стрелкой).
В связи с тем, что воронкообразную отслойку сетчатки могут симулировать пленчатые структуры стекловидного тела V-образной формы, для ее подтверждения необходимо обнаружить в данной структуре ретинальный сосуд. Проще это сделать недалеко от места крепления сетчатой оболочки к диску зрительного нерва. Сигналы при картировании могут быть выражены слабо, прослеживаться на отдельных фрагментах сетчатки, когда в область сканирования попадает крупная ветвь ЦАС. ЛСК в ретинальных сосудах низкоамплитудный, скорости ниже, чем в ЦАС, иногда - в 2 раза.
В проекции пузыревидно отслоенной хориоидеи хорошо регистрируется артериальный кровоток, скорости превышают таковые в ретинальных сосудах, при картировании прокрашивается большая часть «пузырей» (рис. 164).
У детей с ретинопатией недоношенных нередко обнаруживают грубый или слабо выраженный тяж, фиксированный одним из краев в области диска зрительного нерва, другим - в области задней капсулы хрусталика и довольно часто встречающейся у таких детей ретролентальной фиброваскулярной ткани. При подобной ультразвуковой картине создается впечатление наличия Т-образной отслойки сетчатки. Однако режим картирования позволяет увидеть обычно хорошо выраженный артериальный поток в проекции тяжа, скоростные характеристики которого часто гораздо выше, чем в ретинальных сосудах, сигналы кровотока более четкие (рис. 163).
Особое значение метод цветового дуплексного сканирования приобретает при обследовании больных с подозрением на онкоофтальмопатологию. В детской онкоклинике выявление и оценка неоваскулярного русла позволяет проводить дифференциальную диагностику между ретинобластомой, туморо-подобными отложениями твердого экссудата в субретинальном пространстве и в слоях сетчатки при болезни Коатса, фиброваскулярными разрастаниями в стекловидном теле при рубцовых стадиях ретинопатии недоношенных.
Абсолютное большинство внутриглазных злокачественных новообразований у детей представлено ретинобластомой. Цветовое дуплексное сканирование позволяет обнаружить опухолевые сосуды в очаге даже при наличии массивных участков петрификации.
При рубцовых стадиях ретинопатии недоношенных развивающиеся фиброваскулярные структуры создают акустический эффект «плюс-ткани», но в отличие от ретинобластомы сигналы от кровотока по мелким сосудам в ее проекции достаточно слабые, кровоток зарегистрировать трудно из-за низкой скорости.

Рис. 164. Эхограмма глаза в режиме ЦДК. На фоне выраженных помутнений в стекловидном теле идентифицируется «целующаяся» отслойка сосудистой оболочки в виде двух пузырей.
Отложения твердого экссудата на глазном дне у детей с болезнью Коатса при ультразвуковом исследовании в В-режиме фактически идентичны ретино-бластоме. Правильный диагноз устанавливается по совокупности сонографических критериев, одним из которых является аваскулярность очагов, и регистрация лишь ретинального сосуда на поверхности образования, сигналы от кровотока в котором чаще всего неустойчивы, вследствие чего кровоток зарегистрировать не удается.

Рис. 165. Эхограмма глаза в режиме ЦДК. Дифференциальная диагностика внутриглазных опухолей и псевдотуморозных образований:
а. Гемангиома хориоидеи OS (указана стрелками), в проекции которой регистрируется кровоток по новообразованным сосудам в режиме ЦДК;
б. Опухолеподобный аваскулярный очаг OS (указан стрелкой) при псевдотуморозной фазе центральной инволюционной дистрофии сетчатки, кровоток регистрируется только по подлежащей хориоидее.
У взрослых наиболее актуальна дифференциация меланомы хориоидеи, составляющей до 80% всех злокачественных внутриглазных опухолей, от псевдотуморозной фазы центральной инволюционной дистрофии сетчатки, субретинальных и субхориоидальных кровоизлияний, метастаза и гемангиомы сосудистой оболочки. Сочетание сонографических признаков, включая допплерографические, позволяет успешно справиться с этой задачей (рис. 165).

Рис. 166. Эхограмма глаза в триплексном режиме: меланома хориоидеи с измененным кровотоком (низкорезистентный, с венозной составляющей, интенсивным заполнением спектра в области, близкой к базовой линии).
Для меланом хориоидеи характерно развитие преимущественно артериальной сети в очаге, четко выделяют один или несколько питающих сосудов на периферии образования, степень васкуляризации варьирует от скудной до очень выраженной. У разных пациентов меняется и характер распределения новообразованных артерий в опухоли (рис. 166). В сосудах из-за несовершенства неопластического ангиогенеза отсутствуют некоторые компоненты стенки, в связи с чем на допплерограммах видно отклонение части параметров кровотока от нормы.
По васкуляторным характеристикам метастазы хориоидеи, занимающие второе место у взрослых среди злокачественных внутриглазных новообразований, близки к меланомам, и диагноз ставится по совокупности ультразвуковых критериев. В метастатической опухоли гораздо реже выделяют крупный питающий артериальный сосуд, степень васкуляризации обычно умеренная, преобладает диффузный, мультицентричный тип роста.
Гемангиомы хориоидеи с течением времени приобретают развитую сосудистую сеть (рис. 167 а, б в) с признаками артерио-венозного шунтирования в ангио-русле и высокой эхогенности в В-режиме.
Опухолеподобные проминирующие очаги на глазном дне, возникающие при субретинальных и субхориоидальных кровоизлияниях, псевдотуморозной фазе центральной инволюционной дистрофии сетчатки и др в режиме картирования аваскулярны, что в сочетании с иными параметрами позволяет провести дифференциальную диагностику в онкоклинике
При точно установленном диагнозе внутриглазной опухоли допплерографические характеристики (степень и характер неоваскуляризации, показатели гемодинамики в опухолевых сосудах) являются важным критерием успешности проводимого органосохранного лечений. Наряду с уменьшением объема новообразования в качестве положительных критериев рассматриваются запустевание сосудистого русла в нем, снижение ЛCK, повышение резистентности в бассейне опухоли, что расценивали как обструкцию сосудов вследствие постлучевых некротических изменений в очаге воздействия полихимиотерапии, лазерной деструкции и пр. [4].
ЦДС помогает в дифференциальной диагностике объемных образований орбиты и придаточного аппарата глаза, так как ряд патологических состояний, такие как дакриоаденит, воспалительная гранулема, гематома и пр., в В-режиме трудно отличить от неопластического процесса.

Рис 167, Эхсграмма глаза в режиме ЦДК. Меланома хориоидеи
а. Мапанома О S. (указана стрелкой), на поверхности которой визуализируется крупный питающий, (взбирающийся», сосуд,
б. Меланома O.D. (указана стрелкой), гиперваскулярный вариант;
в. Меланома O.S., умеренноваскулярный вариант; стрелками указаны сосуды врастающие в опухоль от периферии к центру очага.
В то же время характер васкуляризации опухолей помогает определить их видовую принадлежность. Так, нейрогенные опухоли - глиома и менингиома - имеют разную степень кровоснабжения (в менингиоме сосудистая сеть хорошо развита). В лимфосаркоме небольших размеров, локализующейся в области конъюнктивы век - глазного яблока сосуды единичны, видны у поверхности очагов. В отдельных случаях у взрослых в гемангиомах, расположенных ретробульбарно, на фоне каверн также регистрируют немногочисленные сигналы. В то же время у детей смешанные гемангиомы в области век и рабдомиосаркомы имеют хорошо развитую сосудистую сеть.
Таким образом, в настоящее время определенный круг патологических состояний глаза, его придаточного аппарата и орбиты требует обязательного использования всего арсенала допплеровских методик для осуществления своевременной и правильной диагностики, от которой нередко зависит не только качество жизни больного с сохраненным зрением, но и сама жизнь. В ряде случаев допплерография в сочетании с В-сканированием помогает избежать более дорогостоящих, иногда - инвазивных вмешательств, таких как рентгеновские ангиография и КТ, МРТ, а при некоторых заболеваниях превосходят их по информативности.
ГЛАВА 12
ЦВЕТОВАЯ ДОППЛЕРОВСКАЯ СОНОГРАФИЯ В ДИАГНОСТИКЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
При профилактических осмотрах женщин в среднем выявляют 15,4% больных раком молочных желез (МЖ). Наблюдается рост числа больных с впервые выявленной IV стадией рака МЖ (в 1995 году - 12,4%, в 1996 году - 12,6%, в 1998 году - 12,9%). В 1998 году в России удельный вес больных злокачественными новообразованиями, выявленных уже при наличии отдаленных метастазов, составил 25% [1]. При этом основной прирост заболеваемости раком МЖ прослеживается у женщин в возрасте свыше 40-45 лет [2].
Необходимость проведения органосохраняющих, функционально-щадящих и реконструктивно-пластических операций при комбинированном лечении больных раком МЖ ужесточило требования к точности диагностики опухолей.
Первые оригинальные исследования МЖ с помощью сонографии проведены J.J. Wild [3]. Авторы использовали ультразвуковые диагностические приборы, работающие в одномерном режиме (А-режим). В последующем J.J. Wild и J.M. Reid в 1952 г., используя аппаратуру с двухмерным бистабильным изображением (В-режим) и сложное сканирование, впервые провели дифференциальную диагностику кисты и тканевого (солидного) образования МЖ [3]. Для улучшения качества изображения такого класса приборов исследователи применяли дополнительные приспособления в виде водных резервуаров (иммерсионное сканирование), водных или гелевых насадок на датчик.
По данным A.I. Mushlin [3], до середины 70-х годов новообразования МЖ диаметром до 1 см при ультразвуковом исследовании (УЗИ) выявляли всего лишь в 8% случаев, тогда как маммография (МГ) позволяла обнаружить опухоли того же размера в 63% случаев.
60-70-е годы характеризовались качественным скачком в развитии ультразвуковой диагностической аппаратуры, в связи с внедрением серошкального сканирования. Возросло качество получаемого изображения. G. Kossoff в 1977 году подробно описал ультразвуковую семиотику послойного строения тканей МЖ: кожи, подкожно-жировой клетчатки, соединительнотканных связок Купера, железистой ткани с протоками [3, 4]. Т. Kobayashi в 1975 году одним из первых подробно описал диагностические критерии опухолей МЖ, основанные на характеристике дорсального эхо. Было описано, что некоторые нормальные структуры могут при ультразвуковой картине симулировать узлы, например, пересечения связок, дольки жировой ткани, подчеркнутые куперовскими связками [3, 5].
В конце 80-х годов в связи с бурным развитием ультразвуковой диагностической техники значительно возрастают возможности эхографии в диагностике заболеваний МЖ. С появлением датчиков 5-10 МГц улучшилась чувствительность метода. Использование широкополосных датчиков с изменяемым фокусным расстоянием для выявления патологии МЖ увеличило специфичность и точность исследования. Оценка выполнения исследования на разной аппаратуре различными датчиками показала наличие корреляции между разрешающей способностью метода, чувствительностью УЗИ и ценой прибора [3, 5].
Патологическую опухолевую васкуляризацию с целью выявления злокачественных узлов в МЖ у женщин, по данным Wells et al. [3], стали успешно диагностировать с середины 70-х годов. В последующих работах состояние сосудистого русла МЖ изучали с помощью дуплексного и триплексного сканирования [7]. При этом появились попытки использовать показатели линейной скорости кровотока (ЛСК) как фактор прогноза течения рака. Высокую степень васкуляризации, выявляемую при раке МЖ, исследователи ассоциируют с процессом малигнизации и степенью его распространения, что очень важно для определения объема оперативного лечения [8, 9].
Использование ультразвукового исследования как метода, дополняющего данные МГ в выявлении рака МЖ, с конца 80-х годов стало меняться на мнение, что УЗИ - обязательное дополнение к МГ и клиническому осмотру. При выявлении узла в МЖ клинически и при ультразвуковой картине рака показана пункция, и только при сомнительном заключении УЗИ рекомендовано проведение МГ [10, 11]. По мнению А.В. Дорофеева [11] УЗИ позволяет провести дифференциальный диагноз при наличии воспалительного процесса, и является методом выбора у больных с отечно-инфильтративным раком МЖ.
По мнению большинства специалистов в настоящее время еще нет таких ультразвуковых критериев, которые бы позволяли во всех случаях без сомнения определять природу процесса. На практике имеют место осложненные случаи: нагноение кист с утолщением капсулы и неоднородным внутренним содержимым, нарушение питания в фиброаденоме с появлением внутри опухоли жидкостных полостей или кальцинатов и др. В этих ситуациях исключить злокачественный процесс по данным УЗИ затруднительно. Кроме того, злокачественные опухоли небольших размеров могут иметь ряд признаков доброкачественного образования. В настоящее время УЗИ занимает ведущее мест среди неионизирующих методов в диагностике заболеваний МЖ.
В настоящее время чувствительность УЗИ в выявлении разных заболеваний МЖ колеблется от 69 до 100% при специфичности от 86% до 100% и точности от 75% до 100% [12-16]. Причем, по данным С. Cressa et al. [17], чувствительность УЗИ возрастает при исследовании пальпируемых узлов до 97% (при осмотре непальпируемых чувствительность метода не превышает 69%). А для непальпируемых малых раков точность не превышает 25-89%, при чувствительности - 56%, а специфичности - 55% [18-27]. В зависимости от стадии заболевания (и размера узла) чувствительность УЗИ в выявлении рака МЖ колеблется от стадии заболевания и размера узла от 54% до 90%.
Чувствительность УЗИ в диагностике разных форм рака молочной железы зависит от гистологической структуры образования и составляет от 25-68% при инвазивно-дольковом раке при узле размером менее 1 см, до 100% при скирре и солидном раке узла такого же размера [27-29].
По эмбриогенезу молочная железа тесно связана с потовыми железами.
Анатомически МЖ представляют сложный альвеолярно-трубчатый орган, состоящий из 15-24 долей. Каждая доля имеет конусовидную форму с вершиной у соска, окружена рыхлой соединительной тканью и небольшим количеством жировой клетчатки, которая тесно охватывает ткань железы и частично проникает между дольками. Все выводные протоки одной железистой доли соединяются в млечный ход, который оканчивается на верхушке соска. Количество протоков может быть от 12 до 20 В молочных железах существует два вида соединительной ткани - опорная (к ней относят и поддерживающие связки Купера) и ложевая, или мантильная [30].
Морфофункциональной единицей МЖ являются альвеолы, величина которых изменяется в зависимости от гормональной фазы. У основания каждой альвеолы находится сеть миоэпителиальных клеток, способных к сокращению. Альвеолы, сужаясь, переходят в тонкий проток. 150-200 альвеол объединены в дольки с общим протоком более крупного диаметра Дольки, в свою очередь, объединены в доли с еще более широкими протоками.
В репродуктивном периоде МЖ достигают полного расцвета. При беременности и лактации уровень развития паренхимы железы превосходит уровень развития у девушек и нерожавших женщин в 50 раз рожавших женщин - в 9 раз [30],
В менопаузе происходит угасание функции яичников. В молочных железах увеличивается количество жировой ткани, уменьшается количество тубулярных долек, вокруг протоков появляются бессосудистые зоны. В возрасте 60-70 лет наиболее типичной структурой МЖ являются островки фиброзной ткани с протоками, расположенные в жировой клетчатке. Одиночно лежащие протоки находятся в спавшемся состоянии. Дольки мелкие, внутридольковая строма плотная, грубоволокнистая, бедная сосудами и клетками.
Кровоснабжение МЖ происходит в основном из трех источников: внутренней грудной артерии (ветвь подключичной артерии), боковой грудной артерии (ветвь подключичной артерии), межреберных артерий числом от 3 до 7 (рис. 168).
Выявлено, что у молодых женщин интенсивность регистрируемых допплеровских сигналов становится более значительной в период овуляции, описана разница в сосудистом рисунке МЖ у женщин в пре- и постменопаузе. Но, несмотря на большое индивидуальное разнообразие сосудистого рисунка, он почти всегда симметричен в обеих МЖ.
Исследование собственно МЖ проводят в положении пациентки лежа на спине, на правом и на левом боку, сидя. Для лучшего осмотра его осуществляют в положении пациента с отведенной рукой, исследуя состояние МЖ и затем осматривают правую подмышечную область (для исключения патологии в добавочной дольке) Далее переходят к исследованию контрлатеральной МЖ и подмышечной области.
Начинают осмотр МЖ с исследования на границе верхних квадрантов, затем по часовой стрелке осматривают всю железу меняя положение датчика, и заканчивают осмотр снова на границе верхних квадрантов. Исследование проводят полипозиционно и полипроекционно, начиная с периферических отделов, далее перемещая датчик к ареоле. В заключение осмотра исследуют область ареолы.

Рис. 168. Схема артерий, кровоснабжающих молочную железу.
Оценивают состояние стромы, железистых структур, распределение жировой клетчатки, степень инволютивных процессов, состояние млечных протоков, связок Купера, изменений кожи и подкожной клетчатки, других патологических изменений или образований в строме МЖ, области ретромаммарного пространства.
При выявлении патологических изменений, таких как узловые образования или диффузные изменения ткани, описывают выявленные структуры. Сначала при исследовании патологического очага устанавливают его точную локализацию. Затем перпендикулярными, поперечными и косыми срезами при различных наклонах датчика изучают размеры, форму, контуры, капсулу и структуру, наличие акустических теней или усиления от боковых и дистальных структур, тяжей инфильтрации, соотношение с окружающими тканями. При оценке размера производят измерение максимальной длины, ширины и толщины образования. Стандартное исследование дополняют компрессионными пробами (при дозированной компрессии МЖ описывают изменение формы и размера структур).
Критериями оценки патологических изменений при УЗИ МЖ являются:
- изменения структуры собственно железистой ткани железы (или участка железы), жировой ткани, кожи, других структур с вовлечением МЖ;
- число образований;
- максимальные длина, ширина и толщина каждого образования;
- форма образования: округлая, овальная, неправильная;
- контуры образования: четкие, нечеткие (размытые); ровные, неровные (бугристые);
- внутренняя структура опухоли (анэхогенная, гипоэхогенная, гиперэхогенная, однородная неоднородная солидная, с жидкостными включениями, либо кистозная с солидными включениями; тяжистая, другая);
- наличие дистальных или боковых теней, ослабления или усиления эхо- сигнала за образованием;
- наличие инфильтрации, ее локализация направление, множественность, характер (диффузная - инфильтрация всей стромы МЖ; очаговая - окружающая образование);
- состояние внутриорганной лимфатической системы МЖ (лимфатические щели расширены, не расширены, изменены диффузно в каком-либо квадранте)"
- состояние протоков (их диаметр в области ареолы наличие инфильтрации по ходу протоков)
- соотношение опухоли с кожей, подкожной клетчаткой, с фасциями мышцами, костными структурами и вовлечение их в опухолевый процесс утолщение кожи (изменение ее структуры).
Далее изучают сосудистый рисунок в опухоли и вокруг нее в контрлатеральной МЖ. Производят оценку сосудистого рисунка собственно в узле и вокруг него сравнивают в симметричных участках обеих желез и разных квадрантах одной МЖ.
При изучении сосудистого рисунка непосредственно узла выделены следующие варианты ультразвуковой картины.
1. В узле и вокруг него сосуды не определяются
2. Выявляются сосуды вокруг узла.
3. Выявляются сосуды в узле
4. Наличие сосудов вокруг узла и внутри него.
При осмотре участка ткани при ЦДС оценивают следующие параметры: сосудистый рисунок (прямолинейность хода извитость сосуда, его диаметр), состояние просвета сосуда, проходимость сосуда, состояние периваскулярных структур.
При ЦДС локацию кровотока проводят в нескольких участках изучаемой структуры. Исследование обычно начинают с оценки величины и направления кровотока
Проведение количественного анализа спектра допплеровского сдвига частот (допплерограмма) позволяет рассчитать две основные группы показателей: абсолютные и относительные. К абсолютным параметрам относят максимальную (пульсовую) скорость в систолу (МСС), минимальную диастолическую скорость (МДС) Относительными являлись два индекса: индекс резистентности (ИР), индекс пульсации (ИП) В узле показатели кровотока измеряют не менее чем в 3-5 сосудах. Изучают форму допплерограммы (подробно глава 3)
В протоколе учитывают три формы заключения доброкачественное образование злокачественное образование, неоднозначное заключение (когда по ультразвуковой картине невозможно дать определенное заключение и нужно провести дифференциальный диагноз между доброкачественным и злокачественным образованием, в этом случае в заключении указывают диагностический ряд возможных заболеваний).
ЦДС позволяет в реальном времени визуализировать в норме кожу как структуру повышенной эхогенности, подкожную и премаммарную жировую.

Рис. 169. Инволютивные изменения молочной железы у пациентки 50 лет. Связки Купера (1), позади которых видна акустическая тень (2).
ткань; железистые дольки; грудную фасцию; связки Купера, как гиперэхогенные структуры, позади которых может определяться акустическая тень (рис. 169). При этом протоки видны как линейные структуры с гипо- или анэхогенным внутренним эхосигналом. Стенка протока видна как линейная гиперэхогенная структура, а просвет в норме не достигает 2 мм. Жировая клетчатка локализована в большей степени подкожно и по периферии органа. Изображение железистой ткани выглядит равномерно гетерогенным с округлыми гипоэхогенными структурами и гиперэхогенной стромой.

Рис. 170 а, б, в, Фиброзно-кистозная мастопатия.
а. Изменения структуры железы: локальное расширение протоков (1) на фоне участка фиброза (2).
б. Микрокальцинаты показаны стрелками.
в. Расширенные и извитые протоки (1).
Сосуды имеют вид линейных (в продольной плоскости) и овальных или округлых (при поперечном сканировании) анэхогенных образований. Диаметр артерий в МЖ не превышает 2 мм. По нашим данным при исследовании показателей кровотока в триплексном режиме мы считаем, что в железистой ткани МСС в норме составляет 13 см/с, МДС - 6 см/с, ИП - 1,20 и ИР - 0,59 [24, 31].
Нарушение сложных гормональных взаимоотношений изменяет течение циклических процессов в организме, что ведет к возникновению заболеваний, морфологическим субстратом которых является пролиферация эпителия альвеол и протоков, именуемых мастопатией. Мастопатией обозначают группу дисгормональных доброкачественных заболеваний МЖ, характеризующихся гиперплазией ее ткани. По гистологической классификации ВОЗ (1984) мастопатию (дисплазию) определяют как фиброзно-кистозную болезнь, характеризуемую широким спектром пролиферативных и регрессивных изменений тканей МЖ с ненормальным соотношением эпителиального и соединительно-тканного компонентов [2, 30, 31].
В целом, при фиброзно-кистозной мастопатии (ФКМ) эхоструктура МЖ (или ее участка) гетерогенная (рис.170 а, б, в). Фиброзная ткань представлена гиперэхогенными гетерогенными структурами, создающими неравномерную тяжистость, в 17% при УЗИ видны микрокальцинаты [24] (рис. 170 б). Преимущественная локализация фиброзных изменений (у 66% больных) - наружные отделы молочной железы.
У части больных ФКМ при УЗИ отмечены локальное, иногда кистозное, расширение протоков, ветвистость и извитость их (рис. 170 в).
Для строения МЖ женщин среднего возраста характерно увеличение в строме жировой клетчатки не только по периферии, но и между железистыми структурами. Соединительная ткань, окружающая жировую дольку, с возрастом утолщается и уплотняется после пункции.

Рис. 171. Сосуды в участке мастопатии.


Рис. 172 а, б. Папиллярная киста (++) (а) до и (б)
Толщина сосочкового эпителия достигает 7 мм (1).
При проведении ЦДС в участке мастопатии отсутствуют признаки усиления или ослабления сосудистого рисунка, не выявляются участки локальной дилатации сосуда (рис. 171). При допплерографии сосудов в участке мастопатии МСС составляет в среднем 19 ± 1 см/с, МДС - 7 ± 4 см/с; ИП - 1,2 ± 0,38 и ИР - 0,65 ± 0,1 [24].
Повышение МСС и концентрация сосудов в зоне узловой мастопатии служит признаком усиления пролиферативных процессов. Н.И. Рожкова с соавт. [32] считает, что при фиброзе чаще (72 % наблюдений) встречается пилообразная форма кривой.
Кисты при УЗИ имеют характерную ультразвуковую картину: чаще овальную или округлую форму, гомогенную анэхогенную (реже гипоэхогенную) структуру с выраженным дистальным усилением и боковыми тенями, хорошо определяемую гиперэхогенную капсулу (рис. 172 а). Полость кист может быть однокамерной или делиться перегородками на несколько камер. Многокамерные кисты бывают неправильной формы. При дозированной компрессии форма кисты меняется - уплощается.
Изнутри кисты могут быть выстланы уплощенным кубическим эпителием (простые кисты), эпителием с сосочковыми разрастаниями (папиллярные кисты) или эпителием с комплексами атипических клеток (кисты с атипией эпителиальной выстилки) (рис. 172 б, в). При УЗИ хорошо видны папиллярные разрастания на стенках кисты.
После пункции и неполного удаления содержимого форма кисты становится овальной или щелевидной, при этом остается дистальное усиление и анэхогенное гомогенное либо гетерогенное содержимое (за счет кровоизлияния или пузырьков газа) (рис. 172, 173 а, б). Васкуляризация собственно кисты может быть выявлена при выраженном утолщении стенки кисты и в сосочковом эпителии. Но, в отличие от рака МЖ, сосуды видны только в сосочковом эпителии, при четкой визуализации капсулы образования.

Рис. 173 а, б, Кисты после пункции, а. Пузырек газа после пункции (показан стрелкой), б. Кровоизлияние в кисту (содержимое представлено сгустками крови).
Сосудистый рисунок вокруг кист МЖ характеризуется наличием сосудов по краю образования, чаще прилежащих локально, реже видны огибающие сосуды, которые расположены над кистой. Сосуды подходят к кисте под острым углом. Показатели кровотока в сосудах вокруг кист соответствуют данным, получаемым в участке узловой мастопатии. Извитые и ветвистые сосуды отсутствуют.
При мастите в В-режиме на фоне отека выявляют гипоэхогенную структуру с нечеткими (размытыми) контурами и неправильной (иногда звездчатой) формой (рис. 174 а, б, в). Ориентация очагов чаще вертикальная (рис. 174 а, б), отмечают утолщение кожи до 0,5 - 0,9 см [11]. Вокруг очага воспаления выявляют некоторое усиление сосудистого рисунка при ЦДС, артериовенозные шунты не видны. Выявляют радиальную направленность сосудов, в участке собственно некроза кровоток не определяют. Дилатации артерий на отдельных отрезках сосуда не наблюдают. По нашим данным, показатели кровотока вокруг очага гнойного воспаления составляют: МСС - от 8 до 35 см/с (в среднем 20 ± 7 см/с): МДС - от 3 до 12 см/с (в среднем 7 ± 3 см/с), ИР - от 0,4 до 0,81 (в среднем 0,67 ± 0,09), ИП - от 0,48 до 1,51 (в среднем 1,26 ± 0,4) [24].
При осмотре больных в процессе лечения отмечено изменение васкуляризации и параметров при триплексном сканировании. Расширенные сосуды не определяются. Сосудистый рисунок возвращается к нормальной картине.
Выявление усиленного сосудистого рисунка в молочной железе при мастите может привести к ложноположительной диагностике рака.

Рис. 174 а, б, в. Мастит. Очаги некроза (1) и утолщение кожи (2).
Фиброаденома имеет достаточно характерную ультразвуковую картину. Эта опухоль чаще представлена образованием с четкими ровными либо волнистыми контурами, гомогенной мелкозернистой изоэхогенной или гипоэхогенной структурой, имеющей усиление эхосигнала за образованием и узкие симметричные боковые тени. Форма её чаще овальная или округлая, могут встречаться участки обызвествления или анэхогенные зоны (рис. 175 а, б, в). Нередко выявляют фиброаденомы, состоящие из нескольких сливающихся структур (долей) круглой или овоидной формы с горизонтальной ориентацией (рис. 175 а). В 62-70 % случаев выявляют наличие двух латеральных акустических теней [16, 33].
Сосудистый рисунок вокруг фиброаденомы практически не изменен и соответствует аналогичному участку контралатеральной железы. Хотя мы согласны с M M. McNicholas et al [34] что при крупных доброкачественных узлах отмечено усиление сосудистого рисунка вокруг узла (особенно по передней поверхности крупного узла, что больше связано с оттеснением сосудов). Сосуды в самой фиброаденоме чаще отсутствуют. Особенно это характерно для мелких узлов размером до 1,5 см. При локации артерий в режиме ЦДК вокруг фиброаденомы они имеют линейную направленность, локальное увеличение просвета сосуда не выявляется (ни вокруг опухоли, ни внутри нее). По нашим данным, показатели кровотока в фиброаденоме составили в среднем: МСС - 20 см/с ± 16 (от 8 до 55 см/с), МДС - 6 см/с ± 4 (от 2 до 18 см/с), ИР - 0,63 ± 0,05 (от 0,46 до 0,91), ИП - 1,21 ± 0,38 (от 0,8 до 1,62) [24].
Предложенные методы подсчета цветовых пикселей трудоемки и ненадежны в практической работе, т. к. они основаны на субъективности исследователя, а также во многом зависят от качества используемой аппаратуры, поэтому мы не считаем целесообразным использовать эту методику для дифференциальной диагностики в определении злокачественности опухоли. Существует зависимость между наличием сосудов в узле, их количеством и размером узла [35].
Диагноз цистосаркомы филлоидной, встречается в 0,3-1 % всех новообразований в МЖ, и чувствительность УЗИ в выявлении листовидной опухоли составляет 75 % [29, 36].

Рис.175 а, б, в. Фиброаденома молочной железы
а. FA- фиброаденома дольчатого строения, М - мышца, С - ребро
б. Фиброаденома (++), дистальное усиление и боковые тени отсутствуют.
в. Фиброаденома с дистальным усилением и гетерогенной структурой. 1 - жидкостной участок
Ультразвуковая картина листовидной опухоли близка к картине фиброаденомы молочной железы. Однако для листовидной опухоли более характерно наличие четкого ровного контура, боковых симметричных теней, гомогенной гипоэхогенной внутренней структуры. Гетерогенную внутреннюю структуру опухоли выявляют при наличии очагов некроза, чаще в крупных узлах (рис. 176 а, б). Патогномоничные ультразвуковые критерии цистосаркомы филлоидной не описаны, тем не менее, Г.П. Корженкова [37] считает, что листовидная опухоль чаще представлена гипоэхогенным образованием со щелевидными и кистевидными полостями, позади филлоидной фиброаденомы чаще выявляют дорсальное усиление эхосигнала
При ЦДС сосуды вокруг узла доброкачественной опухоли имеют неизменный диаметр и входят в узел опухоли под острым углом.
По нашим данным, в филлоидной опухоли значения МСС колеблются от 5 до 42 см/с (в среднем составляя 21 см/с), МДС - от 2 до 18 см/с. (в среднем - 6 см/с), ИП - от 0,54 до 1,55 (в среднем - 1,25), а ИР - от 0,44 до 0,85 (в среднем - 0 66). При саркоме отмечено увеличение показателей скорости кровотока, при небольшом снижении значений индексов [24, 33]
Ультразвуковая картина рака МЖ вариабельна, что не позволяет привести усредненный портрет опухоли и ведет к появлению диагностических ошибок Контур узла может быть как четким, так и нечетким, часто - неровным (рис. 177 178). Форма узлов чаще неправильная, структура обычно солидная, гетерогенная (иногда гомогенная) с дорсальным ослаблением (редко - усилением) эхосигнала, несимметричными боковыми тенями. Эхогенность злокачественной опухоли в подавляющем большинстве низкая или смешанная, реже-изоэхогенная. Иногда выявляют мелкие гиперэхогенные включения участки фиброза, калыдинаты (рис. 177 в). Однако наблюдают узлы с четким контуром (рис 177 б, г) и дистальным усилением эхосигнала (рис 177 б)
В узлах опухоли с выраженным соединительнотканным компонентом наблюдают ослабление дистального эхосигнала, дистальную акустическую тень (рис.177 б) Преобладание соединительнотканного компонента (более 75%) приводит к затуханию ультразвуковых волн [38] Встречаются первично-множественные опухоли, поэтому при выявлении патологии проводят внимательное исследование обеих МЖ (рис. 177 г)

Рис. 176 а, б Листовидная фиброаденома
а. - два узла (++),
б. - гигантская опухоль (++) занимающая всю железу, с участками некроза

Рис.177 а, б, в, г, д, е. Рак МЖ (узел показан стрелкой).
а - звездчатый узел размером 12 мм с дистальной акустической тенью; б - солидно-альвеоляный рак МЖ, узел с четким ровным контуром и дистальным усилением эхосигнала; в - узел гетерогенной структуры с гиперэхогенными включениями - микро-кальцинатами; г - первично-множественная форма рака МЖ. Узлы 0,4 и 0,6 см; д - гетерогенный солидно-кистозный узел; е - усиление сосудистого рисунка в солидной части опухоли.
Известно, что в злокачественном новообразовании формируется собственная сосудистая сеть. Корреляции между уровнем (плотностью) ангиогенеза и интенсивностью эхосигнала при ЦДС выявлено не было [8, 39, 40]. С. Peters Engl et al. [39] доказали, что триплексное сканирование позволяет оценить только макро- васкуляризацию (артериолы) в опухоли. Многие авторы считают [7, 8, 41, 42, 43], что изменения в кровоснабжении опухоли зависят от ее злокачественного роста и биологического поведения, хотя в отдельных случаях наблюдают отсутствие сосудистого рисунка в узле. Имеется корреляция между васкуляризацией опухоли и ее размером.
Гистологические исследования, проведенные W.J. Lee et al. [8, 43], показали, что выявление допплеровского сигнала коррелирует с неправильной (нерегулярной) неоваскуляризацией, пенетрирующей узел с периферии, состоящей из тонкостенных сосудов и большого количества артериовенозных шунтов (рис. 177 д, е; 178 а, б, в).

Вокруг узла злокачественной опухоли, по сравнению с контралатеральной стороной, выявляется зона гиперваскуляризации у 98% больных раком МЖ, иногда расширены вены, чаще по передней поверхности узла. Для рака МЖ патогномонично выявление сосудов, направляющихся радиально к узловому образованию, причем эти сосуды подходят к опухоли под углом, близким к прямому (рис. 177 б).
В 87-94% злокачественных узлов отчетливо прослеживают атипичный сосудистый рисунок, который характеризуется неравномерностью диаметра, чередование узких и широких участков сосуда, хаотичным расположением, большим количеством анастомозов и артерио-венозных шунтов (рис. 176 е; 177 а, в).
Использование ультразвуковой ангиографии с применением контрастных веществ позволяет значительно улучшить визуализацию сосудистого рисунка изучаемой области.
Диагностическая ценность ЦДС в выявлении рака МЖ, по данным литературы, составляет от 78 до 100% при чувствительности от 71 до 100% и зависит от чувствительности прибора, значений выбранных показателей, размера и формы опухоли [13, 24, 25, 27, 38].
Было выявлено, что во вновь образованных сосудах злокачественной опухоли отмечают высокие значения МСС, в среднем равные либо превышающие 0,27 м/с, при чувствительности данного показателя для рака молочной железы - 82%, а специфичности - 81%. W. Teh, A.R.M. Wilson [10] считают типичной для злокачественного новообразования колебания МСС от 5 до 34 см/с, ИП - более 1,5 и ИР - более 0,7. A. Hollerweger et al. [44] доказали, что ИР более или равный 0,80 является показателем злокачественности с высокой специфичностью (96%) и низкой чувствительностью (55%), а различие значений ИР более или равное 0,20 среди сосудов одной опухоли является показателем злокачественности с очень высокой специфичностью (97%), но низкой чувствительностью (39%). При высоком ИП (более 1.5) чувствительность в выявлении рака молочной железы составляет 95%.
Отмечено, что чем больше размер опухоли, тем выше выявляемые в нем скорости кровотока, так в узле размером до 2 см МСС, по нашим данным, составляет в среднем 24 см/с, а в опухоли более 5 см - 40 см/с [24].
Оценка ИР и ИП позволяет предположить степень злокачественности опухоли. У больных с опухолью II и III степени злокачественности, значения ИР колеблются в пределах 0,76 ± 0,13 и 0,84 ±0,15 соответственно, а ИП - 1,65 ± 0,26 и 1,98 ± 0,21. Наиболее отчетливо этот признак проявляется в небольших (до 2 см) опухолях. Таким образом, при выявлении высоких значений ИП и ИР можно предположить, что опухоль будет иметь большую степень злокачественности.
Использование ЦДС позволяет уточнить число узлов при многофокусном поражении, а выявление локального хорошо васкуляризированного участка позволяет заподозрить наличие мелкого изоэхогенного узла (рис. 176 г, 177 в). Изменение диаметра сосуда вокруг узла, неравномерность диаметра сосуда, утолщение стенки сосуда и появление вокруг него гипоэхогенных структур позволяет предполагать наличие инфильтрации по ходу сосудов. Чувствительность триплексного сканирования в выявлении распространения опухолевого процесса по ходу сосудов невысока и составляет 55,6% (при этом ложноположительных заключений мы не отмечали). Трудности в оценке распространенности опухолевого процесса по ходу кровеносных сосудов связаны с тем, что периваскулярные изменения должны быть выявлены на сколько-нибудь значимом протяжении. В случае небольшой протяженности поражения при ЦДС их не обнаруживают. Изменения параметров кровотока в опухоли в зависимости от морфологической структуры узла показали, что при протоковом раке выявляют большие, чем при дольковом раке, значения МСС (28 и 25 см/с) и ИП (1,76 и 1,5 соответственно), что, по-видимому, надо объяснять соотношением соединительно-тканного компонента [24] .
Заболеваемость отечно-инфильтративным раком МЖ за последние годы возросла в 2 раза, и в настоящее время в структуре всех форм рака МЖ на нее приходится 15,9% [11]. При раке МЖ отечно- инфильтративной формы на фоне выраженной диффузной инфильтрации иногда сложно выявить опухолевые узлы и выбрать измененный участок для пункции (рис. 179 а, б). Чувствительность тонкоигольной аспирационной биопсии под контролем УЗИ этой формы рака, по мнению А.В. Дорофеева [11], не превышает 80, 8%, а эксцизионная биопсия МЖ оказывается невыполнима, так как границы здоровых тканей неопределимы, а разрез, проведенный по опухоли, угрожает бурным ростом и диссеминацией [11].
Отечно-инфильтративная форма рака МЖ часто представлена отеком железы, на фоне которого узлы часто невозможно пальпировать, а иногда они не видны и при УЗИ. Кожа железы диффузно утолщена (рис. 178 б). На фоне отека и ультразвуковой картины, напоминающей воспаление, выявляют опухолевые образования (гипоэхогенные, чаще гетерогенные очаги без четких контуров, иногда выполняющие практически всю строму органа), при этом очаги некроза отсутствуют (рис. 178 а). По данным А.В. Дорофеева [11], единичные опухолевые образования выявляют у 24% больных с инфильтративно-отечным раком молочной железы, множественные - у 10% женщин, и в 3% случаев наблюдают поражение обеих МЖ. При проведении дифференциального диагноза с маститом следует учитывать значения показателей кровотока (при раке МСС, ИП и ИР выше). При отечной форме РМЖ ИП ниже, чем в узле без явлений отека, но выше, чем при мастите.
Сосудистый рисунок при отечной форме рака МЖ усилен. При исследовании в В-режиме можно ошибочно расценить усиление сосудистого рисунка как расширение лимфатических щелей.
Показатели ЛСК и ИР в сосудах узла при отечной форме рака МЖ в сравнении с данными, полученными в узле рака без признаков воспаления или отека, близки, а ИП снижен (табл. 39).

Рис. 179 а, б. Рак МЖ. а - три рядом расположенных узла на фоне отека железы, б - изменения представлены утолщением кожи (показано стрелками) на фоне выраженного отека.
Таблица 39. Изменение показателей ЛСК в узле при раке МЖ и вокруг очага продуктивного воспаления при мастите.
|
Заболевание МЖ |
Показатели ЛСК | |||
|
|
МСС (см/с) |
МДС (см/с) |
ИП |
ИР |
|
Рак |
27 ± 15 |
7 ± 5 |
1,71 ± 0,9 |
0,76 ± 0,13 |
|
Инфильтративно-отечная |
28 ± 14 |
8 ± 5 |
1,54 ± 0,9 |
0,72 ± 0,12 |
|
форма рака |
|
|
|
|
|
Воспаления вокруг очага |
20 ± 7 |
7 ± 3 |
1,26 ± 0,4 |
0,67 ± 0,09 |
|
при мастите |
|
|
|
|
Ультразвуковая картина рецидива рака аналогична картине опухолевого образования Сосудистый рисунок и показатели кровотока аналогичны таковому для рака МЖ.
Известно, что оценка размера выявленного при УЗИ узла является наиболее точной, и определяемые данные наиболее близки получаемым при морфологическом исследовании препарата. Тем не менее при УЗИ возможна недооценка в определении границ опухоли. Коэффициент корреляции размера узла при раке МЖ, по нашим данным, составляет 0,84, а для фиброаденомы и цистосаркомы филлоидной приближается к 0,98-0,99 [24].
Большое значение имеет оценка сосудистого рисунка в процессе лечения, причем как при доброкачественных процессах, так и для рака МЖ. При мастопатии отмечено снижение МСС и индексов, коррелирующее с положительной клинической картиной. При лечении мастита отмечено возвращение ИР и ИП к норме после окончания воспалительного процесса.
Клинический эффект после проведения консервативной терапии у больных раком молочной железы оценивают по изменению размера опухоли, определяемого при клиническом и инструментальном исследовании и по степени патоморфоза при гистологическом исследовании препаратов. Критериями оценки эффективности лечения опухолей консервативными методами являются: 1) полный объективный эффект (полное исчезновение опухоли), 2) частичный объективный эффект (уменьшение размера опухоли более чем на 50%), 3) отсутствие эффекта (резорбция менее чем на 50%).
При положительном эффекте на проведение консервативной терапии отмечают: уменьшение или стабилизацию размера опухоли, изменение ультразвуковой картины опухоли и дистальных структур, обеднение сосудистого рисунка вокруг опухоли и в ней, уменьшение значений МСС, ИП. У части пациентов при ЦДС видно, что размер узла не уменьшается, при изменении его структуры и дистальных сигналов, что может быть связано с процессами фиброзирования опухоли (это подтверждается и при морфологическом исследовании). При положительном ответе на химиотерапию у половины больных выявляемые изменения кровотока происходят ранее получения клинического ответа. Появление гипоэхогенных участков и локальное усиление сосудистого рисунка дает повод заподозрить рецидив заболевания.
Ультразвуковая картина изменения МЖ после лучевой терапии зависит от срока проведения исследования. Ранние изменения после лучевой терапии (ЛT) характеризуются во всех случаях отеком тканей и утолщением кожи (иногда до 12-14 мм). Сосудистый рисунок обеднен по сравнению с контралатеральной МЖ. Затем отек ткани и толщина кожи постепенно уменьшаются. Сосудистый рисунок обеднен по сравнению с контрлатеральной МЖ непосредственно после ЛT и остается таковым и через 12-18 месяцев. При длительном наблюдении за больными после лучевой терапии отмечают изменения структуры тканей, проявляющиеся усилением эхогенности, уменьшением размера МЖ в сравнении с контрлатеральной стороной и снижением контрастности внутреннего рисунка тканей железы. Акустические эффекты позади опухоли могут кардинально менять свою интенсивность: дорсальная тень переходит в дорсальное усиление и обратно - акустическое усиление переходит в тень [33]. После каждого курса полихимиотерапии у 2/3 больных выявляют постепенное уменьшение интенсивности дорсального усиления эхосигнала, иногда - исчезновение его. Для сосудистого рисунка после проведения консервативной терапии характерно: уменьшение количества сосудов (сосуды не выявляют или видны наиболее крупные ветви); снижение максимальной скорости; снижение ИП по сравнению с исходными данными.
Исследование кровотока у больных раком МЖ показало, что в процессе лечения меняется не только собственно картина узла, но и показатели кровотока в артериях опухоли (табл. 40).
Таблица 40. Показатели ЛСК в опухоли в процессе консервативной терапии.
|
Результат лечения |
Показатели ЛСК | |||
|
МСС (см/с) |
МДС (см/с) |
ИР |
ИП | |
|
До лечения |
27 ± 15 |
7 ± 5 |
0,76 ± 0,13 |
1,71 ± 0,9 |
|
Патоморфоз II степени |
25 ± 11 |
6 ± 4 |
0,73 ± 0,08 |
1,44 ± 0,72 |
|
Патоморфоз III степени |
20 ± 1 |
5 ± 4 |
0,70 ± 0,1 |
1,35 ± 0,64 |
Таким образом, наблюдается стойкая тенденция к снижению МСС, ИП и ИР в процессе лечения при его положительном эффекте. Использование УЗИ в динамическом наблюдении за больными раком МЖ в процессе лечения позволяет объективно оценить эффективность лечения. У больных инфильтративно-отечной формой рака МЖ характер клинического эффекта непосредственно влияет на пятилетнюю выживаемость и выбор дальнейшей лечебной тактики (возможность операции). Так, при полной регрессии опухоли пятилетняя выживаемость составляет 42%, при частичном клиническом эффекте - 32%, при стабилизации - 17,6%. При полном и частичном эффекте выживаемость растет параллельно увеличению степени лекарственного патоморфоза. Как положительный результат можно оценивать не только уменьшение отека и размера узла, но и стабилизацию, сопровождающуюся лекарственным патоморфозом II-III ст. [11]. Клинически исчезновение отека оценивают как положительный эффект лечения, но уменьшение отека может присутствовать как в случае положительного эффекта, так и при отсутствии патоморфоза II-IV степени. ЦДС позволяет реально оценить эффективность подобранной терапии.
В процессе лечения отечной формы рака МЖ при динамическом УЗИ отмечают уменьшение отека, исчезновение лимфатических щелей, уменьшение диаметра сосудов в ткани железы вокруг узла и обеднение сосудистого рисунка (во всех случаях). Но эти изменения также не коррелируют с морфологическим выявлением патоморфоза. При сохранении размера узла, выявляемого при ЦДС, отсутствие его васкуляризации свидетельствует о положительном эффекте проводимой терапии в сочетании с явлениями фиброза (структура узла становится гиперэхогенной). В оценке эффективности проводимой терапии большее значение имеет изменение показателей ЦДС и особенно уменьшение толщины кожи (при первично-отечной форме рака).
Использование допплеровской оценки кровотока показано в дифференциальной диагностике опухолей МЖ в сложных случаях. Триплексное сканирование позволяет проводить дифференциальную диагностику между доброкачественными и злокачественными опухолями и повышает чувствительность в диагностике фиброаденом. По нашим данным, чувствительность и точность УЗИ (серошкальная методика и триплексное сканирование) в выявлении рака МЖ достигает 97,8%. Использование режима триплексного сканирования позволяет провести дифференциальный диагноз при выявлении мелких (до 1,5 см) узлов, при исследовании гетерогенных доброкачественных узлов (с очагами некроза и кровоизлияния после пункции), при наличии папиллярных кист и т. п.
В случае неоднозначной ультразвуковой картины выполнение диагностической пункции тонкой иглой (иглы 19-25 д) позволяет с точностью 98-99% поставить правильный диагноз, а выполнение пункции толстой иглой (иглы 12-18 д) под контролем УЗИ позволяет получить гистологический препарат и уточнить морфологическую структуру опухоли.
Таким образом, применение метода цветовой допплеровской сонографии молочной железы и оценка сосудистого рисунка и показателей ЛСК в ней при выявлении патологии МЖ позволяет повысить чувствительность метода как в диагностике рака МЖ, так и особенно в оценке эффективности его лечения.
ГЛАВА 13
ЦВЕТОВОЕ ДОППЛЕРОВСКОЕ СКАНИРОВАНИЕ И ТРЁХМЕРНАЯ РЕКОНСТРУКЦИЯ АБДОМИНАЛЬНЫХ СОСУДОВ
1. Заболевания брюшной аорты
Среди причин окклюзирующих заболеваний брюшной аорты (БА) атеросклеротическое поражение занимает одно из ведущих мест. По результатам цветового допплеровского сканирования можно выделить следующие степени поражения аорты: ранние атеросклеротические изменения, стеноз; окклюзия.
Ранние атеросклеротические изменения аорты ограничены локализацией процесса только в стенке аорты. При исследовании в В-режиме может отмечаться неравномерное утолщение стенок аорты, наличие гиперэхогенных включений, соответствующих отложению кальция в виде отдельных глыбок неровный внутренний контур аорты при интактном просвете сосуда и магистральном типе кровотока по данным допплеровской спектрограммы.
Диагностика стеноза аорты основывается на визуализации в В-режиме эхогенных масс, уменьшающих просвет аорты. Эхогенные массы могут быть обусловлены наличием либо локальных, реже пролонгированных атеросклеротических бляшек и/или наличием пристеночного тромбоза Атеросклеротическое поражение чаще локализуется в инфраренальном отделе, в области бифуркации БА и в значительном числе наблюдений - по задней стенке. Для атеросклеротического процесса данной локализации характерно наличие в гомогенных и гетерогенных бляшках эхо-сигналов высокой интенсивности, в отдельных случаях сопровождаемых наличием акустической тени, морфологически соответствующей кальцинозу Пристеночные тромботические массы представлены гипоэхогенными, преимущественно однородными по структуре образованиями, которые, как правило, расположены вдоль стенки аорты, и имеют эхогенность несколько выше, чем просвета сосуда. Четко определить протяженность и форму бляшки, а также пристеночных тромботических масс можно при работе в режиме ЦДК и/или ЭДК. Степень поражения аорты диагностируют по результатам регистрации УЗ изображения с расчетом процента стеноза с использованием компьютерной программы и дополняется данными спектрального анализа кровотока Согласно данным Tb Karasch et al [1], локальное увеличение систолической линейной скорости кровотока (ЛСК) более 200 см/с свидетельствует о наличии гемодинамически значимого стеноза аорты. Стенотическое поражение аорты в ряде наблюдений может сочетаться с девиацией ее, особенно у больных с артериальной гипертензией.
По локализации выделяют три типа окклюзий брюшной аорты: 1. низкая окклюзия - окклюзия бифуркации БА дистальнее отхождения нижней брыжеечной артерии; 2) средняя окклюзия - проксимальнее отхождения нижней брыжеечной артерии; 3) высокая окклюзия - на уровне почечных артерий или в пределах 2 см дистальнее [2].
УЗ-диагностика окклюзии брюшной аорты основывается на следующих критериях:
- Наличие эхогенных масс, обтурирующих просвет аорты и отсутствие кровотока в просвете по данным ЦДК и/или ЭДК и спектра допплеровского сдвига частот.
- Снижение систолической и диастолической скорости кровотока в аорте проксимальнее окклюзии.
- Регистрация коллатерального типа кровотока в артериях дистальнее окклюзии.
Компенсация кровотока при окклюзии БА реализуется коллатеральным кровообращением по различным анатомическим путям, ход которых, по данным цветового допплеровского сканирования (ЦДС), проследить не всегда представляется возможным. Однако в данной ситуации ЦДС позволяет нам получить информацию об отдельных составляющих системы коллатерального кровообращения, в частности нижней брыжеечной артерии, поясничных артериях и верхней брыжеечной артерии.
В зависимости от условий обследования, визуализация нижней брыжеечной артерии (НБА) возможна в 56-80% наблюдений [3, 4]. Визуализацию НБА в начальном сегменте осуществляют при исследовании в сагиттальной или поперечной плоскостях сканирования на 50-60 мм проксимальнее бифуркации аорты на уровне III-IV поясничных позвонков. В норме диаметр НБА составляет 2-3 мм. Качественная характеристика спектра кровотока свидетельствует о высоком периферическом сопротивлении в артерии, участвующей в кровоснабжении левой части поперечной и нисходящей ободочной кишки, сигмовидной и проксимального участка прямой кишки. Высокое периферическое сопротивление в НБА является одним из УЗ критериев дифференциальной диагностики НБА и почечных артерий, для которых характерно низкое периферическое сопротивление.
Поясничные артерии - парные сосуды, располагающиеся в инфраренальном отделе аорты. Качественная оценка спектра свидетельствует о наличии высокого периферического сопротивления. При выполнении функции коллатеральных сосудов в поясничных артериях увеличивается уровень кровообращения, что улучшает возможность УЗ изображения этих артерий.
При окклюзирующих поражениях БА нижняя, верхняя брыжеечные артерии, поясничные артерии несут компенсаторную нагрузку, в результате чего происходит повышение скорости кровотока с постепенным увеличением их диаметра. Особенностью компенсаторного кровотока является регистрация увеличения линейной скорости кровотока на всем протяжении сосуда, доступном УЗ-визуализации, в то время как при гемодинамически значимом стенозе нижней или верхней брыжеечной артерий выявляются локальные изменения гемодинамики на участке сужения артерии.
Другой причиной окклюзирующих заболеваний брюшной аорты является неспецифическии аортоартериит Согласно данным А.В, Покровского и соавт [5] в зависимости от локализации стеноза аорты выделяют три варианта поражения торокоабдоминального сегмента аорты. При I варианте поражения в процесс вовлекается только нисходящая грудная аорта Этот тип встречается в 4.5% наблюдений Для II варианта поражения характерна локализация процесса в супра-, интер- и инфраренальном сегментах аорты с практически обязательным одновременным вовлечением висцеральных и почечных артерий в различных комбинациях. Этот наиболее типичный и часто встречающийся тип поражения аорты авторы отмечали в 68 5% наблюдений. При III типе — 2.7% наблюдений - в процесс одновременно вовлечена нисходящая грудная аорта, ее супра-, интер-. и инфраренальный сегменты, а также висцеральные и почечные артерии.
При выполнении цветовое допплеровского сканирования у данного контингента больных целесообразно придерживаться следующих методических моментов
1. Для оптимизации изображения аорты и детального исследования зоны интереса а в данной ситуации это стенка аорты, необходимо использовать функцию УЗ аппарата, позволяющую получить изображение исследуемой области в увеличенном размере Кроме этого для повышения качества УЗ изображения аорты в В-режиме целесообразно использовать режим тканевой гармоники.
2 Процент стеноза аорты по данным УЗ изображения следует измерять на основании расчета площади поперечного сечения
Увеличение толщины задней и/или передней стенок аорты свидетельствует о наличии неспецифического аортоартериита. Однако количественная оценка толщины стенки не является постоянной величиной и может изменяться в зависимости от активности воспалительного процесса УЗ исследование позволяет диагностировать протяженность изменений в аорте, которые характеризуются пролонгированным поражением постепенно переходящим в неизмененные участки аорты. Эхогенность стенки аорты может соответствовать норме либо быть повышенной
Для определения тактики ведения больных и решения вопроса о показаниях к хирургическому лечению важное значение имеет информация о степени сужения аорты Мы выделяем два варианта: гемодинамически незначимый стеноз, который характеризуется наличием утолщения стенки, процент сужения по данным УЗ-изображения не превышает 70%, сохраняются нормальные значения показателей ЛСК по БА гемодинамически значимый стеноз, который характеризуется утолщением стенки аорты в сочетании с повышением скорости кровотока процент стеноза по данным УЗ-изображения превышает 70%.
Кроме того, полученные данные можно дополнить информацией о роли нижней и верхней брыжеечных артерий, поясничных артерий в развитии коллатерального кровообращения
Ультразвуковые критерии диагностики постэмболических окклюзии, еще одной причины поражения брюшной аорты, аналогичны критериям, описанным ранее в разделе.
2. Аневризмы брюшной аорты
Истинная аневризма брюшной аорты характеризуется локальным выпячиванием или диффузным расширением аорты вследствие нарушения нормального строения стенки. Диагностика аневризмы основывается на исследовании аорты в сагиттальной, поперечной и коронарной плоскостях сканирования с измерением максимального ее диаметра: дистальнее диафрагмы, на уровне висцеральных артерий, на уровне бифуркации аорты. В норме диаметр аорты на этих уровнях составляет 29-26 мм, 24-22 мм и 20-18 мм соответственно. Необходимо провести анализ анатомического хода и расположения аорты с указанием смещения и изгибов. Первым ультразвуковым признаком наличия аневризмы является сегментарное увеличение поперечного сечения аорты в 2 раза и более. Увеличение поперечного сечения аорты менее чем в 2 раза свидетельствует о наличии аневризматического расширения. На экране аневризма представлена полостным образованием округлой или чаще овальной формы. В сагиттальной плоскости сканирования веретенообразная аневризма имеет форму овала, мешотчатая - характеризуется выбуханием одной из стенок аорты.
Максимальный диаметр аневризмы определяют по наружному краю адвентиции стенок аневризматического мешка в сагиттальной и поперечной плоскостях сканирования. Более точно максимальные размеры аневризмы диагностируют при исследовании в поперечной плоскости сканирования. Следует отметить, что деформация аорты с изменением ее анатомического хода, плохая разрешающая способность на границе стенки аорты - окружающая ткань являются ограничениями в правильности точного определения размеров аневризмы по данным ультразвукового исследования.
Оценку состояния просвета аневризмы осуществляют в В-режиме и режимах ЦДК и ЭДК. Чаще внутри аневризмы визуализируются тромботические массы, представленные гипоэхогенными, преимущественно однородными по структуре образованиями, эхогенность которых выше эхогенности остаточного просвета сосуда. В режиме ЦДК полость аневризматического мешка окрашивается разнонаправленными потоками красного и синего цвета. Спектр допплеровского сдвига частот характеризуется низкой систолической скоростью и изменением соотношения величины систолических и диастолических пиков.
Стенка аневризмы может содержать включения кальция. Можно выделить следующие УЗ варианты состояния стенки аневризмы: не изменена по структуре; утолщена; истончена; надрыв интимы с расслоением стенки; разрыв стенки. УЗ картина разрыва стенки аневризмы характеризуется наличием дефекта, как правило, в истонченной стенке и развитием гематомы, чаще в забрюшинном пространстве.
Важно подчеркнуть, что возможности цветового допплеровского сканирования не во всех случаях позволяют решить стоящие перед специалистом диагностические проблемы в оценке состояния стенки аневризмы, в частности, в определении надрыва интимы. Надрыв интимы может приводить либо к расслоению стенки, либо к ее разрыву. Новая методика трехмерной реконструкции аневризмы позволяет контрастнее получить изображение стенки аорты, поэтому в сложных диагностических случаях целесообразно ее применение.
У данной категории больных большое практическое значение имеет исследование почечных артерий В зависимости от расположения аневризмы относительно почечных артерий выделяют следующую локализацию аневризмы; супраренально- го, интерренального или инфраренально- го отдела аорты (рис 180). Существуют два подхода к определению взаимоотношения аневризмы с почечными артериями. 1-й - в режиме ЦДК или ЭДК в сочетании со спектром допплеровского сдвига частот визуализируют почечные артерии и измеряют расстояние от устья исследуемых артерий до аневризмы. 2-й - в случаях, когда невозможно получить информацию о локализации устья почечных артерий, измеряют расстояние от верхней брыжеечной артерии (ВБА) до проксимального края аневризмы Почечные артерии располагаются на 1-1,5 см дистальнее ВБА. Далее проводят анализ состояния стенки и просвета почечных артерий с количественной оценкой кровотока При наличии стеноза в исследуемых артериях необходимо диагностировать его степень и локализацию, при наличии аневризмы - зафиксировать ее максимальный диаметр Кроме этого, целесообразно обращать внимание на наличие или отсутствие добавочных почечных артерий.
Аневризмы дистального отдела аорты могут сочетаться с аневризматическим расширением или аневризмой подвздошных артерий. Чаще отмечается поражение общих подвздошных артерий, однако в ряде случаев диагностируются и изолированные аневризмы наружной подвздошной артерии. Исследование подвздошных артерий начинают с измерения максимального диаметра с последующим определением состояния стенки и просвета артерий При наличии аневризмы или аневризматического расширения необходимо указать максимальный диаметр, протяженность, состояние просвета и стенки аневризмы.

Рис. 180. Эхограмма супра- и интерренального отдела аорты (АО) и правой почечной артерии (ARD) Аневризма супраренального отдела в режиме ЭДК.

Рис. 181. Эхограмма расслаивающейся аневризмы аорты (АО) в В-режиме (ARD - правая почечная артерия IVC - нижняя полая вена).
Наличие дефекта в интиме и заполнение его кровью способствует постепенному расслоению стенки аорты и формированию двух просветов - истинного и ложного. Такая УЗ картина свидетельствует о наличии расслаивающейся аневризмы, которая обычно начинается в грудном отделе. В просвете аорты в В-режиме определяется мембрана, которая состоит из интимы и/или интимы и медии, двигающаяся синхронно пульсации аорты (рис. 181). При использовании режима ЦДК регистрируют двунаправленные потоки в истинном и ложном просветах аорты. В истинном просвете регистрируют антеградное направление кровотока. Артерии аорты могут отходить как от истинного, так и ложного просветов. При выявлении расслаивающейся аневризмы аорты необходимо проведение тщательного исследования грудной аорты, а затем подвздошных артерий для определения границ распространения данного осложнения.
В послеоперационном периоде УЗ-исследование дает возможность оценить состояние протеза и наличие осложнений. Исследование перипротезной области позволяет диагностировать такие осложнения, как инфильтрат, абсцесс или гематому с определением их локализации, протяженности и взаимосвязи с протезом. Цветовое допплеровское сканирование дает информацию о состоянии анастомозов, развитии стеноза дистального анастомоза, тромбоза протеза или ложной аневризмы.
3. Непарные висцеральные артерии
Как показала практическая деятельность, цветовое допплеровское сканирование имеет высокую информативность в оценке состояния верхней брыжеечной артерии, чревного ствола, печеночной (ПА) и селезеночной артерии (СА). Это создает предпосылки для расширения методических возможностей и, в частности, изучения вопроса ультразвуковой анатомии экстра- и интраорганных сосудов селезенки.
Технология исследования селезеночной артерии и вены в режиме ЦДК и/ или ЭДК в области ворот селезенки предполагает косое сканирование в области левого подреберья при положении пациента на спине, через межреберные промежутки в положении пациента на правом боку или со стороны спины. Выполняя УЗ-исследование, необходимо получить изображение селезенки по длинной оси органа, ворот селезенки и селезеночных сосудов. Селезеночные артерия и вена располагаются рядом, при этом вена лежит несколько кпереди от артерии. Не достигая ворот селезенки, ствол СА делится на две, реже - на три ветви. Это ветви селезеночной артерии первого порядка, или зональные артерии.
Теоретически ультразвуковое изображение селезенки по ее длинной оси разделяем на уровне ворот на две половины - верхнюю и нижнюю. Анатомический ход одной артерии первого порядка направлен в сторону верхней половины селезенки, второй артерии - к нижней половине. Прослеживая анатомический ход ветвей первого порядка в дистальном направлении, видно, как эти сосуды достигают паренхимы селезенки. В паренхиме органа каждая ветвь первого порядка делится на две ветви - сегментарные артерии. В свою очередь каждая сегментарная артерия делится на две ветви и т. д. Деление интраорганных ветвей селезеночной артерии носит, в основном, последовательный дихотомический характер. Из двух сегментарных артерий верхней половины селезенки латерально располагается a. polaris superior, медиально - а. terminaiis superior. Аналогично в нижней половине селезенки - a. polaris inferior и - a. terminalis inferior. A. terminalis media располагается в паренхиме на уровне ворот селезенки. Качественная оценка ангиоархитектоники паренхимы селезенки свидетельствует о том, что большая часть сосудов располагается и ветвится в непосредственной близости к воротам селезенки, к внутренней и передней поверхности селезенки, мелкие разветвления направляются к наружной поверхности селезенки.
Ориентиром для определения васкулярных зон селезенки могут служить зональные экстраорганные сосуды. Анатомическое распределение сегментарных артерий лежит в основе сегментарного деления селезенки [6, 7]. В.П. Шмелев [8] и Н.С. Короткевич [9] зоной считают участок, питаемый артериальной ветвью первого порядка. Соответственно этому могут быть 2-3 зоны селезенки, форма которых напоминает 3-4-гранную пирамиду. Сегментом считают морфологически обособленный участок ткани органа, питаемый артериальной ветвью второго порядка. Количество сегментов зависит от анатомической вариации деления ветвей первого порядка и составляет от 2 до 5. По данным А.Д. Хрусталева [7], основной ствол селезеночной артерии в 66,6% случаев делится на две главные ветви, в 15,9% - на три главные ветви, а в остальных случаях ветвей может быть больше. Согласно нашим данным, при изучении УЗ-анатомии селезеночной артерии у 15 практически здоровых лиц в возрасте от 25 до 40 лет селезеночная артерия делилась на 2 зональные артерии в 73,3% случаев, на 3-26,7% наблюдений (рис. 182). Каждая зональная ветвь в паренхеме селезенки делилась на 2 сегментарные артерии. Диаметр селезеночной артерии составлял 4,6-5,7 мм, пиковая систолическая скорость (ПСС) - 60-80 см/с, средняя скорость - 18-25 см/с. Диаметр зональных ветвей в режиме ЦДК и/или ЭДК составляет 3-4 мм, ПСС - 30-40 см/с, сегментарных - 1,5-2 мм, ПСС 20-30 см/с соответственно.
Изучение гематологических и иммунологических показателей после спленэктомии и органосохраняющих операций позволило показать преимущество сберегательной хирургии. Изучение УЗ-анатомии зональных и сегментарных ветвей селезеночной артерии имеет важное практическое значение. Знание принципов распределения внутриорганных сосудов селезенки дает возможность хирургу выбрать наиболее приемлемый и анатомически обоснованный способ сберегательной операции при поражении селезенки.
Окклюзирующие поражения висцеральных артерий имеют характерные особенности. Процесс распространяется на висцеральные артерии на протяжении 1-2 см от устья, при неспецифическом аортоартериите - в виде гипертрофированной стенки, при атеросклерозе - определяют локально расположенную бляшку, которая может переходить со стенки аорты. Нижняя брыжеечная артерия вовлекается в процесс при неспецифическом аортоартериите редко и обычно участвует в компенсации кровотока.

Рис. 182. Трехмерная реконструкция ветвей селезеночной артерии.
Независимо от причины, приводящей к сужению просвета артерии, при сте-
нозе более 60%, наблюдают локальное увеличение J1CK в сочетании с изменениями спектральных характеристик кровотока, приобретающего турбулентный характер, что подтверждается данными анализа спектра допплеровского сдвига частот и изменением окрашивания просвета сосуда в режиме ЦДК. При стенозе 70% и более в ВБА систолическая скорость составляет 275 см/с и более, диастолическая - 45 см/с и более, в чревном стволе - 200 см/с и 55 см/с и более соответственно [10].
В случае окклюзии висцеральных артерий просвет сосуда не окрашивается и ЛСК не регистрируют. При окклюзии чревного ствола может быть зарегистрирован обратный кровоток (ретроградный) в желудочно-двенадцатиперстной или общей печеночной артериях. Чувствительность метода ЦДС в диагностике стеноза 50% и более или окклюзии верхней брыжеечной артерии составляет 89-100%, специфичность - 91-96%, для чревного ствола - 87-93% и 80-100% соответственно [10]. При гемодинамически незначимом стенозе информативность спектра допплеровского сдвига частот существенно снижается. Наиболее трудна диагностика гемодинамически незначимых изменений при неспецифическом аортоартериите, в частности, трудно оценить состояние стенки. Мы внедрили в клиническую практику методику трехмерной реконструкции непарных висцеральных артерий, что расширило диапазон диагностических возможностей УЗ-диагностики.

Рис. 183. а. Эхограмма чревного ствола (ТС) при неспецифическом аортоартериите. Спектрограмма кровотока по чревному стволу
б. УЗ изображение просвета и стенки чревного ствола (ТС) по данным цветового допплеровского сканирования.
в. Трехмерное изображение просвета и стенки чревного ствола (ТС) и верхней брыжеечной артерии (AMS) при неспецифическом аортоартериите. Стеноз чревного ствола. Интактная верхняя брыжеечная артерия.
Программа трехмерной реконструкции включает исследования в В-режиме, режиме УЗ-ангиографии и сочетании В-режима и УЗ-ангиографии. По мере накопления опыта при обследовании данного контингента больных мы считаем, что более информативными являются результаты исследования в В-режиме. Благодаря прозрачности изображения стенки и просвета сосуда более четко регистрируются структурные особенности и контур стенки. Сравнение возможностей цветового допплеровского сканирования и трехмерной реконструкции показало, что трехмерная реконструкция более информативна в определении изменений эхогенности стенки. Качественный анализ трехмерного изображения позволяет дать оценку толщины стенки (рис. 183). Однако следует отметить, что используемая на сегодняшний день программа трехмерной реконструкции не позволяет проводить количественную оценку исследуемых структур, а также не позволяет получить информацию о состоянии гемодинамики. Следовательно, в диагностике изменений, характерных для неспецифического аортоартериита, эти два метода взаимно дополняют друг друга, что дает основание предложить их для комплексного применения. Показанием к проведению трехмерной реконструкции висцеральных артерий является наличие II или III вариантов поражения торакоабдоминального отдела аорты при неспецифическом аортоартериите.
Одной из причин нарушения гемодинамики в чревном стволе (ЧС) является экстравазальная компрессия, обусловленная сдавлением срединной дуговой связкой диафрагмы. Критериями гемодинамики значимой компрессии ЧС являются: углообразная деформация артерии в краниальном направлении; увеличение систолической скорости на 80,2 ± 7,5% и диастолической на 113,2 ± 6,7%; снижение уровня периферического сопротивления, подтвержденное уменьшением значений индекса пульсации (ИП) на 60,4 ± 5,5% и индекса периферического сопротивления (ИПС) на 29,1 ± 3,5%; снижение скорости кровотока и индексов периферического сопротивления в селезеночной артерии (систолическая - на 49,8 ± 8,6%, ИП - на 57,3 ± 5,4%, ИПС - на 31,3 ± 3,1% [11].
Заболевания органов брюшной полости могут приводить к нарушению гемодинамики по типу локальных или диффузных изменений в висцеральных артериях и их ветвях. Так, при экстравазальной компрессии (ЭВК) или прорастании чревного ствола, печеночной артерии увеличенными лимфатическими узлами, объемными образованиями печени, поджелудочной железы с уменьшением просвета сосуда более 60% регистрируют локальные изменения кровотока. Согласно нашим данным, при холангиолцеллюлярном раке в 33% случаев диагностирована экстравазальная компрессия печеночной артерии, что, вероятно, обусловлено инфильтрирующим характером роста опухоли. У пациентов с гепатоцеллюлярным раком ЧС и ПА были сдавлены в 21% наблюдений, ВБА в 7% случаев. Одновременное сдавление ЧС и ПА было отмечено в 14% случаев [12]. Из 55 пациентов с вторичными опухолями печени гемодинамически значимая ЭВК чревного ствола диагностирована в 1,8% случаев, собственной печеночной артерии (СПА) - в 4,6% наблюдений. Прорастание ветвей СПА отмечено в 4,6% случаев. При раке ПЖ верхняя брыжеечная артерия, ЧС и его ветви вовлекаются в процесс на поздних стадиях заболевания. Признаки ЭВК были выявлены в 39% наблюдений, тромбоз или прорастание артерий - в 9,3% случаев.
Наличие объемных образований органов брюшной полости или заболеваний воспалительного генеза способствует диффузному повышению скорости кровотока в артерии, которая непосредственно участвует в кровоснабжении
данного органа. Так, в период острой фазы гепатита регистрировали повышение систолической и диастолической скорости кровотока в ПА [13]. При обследовании 63 пациентов с язвенным колитом, болезнью Крона при обострении процесса отмечали увеличение систолической и диастолической скорости кровотока в НБА в сочетании со снижением ИПС. В период ремиссии показатели гемодинамики нормализовались [14]. Согласно нашим данным, при гепатоцеллюлярном раке, метастатическом поражении печени регистрируют статистически достоверное увеличение значений диаметра и повышение скорости кровотока в чревном стволе и печеночной артерии.
4. Портальная гипертензия
Портальная гипертензия (ПГ) развивается в результате нарушения кровотока на любом участке портального русла. Одной из основных причин развития ПГ является наличие препятствия току портальной крови в печени или в сосудах системы воротной вены, соответственно чему различают: внепеченочную форму ПГ (подпеченочная и надпеченочная), внутрипеченочную форму и смешанную. Кроме этого, исходя из градиента давления между печеночными венами и воротной веной, различают: пресинусоидальный блок, синусоидальный блок и постсинусоидальный блок.
Внепеченочная ПГ формируется при нарушении проходимости вен портальной системы кровообращения. Наиболее частыми причинами тромбоза, прорастания или экстравазальной компрессии вен являются опухоли печени, заболевания поджелудочной железы. При хроническом панкреатите воротная вена поражается лишь в 5,6% случаев, чаще отмечаются изменения в селезеночной вене. Изолированное поражение селезеночной вены вызывает левостороннюю портальную гипертензию. Большое значение в ее развитии имеют рак поджелудочной железы (18%), панкреатит (65%), псевдокисты и панкреатэктомия [17]. Среди причин внепеченочной ПГ отмечают травмы, состояние гиперкоагуляции, длительный прием оральных контрацептивов, инфекции, врожденные аномалии. По нашим данным, при злокачественных опухолях печени нарушение проходимости вен портальной системы вследствие тромбоза или экстравазальной компрессии было отмечено в 52% случаев. Подобная же картина в 6% случаев была обусловлена наличием гемангиом и в 21% наблюдений - кистами печени. У больных с опухолями поджелудочной железы аналогичные изменения были зарегистрированы в 30% наблюдений, а явившиеся результатом прогрессирования хронических панкреатитов - в 35%.
Методически УЗ-диагностика ПГ включает исследования: органов брюшной полости по стандартной методике; магистральных вен системы воротной вены (ВВ): верхней брыжеечной, селезеночной и воротной вен; магистральных вен системы нижней полой вены (НПВ): печеночных вен, НПВ; чревного ствола и его ветвей; коллатеральных сосудов.
При гемодинамически значимом препятствии в системе ВВ и интактных печеночных венах при исследовании в В-режиме размеры, эхогенность, структура и контуры печени (при условии отсутствия сопутствующих заболеваний) остаются в пределах нормы; при наличии очагового поражения печени получаем информацию о размерах, форме, локализации и характере образования. Часто отмечаются спленомегалия и асцит. При остром тромбозе ВВ асцит появляется рано и может исчезать по мере развития коллатерального
кровообращения.
Основным ультразвуковым признаком внепеченочной портальной гипертензии является выявление препятствия кровотоку в системе воротной вены с определением его характера, степени поражения и локализации. Окклюзирующий тромбоз характеризуется наличием эхогенных масс и отсутствием кровотока в просвете сосуда. УЗ-признаками пристеночного тромбоза или частичного прорастания просвета сосуда опухолью являются:
- наличие пристеночных эхогенных масс, частично заполняющих просвет сосуда;
- неполное окрашивание просвета и повышение интенсивности кодируемого потока в режиме ЦДК на участке поражения;
- регистрация турбулентного или пропульсивного характера кровотока в триплексном режиме.
- УЗ-признаками экстравазальной гемодинамически значимой компрессии сосуда являются:
- уменьшение просвета сосуда;
- повышение интенсивности кодируемого потока в режиме ЦДК на участке сужения;
- регистрация турбулентного или пропульсивного характера кровотока при сканировании в триплексном режиме.
При такой ситуации достаточно часто выявляются расширенные до 3-5 мм в диаметре притоки воротной и верней брыжеечной вен, которые в норме при УЗИ не визуализируются. В большинстве наблюдений магистральная вена проксимальнее препятствия расширена.
Наличие препятствия кровотоку в магистральных венах воротной системы способствует развитию коллатеральных сосудов. Функционирование портокавальных коллатеральных путей направлено на снижение давления в портальной системе, порто-портальных - восстановлению кровоснабжения печени обходным путем. Выявление коллатеральных сосудов при ЦДС подтверждает наличие ПГ. Ультразвуковое исследование позволяет получить информацию о наличии коллатеральных сосудов с определением их локализации и анатомического хода. Для диагностики порто-портальных коллатералей исследуется область желчного пузыря, область ствола ВВ и ее долевых ветвей, левая доля печени. Для выявления порто-кавальных коллатералей проводится исследование спленоренального региона, поддиафрагмальной области слева, области круглой связки печени, соответствующей анатомическому расположению пупочной вены, а также гастроэзофагеального региона. При исследовании малого сальника при выявлении дополнительных сосудов целесообразно использовать прием наполнения желудка жидкостью для решения вопроса о принадлежности этих сосудов к стенке желудка и/или малому сальнику. Диаметр коллатеральных сосудов составляет 2-4 мм, ЛСК 10-30 см/с [18].
Определенный интерес представляет также вопрос о влиянии гемодинамически значимого препятствия в системе ВВ на функциональное состояние венозного и артериального кровообращения и распределение кровотока в этой сложной анатомической системе. Так, С.И. Жестовская [18] при обследовании детей с тромбозом вен системы ВВ отметила увеличение средней линейной скорости кровотока компенсаторного характера в общей печеночной артерии, варикозную деформацию и увеличение диаметра селезеночной вены, усиление кровотока по печеночным венам за счет увеличения отрицательной фазы, что является механизмом обеспечения перфузии печени путем ретроградного кровотока при нарушении проходимости ВВ. Кроме того, автором диагностировано различное состояние гемодинамики в дистальных отделах ВВ. Так, при кавернозной трансформации регистрировалось повышение, а при тромбозе - снижение скорости кровотока по сравнению с показателями контрольной группы.
В контексте этой проблемы стоит изучение функционального состояния портального кровотока у пациентов, являющихся претендентами на выполнение гемигепатэктомии. Состояние портального кровообращения напрямую связано с функцией печени. Так, у пациентов после выполнения расширенной гемигепатэктомии, панкреатодуоденальной резекции сравнительный анализ скорости кровотока в ВВ и индекса периферического сопротивления в печеночной артерии с уровнем общего билирубина крови показал, что при высоких значениях билирубина регистрируется снижение кровотока в ВВ и увеличение ИПС свыше 0,75 в печеночной артерии. При нормальном диапазоне значений билирубина существенных изменений в показателях гемодинамики не отмечено [19, 20].
Варикозное расширение вен желудка особенно выражено при внепеченочной ПГ. Варикозное расширение вен пищевода почти всегда сопровождается расширением вен желудка. Наиболее частыми осложнениями ПГ являются желудочно-кишечные кровотечения и печеночная энцефалопатия, которая развивается достаточно часто, обычно после кровотечения, инфекции и т. д.
Внутрипеченочная ПГ формируется при:
- шистосоматозе в 5-10% наблюдений за счет поражения мелких ветвей ВВ. По данным УЗИ, в зависимости от распространения воспалительного процесса в перипортальных тканях выделяют 3 степени заболевания. При I степени гиперэхогенные участки перипортальной ткани локализуются в области бифуркации ВВ и шейки желчного пузыря; при II степени процесс распространяется вдоль ветвей ВВ; III степень включает изменения, свойственные для I и II степеней поражения. Кроме этого, во всех наблюдениях выявляют спленомегалию, в 81-92% случаев - увеличение в размерах желчного пузыря. Может отмечаться увеличение диаметра воротной, селезеночной вен, наличие порто-системных коллатералей [21];
- врожденном фиброзе печени, вероятно, вследствие недостаточного количества терминальных ветвей ВВ;
- миелопролиферативных заболеваниях, когда определенная роль принадлежит тромбозу крупных и мелких ветвей ВВ, частично ПГ связана с инфильтрацией портальных зон гемопоэтическими клетками;
- первичном билиарном циррозе печени ПГ может быть первым проявлением заболевания до развития узловой регенерации, по-видимому, в развитии ПГ играет роль поражение портальных зон и сужение синусов;
- действии токсических веществ, например, мышьяка, меди;
- печеночно-портальном склерозе, для которого характерны спленомегалия и ПГ без окклюзии воротной и селезеночных вен, В этом случае при портальной венографии выявляется сужение мелких ветвей ВВ и уменьшение их количества. Контрастное исследование печеночных вен подтверждает изменения сосудов, обнаруживаются веновенозные анастомозы [16].
Наличие признаков диффузного поражения печени при циррозе, поданным УЗИ, выявляется в 57-89,3% случаев [22]. Поскольку ложноположительные случаи отмечены при жировой дистрофии печени, а ложноотрицательные - в начальной стадии заболевания, достоверно отличить цирроз печени от других нецирротических хронических заболеваний можно только по выявлению признаков портальной гипертензии, характерных для цирроза печени.
На сегодняшний день накоплен значительный опыт в изучении вопросов диагностики ПГ у больных циррозом печени по данным цветового допплеровского сканирования. Традиционно для диагностики ПГ используют анализ показателей диаметра, площади поперечного сечения, значения линейной и объемной скоростей кровотока с последующим расчетом индексов, а также регистрацию направления кровотока в воротной вене, реже в селезеночной и верхней брыжеечной венах, оценку показателей кровотока в печеночной и селезеночной артериях. Несмотря на разнородность в количественной оценке исследуемых показателей, большинство авторов единодушны в мнении о том, что исследуемые параметры системы ВВ зависят от наличия и уровня коллатеральных путей оттока и стадии заболевания [18, 23-25]. Последствия нарушения проходимости артерий печени зависят не только от их калибра, состояния притока портальной крови, но и от возможности оттока по печеночным венам. Следствием нарушения оттока крови является не только ПГ, но и атрофия паренхимы печени. При наличии маленькой цирротической печени нельзя исключить веноокклюзивные изменения в печеночных венах [18].
Несмотря на то, что не существует прямой корреляции между данными ЦДС и риском развития желудочно-кишечных кровотечений у больных с ПГ, некоторые авторы отмечают информативность отдельных УЗ-критериев, наличие которых может свидетельствовать о повышении или снижении риска развития кровотечения. Так, при циррозе печени регистрация гепатофугального направления кровотока в ВВ свидетельствует о снижении риска развития кровотечения, гепатопетальное направление в коронарной вене связано с низким риском развития этого осложнения [26, 27]. При варикозном расширении вен и наличии кровотока в селезеночной вене, величина которого превышает величину кровотока в ВВ, отмечают тенденцию к увеличению размеров варикозно расширенных вен и повышению риска развития кровотечения [28]. При высоких значениях индекса застоя (гиперемии, congesion index) велика вероятность раннего развития кровотечения из варикозно расширенных вен [29]. Индекс застоя - это отношение площади поперечного сечения к средней линейной скорости кровотока в ВВ. В норме величина индекса находится в диапазоне 0,03-0,07 [24, 30, 31]. При циррозе печени индекс достоверно увеличивается до значений 0,171 ± 0,075. Выявлена корреляция индекса застоя с величиной давления в ВВ, степенью печеночной недостаточности и выраженностью кол- латералей, индексом периферического сопротивления в печеночной артерии [31-33]. Высокий риск другого осложнения ПГ - печеночной энцефалопатии связан с наличием гепатофугального направления кровотока в ВВ, часто наблюдается у пациентов с обратным направлением кровотока в селезеночной вене и наличием порто-системных коллатералей [25, 34].
Для снижения риска развития печеночной энцефалопатии выполняют порто-системное шунтирование с целью снижения давления в ВВ и поддержания общего печеночного кровотока. Согласно данным С.И. Жестовской (18), при исследовании сосудистых анастомозов, создаваемых хирургическим путем, целесообразно придерживаться следующих методических моментов.
- Визуализацию сплено-ренального анастомоза «конец-в-бок» осуществляют со стороны спины больного по левой среднелопаточной линии при сагиттальном сканировании подлиннику левой почки. Анастомоз определяется в виде единичного дополнительного сосуда, отходящего под различным углом от боковой стенки левой почечной вены ближе к верхнему полюсу почки.
- Визуализация сплено-ренального анастомоза «бок-в-бок» отличается наличием двух дополнительных сосудов, отходящих симметрично от почечной вены в одной плоскости. Сосуд, прилежащий ближе к верхнему полюсу почки, визуализируется до ворот селезенки, при этом, кроме осмотра больного в положении на спине, производят осмотр в положении больного на правом боку в области левого подреберья по передней и средней подмышечным линиям, косым сканированием. УЗ-изображение сплено-ренального анастомоза необходимо дифференцировать от яичковой вены. Анастомоз располагается ближе к верхнему полюсу почки, представлен в виде ровной тубулярной структуры, легче визуализируется со стороны спины пациента. Яичковая вена располагается ближе к нижнему полюсу почки, может иметь извитой ход, легче визуализируется при косом сканировании из левого подреберья.
- Визуализацию илео-мезентериального анастомоза осуществляют справа от средней линии живота от мезогастральной области до крыла подвздошной кости. Исследуется нижняя полая вена. Далее датчик располагают в околопупочной области с наклоном УЗ-луча к средней линии живота. При продвижении датчика от начала НПВ, косо к эпигастральной области, визуализируется сосудистый анастомоз, соответствующий месту соединения подвздошной вены и верхней брыжеечной вены.
Прямыми УЗ-признаками, подтверждающими проходимость портосистем- ного шунта, являются окрашивание просвета шунта в режиме ЦДК или ЭДК и регистрация показателей венозного кровотока. К косвенным признакам относятся данные об уменьшении диаметра ВВ и расширении реципиентной вены.
К портальной гипертензии могут приводить нецирротические заболевания, сопровождающиеся образованием узлов в печени. Узловую регенеративную гиперплазию, частичную узловую трансформацию относят к редким доброкачественным заболеваниям печени. В печени определяют узелки из клеток, похожих на портальные гепатоциты, которые образуются в результате облитерации мелких ветвей воротной вены на уровне ацинусов. Развитие этих изменений связано с наличием системных заболеваний, миелопролиферативных нарушений. УЗ-изображение узелков не имеет специфических признаков и диагноз основывается на выявлении признаков ПГ, которые отмечаются в 50% случаев [25].
В основе синдрома Бадда-Киари лежит обструкция печеночных вен на любом уровне - от выносящей дольковой вены до места впадения нижней полой вены в правое предсердие. Причины, приводящие к развитию этого синдрома, чрезвычайно разнообразны: первичные и метастатические опухоли печени, опухоли почек и надпочечников, заболевания, сопровождающиеся гиперкоагуляцией, травма беременность, использование оральных контрацептивов заболевания соединительной ткани, сосудистые мембраны, стеноз или тромбоз нижней полой вены [35-37]. Примерно у 70% пациентов причина данного состояния остается невыясненной. При УЗИ в В-режиме может наблюдаться гипертрофия хвостатой доли, изменение структуры печени асцит. В зависимости от стадии заболевания изменяется эхогенность печени, от гипоэхогенной в период острого тромбоза вен до гиперэхоенной в отдаленном периоде заболевания [25].
При триплексном сканировании в зависимости от степени поражения печеночных или нижней полой вен может выявляться, отсутствие кровотока; непрерывный (псевдопортальный) низкоамплитудный кровоток; турбулентный; кровоток обратного направления.
Двойное окрашивание печеночных вен в режиме ЦДК является патогномоничным признаком при синдроме Бадда-Киари. Кроме этого ЦДК позволяет обнаружить внутрипеченочное венозное шунтирование регистрировать параумбиликальные вены Выявление внутрипеченочных коллатеральных сосудов играет важную роль в дифференциальной диагностике синдрома Бадда-Киари и цирроза печени.
Результаты наших исследований свидетельствуют о наличии синдрома Бадда-Киари у пациентов с очаговыми образованиями печени, возникшими вследствие прорастания или экстравазальной компрессии одной или нескольких печеночных вен при гепатоцеллюлярном раке - в 54% случаев при метастазах в печень - в 27%, с кистозными образованиями печени - в 30%, у лиц с кавернозными гемангиомами печени - в 26% наблюдений.
Воноокклюзионная болезнь (ВОБ) характеризуется развитием облитерирующего эндофлебита печеночных венул. Печеночные венулы чувствительны к токсическому воздействию, которое развивается вследствие длительного приема азатиоприна после трансплантации почки или печени, лечения цитостатическими препаратами облучения печени (общая доза облучения достигает или превышает 35 гр.) [38-40]. Клинически ВОБ проявляется желтухой, наличием боли в правом подреберье увеличением печени, наличием асцита [25] Диагностика данного заболевания достаточно сложна поскольку печеночные вены остаются проходимыми.
5. Комплексное ультразвуковое исследование рака поджелудочной железы
На основании данных УЗИ выработан алгоритм обследования пациентов, страдающих раком ПЖ
- чрескожное исследование в В-режиме в реальном масштабе времени, широко используемое для выявления опухолей ПЖ, по существу является скрининговым методом, с которого начинают обследование больного;
- цветовое допплеровское сканирование или исследование в В-режиме в сочетании с использованием двуокиси углерода (микропузырьков С02) в качестве контрастного вещества, предоставляет дополнительные возможности в дифференциальной диагностике опухолевого процесса и воспалительных изменений ПЖ;
- цветовое допплеровское сканирование с использованием режимов ЦДК или ЭДК дает информацию о характере взаимоотношения опухоли с сосудами системы воротной вены, системы нижней полой вены, а также аорты и ее ветвей.
Если диагноз окончательно не установлен, то на основании результатов комплексного УЗИ принимается решение о выборе необходимого дополнительного метода исследования или их сочетанного использования. К ним относят: УЗ-эндоскопическое исследование, УЗ-внутрипротоковое исследование, чрескожная аспирационная биопсия ПЖ под контролем УЗИ. Интраоперационное ультразвуковое исследование позволяет уточнить вид и объем операции.
Диагностика рака в В-режиме в реальном масштабе времени основывается на прямых и косвенных признаках. К прямым признакам относятся выявление солитарного очага или полости неоднородной плотности с наличием линии демаркации между опухолью и паренхимой ПЖ. Опухолевая перестройка паренхимы ПЖ - это основной прямой признак наличия опухоли. Перестройка структуры в зоне поражения вызывает изменение интенсивности отражения эхосигналов от опухоли. Выделяют следующие варианты эхогенности опухоли: гипоэхогенный, гиперэхогенный, изоэхогенный и смешанный.
Согласно нашим данным УЗИ в В-режиме 131 больного аденокарциномой ПЖ, локализацию процесса в головке отмечали в 62% наблюдений, в теле - в 12%, хвосте - 24% и тотальное поражение - в 2% случаев. В большинстве наблюдений диагностировали гипоэхогенные образования - 81,7%, смешанной эхогенности - в 10,7% случаев, гиперэхогенные - в 4,5 % и изоэхогенные - в 3,1 % наблюдений.
Возможность УЗИ в В-режиме в диагностике опухолей зависит от локализации и ее размеров. В зависимости от величины опухоли, размеры железы могут оставаться неизменными либо отмечается локальное или диффузное ее увеличение.
К косвенным признакам аденокарциномы относятся расширение панкреатического протока, расширение общего желчного протока (ОЖП). Обструкция главного панкреатического протока (ГПП), обусловленная сдавлением или прорастанием опухолью, может происходить непосредственно в области его перехода в ампулу с последующей дилатацией дистальнее уровня обструкции. В этом случае визуализируется проток в теле и/или головке диаметром более 3 мм. Нами отмечена дилатация ГПП от 4 до 11 мм в 71% наблюдений при локализации опухоли в головке поджелудочной железы. При локализации опухоли в головке ПЖ и близком расположении к интрапанкреатической части общего желчного протока, вследствие опухолевой инвазии, циркулярного сдавления опухолью или роста опухоли в просвет протока развивается обструкция ОЖП. При диаметре ОЖП 12-17 мм просвет внутрипеченочных желчных протоков достигал 8 мм в сочетании с увеличением размеров желчного пузыря Расширение внутрипеченочных желчных протоков может быть обусловлено наличием опухоли в головке ПЖ либо лимфатических узлов в области гепато-дуоденальной связки
При локализации рака в области крючковидного отростка не всегда удается по данным УЗИ в В-режиме адекватно визуализировать и оценить изменения на ранней стадии заболевания. По мере распространения процесса и инфильтрации головки ПЖ опухолевые массы достигают уровня терминального отдела общего желчного протока. Однако эти изменения, как правило, диагностируются уже на поздней стадии заболевания, Поэтому для опухоли, исходящей из крючковидного отростка, характерна дилатация общего желчного протока, ГПП и развитие желтухи на поздней стадии заболевания.
Дифференцировать эхографическую картину рака необходимо, прежде всего, с локальными формами панкреатита, раком большого дуоденального сосочка, иногда псевдокистами, лимфомами, метастазами в ПЖ. Тактически важным является учет клинических и лабораторных данных в сочетании с результатами биопсии
Дополнительные возможности в дифференциальной диагностике опухолевого процесса и воспалительных изменений ПЖ открывает применение цветового допплеровского сканирования в режиме ЦДК, ЭДК и/или В-режиме в сочетании с использованием двуокиси углерода. Нами проанализированы дополнительные возможности получения необходимой информации с помощью цветового допплеровского сканирования. При использовании данной методики определяли наличие сосудов характер и скорость кровотока в них. При дуплексном сканировании у больных раком ПЖ отмечается либо отсутствие кровотока сосудов внутри опухоли, либо регистрируются сосуды преимущественно с артериальным кровотоком коллатерального типа, диаметром 1-3 мм. ЛСК- 10-30 см/с. Ни в одном наблюдении не было выявлено сосудов, огибающих опухоль в виде ободка.
Для усиления ультразвукового сигнала, отражающегося от эритроцитов, используют эхоконтрастные вещества. В нашей работе был использован левовист. Проводили исследования в два этапа у трех больных раком ПЖ и шести - хроническим панкреатитом (ХП) На первом этапе выполняли УЗ-исследование сосудистого русла в головке ПЖ. На втором - оценивали кровоток в сосудах головки ПЖ после внутривенного введения 6 мл левовиста в концентрации 400 мг/мл, с последующим сравнением интенсивности сигналов от кровотока до и после применения левовиста. При раке ПЖ на первом этапе исследования у трех больных отсутствовал кровоток внутри опухоли. После введения левовиста через 15-20 с на протяжении одной-двух минут в двух случаях отчетливо визуализировали артериальные сосуды диаметром до 2 мм с коллатеральным типом кровотока. Среди 6 пациентов с ХП на первом этапе в четырех случаях в головке ПЖ визуализировались артерии с магистральным типом кровотока и вены. На втором этапе регистрация хода ранее зафиксированных сосудов заметно улучшилась. В остальных наблюдениях появилось изображение сосудов, преимущественно вен, которые не определяли ранее. Таким образом, на основании накопленного опыта мы рекомендуем применение в сложных диагностических ситуациях цветового допплеровского сканирования в режимах ЦДК. ЭДК для дифференциальной диагностики заболеваний ПЖ.
Наиболее простым веществом, усиливающим изображение в В-режиме, является двуокись углерода (микропузырьки СO2). Введение в чревный ствол микропузырьков СO2 во время агиографического исследования при изучении ПЖ с помощью УЗИ в В-режиме является по существу комбинированным способом диагностики. Использование двуокиси углерода дает возможность более четко подтвердить и дифференцировать характер процесса в ПЖ. Согласно данным Kazumitsu Koito et al. [41] при обследовании 30 пациентов раком ПЖ и 20 - хроническим панкреатитом, в зависимости от наполнения зоны поражения микропузырьками СO2, диагностировали наличие и степень васкуляризации. Авторы выявили, что раковая опухоль в 91% наблюдений гиповаскулярная, зона ХП в 95% случаев - изоваскулярная. Сопоставление результатов УЗИ в В-режиме с использованием двуокиси углерода, компьютерной томографии и дигитальной субтракционной ангиографии в дифференциальной диагностике рака ПЖ и ХП показало, что чувствительность методов составляет 98%, 73% и 67% соответственно.

Рис. 184. Трехмерная реконструкция и ЦДС селезеночной артерии. Рак ПЖ
а. Изображение опухоли (T) тела-хвоста поджелудочной железы и селезеночной артерии (AL) в структуре опухоли. Трехмерная реконструкция сочетание В-режима и УЗ-ангиографии (ТС-чревный ствол, АНС - общая печеночная артерия, VP - воротная вена).
б. Изображение опухоли (TUMOR) поджелудочной железы и селезеночной артерии (AL) в структуре опухоли. Спектрограмма селезеночной артерии на участке компрессии.
Одним из ключевых моментов в определении резектабельности рака является оценка состояния магистральных сосудов и степень вовлечения их в опухолевый процесс. Уже на дооперационном этапе по данным УЗ-исследования можно получить необходимую информацию. При локализации рака в головке ПЖ, как правило, проводится целенаправленное исследование верхней брыжеечной вены, воротной вены и ее конфлюенса, верхней брыжеечной артерии, общей печеночной артерии и чревного ствола, в теле - чревного ствола, общей печеночной и селезеночной артерий, в хвосте - чревного ствола и селезеночных сосудов. В определении резектабельности опухоли имеет значение и состояние нижней полой вены. На наш взгляд, для оценки состояния сосудов по данным цветового допплеровского сканирования целесообразно проводить
анализ:
- Локализации и анатомического расположения магистральных артерий и вен относительно опухоли (сосуд не контактирует с опухолью, контактирует с опухолью, располагается в структуре опухоли).
- Состояния стенки и просвета сосуда (эхогенность стенки сосуда не изменена, повышена; величина просвета не изменена, изменена на участке контакта с опухолью).
- Величины линейной скорости кровотока на всем протяжении сосуда, доступном УЗ-визуализации.
При контакте сосуда с опухолью регистрация локального увеличения ЛСК свидетельствует о наличии гемодинамически значимой экстравазальной компрессии сосуда опухолью. В такой ситуации для определения резектабельно- сти опухоли первостепенное значение имеет информация об инвазии опухоли в стенку сосуда. Повышение эхогенности стенки сосуда на участке контакта с опухолью свидетельствует либо о фиксации опухоли, либо о прорастании опухолью стенки сосуда. Повышение эхогенности стенки и наличие субстрата в просвете сосуда указывает на прорастание сосуда опухолью. Отсутствие УЗ-изображения сосуда, анатомический ход которого располагается в структуре опухоли, также свидетельствует о прорастании сосуда. Кроме этого, при раке ПЖ часто развивается пристеночный или обтурирующий тромб в верхней брыжеечной вене и/или селезеночной вене. Тромбоз из этих вен может распространяться и на воротную вену.
На сегодняшний день трехмерная реконструкция опухоли ПЖ и близлежащих магистральных сосудов при использовании сочетания В-режима и ангиографии позволяет оценить их анатомическое взаимоотношение и степень контакта. Однако для решения вопроса о состоянии стенки сосуда на участке контакта с опухолью преимущественное значение имеют данные, полученные при использовании В-режима. Сравнение возможностей В-режима при двухмерном сканировании и трехмерной реконструкции свидетельствует о более высокой разрешающей способности метода при трехмерном УЗ-изображении. Более четко регистрируют структурные особенности и контур стенки, а также состояние ее эхогенности, что имеет важное клиническое значение при определении показаний к оперативному лечению пациентов, страдающих раком ПЖ.

Рис. 185. Трехмерная реконструкция селезеночной артерии. Изображение стенки и просвета селезеночной артерии (AL) в структуре опухоли (Т). Прорастание стенки селезеночной артерии опухолью. Интактная общая печеночная артерия (АН).
В качестве примера на рис. 184, 185 прослеживается анатомический ход селезеночной артерии в структуре опухоли ПЖ. При дуплексном сканировании просвет артерии окрашивается, на участке контакта с опухолью регистрируют локальное повышение скорости кровотока, что свидетельствует о наличии гемодинамически значимой экстравазальной компрессии. Сравнение эхогенности и толщины стенки селезеночной и общей печеночной артерий показывает наличие признаков прорастания стенки СА опухолью.
Варианты взаимоотношения рака ПЖ с магистральными сосудами представлены в таблице 41.
Таблица 41. Взаимоотношение рака ПЖ с магистральными сосудами по данным ультразвукового исследования.
|
Взаимоотношения сосудов с опухолью |
Состояние сосудов | ||
|
Эхогенность стенки Величина просвета |
Локальное повышение ЛСК | ||
|
I Не контактируют |
не изменена |
не изменена |
- |
|
II Контактируют 1 |
не изменена |
не изменена |
- |
|
2 |
не изменена |
изменена |
+ |
|
3 |
повышена |
не изменена |
- |
|
4 |
повышена |
изменена |
+ |
|
III В структуре опухоли 1 |
повышена |
изменена |
+ |
|
2 |
не дифференцируется от окружающих тканей |
не определяется |
кровоток не регистрируют |
«-» - отсутствие; «+» - наличие
Методика трехмерной реконструкции эффективна в оценке состояния стенки сосудов и имеет меньшее клиническое значение в оценке УЗ-характеристик патологического очага. Улучшение изображения опухоли в В-режиме при трехмерной реконструкции по сравнению с двухмерным сканированием (более ярко визуализируют границы опухоли, более четко определяют структурные особенности) не является строго необходимой информацией для решения вопроса о резектабельности рака ПЖ.
Подобная информация на дооперационном этапе позволяет определить тактику ведения больного и решить вопрос о возможности удаления опухоли с реконструкцией или без реконструкции пораженного сегмента сосуда.
Анализируя наш материал, основанный на результатах обследования более 50 больных с очаговыми поражениями поджелудочной железы, мы пришли к выводу, что для оценки состояния стенки, просвета сосуда и решения вопроса о возможности выполнения оперативного лечения и его объема у больных раком ПЖ, показанием к проведению трехмерной реконструкции является наличие опухоли поджелудочной железы, контактирующей с магистральными сосудами.
6. Комплексное ультразвуковое исследование неорганных забрюшинных образований
Забрюшинное пространство заключено между задним листком париетальной брюшины и задней стенкой полости живота, которая образована телами позвонков, четырьмя нижними ребрами и предбрюшинной фасцией, покрывающей ножки диафрагмы, квадратную поясничную и подвздошную мышцы. Верхней
границей пространства является диафрагма, нижней-промонториум и безымянная линия боковыми границами - места перегиба париетальной брюшины,
В забрюшинном пространстве, в клетчатке, расслоенной фасциями, находятся почки с мочеточниками, надпочечники брюшная аорта с крупными ветвями, нижняя полая вена с рядом крупных притоков, восходящие поясничные вены, начальные отделы vv. Azygos и hemiazygos, вегетативные нервные сплетения, поясничный отдел симпатического нервного ствола, лимфатические узлы, лимфатические сосуды, поясничные лимфатические стволы, trunci intestinales, cycterna chili. К ретроперитонеальным органам относят также двенадцатиперстную кишку (кроме начального отдела), поджелудочную железу (кроме хвоста). Вышесказанное определяет многообразие клинических форм и различие по генезу первичных неорганных забрюшинных опухолей
Суммируя данные об особенностях неорганных забрюшинных образований (НЗО), следует отметить, что:
- Отсутствует специфическая клиническая картина НЗО. Разнообразие клинических признаков заболевания обусловлено тем, что НЗО могут распространяться от диафрагмы до малого таза, и только локализация опухоли обуславливает развитие патогномоничных клинических симптомов.
- Ведущими характеристиками общего состояния являются признаки опухолевой интоксикации и потеря массы тела Несоответствие между большими размерами новообразования и малой степенью его воздействия на организм в течение длительного времени является характерной чертой НЗО.
Общепризнанным является тот факт, что ультразвуковое исследование в В-режиме является скрининговым методом в диагностике опухолей брюшной полости и забрюшинного пространства. На основании данных исследования в В-режиме можно получить сведения о размерах, форме и структуре образования [42-47] Несмотря на то, что в литературе существуют различные точки зрения, данные УЗИ в В-режиме дают довольно определенную информацию о структуре отдельных нозологических форм НЗО, таких как опухоли из жировой ткани, некоторые нейрогенные образования, тератомы.

Рис. 186. Схема забрюшинного пространства.
Для уточнения расположения новообразования и решения вопроса о его резектабельности В В Цвиркуном [48] предложена схема деления забрюшинного пространства на 5 зон (рис 186), нумеруемых по часовой стрелке: 1) между диафрагмой сверху, аортой слева, левой почечной артерией снизу и боковой брюшной стенкой справа; 2) между левой почечной артерией сверху, аортой слева левой подвздошной артерией снизу и боковой брюшной стенкой справа 3) тазовая - ниже подвздошных артерий и безымянной линии; 4) между правой общей подвздошной артерией снизу, инфраренальным сегментом аорты справа, боковой брюшной стенкой слева и правой почечной артерией сверху; 5) между правой почечной артерией снизу, супраренальным сегментов аорты справа, боковой стенкой слева и правым куполом диафрагмы сверху.
По данным УЗ-изображения магистральных артерий и вен необходимо анализировать их анатомическое расположение и ход относительно новообразования. При этом анатомический ход сосудов может иметь следующие варианты: неизменен, изменен или находится в структуре образования. Регистрация ЛСК позволяет судить о состоянии гемодинамики в исследуемых сосудах с учетом наличия либо отсутствия локальных изменений кровотока. Так, согласно данным Ю.А. Степановой [47], среди 60 исследованных НЗО изменения анатомического хода сосудов выявили в 76,7% наблюдений, из которых у 65,9% больных диагностировали гемодинамически значимую экстравазальнук компрессию на этом участке. При рецидивных опухолях возможны изменения анатомического хода магистральных сосудов.
Сосуды, огибающие опухоль, визуализируются только при злокачественном генезе опухоли. Источником данных сосудов могут быть поясничные артерии, нижняя полая вена, подвздошные артерии и вены. Исследуемые сосуды диаметром 1,5-3,0 мм представлены артериями с коллатеральным кровотоком и венами с монофазным спектром кровотока. Однако при опухолях больших размеров, полициклической и/или многоузловой форме могут возникать трудности в определении наличия и регистрации анатомического хода сосудов огибающих опухоль. В ряде наблюдений поясничные, подвздошные сосуды являются источником сосудов, участвующих в кровоснабжении НЗО. Используя режим ЦДК и/или ЭДК, удается проследить их анатомический ход к опухоли зарегистрировать диаметр (1,5-5,0 мм), а также определить характер и величину кровотока.
Диагностика различных вариантов внутриопухолевой ангиоархитектоники является одним из интересных и малоизученных вопросов. При интерпретации данных ангиоархитектоники НЗО следует оценить степень их васкуляризации. НЗО могут быть гиперваскулярными, гипо- и аваскулярными. Степень васкуляризации зависит от вида, размера опухоли и характера ее кровоснабжения. Мы провели сопоставление результатов морфологического исследования неорганных опухолей и данных цветового допплеровского сканирования. Полученные нами данные позволили проанализировать ангиоархитектонику различных по генезу групп забрюшинных образований и выявить некоторые их особенности. Так, анализ ангиоархитектоники 80 НЗО, по данным Ю.А. Степановой [47], показал, что в липоме не выявляют внутриопухолевый кровоток. В липосаркоме прослеживают следующие тенденции: при размере опухоли менее 5,0 см данные о наличии внутриопухолевого кровотока не получены ни в одном наблюдении, но по мере увеличения опухоли выявляют единичные артерии с коллатеральным типом кровотока и вены. Опухоли больших размеров преимущественно гиперваскулярные. В них регистрируется множество артерий и вен. Рецидивные опухоли, как правило, гиперваскулярны. Сосудистая сеть внутри опухоли усиливается с каждым новым рецидивом. По-видимому, именно этим обстоятельством можно объяснить отсутствие очагов распада в липосаркоме в отличие от лейомиосаркомы. Внутриопухолевая сеть внутри лейомиосаркомы представлена артериями и венами, однако она незначительна даже при размере опухоли более 15 0 см. Не выявили внутриопухолевого кровотока в гемангиомах лимфангиомах, при системных заболеваниях При злокачественных морфологических формах диагностировали артериальный и венозный кровоток у больных с рабдомиосаркомой, гемангиасаркомой, лимфангиосаркомой, мезенхимомой, нейросаркомой, опухолями неясного генеза Описанные УЗ-картины на уровне опухолевых сосудов изобилуют различными вариантами, что связано с многообразием морфологических видов опухоли, различным генезом и индивидуальными особенностями их кровоснабжения.
Суммируя представленные данные о возможностях цветового допплеровского сканирования при обследовании больных с НЗО, следует подчеркнуть, что метод позволяет уточнить локализацию новообразования и определить взаимоотношение с магистральными сосудами, выявить источники и пути кровоснабжения новообразований, он является одним из ведущих методов в оценке регионарной ангиоархитектоники в зоне НЗО Подобный объем информации об анатомическом и функциональном состоянии артерий и вен брюшной полости и забрюшинного пространства помогает хирургам решить вопрос о характере и объеме хирургического вмешательства у данной категории больных
Однако ЦДС присущи и ограничения УЗ-изображение сосудистой системы возможно лишь отдельными сегментами; при наличии низкой скорости кровотока в сосуде проследить его анатомический ход не представляется возможным
Трехмерная реконструкция УЗ-изображения включает исследование в В-режиме, режиме УЗ-ангиографии и сочетание В-режима и УЗ-ангиографии Применение трехмерной реконструкции в В-режиме при обследовании пациентов с НЗО позволяет получить более четкое изображение структурных особенностей исследуемых образований благодаря прозрачности изображения (рис. 187, 188); больший объем информации о состоянии прилежащих тканей и структур за счет объединения их в единый визуальный массив, преимущества в оценке краевой зоны и формы патологического очага

Рис. 187. Эхограмма нейрофибромы (TUMOR) в В-режиме при двухмерном сканировании

Рис. 188. Эхограмма нейрофибромы (T) в В-режиме при трехмерной реконструкции (AIE - наружная подвздошная артерия. VIE - наружная подвздошная
вена;.
Подобная информация позволяет уточнить детали структурных особенностей новообразования однако большое клиническое значение имеют данные,
полученные при использовании сочетания В-режима и УЗ-ангиографии.
Трехмерная реконструкция при использовании сочетания В-режима и УЗ-ангиографии позволяет визуализировать магистральные сосуды на большем протяжении, в ряде случаев проследить анатомический ход, не определяемый при цветовом допплеровском сканировании (рис.189 а, б). Особенно улучшается возможность визуализации сосудов среднего и мелкого калибра, что позволяет более тщательно проследить их анатомический ход. Эта информация особенно важна в диагностике сосудов, участвующих в кровоснабжении новообразования, и сосудов, огибающих его, а также внутриопухолевых сосудов. Использование сочетания В-режима и УЗ-ангиографии позволяет правильно соотнести анатомическое расположение сосудов относительно образования и получить цельную картину ангиоархитектоники неорганных забрюшинных образований. Цветовое допплеровское сканирование и трехмерная реконструкция взаимно дополняют друг друга, что дает основание предложить эти два метода для комплексного применения при проведении УЗ-исследования больных с неорганными забрюшинными образованиями.
Анализируя наш материал, основанный на результатах обследования больных с НЗО с помощью трехмерной реконструкции, полагаем, что показанием к проведению трехмерной реконструкции является уточнение анатомических особенностей и расположения сосудистой системы в зоне неорганного забрюшинного образования.

Рис. 189 а, б. Цветовое допплеровское сканирование сосудов, окружающих нейрофиброму (TUMOR). (АНР - собственная печеночная артерия, VP - воротная вена, IVC - нижняя полая вена, AMS - верхняя брыжеечная артерия, АО - аорта, VRS - левая почечная артерия, VL - селезеночная вена, AL - селезеночная артерия).
Таким образом, использование новейших ультразвуковых технологий - цветового допплеровского сканирования и трехмерной реконструкции абдоминальных сосудов - показало, что неинвазивная ультразвуковая диагностика выходит на качественно новый уровень, позволяющий принимать участие в выборе тактики лечения больных.
ГЛАВА 14
ДОППЛЕРОВСКИЕ УЛЬТРАЗВУКОВЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ В УРОНЕФРОЛОГИИ
1. Допплеровские технологии при исследовании почек и верхних мочевых путей
С появлением новых компьютерных технологий диагностические возможности допплеровских методик при ультразвуковом исследовании значительно расширились. Благодаря высокому качеству визуализации самых мелких анатомических структур, использованию функциональных нагрузок, эхоконтрастному усилению и возможности оценки трехмерных виртуальных изображений, диагностика заболеваний почек и верхних мочевых путей поднялась на новый качественный уровень.
1.1. Методика цветового дуплексного сканирования при исследовании почек и верхних мочевых путей
Кровоснабжение почек осуществляется за счет почечных артерий, отходящих от аорты по одной с каждой стороны. Почечные артерии являются терминальными сосудами, которые не коммуницируют по мере направления к периферии почки. В воротах почечная артерия делится на переднюю и заднюю ветви, от которых отходят междолевые артерии, располагающиеся в почечном синусе. На периферии междолевые артерии образуют сосудистую сеть, которая состоит из аркуатных или дуговых артерий, идущих параллельно капсуле почки на уровне кортико-медуллярного перехода, от которых к капсуле почки отходят корковые или междольковые артерии, и медуллярные ветви, снабжающие кровью пирамидки.
Венозная система почки повторяет строение артериальной. Из междолевых вен формируется правая и левая почечные вены, которые впадают в нижнюю полую вену на уровне I-II поясничного позвонка почти под прямым углом. Левая почечная вена располагается позади верхней брыжеечной артерии и кпереди от аорты. Правая почечная вена короче левой. Устье левой почечной вены расположено выше, чем правой. В левую почечную вену впадают также левая надпочечниковая вена и левая тестикулярная (яичниковая) вена.
Кровоснабжение мочеточников осуществляется за счет мочеточниковых артерий, отходящих в верхнем отделе от почечных и гонадных артерий, в нижнем отделе - от различных ветвей внутренней подвздошной артерии.
Для оценки основных стволов почечных артерий применяются две стандартные позиции. Первая - поперечное сканирование из переднего абдоминального доступа, когда можно получить изображение сразу обеих почечных артерий и вен, применяя как цветовое, так и энергетическое картирование
(рис. 190). Вторая позиция для оценки почечных артерий - продольное сканирование, при положении пациента на правом боку. При этом датчик располагается субкостально и при глубоком вдохе в режиме ЦДК, применяя компрессию, получается четкое изображение обеих почечных артерий (рис. 191). Эта позиция рекомендуется для оценки уровня отхождения почечных артерий и их количества. Нужно отметить, что приблизительно 30% пациентов имеют множественные почечные артерии, которые могут варьироваться как по числу, так и по расположению. Если необходимо оценить характер кровотока в корковых отделах почки, то следует использовать режим ЭДК. Применение ЭДК обеспечивает лучшую визуализацию как основных стволов почечных артерий, так и мелких ветвей. Однако при этом теряется информация о направлении тока крови. Методика Dynamic-Flow обеспечивает отображение тока крови вне зависимости от его направленности и глубины залегания сосуда (рис. 192). Эта ее способность основана на одновременном использовании технологии широкополосного сканирования и оценки допплеровского сдвига эритроцитов. Трехмерная реконструкция сосудов с использованием режима ЭДК и проекции максимальной интенсивности позволяет получать сопоставимые с ангиографическим изображения почечных сосудов. Для оценки почечных вен также используются два вышеперечисленных доступа и режим ЦДК. Правая почечная вена может быть прослежена на всем протяжении от ворот почки до впадения в нижнюю полую вену.

Рис. 190. Схема визуализации основных стволов почечных артерий из переднего поперечного доступа.

Рис. 191. Схема визуализации основных стволов почечных артерий из бокового субкостального доступа.

Рис. 192. Эхограмма почечного кровотока. Методика Dynamic flow.
Позиция продольного сканирования из субкостального доступа может быть рекомендована также для измерения допплеровского спектра в обеих почечных артериях. Известно, что допплеровский сигнал в почечных артериях является низкорезистивным, схожим с сигналом, получаемым в паренхиматозных органах. Отличительными характеристиками этого сигнала являются быстрый систолический подъем и длительная высокоскоростная кривая во время диастолы (рис. 193). На допплеровской кривой в конце систолического пика присутствует небольшая выемка, отражающая так называемый ранний систолический пик. Этот знак чрезвычайно важен при оценке времени систолического ускорения на почечной допплерограмме. В норме пик систолической скорости в основной почечной артерии должен быть менее 100 см/с. Пиковая систолическая скорость плавно снижается в интраренальных артериях по направлению к периферии почки. Диастолическая скорость примерно вдвое ниже систолической, и это отражается в показателях индекса резистентности (ИР), который в нормальной почке ниже 0,7. Среди допплеровских индексов принято измерять также соотношение систолической скорости кровотока в аорте к аналогичному показателю в почечных артериях. Совокупность наиболее часто используемых показателей представлена в таблице 42.
Таблица 42. Допплеровские показатели кровотока в почечных артериях [1].
|
Индексы |
Формула расчета |
Значения |
|
МСС: почечная артерия |
|
60-100 см/с (<180 см/с) |
|
Индекс резистентности |
МСС - КДС /МСС |
0,56-0,7 (<0,7) |
|
Систоло-диастолическое отношение |
КДС / МСС |
0,26-0,4 |
|
Индекс пульсации |
МСС - КДС/средняя СК |
0,7-0,14 |
|
Соотношение поч.арт./аорта |
МСС поч.арт/МСС аорта |
<3,0 |
|
Время акселерации |
Время до систолического пика |
0,04-0,06 с |
|
Индекс акселерации |
|
250-380 см/с2 |
Сокращения: МСС - максимальная систолическая скорость кровотока, КДС - конечная диастолическая скорость кровотока, средняя СК - средняя скорость кровотока.
Необходимо помнить, что показатель индекса резистентности отражает большую зависимость от возраста исследуемого и от места его измерения в сосудистой системе почки. Так, значения ИР для уровня ворот почки будут примерно 0,65 ± 0,17, тогда как на уровне междольковых артерий его значение будет примерно 0,54 ± 0,2 [2]. Показатели ИР для разных возрастных групп отражены в таблице 43.

Рис. 193. Допплерограмма кровотока по почечной артерии. Ранний систолический пик обозначен стрелкой.
Допплерограмма кровотока по вене небольшого калибра носит практически постоянный характер, приобретая небольшую фазовую зависимость от дыхания только у вены большого диаметра (рис. 194).
Таблица 43. Значение показателей индекса резистентности в междолевых артериях
в зависимости от возраста [2].
|
Возраст |
ИР |
m ± 2 SD |
|
<20 |
0.567 |
0.523-0.611 |
|
21-30 |
0.573 |
0.528-0.618 |
|
31-40 |
0.588 |
0.546-0.630 |
|
41-50 |
0.618 |
0.561-0.675 |
|
51-60 |
0.688 |
0.603-0.733 |
|
61-70 |
0.732 |
0.649-0.815 |
|
71-80 |
0.781 |
0.707-0.855 |
|
>80 |
0.832 |
|

Рис. 194. Допплерограмма кровотока по правой почечной вене.

Рис. 195. Цветовая допплеровская эхограмма мочевого пузыря в триплексном режиме. Допплерограмма мочеточникового выброса из устья левого мочеточника.
Методика исследования проходимости верхних мочевых путей предусматривает предварительную водную нагрузку. Мочеточниковые выбросы из устьев мочеточников наблюдают в режиме энергетического картирования при традиционном трансабдоминальном сканировании мочевого пузыря. В случае необходимости прибегают к трансректальному сканированию. Особое внимание уделяют выявлению асимметрии мочеточниковых выбросов. Оптимальными условиями для регистрации мочеточниковых выбросов в режиме ЭДК являются средние степени наполнения мочевого пузыря до 150-350 мл. Так как при повышении в мочевом пузыре давления выше нормально допустимого (25-40 см вод. ст.), резко замедляется опорожнение мочеточников. Поэтому при переполнении мочевого пузыря визуализируются очень редкие выбросы в виде «остроконечных пиков» с высоким ускорением, небольшим временем выброса и объемом потока. При анализе допплеровских спектрограмм скоростей потоков мочи в норме они представлены в виде одного, двух или трех пиков. Пики могут быть соединены или разделены (рис. 195).
1.2. УЗ-диагностика заболеваний магистральных почечных сосудов
Известно, что почечные артерии отличаются большим разнообразием по расположению и числу [3,4]. Среди аномалий количества и расположения почечных сосудов выделяют агенезию, гипоплазию, добавочные и множественные почечные артерии Агенезия почечной артерии, как правило, сочетается с агенезией почки и встречается достаточно редко - в 0,001% случаев [5]. При агенезии визуализируется увеличенная в диаметре одна почечная артерия. Гипоплазия почечной артерии сочетается с гипоплазией почки. Наблюдают уменьшение диаметра почечной артерии и ее укорочение, в отличие от почечной артерии при вторичном сморщивании Добавочные почечные артерии могут иметь место в 30-35% случаев [3-
5]. Добавочные почечные артерии чаще кровоснабжают нижний (15,7%), чем верхний (3,8%), сегмент почки По отношению к почечной лоханке они более часто наблюдаются кпереди от нее (12%), чем кзади (5%) [3]. Диаметр добавочной почечной артерии меньше, чем диаметр основного ствола. Основное клиническое значение имеет выявление добавочных почечных артерий, кровоснабжающих нижний сегмент почки, так как они могут спровоцировать обструкцию мочеточника и привести к гидронефрозу Учет количества и уровня отхождения добавочного сосуда также важен у пациентов перед оперативным вмешательством, так как его пересечение может вызвать опасное кровотечение. Двойную почечную артерию диагностируют, когда к почке подходят два одинаковых по диаметру артериальных сосуда (рис. 196). Клиническое значение такое же, как при добавочной почечной артерии. Очень редкий вариант - тройная почечная артерия Множественные почечные артерии наблюдают при подковообразной или дистопированной почке Их число и калибр может варьироваться Чем ниже расположена дистопированная почка, тем больше артерий ее кровоснабжают.

Рис. 196. Цветовая эхограмма брюшного отдела аорты с отходящими от нее почечными артериями. Двустороннее удвоение почечных артерий. Режим трехмерной УЗ-ангиографии (LRA 1,2-левые, RRA - правые почечные артерии)
Множественные почечные вены встречаются значительно реже, чем артерии Чаще наблюдают добавочные правые почечные вены. Ретроаортальная левая почечная вена чаще сочетается с удвоением или добавочными почечными артериями. При выходе из ворот почки она следует косо вниз, позади аорты и впадает в нижнюю полую вену на уровне Il-IV поясничных позвонков. Кольцевидная левая почечная вена встречается в 6-17% случаев, представлена двумя ветвями, «охватывающими» аорту спереди и сзади Передняя левая почечная вена следует как обычно, задняя направляется косо вниз, следует позади аорты и впадает в нижнюю полую вену на уровне IM-IV поясничных
позвонков (рис 197). Экстракавальное впадение левой почечной вены наблюдается крайне редко. При данной аномалии левая почечная вена впадает или в общую подвздошную или в левую полунепарную вену. Вследствие того что давление в этих венах отличается от давления в нижней полой вене то возникает венозная гипертензия
Среди наиболее частых заболеваний почечных сосудов выделяют стеноз почечной артерии, тромбоз почечной вены.
Стеноз почечной артерии развивается вследствие атеросклеротических изменений или фибромышечной дисплазии стенок. Причем если атеросклеротические изменения поражают самые проксимальные части основной почечной артерии, то фибромышечная дисплазия развивается в дистальных отделах основной почечной артерии и сегментарных ветвях. Исследование показателей кровотока при ЦДС в триплексном режиме имеет ряд признаков, которые позволяют достаточно надежно диагностировать стеноз почечных артерий. Вопросы диагностики стеноза почечных артерий с помощью ультразвукового метода широко обсуждают в литературе [6-10]. При этом критерии стенозов разделяют на две группы: проксимальные и дистальные признаки (табл, 44).
К проксимальным относят следующие прямые признаки 1) увеличение пика систолической скорости по почечной артерии выше, чем 150 см/с (рис 198), что свидетельствует о степени стеноза в 50%, а при показателях скорости более 180 см/с уже в 60% и выше; 2) превышение отношения максимальной пиковой систолической J1CK в почечной артерии к аналогичному показателю кровотока в аорте превышает 3.5: 3) наличие турбулентного кровотока в постстенотическом участке почечной артерии, что проявляется в мозаичности рисунка при ЦДК (рис. 199).

Рис. 197. Цветовая эхограмма брюшной аорты. Ретроаортальная левая почечная вена. Режим ЦДК,
Таблица 44. Допплерографические показатели при стенозе почечных артерий.
|
Признаки |
Стеноз <50% |
Стеноз >50% | |
|
1 |
Проксимальные |
|
|
|
|
МСС (см;с) |
>150см/с, до 180см/с |
>180см/с |
|
|
RAR (МСС поч. арт. / МСС в аорте) |
>3,0 |
>3,5 |
|
|
Постстенотическая турбулентность |
+ |
+ |
|
2 |
Дистальные |
|
|
|
|
Конечный систолический пик |
+ |
Отсутствует |
|
|
Время акселерации (ВА) |
N |
>0,07с |
|
|
Индекс акселерации (ИА) |
N |
>30м/с2 |
|
|
Индекс резистентности (ИР) |
N |
<0,5 |
|
|
Различия ИР правой и левой почки |
N |
>5% |

Рис. 198. Цветовое допплеровское сканирование правой почки. Триплексный режим. Стеноз более 60% правой почечной артерии. Режим импульсной допплерографии. Повышение МСС кровотока до 367см/с в месте сужения.

Рис. 200. Схема допплеровского спектра кровотока в почечных артериях на дистальном уровне: а) неизмененный спектр, б) «tardus-parvus» спектр. Обозначения: AI - индекс акселерации, AT - время акселерации, в) Допплерограмма на уровне дистальных отделов почечных артерий при стенозе почечной артерии более 80%. Спектр соответствует кривой типа «tardus-parvus».

Рис. 199. Стеноз правой почечной артерии. Режим ЦДК. Мозаичный кровоток в месте сужения (стрелка).
Дистальная группа признаков, в первую очередь, характеризуется наличием характерной допплеровскои кривой в интраренальных артериальных сосудах - кривой типа «tardus-parvus», для которой характерно отсутствие типичного для нормального почечного кровотока высокого систолического пика и значительное замедление систолического времени ускорения (рис. 200). К другим дистальным признакам стеноза почечных артерий относят наличие разницы в показателях индекса резистентности между обеими почками более чем в 0,05 и снижение индекса резистентности в периферических почечных артериях менее 0,5. Последние два показателя не являются специфическими и могут наблюдаться и при других патологических состояниях, таких как тромбоз почечной вены, хронические диффузные заболевания почек, и других.
Анализ литературных данных и собственный материал позволяет констатировать, что роль допплеровских ультразвуковых методик в диагностике стеноза почечных артерий еще до конца не выяснена. Сегодня можно только согласиться с уже определившимися двумя подходами к выявлению данной патологии с помощью ультразвукового метода: один путь - это применение технологии визуализации непосредственно самих почечных артерий и оценки гемодинамики в устьях артерий; второй - это оценка гемодинамики в интраренальных сосудах.
Аневризма почечной артерии - довольно редкая аномалия. Чаще всего она бывает односторонней и встречается в возрасте 50-70 лет. Характерным признаком можно считать наличие в аневризме обызвествленной стенки, которая хорошо видна при рентгеновском и ультразвуковом исследованиях.
Артерио-венозные фистулы возникают чаще как осложнение после пункционной биопсии. Режим ЦДК значительно помогает в диагностике артериовенозных фистул. Подтверждением их наличия служит мозаичный кровоток, характеризующий увеличение пиковой скорости кровотока в питающей артерии со снижением ИР в диапазоне 0,31-0,50, и пульсирующий характер венозного спектра в дренирующей вене (рис. 201).
Тромбоз почечной вены в 40% случаев развивается на фоне обезвоживания и септицемии у детей [11]. У взрослых он может возникать на фоне нарушения коагуляционных механизмов и при снижении почечного кровотока. Чаще всего он сопровождает такие заболевания, как гломерулонефрит, системная красная волчанка, сахарный диабет, нефротический синдром при выраженном гиповолемическом шоке и после трансплантации почки.
При остром тромбозе возникает общее снижение почечного кровотока, артериальный кровоток лоцируют только на уровне ворот почки. В режиме ЦДК отсутствуют цветовые сигналы в расширенной почечной вене. Наличие венозного кровотока в паренхиме почки еще не исключает возможность тромбоза почечной вены, так как очень быстро могут образовываться венозные коллатерали, особенно у детей, что приводит к восстановлению венозного кровотока в паренхиме почки.

Рис. 201. Цветовая эхограмма левой почки в триплексном режиме: допплеровский спектр кровотока при артериовенозной фистуле. Виден мозаичный кровоток в фистуле.
Нередко может развиваться опухолевый тромбоз почечной вены. При этом в расширенной почечной вене визуализируются эхогенные опухолевые массы. В режиме ЭДК имеется дефект прокрашивания сосуда, в самом тромбе лоцируют мелкие сосуды с артериальным спектром. Опухолевый тромбоз может распространяться вверх по нижней полой вене до правого предсердия. Для полного тромбоза почечной вены характерно снижение диастолического компонента или реверсивный диастолический кровоток на допплерограмме почечной артерии (рис. 202).

Рис. 202. Цветовая эхограмма правой почки в триплексном режиме. Тромбоз правой почечной вены. Допплерограмма кровотока по правой почечной артерии. Повышение ИР до 0,9.

Рис. 203. Эхограмма правой почки. Кистозно-солидный рак правой почки. Методика Dynamic flow. Четко видны мелкие сосуды в перегородках опухоли.
Синдром «аорто-мезентериального пинцета» может возникнуть в редких случаях, когда левая почечная вена может быть сдавлена между аортой и верхней брыжеечной артерией. В этом случае левая почечная вена проксимальнее сдавления будет расширена, причем расширение усугубляется в положении стоя. Для установления данного диагноза было предложено использовать отношение передне-заднего диаметра левой почечной вены на уровне аорто-мезентериального сужения и на уровне ворот. Если данное отношение более 5, то устанавливается диагноз «аорто-мезентериального пинцета» [12].
1.3. Заболевания, затрагивающие паренхиматозные почечные сосуды
При острых воспалительных заболеваниях почек допплерографические проявления зависят не только от того, носит ли процесс диффузный или локальный характер, но также и от преобладающей фазы гиперемии или отека. При выраженной фазе гиперемии наблюдают усиление паренхиматозного кровотока, со снижением индексов периферического сопротивления кровотоку, ИР, тогда как в фазе отека за счет вазоконстрикции отмечают, наоборот, снижение перфузии и увеличение ИР на периферии. При развитии локальных форм могут выявляться зоны со сниженной перфузией. При хронических формах отмечают обеднение коркового кровотока с повышением ИР.
Диагностика опухолей почек и мочеточников с развитием допплеровских технологий и активным внедрением эхоконтрастных препаратов значительно расширила свои возможности. Применение методик ультразвуковой ангиографии существенно помогает в оценке васкуляризации образования и, следовательно, идентификации злокачественного процесса. Для опухолевых сосудов характерно патологическое ветвление, различный калибр, прерывистость, извитость, что может быть отражено при применение трехмерной ультразвуковой ангиографик опухолевых сосудов. ЦДК и допплерография помогают обнаружить характерные для рака артерио-венозные шунты. Для кистозно-солидных опухолей почки характерно присутствие кровотока в перегородках опухоли и в солидном компоненте, что отличает кистозные формы рака от мультилокулярных кист (рис. 203). Для усиления допплеровского сигнала с целью получения дополнительной информации целесообразно проведение динамической эхоконтрастной ангиографии. Она позволяет проследить все фазы прохождения контрастного вещества по сосудам, визуализировать тонкую сеть патологических сосудов в раннюю артериальную фазу, недоступную для визуализации без контрастного усиления (рис. 204). При выявлении объемного образования, подозрительного на злокачественную опухоль необходимо оценить состояние почечной вены, так как нередко развивается ее опухолевый тромбоз.
Большое значение имеет также оценка характера и расположения сосудов почки перед оперативным вмешательством по поводу рака почки. Наш опыт применения 3D виртуальной эхо-ангиографии в клинической практике показал, что можно получать практически сопоставимые с рентгеновской ангиографией ультразвуковые изображения основных почечных сосудов (рис. 205) [13-16]. Так, качество визуализации добавочных почечных сосудов при ультразвуковом исследовании не намного уступает качеству изображений, получаемых при MP-ангиографии. При оценке архитектоники интраренальных сосудов при опухолевом поражении почки новая методика обеспечивает хорошую визуализацию питающего опухоль сосуда и помогает в планировании объема операции.

Рис. 204. Цветовая эхограмма правой почки. Рак правой почки: а) до контраста визуализируется единичный питающий опухоль сосуд (стрелка) в режиме ЭДК, б) эхоконтрастная ангиография в режиме второй гармоники в артериальную фазу контрастирование опухолевых сосудов.
Диагностика причин обструктивных заболеваний почек и мочеточников повысилась с внедрением в практику допплеровских технологий, что позволило проводить не только морфологическую, но и функциональную оценку верхних мочевых путей у пациентов с обструктивными поражениями почек.
Развитие острой обструкции сопровождается значительными гемодинамическими нарушениями. В первые 2-4 часа после приступа наблюдают резкое усиление артериального притока в результате артериолярной дилатации, направленное на поддержание гломерулярной фильтрации. Через 3-5 часов после приступа возникает повышение внутрипочечного сосудистого сопротивления в связи с вазоконстрикторным механизмом. Через 18-24 часов после обструкции наступает значительная вазоконстрикция, которая выражается снижением почечного кровотока.
В последнее время для уточнения степени выраженности и наличия обструкции, стал использоваться допплеровский метод. Повышение сосудистого сопротивления выражается в снижении диастолического компонента на допплерограмме в паренхиматозных сосудах почки и повышении ИР [17] Для диагностики обструкции использовали значение ИР более 0,7 и различия в показателях между здоровой почкой и почкой на стороне обструкции более 0,1 [17-19] Для усиления различий ИР и повышения чувствительности допплеровской методики используют тест с форсированным диурезом или усиленной водной нагрузкой фуросемидом (0,5 мг/кг) [20] Данные результаты работают только при наличии полной обструкции, тогда как при неполной обструкции результаты теста остаются сомнительными. Еще одним фактором, снижающим достоинства допплерографической диагностики обструктивных и необструктивных состояний, является повышение индексов периферического сопротивления в сосудах почки с возрастом, а также необструктивные состояния вызывающие дилатацию чашечно-лоханочной системы (ЧЛС) которые могут сочетаться с обструкцией конкрементом.

Рис 205, Опухоль правой почки больного Н а) режим трехмерной УЗ-ангиографии (основная (1) и добавочные (2) почечные артерии обозначены стрелками), 6) рентгеновская ангиография нижнеполярная артерия (RA2) отходит от поясничного отдела аорты.
Еще один критерий, широко используемый в диагностике обструкций, это отсутствие или изменение характеристик мочеточникового выброса на стороне обструкции.

Рис. 206. Аномалия развитая левой почки. Полное удвоение ЧЛС и мочеточников. Гидронефротическая трансформация нижней половины удвоенной левой почки. Уретровазальный конфликт: а. Ретроградная уретеропиелография сужение в зоне ЛМС нижней половины удвоенной левой почки.
Выброс мочи в мочевой пузырь сопровождается образованием движущегося потока, который может быть зарегистрирован при помощи допплеровских технологий [21] При полной обструкции наблюдают отсутствие мочеточниковых выбросов на стороне поражения, при неполной - выбросы могут быть замедленными или ослабленными в сравнении со здоровой стороной.

Рис. 206. б, Трехмерная УЗ-ангиография с комбинацией проекций MIP и Min. Аберрантная левая почечная артерия, отходящая от левой подвздошной артерии пересекается с мочеточником в зоне ЛМС.
Частой причиной развития хронической обструкции ЧЛС является наличие вазоуретерального конфликта, обусловленного наличием нижнеполярных добавочных сосудов почки, раннего деления почечной артерии, наличие добавочных и множественных почечных артерий и вен Наличие добавочных сосудов почек вначале вызывает периодические нарушения пассажа мочи из лоханки за счет дискинезии лоханочно-мочеточникового сегмента, а затем приводит к его рубцовому поражению вследствие непрерывного давления на него [22], У некоторых пациентов в месте конфликта развивается стриктура мочеточника, которая затем приводит к гидронефрозу (рис, 206) У детей наблюдают вазоренальные конфликты, когда происходит компрессия чашечки проходящим сегментарным сосудом (синдром Фролея).
К диффузным заболеваниям паренхимы почек относят острый и хронический гломерулонефриты, нефросклероз, различные нефропатии, острую и хроническую почечную недостаточность, нефрокальциноз. При ультразвуковой ангиографии при всех заболеваниях данной группы отмечают обеднение сосудистого рисунка, а при допплерографии имеет место повышение индекса периферического сопротивления в аркуатных артериях в то время как в сегментарных и междолевых артериях допплеровские показатели могут не изменяться [23].
При УЗ-исследовании почечного трансплантата в протокол должны входить: оценка зоны анастомоза для исключения сосудистого стеноза, возможных аневризм; оценка хода и состояния почечных артерии и вены, оценка почечного кровотока вплоть до капсулы пересаженной почки. Важна также оценка ИР в интраренальных артериях. В норме значение ИР в сосудах пересаженной почки менее 0,71. с тенденцией к понижению к периферии [24-26]. Определение в зоне анастомоза скорости почечного кровотока свыше 150-200 см/с указывает на признаки стеноза [27] ЭДК оказывает существенную помощь в оценке перфузии почечной паренхимы особенно корковых отделов Например, сопоставляя гемодинамику в отдельных почечных сегментах, можно выявлять зоны со сниженной перфузией [28].

Рис. 206. в. Контрастная MP-ангиография. Подтверждение УЗ-данных.
Чрезвычайно большое значение имеют, по данным В.А. Сандрикова и В И. Садовникова, допплерографические признаки реакции отторжения почечного трансплантата Согласно этим авторам, если ИР больше 0,9 достигает у пациентов с немедленной функцией до 14 суток после пересадки, то это указывает на острую реакцию отторжения [29] У пациентов с отсроченной функцией ИР 0 9-1,0 встречается в первые сутки после операции. Однако уже на 4-6 сутки он обычно снижается вместе с улучшением внутрипочечной динамики. Повторное повышение ИР до 0.9 будет, несомненно, свидетельствовать в пользу острой реакции отторжения. Для дифференциальной диагностики между острым канальцевым некрозом и острой реакцией отторжения авторы используют индекс пульсации, время акселерации, анализ реверсивного кровотока.
Если индекс пульсации более 2,5 реверсивный кровоток второго типа и клубочковая фильтрация более 6,0 мл/мин то имеет место острая реакция отторжения трансплантата [30]. Оценка венозных сосудов помогает в обнаружении венозного тромбоза после пересадки почки. Для хронической реакции отторжения характерно сохранение размеров почечного трансплантата и значительное повышение эхогенности корковых отделов почки При импульсной допплерографии отмечают снижение систолической и диастолической скоростей кровотока, появление реверсивного кровотока в диастолу, снижение ИР [31]. У пациентов с длительно существующим почечным трансплантатом можно наблюдать типичные ультразвуковые признаки хронической почечной недостаточности.
При травмах почек методом выбора считается КТ, однако и при УЗИ очень хорошо могут быть видны подкапсульные гематомы и нарушения целостности почечной паренхимы. Энергетическое картирование помогает в оценке почечной перфузии и определении аваскулярных зон, особенно при поиске сегментарных инфарктов, когда не удается четко дифференцировать сегментарные почечные сосуды.
2. Доплеровские технологии при исследовании мочевого пузыря
Ультразвуковое исследование является оптимальным для оценки состояния мочевого пузыря Оно также может давать важную дополнительную информацию о характере образований и состоянии стенки мочевого пузыря после цистоскопии, урографии, компьютерной томографии
Кровоснабжение мочевого пузыря осуществляется за счет верхних и нижних мочепузырных артерий, являющихся ветвями пупочных артерий и внутренней подвздошной артерии. Дополнительно в кровоснабжении участвуют внутренняя половая, запирательная и средняя прямокишечная артерии. Венозная система представлена мочепузырным сплетением, анастомозирующим с поповым и прямокишечным венозными сплетениями. Также кровь от мочевого пузыря может непосредственно оттекать во внутренние подвздошные вены. Сосуды мочевого пузыря не исследуют.
Опухоли мочевого пузыря по морфологическому строению в 90-95% случаев имеют эпителиальное происхождение. Из них 80-95% приходится на переходно-клеточный рак. 3% - на аденокарциному, 3% - на плоскоклеточный рак, 1 % - на папилломы и 3% - на саркомы [32]. В ранней диагностике и дифференциальной диагностике опухолей мочевого пузыря особое значение приобретает оценка характера васкуляризации образований мочевого пузыря, которая стала возможной с появлением допплеровских методов исследования [33].
Папиллома мочевого пузыря может не проявляться клинически и часто является находкой при ультразвуковом исследовании Папиллома представляет собой полиповидное образование на тонкой ножке локализующееся в пределах слизистой оболочки. При УЗ-ангиографии в папилломе сосуды чаще не определяются или определяется единичный питающий сосуд в основании. При спектральном анализе в опухоли лоцируется преимущественно венозный кровоток.
Злокачественная опухоль может проявляться как локальным так и диффузным утолщением стенки (рис 207) а также иметь вид внутрипросветного образования по типу «цветной капусты». При УЗ-ангиографии отмечают гиперваскуляризацию с наличием множественных разветвленных сосудов Степень васкуляризации усиливается с увеличением размеров опухоли. При спектральном анализе для злокачественных опухолей мочевого пузыря характерно снижение ИР менее 0.5 (рис. 208) Косвенным признаком инвазии опухоли в устья мочеточника является наличие дилатации верхних мочевых путей со стороны пораженного устья Мочеточниковые выбросы могут быть ослаблены отклонены или отсутствовать.

Рис. 207. Эхограмма мочевого пузыря Рак мочевого пузыря Диффузное утолщение стенки, а. Режим ЭДК сосуды опухоли, б. Триплексный режим, ИР в сосудах опухоли 0,49.

Рис. 208 Эхограмма мочевого пузыря б- ного К
а. Методика Dynamic flow Разветвленная питающая сеть сосудов опухоли (стрелки): рак мочевого пузыря по типу «цветной капусты»;
б. Режим триплексного сканирования ИР в сосудах опухоли снижен до 0,46.
3. Допплеровские технологии при исследовании предстательной железы и семенных пузырьков
С появлением таких методик, как цветовое и энергетическое допплеровское картирование тканевая гармоника, трехмерная эхография и трехмерная ангиография эхоконтрастная ангиография, диагностика заболеваний предстательной железы (ПЖ) перешла на новый уровень. С помощью новых ультразвуковых технологий получения изображения ткани предстательной железы и ее сосудистых структур стало возможным осуществлять высокоточную диагностику самых ранних форм заболеваний и вести мониторинг лечения.
Кровоснабжение железы происходит из парных простатических артерий, являющихся ветвями нижнепузырной артерии. Они следуют кпереди от передней фиброзно-мышечнои зоны и образуют на поверхности железы густое сплетение К центральной части железы отходят уретральные артерии, к периферической части - капсулярные (рис 209). В кровоснабжении железы также участвуют парные нижние половые артерии, проходящие в парапростатической клетчатке кзади и латерально от предстательной железы в составе нервно-мышечного пучка. Они дают отдельные веточки, участвующие в кровоснабжении задних отделов железы. Вены формируют сплетения в окружающей парапростатической клетчатке на боковых поверхностях железы
При трансректальном продольном сканировании простатическая артерия определяется над передней фиброзно-мышечной зоной и следует вдоль нее в парапростатической клетчатке. Визуализировать ее на всем протяжении часто бывает затруднительно, вследствие извитого хода. От простатической артерии к центральной части железы отходят уретральные артерии, а к периферической части железы - капсулярные артерии.

Рис. 209. Схема кровоснабжения предстательной железы. Стрелками обозначены: 1 - простатическая артерия. 2 - капсулярные артерии 3 - уретральные артерии.

Рис. 210. Сосудистый рисунок предстательной железы в режиме трехмерной УЗ-ангиографии.
Режим энергетического картирования широко распространен в настоящее время и считается наиболее информативным для визуализации сосудов предстательной железы [34 35]. Он позволяет визуализировать более мелкие сосуды железы и лоцировать капсулярные сосуды периферической зоны, ход которых перпендикулярен ультразвуковому лучу. При трехмерной волю метрической реконструкции в режиме энергетического картирования можно объемно представить ход и взаиморасположение сосудов в паренхиме железы (рис. 210) Распределение сосудов в предстательной железе равномерное, веерообразное. При сравнении сосудистый рисунок правой и левой долей ПЖ на поперечных срезах симметричен и равномерно распределен, что было продемонстрировано в серии экспериментальных работ [36 37].
Результаты исследования гемодинамики в сосудах ПЖ показали, что простатическая артерия имеет высокий, узкий, острый систолический пик и низкоамплитудный пологий диастолический. Значения пиковых скоростей кровотока в простатической артерии в среднем составляют 20,4 см/с (от 16 6 до 24,5 см/с), ИР - 0,92 (от 0,85 до 1,00) [38].
Допплерограммы уретральных и капсулярных артерий сравнимы между собой, имеют среднеамплитудный широкий, острый систолический пик и пологий диастолический Значения пиковых скоростей кровотока и ИР в уретральных и капсулярных артериях схожи и в среднем равны 8,19 ± 1,2 см/с и 0,58 ± 0,09 соответственно Допплерограммы вен предстательной железы не имеют осцилляторных фаз, представляя собой среднеамплитудную прямую. Средняя скорость в венах предстательной железы варьирует от 4 до 27 см/с, составляя в среднем 7,9 см/с.
3.1 Ультразвуковая оценка заболеваний предстательной железы и семенных пузырьков
При остром простатите в равной степени может отмечаться как усиленная, так и сниженная васкуляризация в зависимости от стадии воспалительного процесса. При преобладании фазы гиперемии наблюдается усиление васкуляризации и снижение ИР в сосудах железы, тогда как в фазе отека преобладает снижение васкуляризации и повышение ИР (рис. 211) Значение трансректального УЗИ с новыми технологиями в мониторинге лечения пациентов с простатитом было наглядно показано в ряде работ [39-42] При остром простатите рекомендуют проведение динамического контроля лечения через 2-3 дня с помощью комплексного ТРУЗИ
для определения эффективности проводимой терапии Динамика изменения васкуляризации является индикатором эффекта лечения. При положительном эффекте наблюдается восстановление симметричности сосудистого рисунка, обогащение сосудистого рисунка и усиление перфузии железы (в участках с ранее сниженным кровотоком) или снижение степени васкуляризации в зонах с ранее усиленным кровотоком (рис. 212) При анализе изменений венозного кровотока наблюдают достоверный прирост линейной скорости венозного кровотока в перипростатическом венозном сплетении в среднем на 5 3 ± 2,1 см/с (15%), свидетельствующий об улучшении венозного оттока и, как следствие, о снижении застойных явлений. Аналогичные изменения отмечают в интрапро-статических венах (периуретральных и капсулярных).

Рис. 211. Острый простатит Режим ЭДК. Усиление кровотока в правой доле железы с наличием неизмененного хода сосудов
Методика УЗ-ангиографии позволяет заподозрить на ранних стадиях формирование абсцесса предстательной железы и выявить неэффективность проводимого лечения. В режиме серой шкалы, даже при использовании режима тканевой гармоники, невозможно сразу заподозрить формирование абсцесса.

Рис. 212. Мониторинг лечения острого простатита. Режим трехмерной УЗ-ангиографии с использованием методики Dynamic flow: а) до лечения: кровоток усилен, б) после лечения: снижение степени васкуляризации.
При УЗ-ангиографии данная зона, как правило, аваскулярна или гиповаскулярна. Снижение степени васкуляризации железы или снижение васкуляризации в фокальном очаге при контрольном исследовании также свидетельствует об ухудшении кровоснабжения зоны воспаления и в дальнейшем, при отсутствии корректировки лечения, приводит к формированию абсцесса. При УЗ-ангиографии для абсцесса характерен кровоток по типу «пылающего кольца» (рис. 213).
Везикулит эхографически определяют при резком расширении семенных пузырьков с утолщенными стенками, заполненных анэхогенным содержимым. При УЗ-ангиографии в стенках семенных пузырьков лоцируют усиленный кровоток.
При хроническом простатите анализ васкуляризации с помощью методик УЗ-ангиографии у всех пациентов с преобладанием фиброзных изменений показал локальное снижение васкуляризации в зонах фиброза. В отдельных случаях при длительно существующем хроническом простатите отмечалось общее снижение васкуляризации железы. Показатели пиковых ЛСК и ИР в интрапростатических артериях у пациентов с хроническим простатитом практически не отличались от аналогичных показателей в группе нормы [43].

Рис. 213. Эхограмма предстательной железы. Режим трехмерной УЗ-ангиографии. Сосудистый ободок по периферии абсцесса правой доли ПЖ (показан стрелками).
При доброкачественной гиперплазии предстательной железы сосудистый рисунок значительно изменяется, в основном за счет гиперплазии уретральной группы артерий, что было описано в ряде научных работ [43, 44]. Для
нее характерен гиперпластический тип васкуляризации. Нарушается соотношение степени васкуляризации центральной и периферической частей железы за счет снижения васкуляризации периферической зоны и усиления васкуляризации центральной части
Доброкачественная гиперплазия предстательной железы сопровождается не только качественными, но и количественными изменениями гемодинамики. Она характеризуется повышением пиковых скоростей кровотока в среднем до 14,8 ± 5,2 см/с в уретральных артериях и до 16,8 + 4,3 см/с в капсулярных артериях, ИР до 0,71 ± 0,08 и 0,72 ± 0,09 соответственно, независимо от формы роста аденомы [43].

Рис. 214. Рак предстательной железы: Цветовая эхограмма предстательной железы а) Режим ЭДК. Асимметрия и деформация сосудов в левой доле железы б) Режим трехмерной УЗ-ангиографии. Асимметрия и деформация сосудистого рисунка всей железы.
Рак предстательной железы (РГЖ), по мнению многих исследователей характеризуется гиперваскуляризацией в зоне поражения [45-47] Однако было установлено что гиперваскуляризация не является решающим фактором в его диагностике. При РПЖ одинаково часто встречаются как гиперваскулярные опухоли, так и гиповаскулярные [48 49]. Степень васкуляризации опухоли тесно связана с ее способностью к быстрому росту и метастазированию [50] Изучение ангиоархитектоники и характера сосудистого рисунка является более важным, чем определение степени васкуляризации опухоли Опухолевые сосуды отличаются от нормальных. Для опухолевых сосудов характерно патологическое ветвление, различный калибр извитой ход. слепые карманы вместо концевых артериол [50]. Такой тип сосудистого рисунка получил название «дезорганизованного» Определение характера сосудистого рисунка возможно наиболее полно при использовании методики трехмерной ангиографии [51, 52]. При трехмерной реконструкции сосудов можно точнее оценивать сосудистый рисунок железы в целом, выявлять не только зоны асимметрии сосудистого рисунка, но и выявлять зоны неоваскуляризации, говорить о пространственном распределении сосудов в опухоли. В данном режиме более точно можно провести дифференциальную диагностику различных гипоэхогенных участков в предстательной железе. Это позволяет уже на первом этапе отличить гипоэхогенные участки при остром простатите и раке у пациентов пожилого возраста (рис. 214) Исследование симметричности васкуляризации повышает положительную предсказательную ценность ТРУЗИ в выявлении инфильтрирующих изоэхогенных опухолей и опухолей с нечеткими контурами. При отсутствии локальных изменений в режиме серой шкалы асимметрия сосудистого рисунка, локальное снижение или усиление степени васкуляризации могут оказывать определенную помощь при поиске изоэхогенных опухолей и инфильтративном РПЖ.
4. Ультразвуковые допплеровские технологии при заболеваниях органов мошонки
Ультразвуковое исследование мошонки дает клиницисту существенную, а иногда определяющую диагностическую информацию. С внедрением цветовых допплеровских технологий стало возможным исследовать васкуляризацию и перфузию органов мошонки, что облегчило диагностику перекрута семенного канатика, воспалительных заболеваний мошонки, травмы мошонки и варикоцеле.
Кровоснабжение яичка и придатка осуществляется в основном за счет тестикулярных артерий, берущих свое начало от аорты, ниже уровня отхождения почечных артерий. В кровоснабжении также участвуют артерии семявыносящего протока и кремастерная артерия, анастомозирующие с тестикулярной артерией. Артерия семявыносящего протока является ветвью подчревной артерии, а кремастерная артерия - нижней надчревной артерии. Оболочки яичка получают кровоснабжение из непаренхиматозных ветвей тестикулярных и кремастерных артерий.
Венозный отток осуществляется из гроздьевидного сплетения в парные тестикулярные вены. Левая тестикулярная вена впадает в левую почечную вену, а правая - в нижнюю полую вену на уровне 1-2 поясничных позвонков. Помимо гроздьевидного сплетения имеется также сплетение семявыносящего протока и кремастерное сплетение. Все три сплетения объединены между собой посредством коммуникантных вен. Отток из сплетений семявыносящего протока и кремастерного сплетения может осуществляться непосредственно в систему наружной подвздошной вены или через глубокую нижнюю надчревную вену.

Рис. 215. Трехмерная реконструкция сосудов неизмененного яичка.
Ультразвуковое исследование начинают с оценки паренхиматозного кровотока яичка и придатка. Для этого применяют режимы ЦДК, ЭДК и направленного ЭДК. Сравнивают симметричность степени васкуляризации обоих яичек и придатков. Режим трехмерной ангиографии позволяет наиболее полно представить сосудистый рисунок яичка (рис. 215). Более сложно визуализировать артерии придатка. Для этого используют режим ЭДК. Артерия придатка делится на 2 ветви: переднюю, кровоснабжающую головку придатка и заднюю, несущую
кровь к телу и хвосту Венозный отток осуществляется через центрипетальные и центрифугальные вены. Скорость венозного кровотока в норме столь мала, что вены, как правило, не получают своего отображения в режимах ЦДК и ЭДК. Вены, несущие кровь от яичка, выходят из его средостения и образуют гроздьевидное сплетение, проходящее в семенном канатике. По латеральному контуру яичка, используя режимы ЦДК и ЭК, а также функциональные пробы, можно визуализировать их более отчетливо. В норме при пробе Вальсальвы диаметр вен гроздьевидного сплетения не должен превышать 3 мм.

Рис. 216. Острый правосторонний эпидидимит. Режим ЭДК. Усиление васкуляризации в придатке правого яичка по сравнению с контралатеральным отделом
Капсулярные и паренхиматозные артерии яичка имеют низкорезистентный допплеровский спектр кровотока с высокой диастолической фазой. По данным различных авторов, ИР в интрапаренхиматозных сосудах яичка колеблется в различных возрастных группах. У подростков, не достигших половой зрелости, он выше, достигает 0,87 ± 0,215. В среднем у взрослых пациентов он равен 0.57 ± 0.09 [53]. Его колебания могут быть в пределах от 0.48 до 0,72 [54]. Допплеровский спектр вен представляет собой монофазную прямую
4.1. Ультразвуковая диагностика заболевания органов мошонки
К воспалительным заболеваниям относят эпидидимит, эпидидимоорхит и орхит. При остром эпидидимите в режимах УЗ-ангиографии отмечают гиперваскуляризацию придатка на стороне поражения (рис. 216) Чувствительность признака гиперваскуляризации хвоста в диагностике острого эпидчдимита составляет 91- 100% [55]. Нередко гиперваскуляризация придатка может быть единственным проявлением фокального воспаления, без каких-либо изменений на изображениях в серой шкале. Чем активнее воспаление, тем выраженнее гиперваскуляризация. При допплерографическом анализе сосудов пораженного придатка отмечают усиление ЛСК почти вдвое по сравнению
с нормативными показателями и снижение ИР во внутрияичковых артериях <0 5, в артериях придатка <0,7 [56].
Как осложнение может возникнуть тромбоз вен гроздьевидного сплетения. Клинически по ходу пахового канала пальпируют болезненный плотный тяж, боли иррадиируют вверх по ходу семенного канатика. В режиме серой шкалы по ходу семенного канатика определяют гипоэхогенный тяж. При компрессии не происходит смыкания стенок. В режиме ЭДК при проведении функциональных проб отмечается полное отсутствие венозного кровотока, определяются лишь артериальные сосуды.
Переход воспаления на яичко наблюдают в 20% случаев при остром эпидидимите [57]. При УЗ-ангиографии определяют выраженную гиперваскуляризацию по сравнению с контралатеральным яичком и придатком (рис. 217). Острый орхит как самостоятельное заболевание наблюдают редко, чаще - как осложнение вирусного паротита. Степень васкуляризации воспаленного яичка повышена.
У всех пациентов с воспалительными заболеваниями необходимо проводить динамическое ультразвуковое наблюдение в процессе лечения, для исключения формирования абсцесса. При динамическом наблюдении в процессе лечения целесообразно использовать степень васкуляризации, как критерий эффективности терапии. При положительном эффекте лечения степень васкуляризации постепенно снижается. Появление очагов гипоперфузии может служить ранним, но обратимым при эффективном лечении, признаком формирования абсцесса.
Опухоли яичка составляют от 1 до 3% всех злокачественных новообразований у мужчин [58]. Оценка васкуляризации имеет важное значение в дифференциальной диагностике объемных образований яичек. В отличие от гипоэхогенных участков при воспалительных заболеваниях, при злокачественных опухолях происходит патологическая деформация сосудистого рисунка. Степень васкуляризации опухоли яичка находится в прямой зависимости от ее размеров. С увеличением опухоли более 1,5 см, как правило, наблюдают гиперваскуляризацию. При допплерографическом анализе кровотока в сосудах опухоли имеется тенденция к снижению ИР (рис. 218).

Рис. 217. Острый правосторонний орхит. Режим ЭДК. Усиление васкуляризации в правом яичке по сравнению с контралатеральным отделом (показано стрелками).

Рис. 218. Цветовая эхограмма яичка: а. Режим ЭДК. Гипоэхогенная опухоль с усиленным кровотоком и извитыми сосудами 6. Допплерограмма кровотока по сосудам опухоли (семинома). ИР снижен до 0,47.
При травмах мошонки клиническое исследование затруднено, в связи с резкой болезненностью при пальпации органа. Ультразвуковое исследование является ведущим в определении характера повреждения яичка. Важную роль играет и ультразвуковая ангиография. Критерием разрыва яичка является отсутствие в нем кровотока.
При перекруте семенного канатика в отличие от воспаления наблюдают резкую асимметрию кровотока с частичным или полным его обеднением. В стенке мошонки отмечают реактивную гиперваскуляризацию. На поздних стадиях в результате ишемии возникают четко отграниченные зоны фиброза. В этой зоне кровоток не прослеживают. При сравнении с другим яичком хорошо заметна асимметрия васкуляризации.
Варикоцеле, или варикозное расширение вен семенного канатика, чаще возникает вследствие нарушения оттока крови из левой яичковой вены, вследствие несостоятельности ее клапанов, на фоне тромбоза, стеноза, сдавления левой почечной вены, реже самой тестикулярной вены Сужение левой почечной вены может быть обусловлено ретроаортальным ее расположением, Рубцовым процессом, острым углом отхождения верхней брыжеечной артерии от аорты. Чаще наблюдают слева. При аномалиях впадения правой яичковой вены в правую почечную можно наблюдать правостороннее варикоцеле. В начальной стадии заболевания отмечается расширение вен более 2 мм, которые визуализируются только при натуживании или в вертикальном положении, в горизонтальном положении просвет вен уменьшается. Длительный венозный застой характеризуется массивным расширением вен и приводит к уменьшению размеров яичка, его атрофии.
5. Допплеровские технологии при исследовании сосудов полового члена
В настоящий момент ультразвуковое исследование полностью вытеснило такие методики, как рентгеновскую артериографию и манометрию при исследовании сосудов полового члена. Отсутствие лучевой нагрузки, высокая информативность при использовании высокочастотных датчиков, функциональных и медикаментозных проб, возможность динамической записи ультразвукового исследования обеспечивают несомненный приоритет данной технологии в диагностике патологии сосудов полового члена.
Кровоснабжение полового члена осуществляется за счет парных внутренних половых артерий. Внутренняя половая артерия, отдав несколько ветвей к прямой кишке, мочевому пузырю и промежности, продолжается в общую артерию полового члена. Правая и левая общие артерии полового члена, каждая со своей стороны, дают начало трем ветвям: артерии луковицы полового члена, уретральной артерии, дорсальной артерии и артерии пещеристых тел. Дорсальные артерии питают губчатое тело, головку пениса, подкожные ткани и кожу. Они анастомозируют с артериями пещеристых тел Артерии пещеристых тел расположены центрально в кавернозных телах. Каждая из них дает начало спиральным артериям, проникающим глубоко в пещеристое губчатое вещество пениса и анастомозирующим между собой и другими артериями полового члена.
Венозный отток из губчатого тела осуществляется через дорсальную вену, проходящую в толще губчатого тела. Венозный отток от пещеристых тел осуществляется через вены-эмиссарии, которые перфорируют белочную оболочку и несут кровь в глубокую дорсальную вену проксимально или пещеристые
вены и вены корня пениса в основании полового члена.
Комплексное ультразвуковое исследование включает гемодинамическую и структурную оценку органа до и после проведения фармакологической пробы. Для достижения эрекции используют внутрикавернозное введение 15-60 мг папаверина (возможна комбинация 30 мг папаверина с 1 мг фентоламина) или 1 мг фентоламина или 20 мкг простагландина Е1. Кроме того, возможно применение современных форм простагландина Е1 - «Каверджет», «Альпростадил», «Эдекс». Допплерометрию кавернозных артерий проводят при продольном сканировании в области корня полового члена, в различные фазы эрекции, для получения адекватных допплеровских характеристик (дистальнее ход кавернозных артерий перпендикулярен УЗ-лучу). Выделяют 5 фаз эрекции: нулевую - покоя, далее - наполнения, набухания, полной эрекции, ригидную и детумесценции.

Рис. 219. Эхограммы полового члена. Режим ЭДК.
а. Поперечный срез полового члена. Стрелками обозначены: 1 - кавернозные артерии, 2 - дорсальная вена, 3 - дорсальные артерии.
б. Продольный срез полового члена. Кавернозная артерия и спиралевидные артерии в фазе наполнения.
Фаза покоя характеризуется тем, что в невозбужденном состоянии диаметр кавернозных артерий очень мал для измерения (менее 0,3 мм) до 1 мм, в среднем 0,3-0,5 мм. В невозбужденном состоянии иногда кровоток в этих артериях может не выявляться, но чаще он присутствует, при этом максимальная ЛСК достигает 5-10 см/с, венозный компонент отсутствует. ИР равен 1,0. В фазу наполнения наблюдают увеличение диаметра пещеристых артерий на 70% и ускорение кровотока, гладкие мышцы синусоидов расслабляются, в результате этого обеспечивается быстрое заполнение кровью пещеристых кавернозных тел и их дилатация. В режиме ЭДК улучшается визуализация кавернозных артерий и появляются спиралевидные артерии (рис. 219). Максимальная ЛСК в норме увеличивается более 35 см/с, хотя возможны колебания от 19 до 120 см/с [59]. ЛСК в дорсальной артерии также увеличивается в 2 раза и достигает значений 45 см/с. Диастолический компонент не превышает 10 см/с (рис. 220). В следующую - фазу набухания - расширенные кавернозные тела вызывают компрессию эмиссарных вен между расширенными кавернозными телами и белочной оболочкой, тем самым, препятствуя оттоку крови из пениса и поддерживая эрекцию. Диаметр кавернозной артерии уменьшается, снижается диастолический компонент. Спиральные
артерии хорошо видны на всем протяжении. возможно построение трехмерных ангиограмм сосудов полового члена (рис. 221), Максимальная скорость кровотока может незначительно увеличиваться, диастолический компонент снижается. В фазу полной эрекции продолжается приток крови, отсутствует венозный отток и растет внутрикавернозное давление. В денную фазу скорость кровотока в кавернозных артериях максимальная. В эту фазу проводят измерение кровотока в венах для исключения венозной несостоятельности. Венозный компонент отсутствует или может быть ретроградным (рис 222). Спиралевидные артерии за счет сдавления визуализируются хуже, чем при ранних стадиях. В ригидную фазу объем полового члена остается постоянным на протяжении всей фазы. По достижении конечной фазы кровоток и диаметр артерии самые минимальные Приток крови, как и отток, отсутствуют. Диаметр кавернозных артерий минимальный. Кровоток в кавернозных артериях может не выявляться или резко снижаться Венозного оттока нет. В фазу детумесценции ригидность полового члена снижаетсяПадает внутрикавернозное давление Гладкая мускулатура сокращается, обеспечивая открытие венэмиссариев. Нарастает венозный отток Наблюдают незначительный артериальный компонент кровотока и повышение диастолической фазы, усиление кровотока по дорсальной вене.

Рис. 220. Эхограмма полового члена в триплексном режиме. Допплерограмма кровотока по кавернозной артерии в фазе наполнения

Рис. 221. Трехмерная УЗ-ангиограмма сосудов полового члена. Аномалия развития. Двухстороннее удвоение кавернозных артерий (показано стрелками).

Рис. 222. Эхограмма полового члена в триплексном режиме Допплерограмма кровотока по кавернозной артерии в фазе полной эрекции.
Васкулогенная эректильная дисфункция характеризуется отсутствием эрекции или поддержанием ее на адекватном уровне Сосудистый генез импотенции является одним из ведущих. Диагностика сосудистых изменений важна для пациентов с возможной хирургической коррекцией этой патологии. К примеру, изолированная сегментарная окклюзия артерии полового члена или нормальные артерии пениса при венозной несостоятельности. Показаниями к проведению УЗИ являются неврогенная или психогенная эректильная дисфункция артериогенная, веногенная, смешанная эректильная дисфункция, болезнь Пейрони, кавернозный фиброз, приапизм, опухоли, травмы, послеоперационные, воспалительные поражения.
Артериогенная эректильная дисфункция заключается в снижении артериального притока крови к половому члену и кавернозным телам. Причинами артериогенной эректильной дисфункции могут быть в 83% случаев анатомические аномалии полового члена, а также аномалии сосудистого русла, травматические повреждения артериального русла, наличие тромбоза, окклюзии или атеросклероза аорты, артерий малого таза и полового члена. Основным допплерографическим признаком артериогенной эректильной дисфункции является снижение максимальной систолической скорости кровотока в кавернозных артериях менее 25 см/с. При использовании режима энергетического картирования при окклюзии, тромбозе или атеросклерозе артерий полового члена или кавернозных артерий отмечают их извитость, прерывистость, неполную частичную визуализацию в дистальном отделе, коллатерали с дорсальной артерией и контрлатеральной артерией. При фармакопробе отмечают нарушение фаз эрекции, укорочение или удлинение времени реакции на фармакопробу или ее полное отсутствие.
Веногенная эректильная дисфункция сопровождается повышенным венозным оттоком из кавернозных тел полового члена. При этом артериальный приток полноценный. Нарушение веноокклюзионного механизма связано с недостаточным расслаблением гладкой мускулатуры кавернозных тел, травмами, снижением эластичности кавернозных тел. При повышении диастолической фазы кровотока более 10 см/с, а по некоторым данным и более 3—5 см/с, диагностируют венозную несостоятельность в 80% случаев [60, 61]. Другим критерием является сохранение постоянного ИР через 10 минут после инъекции фармпрепарата, что также свидетельствует о венозной несостоятельности [62]. С помощью высокочувствительного допплера возможна непосредственная визуализация венозного оттока, усиливающаяся при проведении пробы с натуживанием (рис. 223). Отмечено сочетание венозной эректильной дисфункции и варикозного расширения вен нижних конечностей [63].

Рис. 223. Цветовая эхограмма полового члена в поперечном срезе. Методика Dynamic flow. Венозный сброс при веногенной эректильной дисфункции.
Болезнь Пейрони, или фибропластическая индурация пениса, характеризуется локальным или диффузным утолщением белочной оболочки пещеристых тел полового члена за счет появления фиброзных бляшек [64]. Возможно развитие кальцификации в бляшках. За счет этого возможно искривление полового члена, болезненность во время эрекции, нарушения гемодинамики и иннервации. Все это приводит к эректильной дисфункции, механизм которой может быть смешанным, артериогенным, веногенным, психогенным [65].
При кавернозном фиброзе нарушается эластичность синусоидов пещеристых тел в результате замещения рубцовой тканью. К этому состоянию могут приводить травмы, сахарный диабет, ятрогенные повреждения и др. В режиме серой шкалы в пещеристых телах определяются участки повышенной эхогенности лучше визуализирующиеся при фармакопробе.
Таким образом, завершая знакомство с разделом, описывающим применения новейших допплеровских технологий в уронефрологии, читатель может убедиться в их большой как диагностической, так и лечебно-профилактической значимости. Используемые технологии являются передним краем развития современных ультразвуковых методов диагностики, они продолжают непрерывно развиваться и совершенствоваться, пополняясь новыми техническими приемами и методиками что делает процесс их освоения особенно привлекательным и интересным как для молодых так и для опытных специалистов ультразвуковой диагностики.
ГЛАВА 15
ЦВЕТОВАЯ ДОППЛЕРОВСКАЯ СОНОГРАФИЯ В ГИНЕКОЛОГИИ
В последние годы в комплексе средств, которые используют для диагностики заболеваний внутренних половых органов (ВПО) у женщин, особенно в онкогинекологии. одно из заметных мест начинает занимать метод цветовой допплеровской сонографии (ЦДС). Этот метод позволяет по- новому подойти к решению старых проблем с позиций оценки органного и внутриопухолевого кровотока. В настоящее время проблема ранней диагностики рака внутренних половых органов по-прежнему остается одной из наиболее важных и наименее решенных проблем. Во всем мире сохраняются высокие показатели смертности от этого заболевания, при этом ни один из существующих доступных аппаратных диагностических методов не позволяет с высокой эффективностью выявлять ранние стадии злокачественного процесса.
С начала внедрения в середине 80-х годов в клиническую практику трансвагинальной эхографии накоплен положительный опыт, свидетельствующий о большом значении этого метода для дифференциальной диагностики доброкачественных и злокачественных новообразований ВПО. Все исследователи [1-3] отметили значительные его преимущества над трансабдоминальным сканированием. Эхография является эффективным методом обнаружения новообразований, оценки их строения. Однако при выявлении злокачественного процесса на ранних стадиях точность этого метода остается невысокой: чувствительность составляет в среднем 60-70%, а специфичность - 70-80% [4-8]. Стало очевидным, что на настоящем этапе эхография в диагностике ранних форм рака ВПО подошла к определенному рубежу, уступая первенство другой диагностической технологии - цветовой допплеровской сонографии Подобное заключение базируется на способности метода ЦДС выявлять как допплерографические характеристики потоков в кровеносных сосудах, так и показатели скоростей в них при изменениях, характерных для ранних форм рака. Для обоснования этого тезиса есть два важных аргумента.
Первый - в настоящее время доказана возможность выявления неоваскуляризации при таких физиологических процессах, как формирование желтого тела и трофобласта (рис. 224). Хорошо известно, что в основе этих процессов лежит выраженная пролиферативная активность тека-лютеиновых клеток и клеток трофобласта [9], ЦДС - настолько чувствительный метод, что позволяет выявлять сопровождающие пролиферацию сосудистые изменения уже на самых ранних стадиях.
Второй аргумент - в 1999 году группа исследователей во главе с Murray опубликовали в журнале «Seminars in Reproductive Endocrinology» одно из интереснейших сообщений последнего времени: экспериментальные данные показали, что механизмы имплантации эмбриона и инвазии раковой опухоли имеют схожий характер. К сказанному следует добавить то, что современные патоморфологии уже давно нашли связь клеточной пролиферации с ангиогенезом - развитием новых сосудов. Результаты их исследований обнаруживают тонкостенные сосуды в 100% случаев при росте опухоли, обусловленном активной пролиферацией клеток, в 20-30% в опухолях с медленным ростом и никогда при регрессе опухоли [10].
Таким образом, возможности ЦДС в онкогинекологии определяются способностью современной аппаратуры локализовать такие сосуды и произвести в них измерение кровотока. Однако следует добавить, что подобные, но еще недостаточно полно изученные процессы ангиогенеза и, следовательно, схожие показатели сосудистого импеданса могут иметь место в участках деструктивно измененных тканей доброкачественных опухолей. Поэтому кровоток с низкими значениями индекса периферического сопротивления, более известного как индекс резистивности (ИР), можно обнаружить не только в злокачественных, но и в части доброкачественных новообразований [11].
Тем не менее и у этого метода уже появились свои внутренние проблемы, которые можно было бы в целом охарактеризовать как болезнь роста. Так, А. Kurjak et al. [12] утверждает, что в диагностике рака яичников при использовании ЦДС чувствительность и специфичность достигают 100%. Парадоксально, но в оценке этой же патологии при использовании подобной диагностической аппаратуры у других врачей получены иные результаты. Например, у В. Leeners et al. [8] чувствительность и специфичность составили уже 74,2% и 57,5% соответственно. Третья группа авторов [13-15] пишет о том, что ЦДС не внесла практически ничего нового в существующую систему обследования, а низкие результаты являются следствием погрешности самой методики.
Прежде всего, следует отмести упреки в адрес допплеровской сонографии о ее несостоятельности, поскольку многочисленные и многолетние исследования доказали, что эта методика сегодня по праву является одной из ведущих в неинвазивной оценке кровотока у человека. Существующие в литературе противоречия можно объяснить многими причинами:
- Отсутствием целостного представления о гемодинамике во внутренних половых органах у женщин разного возраста в норме и при наличии в них различных доброкачественных и злокачественных процессов [16-20].

Рис. 224. Трансвагинальное сканирование. Допплерограмма желтого тела (1) и плодовместилища (2) при сроке беременности 5,5 нед.
- Разным практическим опытом исследователей и количеством проведенных исследований [21, 22].
- «Погрешностями измерений. Так, A. Tekay и Р. Jouppila [23] показали, что при измерении у одних и тех же больных разными исследователями разброс цифровых значений пульсационного индекса достигал 15-25%, индекса резистентности -13-18% пиковой систолической скорости - 17-28% а средней скорости - 23-33%
- Смешиванием результатов, полученных при анализе внутриопухолевого кровотока опухолей различной морфологии и размеров [16-20, 24]
- Сопоставлением показателей внутриопухолевого кровотока без учета фазы менструального цикла при обследовании женщин репродуктивного возраста [25], а также исследованием кровотока в маточных трубах, которые ошибочно принимали за сосуды яичника [26].

- Неучтенным приемом гормональных препаратов (для пациенток в постменопаузе) и гипотензивных средств [27, 28].

Рис. 225 а. Схема кровоснабжения внутренних половых органов женщины 1 - аорта 2 - левые яичниковые артерия и вена, 3 - нижняя полая вена 4 - правые яичниковые артерия и вены 5 - левые общие подвздошные артерия и вена, 6 - фаллопиева труба 7 - левые наружные подвздошные артерия и вена, 8 - левые внутренние подвздошные артерия и вена 9 -маточная вена 10 - яичниковая ветвь маточной вены, 11 - аркуатные вены 12 — маточная ветвь маточной вены 13 - влагалищная ветвь маточкой вены б. Полусхема внутренних половых органов женщины.
Таблица 45. Стандартная настройка прибора при изучении кровотока в маточных артериях.
|
Параметры |
Уровень |
|
Выходная акустическая мощность |
50 мВт/см2 |
|
Частота повторения импульсов (PRF) |
от 3 до 5 KHz |
|
Размеры окна опроса |
Минимальные |
|
Размеры пробного объема |
3-4 мм |
|
Угол инсонации |
60 градусов |
|
Оптимизация изображения кровотока |
Средний |
|
Плотность цветовых линии |
Средний |
|
Фильтр колебаний стенки |
Средний |
|
Приоритет цвета |
Средний |
|
Уровень приема сигналов |
Максимальный |
Таблица 46. Стандартная настройка прибора при изучении кровотока во внутриматочных внутрияичниковых и внутриопухолевых сосудах.
|
Параметры |
Уровень |
|
Выходная акустическая мощность |
50 мВт/см2 |
|
Частота повторения импульсов (PRF) |
от 700 до 1000 Hz |
|
Размеры окна опроса |
Минимальные |
|
Размеры пробного объема |
Минимальный |
|
Оптимизация изображения кровотока |
Максимальный |
|
Плотность цветовых линий |
Максимальный |
|
Фильтр колебании стенки |
Минимальный |
|
Приоритет цвета |
Максимальный |
|
Уровень приема сигналов |
Максимальный |
- Некорректным сопоставлением результатов трансабдоминальных и трансвагинальных исследований [12].
- Различием в настройке и качестве ультразвуковой техники [29],
При внимательном рассмотрении всех представленных выше данных становится очевидным, что главной причиной разногласий является отсутствие жестких стандартов, договоренностей, определяющих все детали исследования - кого и когда обследовать, что сравнивать и по каким критериям, при каких параметрах настройки приборов и т. д.
Известно, что неадекватная настройка прибора может серьезно повлиять на результаты исследования. Очевидно, что ультразвуковая диагностика представляет собой устойчивый «симбиоз» врача и ультразвукового прибора; нет ультразвуковых диагностических систем которые автоматически обследовали бы больных как и нет врача УЗД, который может что-либо сделать без ультразвукового прибора. Тем не менее обе стороны в равной степени могут быть не подготовлены к выполнению определенных задач. Внедрение ЦДС в клиническую практику оказалось столь стремительным, что опередило своевременную подготовку специалистов. Анкетирование курсантов, проведенное во время одного из циклов тематического усовершенствования, показало, что только 15% из них полностью ответили на вопросы по основам допплерографии. Очевидно, что врачи в ближайшее время начнут активно работать с допплерографическими приборами и важно, чтобы свою работу они начинали с унифицированной стандартизованной методики обследования и применения единой терминологии.
Таким образом решение всех перечисленных проблем вращается вокруг необходимости применения единого алгоритма, направляющего исследование врача и определяющего оптимальную настройку прибора Фундаментом исследования должны стать стандартизованные нормативы которые мы рекомендуем использовать для настройки прибора при исследовании кровотока по сосудам ВПО женщины (табл 45 46).
1. Кровоснабжение и венозный дренаж внутренних половых органов женщины
В целом, сосудистая анатомия малого таза женщины относительно постоянна (рис. 225. 226). Однако размер сосуда и характер кровотока в нем могут изменяться в зависимости от возраста репродуктивного состояния и перенесенных заболеваний.
Кровоснабжение матки осуществляется маточными артериями - короткими, но крупными ветвями внутренних подвздошных артерий. Маточные артерии достигают перешейка матки через кардинальную связку где идут в сопровождении сплетения маточных вен Проксимальный участок артерий прямой, тогда как дистальный, располагающийся в параметрии и по боковому краю матки, извилист. На уровне перешейка маточные артерии делятся на восходящие и нисходящие ветви. Нисходящие ветви дают начало множеству мелких сосудов к шейке где они анастомозируют с сосудами влагалища Часто влагалищные ветви берут начало непосредственно от маточных артерий, однако иногда они могут исходить из нижней пузырной артерии или непосредственно из внутренней подвздошной. Венозный отток осуществляется по одноименным венам Влагалищные и маточные венозные сплетения располагаются с каждой стороны органа и. соединяясь между собой впадают в маточную вену, затем внутреннюю и общую подвздошную вены.

Рис. 226. Схема кровоснабжения матки.
Восходящие артерии в сопровождении одноименных вен поднимаются по боковому краю тела матки, отдавая в области дна ветви к яичнику и трубе Восходящая маточная артерия, проникая в толщу миометрия на границе внутреннего и среднего слоев, образует аркуатные, продолжающиеся в радиальные артерии, которые проникают глубоко в средний и внутренний слои миометрия Непосредственно перед эндометрием они делятся на два вида артериол. Прямые артериолы снабжают базальный слой эндометрия, а спиральные - функциональный слои Последние заметно измененяются в течение менструального цикла.
1.1. Ультразвуковая методика исследования кровеносных сосудов матки
Для изучения состояния гемодинамики внутренних половых органов женщины предпочтителен трансвагинальный доступ при комплексном использовании цветового и спектрального допплеровских режимов.
Допплерометрию проводят после визуальной оценки состояния сосуда, при этом следует стремиться к тому, чтобы на экране были зарегистрированы не менее пяти одинаковых максимально четких и ровных допплерограмм кровотока одного направления.
Наиболее целесообразно рассчитывать пиковую (максимальную) систолическую скорость кровотока (ПСС или PSV), минимальную диастолическую скорость (МДС или MDV), индекс резистентности (ИР или RI), индекс пульсации (ИП или PI). Учитывая многочисленные данные литературы (обзор А. Tekay и P. Jouppila) [23] о том, что разброс цифровых значений при измерении пульсационного индекса и средней скорости может достигать 25-33%, мы воздерживаемся от их применения.
Поскольку венозный кровоток вариабелен по амплитудным характеристикам, целесообразно оценивать лишь его максимальную скорость за сердечный цикл и такие качественные спектральные параметры, как фазность и синхронизацию с актом дыхания.
При изучении кровотока по внутриматочным ветвям маточных артерий и венам обычно выделяют следующие зоны: бассейн сосудов аркуатного сплетения (зона I), бассейн радиальных сосудов (зона II), бассейн базальных и спиральных сосудов (зона III), интраэндометриальный кровоток (зона IV), бассейн сосудов стромы шейки матки (зона V), бассейн субэндоцервикальных сосудов (зона VI), интраэндоцервикальный кровоток (зона VII).
При ЦДС эндометрия необходимо учитывать то, что в фазу ранней пролиферации спиральные сосуды отсутствуют, поскольку они формируются из базального слоя только в середине цикла [30]. Тогда как во второй фазе менструального цикла наличие развитых спиральных сосудов в функциональном слое эндометрия считают одним из обязательных и наиболее достоверных признаков, определяющих полноценный прогестероновый эффект, а их отсутствие в секреторной фазе расценивают как проявление слабой функции желтого тела. Поэтому важнейшим условием стандартизованных исследований является оценка эндометрия только на 5-7 дни цикла - в фазу ранней пролиферации, когда фактически нет ни функционального слоя, ни спиральных сосудов.
Оценку овариального кровообращения проводят в стромальных сосудах.
ЦДС патологических структур в матке или яичниках начинают с локализации и оценки количества внутриопухолевых кровеносных сосудов. В связи с тем, что в «пробный объем» одновременно могут попадать несколько мелких сосудов с разнонаправленным кровотоком, то при описании цветовых эхограмм следует отдавать предпочтение термину «цветовой локус» (ЦП) Изучают максимально возможное количество ЦЛ с определением характера кровотока (артериальный или венозный) и мультилокусного обязательного анализа кровотока в двух типах локусов - 1) с максимальной скоростью и 2) минимальным периферическим сопротивлением.
Допплерометрические показатели внутриопухолевого кровотока в преимущественно эхонегативных новообразованиях анализируют по контуру опухоли, во внутренних линейных эхогенных включениях (перегородках) и внутренних включениях округлой и неправильной формы (папиллярных разрастаниях). В новообразованиях, преимущественно эхопозитивных допплерометрические показатели регистрируют по контуру опухоли, а также в периферической и центральной части опухоли. Границу периферической и центральной части преимущественно эхопозитивных новообразований определяют примерно на расстоянии половины радиуса опухоли.
2. Стандартизованные допплерографические нормативы гемодинамики внутренних половых органов женщины
Кровоток у женщин репродуктивного возраста изучен в настоящее время достаточно хорошо. Тем не менее целесообразно уточнить ряд параметров кровоснабжения внутренних половых органов.
Визуализация внутренних подвздошных артерий и вен возможна в 100% наблюдений. Расположенные ретроперитонеально, они определяются при продольном сканировании выше и латеральнее яичников в виде гипоэхогенных линейных структур, ограниченных сосудистой стенкой, имеющей высокую эхогенность. Для диаметра артерий характерна небольшая вариабельность - от 5 до 6 мм. Диаметр вен в среднем составляет 11,1 ± 0,87 мм. При использовании режима ЦДК просвет сосудов равномерно прокрашен. Исследование артерий в спектральном допплеровском режиме позволяет получить допплерограммы, характерные для сосудов с высоким периферическим сопротивлением. При исследовании вен регистрируется трехфазный кровоток, синхронизированный с актом дыхания. Среднее значение пиковой скорости кровотока по внутренней подвздошной артерии составляет справа 20,3 ± 7,2 см/с (диапазон 15-35 см/с) и слева 18,8 ± 8,3 см/с (диапазон 12^0 см/с).
По сравнению с внутренними подвздошными, маточные артерии и вены имеют меньший диаметр, извитой ход и более выраженную вариабельность локализации. Поэтому визуализация и идентификация их в течение ультразвукового исследования может быть затруднена. Наиболее четкое изображение маточных сосудов можно получить при поперечном сканировании на уровне внутреннего зева латеральнее маточно-влагалищного сосудистого сплетения. Визуализация маточных сосудов значительно упрощается при использовании 3D технологии.
В репродуктивном возрасте качественные и количественные параметры кровотока изменяются в зависимости от фазы менструального цикла. Так, в течение овуляторного цикла имеется статистически достоверное увеличение перфузии матки к началу второй фазы цикла. Этот процесс характеризуется увеличением пиковой систолической скорости от 40 см/с в средней стадии фолликулярной фазы до 50 см/с в средней стадии лютеиновой фазы. При этом значение индекса периферического сопротивления снижается от 0,9 в середине первой фазы до 0,7 в середине второй фазы менструального цикла. Подобная модель изменений имеет место во всех ветвях маточных артерий.
Кроме того, по мере деления сосудов на более мелкие ветви скорость кровотока и ИР снижаются (табл. 47).
Таблица 47. Допплерографические характеристики артериального кровотока в матке у женщин репродуктивного возраста (5-7 дни цикла).
|
|
ПСС (см/с) |
ИР | ||
|
|
M±SD |
Колебания |
M±SD |
Колебания |
|
Маточная артерия восх. |
44,4 ± 13,3 |
14-50 |
0,87 ± 0,12 |
0,65-0,98 |
|
зона I |
34,4 ± 12,6 |
29-39 |
0,83 ± 0,03 |
0,79-0,87 |
|
зона II |
12,8 ± 3,1 |
8-18 |
0,78 ± 0,07 |
0,67-0,91 |
|
зона III |
7,5 ± 1,9 |
5-11 |
0,55 ± 0,08 |
0,5-0,72 |
|
зона IV |
- |
- |
- |
- |
|
Маточная артерия нисх. |
21,6 ± 4,9 |
18-26 |
0,77 ± 0,09 |
0,5-0,77 |
|
зона V |
15,1 ±4,3 |
12-18 |
0,65 ± 0,08 |
0,5-0,82 |
|
зона VI |
6,3 ± 1,6 |
5-10 |
0,6 ± 0,06 |
0,5-0,78 |
|
зона VII |
- |
- |
- |
- |
Своеобразная мелкоячеистая структура матки в В-режиме отражает наличие большого количества кровеносных сосудов в миометрии, которые четко определяются при использовании цветового режима. Следует иметь в виду, что эхографическое изображение структуры миометрия и внутриматочных кровеносных сосудов во многом определяется контрактильной активностью матки.
При продольном исследовании матки аркуатные сосуды эхографически визуализируют как линейные структуры во внешнем слое миометрия, следующие параллельно наружному контуру органа, причем при динамическом наблюдении в различные фазы цикла диаметр их изменяется от 3 мм в I фазе до 1-2 мм во Il фазе цикла. Наиболее четкое их изображение может быть получено в фазе пролиферации, особенно трудно визуализировать внутри- маточные сосуды непосредственно до и во время менструации. Некоторое сужение сосудов в позднюю лютеиновую фазу, а затем их дилятация в фолликулярную фазу обусловлены как циклическим действием эстрогенов, так и сократительной активностью матки.
В наших исследованиях ни у одной из обследованных здоровых женщин репродуктивного возраста не был выявлен внутриэндометриальный (зона IV) и внутриэндоцервикальный (зона VII) кровоток.
В постменопаузе (ПМП), в связи с уменьшением перфузии органа по мере увеличения длительности постменопаузального периода, кровоток в маточных артериях и их ветвях претерпевает значительные изменения (табл. 48, 49).
В отличие от артериального звена, не выявлено достоверного (р>0,05) изменения скоростей венозного кровотока в аркуатных и радиальных сосудах миометрия, как в течение менструального цикла, так и по мере увеличения длительности постменопаузального периода (табл. 50).
Следует отметить, что осмотр области придатков матки в режиме ЦДК может испугать не только новичков обилием разнообразных сосудов.
Таблица 48. Средние значения показателей гемодинамики в маточных артериях у здоровых женщин в зависимости от длительности постменопаузы.
|
Длительность |
ПСС (см/с) |
МДС (см/с) |
ИП |
ИР |
|
постменопаузы |
|
|
|
|
|
До 5 лет |
47,05 ± 19,2 |
11,7 ± 4,3 |
2,01 ± 0,12 |
0,79 ± 0,05 |
|
6-10 лет |
42,4 ± 6,1 |
8,65 ± 1,3 |
2,54 ± 0,2 |
0,85 ± 0,01 |
|
11-20 лет |
32,7 ± 8,7 |
7,45 ± 0,4 |
2,78 ± 0,6 |
0,89 ± 0,03 |
|
Более 20 лет |
26,7 ± 0,14 |
2,89 ± 0,12 |
3,3 ± 0,4 |
0,9 ± 0,01 |
Таблица 49. Показатели гемодинамики по внутриматочным артериям в зависимости от длительности постменопаузы.
|
Показатели |
До 5 лет ПМП |
6-10 лет ПМП |
11-20 лет ПМП |
Более 20 лет ПМП |
|
Аркуатные артерии ПСС (см/с) |
21,9 ±4,1 |
20,7 ± 2,5 |
18,6 ± 2,7 |
14,9 ± 1,8 |
|
МДС (см/с) |
4,4 ± 0,98 |
3,6 ±0,5 |
3,25 ± 0,4 |
3,0 ± 0,1 |
|
ИП |
1,52 ± 0,87 |
2,4 + 0,3 |
2,5 ± 0,7 |
2,72 ± 0,16 |
|
ИР |
0,68 ± 0,01 |
0,78 ±0,18 |
0,85 ± 0,09 |
0,92 ± 0,09 |
|
Радиальные артерии ПСС (см/с) |
11,7 ± 2,1 |
10,7 ± 2,1 |
9,2 ± 4,8 |
4,9 ± 0,52 |
|
МДС (см/с) |
2,4 ± 0,7 |
2,01 ± 0,9 |
1,06 ± 0,8 |
1,04 ± 0,15 |
|
ИП |
1,3 ± 0,3 |
2,2 ± 1,06 |
2,31 ± 0,26 |
2,4 ± 0,13 |
|
ИР |
0,62 ± 0,24 |
0,76 ± 0,06 |
0,81 ± 0,12 |
0,88 ± 0,05 |
|
Базальные артерии ПСС(см/с) |
8,5 ± 1,2 |
5,3 ± 0,4 |
3,8 ± 0,19 |
Не определяют |
|
МДС (см/с) |
1,3 ±0,8 |
1,1 ± 0,07 |
0,9 ± 0,6 | |
|
ИП |
1,2 + 0,4 |
1,66 ± 0,14 |
1,91 ± 0,2 | |
|
ИР |
0,59 ±0,18 |
0,69 ± 0,16 |
0,79 ± 0,18 |
Таблица 50. Показатели внутриматочной венозной гемодинамики в различные возрастные периоды.
|
Возрастные периоды |
Показатели ЛСК в венах (см/с) | ||
|
Аркуатные Радиальные |
Базальные | ||
|
Репродуктивный возраст и ПМП до 5 лет |
5,87 ± 3,41 |
3,6 ± 0,5 |
1,07 ±0,02 |
|
6-10 лет ПМП |
5,85 ±2,6 |
3,4 + 0,7 |
1,1 ±0,04 |
|
11-20 лет ПМП |
6,05 ± 2,9 |
3,65 ± 0,6 |
1,01 ±0,07 |
|
Более 20 лет ПМП |
6,0 + 2,5 |
3,9 + 0,9 |
Не определяются |
Действительно, в этой зоне располагаются многочисленные ветви маточных и яичниковых артерий и вен, подвздошные сосуды. Без внимательного и подчас длительного сканирования трудно ответить, какой из перечисленных выше сосудов представлен на экране. Так, сложно уверенно идентифицировать яичниковую артерию даже в области ворот. Как показали проведенные исследования, репрезентативная оценка этих сосудов оказалась практически невозможной, и мы не делаем акцента на необходимости их поиска, рекомендуя заниматься изучением внутрияичникового (стромального) кровотока.
У женщин репродуктивного возраста кровоток внутри яичников характеризуется относительно низкими пиковыми скоростями (от 6 до 15 см/с) и относительно низким сосудистым сопротивлением (0.49-0.65),
Если гемодинамика в неизмененных яичниках у женщин репродуктивного периода изучена всесторонне то кровоток в яичниках женщин постменопаузального возраста по нашему мнению, изучен недостаточно и требует уточнения отдельных показателей.

Рис 227. Трансвагинальное цветовое дуплексное сканирование в триплексном режиме. Двухфазный кровоток в вене ворот яичника
Принимая во внимание тот факт, что у женщин в постменопаузе уровень перфузии яичников снижается, что, в частности, обусловлено прекращением продукции вырабатываемых фолликулами и желтым телом факторов ангиогенеза (фактор роста фибробластов фактор роста сосудистого эндотелия) [31], то идентификация сосудов во многом зависит от разрешающей способности используемой ультразвуковой аппаратуры и выбранного режима исследования Так, при применении технологии энергетического кодирования внутри- органные сосуды определяются у 100% женщин в постменопаузе до 5 лет и у 36% женщин в менопаузе от 6 до 10 лет. Однако в большинстве случаев (85,2%) в постменопаузе длительностью более 10 лет и у 100% женщин старшей возрастной группы (менопауза более 20 лет) внутриорганный кровоток не определяется независимо от используемого режима.
Для артериального кровотока в яичнике характерны более низкие скорости, чем в маточных артериях, относительно высокие значения конечной диастолической скорости (табл. 51), и отсутствие протодиастолической вырезки.
Таблица 51. Показатели внутрияичниковой гемодинамики в различные возрастные периоды.
|
|
ПСС (см/с) |
МДС(см/с) |
ИП |
ИР |
ЛСК вен (см/с) |
|
До 5 лет ПМП |
8,4 ± 0,25 |
2,3 ± 0,6 |
1,1 ±0,3 |
0,78 ± 0,12 |
2,9 ± 0,6 |
|
|
(7,3-12,0) |
(2,03-3,0) |
(0,87-1,7) |
(0,73-0,91) |
|
|
6-10 лет ПМП |
6,1 ± 1,35 |
1,6 ± 1,0 |
1,64 ± 0,13 |
0,86 ± 0,07 |
2,93 ± 0,6 |
|
|
(5,0-10,0) |
(0-2,5) |
(1,5-2,2) |
(0,8-0,91) |
|
|
11-20 лет ПМП |
5,8 ± 1,17 |
1,35 + 0,5 |
2,4 ± 0,03 |
0,92 ± 0,09 |
2,5 + 0,76 |
|
|
(4,0-8,0) |
(0-2,0) |
(2,2-2,5) |
(0,8-1,0) |
|
|
Более 20 лет |
Не опреде- |
Не опреде- |
Не опреде- |
Не опреде- |
Не опреде- |
|
ПМП |
ляется |
ляется |
ляется |
ляется |
ляется |
Внутрияичниковый венозный кровоток во всех возрастных подгруппах, кроме старшей, где внутрияичниковые сосуды не определяются, характеризуется низкой линейной скоростью при монофазном характере допплеровского спектра не синхронизированного с актом дыхания (рис 227)
Установленный нормативный диапазон допплерографических параметров кровотока для каждого возрастного периода может стать отправной точкой для выявления гинекологических заболеваний.
3. Гемодинамика матки при миоме
Большой интерес представляет оценка гемодинамики матки у больных с миомой, а также особенности васкуляризации опухоли. По нашим данным, особенностью органного кровотока при наличии узлов миомы преимущественно интерстициальной локализации и размерами более 25 мм является стойкое расширение аркуатных вен миометрия более 2 мм в диаметре у 28,7% больных репродуктивного возраста и у 39,6% больных в постменопаузальном периоде. При этом фазность кровотока приобретает не свойственную аркуатным венам двухфазную кривую, Расширение внутриматочных венозных сосудов при миоме, учитывая дилятирующее действие эстрогенов, возможно, является своеобразным эхографическим маркером гиперэстрогении.
В целом при миоме ПСС в маточных артериях (независимо от размера и локализации узла) выше (р<0.002), а индексы периферического сопротивления ниже (р<0,001) по сравнению с аналогичными параметрами у здоровых женщин. Однако наиболее заметные различия в показателях ПСС и ИР проявляются в субэндометриальнои зоне (табл. 52).
Таблица 52. Показатели маточной гемодинамики у больных миомои матки.
|
Исследуемый параметр |
Больные миомой |
Здоровые |
Достоверность |
|
ПСС маточные артерии |
54,1 ± 14,9 |
44,4 ± 13,3 |
Р<0,005 |
|
ИР маточные артерии |
0,69 ± 0,08 |
0,87 ±0,12 |
Р<0,005 |
|
ПСС базальные артерии |
10,8 ±4,7 |
7,5 ± 1,9 |
Р<0,005 |
|
ИР базальные артерии |
0,56 ± 0,04 |
0,55 + 0,08 |
Р>0,05 |
Важную дополнительную информацию о миоматозных узлах дает оценка особенностей их васкуляризации, ее оценивают как на основании самого факта наличия цветовых локусов, особенностей локализации визуализируемых сосудов так и состояния сосудистой резистентности маточных сосудов, артерий, снабжающих миоматозные узлы кровью, и внутриопухолевых сосудов [32, 33]. Вокруг этой темы остается много дискуссионных вопросов.
По литературным данным, на изменения визуализации внутриопухолевого кровотока и допплеровских параметров в узлах миомы оказывают влияние четыре фактора размер опухоли, ее локализация, гистологическое строение и наличие вторичных дегенеративных изменений [33 34].
Судя по опубликованным материалам, частота визуализации внутриопухолевых сосудов снабжающих миоматозные узлы, весьма вариабельна и колеблется от 54 до 100% [35]. И.С Сидорова и соавт. [34] в простых миомах регистрировали периферический кровоток, тогда как в пролиферирующих - как центральный, так и периферический. В то же время Е.Д. Лютая [36] в аналогичных исследованиях не выявила достоверной зависимости частоты визуализации центрального внутриопухолевого кровотока от морфологической формы миоматозного узла При допплерометрии показатели периферическиого сопротивления в миоматозных узлах варьировали от 0,48 до 0,64 [37, 38].
В наших наблюдениях за больными репродуктивного возраста и в постменопаузе с неизмененными миоматозными узлами в 53,9-78,2% случаев более характерным оказался тип васкуляризации с преимущественно периферическим расположением цветовых локусов (1 тип). А у всех больных (100%) с пролиферирующей миомой и саркомой матки был выявлен тип васкуляризации со смешанным расположением цветовых локусов (2 тип).
В миоматозных узлах частота выявления 2-го типа ЦП возрастала по мере увеличения размеров опухоли. При этом пиковая скорость также росла по мере увеличения среднего диаметра опухоли, а ИР - снижался. Наибольших значений ПСС достигала в миоматозных узлах, превышающих 50 мм в диаметре (до 35,6 см/с), в пролиферирующих миомах (до 43,7 см/с) и в саркомах (52,7 см/с) (р<0,01). Показатели ИР снижались в узлах такого размера до 0,42 и 0,29 соответственно (р<0,01). Характерно, что пиковая скорость и ИР в восходящих ветвях маточных артерий у больных с миомой матки и саркомой достоверно не отличались друг от друга. В то же время разница ПСС внутриопухолевого кровотока у больных с миомой матки в постменопаузе с одной стороны и у больных с пролиферирующей миомой и саркомами матки с другой, была статистически достоверной.
По нашим данным, допплерометрические показатели артериального кровотока в пролиферирующих миомах и саркомах матки не отличаются друг от друга: ИР снижается в среднем до 0,44 и 0,28 соответственно, статистически достоверно отличаясь от показателей ИР у больных с простыми миоматозными узлами.
Показательно, что у больных миомой матки большинство цветовых локусов в I и II зонах, а также составляющих периферическое обрамление миоматозных узлов соответствуют венозным сосудам. Внутриопухолевый венозный кровоток в узлах простой миомы характеризуется монофазным типом допплерограммы и низкими скоростями (в среднем 4,76 ± 0,54 см/с). Однако в узлах с дегенеративно-воспалительными изменениями и в пролиферирующих миомах максимальная скорость венозного кровотока оказывается выше, составляя в среднем 6,75 ± 0,9 см/с и 16,2 ± 3,4 см/с соответственно. Кроме того, в случаях с признаками активной пролиферации выявляются шунтирующие сосуды с характерной формой допплерограммы, характеризующейся высокой скоростью кровотока с низким сопротивлением в артериях и признаками псевдопульсации в венах.
Центральным в проблеме изучения миомы матки стоит вопрос о причине появления в практически неизмененных миоматозных узлах, как показало дальнейшее послеоперационное патоморфологическое исследование, допплерографических признаков, более типичных для пролиферирующей миомы. Так, в наших исследованиях практически у половины (42,9%) больных репродуктивного возраста был выявлен заметно выраженный 2-й тип васкуляризации, а у 5,8-8,5 % показатели ИР были ниже 0,4.
Объяснением этому феномену, на наш взгляд, служит ряд исследований патоморфологов [10], которые показали, что в миоме матки развивается особый вид сосудов, лишенный активной способности суживать или увеличивать свой просвет. Сосуды миомы, по мнению авторов, следует считать «особой популяцией сосудов». Они лишены мышечной оболочки, но самой примечательной особенностью является их дегерметизация. В результате кровоток, измеренный в таких сосудах, характеризуется низкими показателями периферического сопротивления, «типичными», по мнению отдельных специалистов ультразвуковой диагностики, для злокачественного процесса.
Помимо этого, к снижению сосудистого сопротивления может приводить часто возникающая при отеке узлов тканевая гипоксия с последующей дегенерацией и деструкцией тканей [10]. На практике мы неоднократно отмечали волнообразное изменение допплерографических показателей в виде появления и регресса 1 типа васкуляризации, а также снижения и, затем, повышения индексов резистентности. Как отмечалось выше, обращала на себя внимание интересная особенность 2 типа васкуляризации, заключающаяся в том, что превалирующее число выявленных в узлах сосудов составляют вены. Морфологи отмечают, что отек тканей ведет к блоку его собственных вен и затруднению оттока, что в свою очередь усиливает пропотевание жидкости из окружающих сосудов. Нарастающий отек узла приводит к появлению в разных его участках ишемических очагов, кровоизлияний и некробиотических изменений [10].
Мы разделяем точку зрения Г.А. Савицкого и соавт. [10], считающих, что «...темп увеличения функциональной массы узла миомы, равно как и сама величина абсолютного прироста этой массы, лишь в крайне редких случаях (около 0,1%) могут быть патогенетически связаны с изменением гистобласти- ческих потенций клеток ростковых зон. В абсолютном большинстве случаев (99,9%) быстрое возрастание массы узла миомы связано прежде всего с процессами гипертрофии миоцитов, переобводнением тканей узлов в результате нарушений кровообращения и только затем усилением процессов пролиферации миогенных элементов в ростковых зонах узла». Авторы подчеркивают, что трансформация миомы в миогенную саркому процесс скорее случайный и по вероятности возникновения (0,7%) не превышает частоту возникновения миогенной саркомы de novo.
Таким образом, напрашивается вывод, что выявление часто встречаемых в миоматозных узлах 2 типа васкуляризации и снижения ИР не является признаком активной пролиферации, а представляет собой скорее всего допплерографическую характеристику отека узла, что, естественно, если и предполагает необходимость активных действий со стороны клиницистов, но только не с позиций онкологии.
4. Возможности ЦДС в диагностике гиперпластических процессов эндометрия
Поданным литературы, частота визуализации внутриэндометриальных кровеносных сосудов у больных с доброкачественной гиперплазией колеблется от 8 до 64,7% [12, 39, 40], а с полипами эндометрия - в 30-64% случаев [41, 42]. По мнению А.Д. Липмана [43], при наличии доброкачественной патологии эндометрия частота визуализации его сосудов зависит как от возраста пациенток, так и от гистологической принадлежности гиперпластического процесса [43].
Мы зарегистрировали и изучили интраэндометриальный кровоток у 95,8% больных с внутриматочной патологией. При этом для абсолютного большинства доброкачественных процессов в эндометрии было характерно наличие субэндометриального и интраэндометриального кровотока. Однако, у 77.7- 83,3% (в зависимости от гистологической принадлежности патологического процесса) обследованных он был слабо выражен и только у 12,5% - выраженный. Кроме того для каждой гистологической формы заболевания выявлены характерные особенности внутриопухолевой гемодинамики (табл. 53).
Таблица 53. Частота визуализации внутриэндометриального кровотока при различных гиперпластических процессах эндометрия.
|
Исследуемый сосуд |
Частота визуализации (%) | ||
|
Полипы |
Гиперплазии |
Рак | |
|
Артериальные сосуды |
90,2% |
35,1% |
92,5% |
|
Венозные сосуды |
29,7% |
83,5% |
100% |
|
Артерио-венозные шунты |
0 |
0 |
18,5% |
Особенностью получения изображения кровотока полипов в режиме ЦДК явился питающии сосуд, имевший вид одиночного цветового локуса линейной формы, как бы связывающего субэндометриальную и интраэндометриальную зоны в виде «мостика» Для гиперплазий характерным было либо полное отсутствие, либо присутствие незначительного количества цветовых локусов внутри утолщенной слизистой. При злокачественных поражениях эндометрия внутриопухолевыи кровоток выявлен в 100% наблюдений, причем у всех больных явное количественное преимущество принадлежало венозным сосудам, а у 18 5% определяли артерио-венозные шунты
Значения пиковой систолической скорости в маточных артериях, без учета стадийности процесса были несколько выше при раке эндометрия Достоверно отличались показатели ПСС во внутриопухолевых артериях при доброкачественных (7,6 ± 34 см/с) и злокачественных (14,5 ± 5 3 см/с) гиперпластических процессах (р<0,002). В целом, значения ИР внутриопухолевых сосудов при раке эндометрия ниже аналогичных значений при доброкачественных поражениях слизистой оболочки матки. Однако разброс колебаний ИР как при гиперплазии (0,44-0,69), так и при раке (0,43-0 69) был в пределах одних и тех же значении.
Более чувствительным параметром в дифференциальнои диагностике доброкачественной и злокачественной патологии эндометрия оказалась скорость кровотока в венозных внутриопухолевых сосудах. Если в полипах и гиперплазированном эндометрии ее значения не превышали 4 см/с, то в сосудах злокачественной опухоли минимальное значение составило 6 см/с. Последнее обстоятельство определило более высокие цифры специфичности и чувствительности допплерографии (94 6% и 95,6% соответственно) по сравнению с эхографией (90.6% и 87,8% соответственно).
Безусловно, окончательный выбор необходимого объема оперативного вмешательства при выявленной ультразвуковым методом внутриматочной патологии может основываться только лишь на результатах гистероскопии и гистологического исследования полученного соскоба. При этом совершенно
очевидна значительная роль триплексного сканирования в качестве первого звена в диагностике внутриматочной патологии эндометриального происхождения. Однако неадекватное использование результатов ЦДС, без учета кпинико-лабораторных данных, может провоцировать увеличение количества необоснованных оперативных вмешательств. Так, само по себе заметное изменение внутриорганного кровотока может быть проявлением воспалительного процесса, а в результате усиления перфузии и дилатации сосудов значения скоростей кровотока и индексов периферического сопротивления будут идентичны параметрам органного кровотока при I) патогенетическом варианте рака эндометрия.
В литературе единичны работы, определяющие значение показателей кровотока в оценке инвазии, но их результаты обнадеживают специалистов. Так, высокие результаты получены A. Kurjak et al. [33], которым ЦДС отчетливо помогла в выявлении 18 из 19 гистологически доказанных случаев инвазии миометрия. А три бессимптомных случая были обнаружены только на основе изменений показателей кровотока [44]. При этом чувствительность метода составила 100%, специфичность - 94,4%.
Вместе с тем, К. Hata et al. [45], обследуя 36 женщин с эндометриальным раком (5 - в стадии IA, 14 - в стадии IB, 5 - в стадии 1С, 4 - в стадии II и 8 - в стадии III), не нашли существенных различий в ПСС и ИР для каждой стадии. Не обнаружено также никаких значимых различий показателей кровотока и для каждого опухолевого гистотипа.
Отдельные исследователи считают, что использование индексов сосудистого сопротивления в сосудах эндометрия не позволяет надежно дифференцировать его злокачественные и доброкачественные заболевания [46, 47]. По данным P. Sladkevicius et al. [48], измерение толщины эндометрия у пациенток с постменопаузальным кровотечением является более надежным методом, чем допплерография. J.Carter et al. [49], оценивая точность метода, получили чувствительность - 39% и специфичность - 92%. Они не сумели выделить ни одного явного дифференциально-диагностического критерия. У S. Sheth et al. [47] различия средних значений ИР и ИП в доброкачественных и злокачественных новообразованиях эндометрия оказались несущественными. Низкий импеданс артериального кровотока наблюдался при различных патологических состояниях эндометрия. При этом имелись наложения показателей ИР и ИП доброкачественых и злокачественных образований. G. Gonoscenti et al. [50], F. Flam et al. [51], обследовав женщин с эндометриальным раком, не нашли никакой корреляции между выраженностью процесса и показателями кровотока. В работе О. El Ahmady et al. [52] ЦДС способствовала обнаружению только 76% эндометриальной патологии.
М. Vuento et al. [53] заключили, что ЦДС не способствует обнаружению предраковых и раковых состояний эндометрия. Интересно, что такой вывод авторы сделали на 3-х наблюдениях рака эндометрия и одном наблюдении рака шейки матки.
В нашем исследовании при злокачественных поражениях эндометрия у больных с I патогенетическим вариантом интраэндометриальный кровоток присутствовал практически в 100% случаев в виде множественных хаотически расположенных цветовых локусов. Для II патогенетического варианта оказалось характерным лишь незначительное усиление субэндометриального кровотока, и это стало единственным ультразвуковым визуальным признаком злокачественного процесса. В дискуссии о порогах ЦДС, на наш взгляд, вносит решающий аргумент в свою пользу не толщина, а аномальные цветовые локу- сы, которые являются признаком патологии.
Начальные проявления инвазии характеризуются заметным локальным усилением субэндометриального и интраэндометриального кровотока, при котором цветовые локусы, в отличие от полипа, имеют множественный, даже хаотичный характер. У больных со II патогенетическим вариантом на цветовых допплерограммах инвазия также выдает себя заметным локальным усилением субэндометриального кровотока.
Важно добавить, что скорость кровотока в маточных артериях не стала критерием оценки состояния эндометрия при начальных стадиях злокачественного процесса. Достоверным оказалось лишь повышение скорости кровотока в субэндометриальной и интраэндометриальной зонах у больных раком эндометрия по сравнению с аналогичными показателями у женщин с гиперплазиями и полипами. Так, например, у больных раком эндометрия в постменопаузе скорость кровотока в субэндометриальной зоне достигала 22,6 см/с.
Изучение средних значений ИР в маточных артериях и ее ветвях также не имеет статистически существенных закономерностей. Тем не менее достоверным оказалось то, что кровоток в зоне IV ст. у больных раком тела матки характеризовался сниженным ИР (0,45-0,46), тогда как в доброкачественных опухолях ИР всегда превышал 0,54 (р<0,01).
По мере прогрессирования злокачественного процесса, а также при снижении степени дифференцирования в маточных артериях отмечалось изменение допплерометрических показателей. Однако достоверным (по сравнению с I ст. или высокодифференцированной опухолью) оно было лишь у больных с III ст. или при наличии низкой дифференциации опухоли: увеличение ПСС до 116-132 см/с. (р<0,05) и снижение ИР до 0,41 (р<0,05). Таким образом, значительное повышение скорости кровотока в маточных артериях свидетельствует о запущенной форме рака эндометрия.
5. Допплерографические критерии дифференциальной диагностики опухолей яичников
При ЦДС в большом числе (76,3%) доброкачественных новообразований яичников характерным являлось наличие единичных (1-3) внутриопухолевых цветовых локусов; тогда как для большинства (72,1%) злокачественных опухолей число ЦЛ было >5. При этом в доброкачественных опухолях цветовые локусы располагаются преимущественно по периферии (62,2-72,6%), тогда как в злокачественных - в центре преимущественно эхопозитивных (86,5%) и в линейных и нелинейных включениях преимущественно эхонегативных (88,4- 94,5%) опухолей.
У больных с доброкачественными опухолями одной гистологической принадлежности значения SD для ПСС и ИР отличаются незначительным разбросом, тогда как у больных со злокачественными опухолями они очень вариабельны.
По нашим данным, у больных со злокачественными новообразованиями достоверно повышается ПСС в опухолях объемом >500 см3 (34,0 ± 17,6 см/с} по сравнению с опухолями, объем которых <50 см3 (12,7 ± 5,3 см/с) (р<0,01).
При наличии гнойно-некротических изменений в доброкачественных опухолях повышается ПСС в ЦЛ-1 до 25,8 см/с и достоверно снижается ИР до 0,29 в ЦЛ-2.
Достоверное (р<0,05) снижение ИР имеется при сравнении показателей при стадиях I и II в ЦЛ-1 (0,52 ± 0,16 и 0,28 + 0,06) и ЦЛ-2 (0,36 ± 0,06 и 0,27 ± 0,04).
Пиковая скорость оказывается более высокой в ЦЛ-1 опухолей со средней и низкодифференцированной степенью злокачественного процесса (соответственно 30,5 ± 16,9 см/с и 31,3 + 18,7 см/с), если сравнения проводятся с высокодифференцированными опухолями (20,5 ± 13,7 см/с) (р<0,05).
В серии выполненных нами работ [54, 55] найдено объяснение причины разногласий в дискуссии о приоритетности ИР или ПСС. Практически всегда при исследовании злокачественных новообразований матки и яичников обращала внимание закономерность взаимоотношений этих двух показателей - в локусах с высоким значением ПСС выявляли ИР также с относительно высокими значениями, а в локусах с низкими значениями ИР отмечали кровоток с относительно низкими значениями ПСС. Иными словами, это означает, что при обследовании опухоли не следует опираться на результаты, полученные из одного локуса, поскольку очевидно, что эти два показателя призваны характеризовать сосудистые структуры различного строения: первые - сосудистые шунты, а вторые - сосуды, лишенные мышечного слоя. Суть предложенного нами мультилокусного анализа заключается в том, что для результатов исследования необходимо использовать максимальные значения ПСС и минимальные значения ИР.
Дополнительные дифференциально-диагностические данные были получены при оценке изменений количественного соотношения артериальных и венозных сосудов внутриопухолевого кровотока в зависимости от эхографического изображения и гистологической принадлежности опухоли. Так, в стенках гладкостенных цистаденом 55-60% составляют артериальные сосуды и 40- 45% - венозные. В пристеночных включениях папиллярных цистаденом выявляется 40-45% артериальных и 55-60% венозных сосудов. В муцинозных цистаденомах регистрируются сосуды как в стенке опухоли, так и во внутриопухолевых перегородках, причем 55% из них соответствуют артериальным и 45% - венозным, в то время как в тератомах венозные сосуды определяются всего лишь в 35,5% от всего количества визуализируемых сосудов.
В злокачественных опухолях среди всех выявляемых сосудов от 60% до 85% приходится на венозное звено. В стенке серозных и муцинозной цистаденокарцином, а также в перегородках последней количественное преимущество вен очевидно - от 70% до 85%. В опухоли Бреннера количество вен составляет 65% от всех выявленных сосудов, в эндометриоме - 67,5%, в фолликуломе - 60%.
Для венозного внутриопухолевого кровотока как в злокачественных, так и в доброкачественных опухолях характерна монофазная допплерограмма со средними значениями скорости 3,4 ± 042 см/с в доброкачественных и 11,45 + 1,76 см/с в злокачественных образованиях (табл. 54), различия статистически достоверны (р<0 002).

Рис 228, Трансвагинальное сканирование Продольная 3D ангиограмма неизмененного эндометрия и сосудов субэндометриальной зоны
Нельзя забывать, что метод ЦДС сегодня еще молод и не может обходиться без необходимой верификации Следует согласиться с мнением К. Hata et аl.
Таблица 54. Дифференциально-диагностические признаки доброкачественной и злокачественной патологии яичников
|
Признаки |
Доброкачественные |
Злокачественные |
Р |
|
|
новообразования |
новообразования |
|
|
Наличие внутриопухолевых сосудов |
25% |
96,9% |
р<0,001 |
|
Соотношение сосудов: |
|
|
|
|
артериальных |
55,8 ±9,1% |
49 ± 5,65% |
р<0,005 |
|
венозных |
41,9 ±7,04% |
64,2 + 12,08% |
р<0,001 |
|
ПСС |
10,2 ±2,8 см/с |
21,5 ± 13,68 см/с |
р<0,001 |
|
МДС |
3,3 ± 1,1 см/с |
6,5 ± 1,3 см/с |
р<0,01 |
|
ИР |
1,48 + 0,59 |
0,81 ±0,09 |
р<0,001 |
|
ИР |
0,61 ±0,05 |
0,44 + 0,02 |
р<0,001 |
|
ЛСКВЕН. |
3,4 ± 0,42 см/с |
11,45 ± 1,76 см/с |
р<0,002 |
заключивших, что ЦДС способна эффективно использоваться для обнаружения ранних форм рака ВПО, особенно у женщин в постменопаузе Авторы отмечают, что этот метод может быть использован для отбора больных действительно нуждающихся в инвазивной диагностике, а золотым стандартом в оценке состояния эндометрия и эндоцервикса современные онкогинекологи справедливо называют гистероскопию с прицельной биопсией. Для верификации же допплерографического заключения рака яичников показана лапароскопия с прицельнои биопсией [58].
6. Применение 3D технологии в диагностике гинекологических заболеваний
Одним из самых больших технических достижений последних лет явилось создание ультразвуковых приборов, способных формировать трехмерное изображение выявленных сосудов
Выполненные нами исследования показали, что у здоровых женщин репродуктивного возраста характерными оказались трехмерные ангиограммы матки, на которых отчетливо прорисовывались сосуды субэндометриальной зоны в то время как зона эндометрия имела полностью ахроматичный вид (рис 228). На трехмерных ангиограммах неизмененной шейки отчетливо прописывались нисходящие маточные сосуды и чуть заметно - стромальные, оставляя в центре изображения характерную пуной слизистой (рис 231).

Рис. 229. Трансвагинальное сканирование. Трехмерная ангиограмма шейки матки с характерной ахроматичной центральной частью.

Рис. 230. Трансвагинальное сканирование. 3D ангиограмма питающего сосуда полипа эндометрия.

Рис. 231. Трансвагинальное сканирование. Допплерограмма (слева) и 3D ангиограмма (справа) гиперплазированного эндометрия.

Рис. 232. Трансвагинальное сканирование. Допплерограмма (слева) и 3D ангиограмма (справа) аденокарциномы эндометрия ст. 1 в с зоной инвазии.
При трехмерной реконструкции злокачественного процесса в эндометрии отмечали практически полное исчезновение зоны, характерной для доброкачественных процессов в эндометрии и появление на ее месте многочисленных цветовых локусов. На 3D ангиограммах инвазия характеризовалась переориентацией сосудов, окружающих эндометрий и появлением выраженных множественных линейных цветовых локусов при которых зона инвазии приобретала специфическое изображение, напоминающее «всполохи пламени» (рис. 232) С помощью 3D опухоль шейки, определяемая на обычных эхограммах как крайне неотчетливая выявлялась благодаря всегда хорошо заметному кровотоку (рис 233).
На 3D ангиограммах миоматозный узел с периферическим типом васкуляризации имел характерный вид практически ахроматичной зоны с окружающими ее многочисленными сосудами, а миоматозный узел с центральным типом васкуляризации был заполнен многочисленными цветовыми локусами (рис 234).

Рис. 233. Трансвагинальное сканирование. Допплерограмма и 3D ангиограмма рака шеики матки ст 2 б.

Рис. 234. Трансвагинальное сканирование. Допплерограмма (слева) и 3D ангиограмма (справа; миоматозного узла с преимущественно периферическим типом васкуляризации.
Следует подчеркнуть, что эта методика, названная трехмерной ультразвуковой ангиографией, еще недостаточно описана в специальной литературе и наши исследования по существу являются первым опытом применения 3D ангиографии у гинекологических больных.
ГЛАВА 16
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ АРТЕРИЙ НИЖНИХ КОНЕЧНОСТЕЙ
Все большее распространение облитерирующих заболеваний брюшной аорты и периферических артерий, отчасти в связи с демографическим сдвигом, определяющим значительное увеличение числа больных пожилого и старческого возраста, страдающих распространенными формами поражения сосудистой системы (атеросклероз, гипертоническая болезнь) и одновременно тяжелыми сопутствующими заболеваниями, с одной стороны, и достигнутые за последние десятилетия успехи реконструктивной сосудистой хирургии, обеспечивающие возможность внедрения в практику эффективных методов восстановительного хирургического лечения, с другой, определяют необходимость совершенствования неинвазивной диагностики периферических поражений сосудов с целью отбора больных и определения на основе прогнозирования строго очерченных показаний к тому или иному виду лечения [1].
Основные требования, предъявляемые к диагностике окклюзирующих заболеваний сосудов, состоят в точной диагностике локализации окклюзии и выявлении ее гемодинамической значимости, оценке дистального сосудистого русла ниже места поражения и состояния развития коллатеральных артерий.
Так называемым «золотым стандартом» - высокоинформативным и надежным методом диагностики - до сих пор является рентгеноконтрастная ангиография. Однако мнение большинства специалистов-ангиологов и ангио- хирургов сводится в настоящее время к тому, что ангиографию необходимо производить только у кандидатов на операцию, выявленных с помощью предварительных ультразвуковых исследований [2-4].
Формированию этой концепции способствовало широкое внедрение в клиническую практику ультразвуковых методов исследования, в первую очередь УЗДГ, и создание специализированных сосудистых лабораторий, показавших на большом материале, что если раньше треть больных после ангиографии не направляли на хирургическое лечение, то со времени открытия этих лабораторий практически всем больным, прошедшим ангиографию, хирургическое лечение было рекомендовано [5].
Неинвазивность и безопасность УЗДГ для больного, возможность повторных неоднократных исследований и количественной оценки гемодинамической значимости облитерирующего заболевания сделали УЗДГ в течение двух последних десятилетий приоритетным методом неинвазивной диагностики в ангиологии, получившим распространение и в нашей стране, и за рубежом [6-16].
Успех неинвазивной диагностики заболеваний периферического артериального русла нижних конечностей зависит от разрешающих возможностей избранного метода диагностики и может быть обеспечен хорошим знанием:
а) нормальной анатомии магистральных сосудов, снабжающих кровью нижние конечности, и естественных путей коллатерального кровообращения, участвующих в компенсации развивающихся расстройств кровообращения при стенозирующих и окклюзирующих поражениях артериальной системы; б) клинических проявлений острой и хронической ишемии конечностей; в) участков сосудистой системы, наиболее подверженных атеросклеротическому и другим видам поражений.
1. Анатомия брюшной аорты, артерий нижних конечностей и пути коллатерального кровообращения при их облитерирующих поражениях
В сосудистой системе нижних конечностей различают три основных сегмента: I - выше паховой складки - аортоподвздошный; II - ниже паховой складки - бедренно-подколенный; III - голенной (рис. 235).
В анатомии сосудистой системы брюшной полости, таза и нижних конечностей заложены потенциальные возможности для формирования различных вариантов компенсаторной коллатеральной циркуляции, которые зависят от уровня артериальной окклюзии и существенно влияют на развитие артериального заболевания. При этом возможности развития компенсации кровообращения значительно выше в брюшной полости и полости таза в сравнении с кровообращением в нижних конечностях. Следует также помнить о том, что для формирования достаточной коллатеральной циркуляции необходимо продолжительное время. Поэтому медленно прогрессирующее заболевание магистральных артерий может протекать с минимальной симптоматикой, в то время как быстрое формирование окклюзии сопровождается тяжелыми симптомами ишемии.

Рис. 235. Схема строения основных сегментов артерий нижних конечностей: А - аорто-подвздошный, Б - бедренно-подколенный, В - голенной. 1 - аорта, 2 - ОПА, 3 - НПА, 4 - ОБА, 5 - ГБА, 6 - ПБА, 7 - ПкА, 8-ПББА, 9-МБА 10-ЗББА.
Аорто-подвздошный сегмент (АПС). Брюшная аорта (БА) начинается на уровне диафрагмального отверстия и заканчивается делением в области бифуркации на две общие подвздошные артерии (ОПА) (рис. 236). Первая большая ветвь БА - чревный ствол - не участвует, так же как и парные почечные артерии, в формировании коллатеральной компенсации при артериальном заболевании нижних конечностей. Остальные ветви БА - верхняя брыжеечная артерия (ВБА), передние ветви поясничных артерий, отходящие на уровне каждого поясничного позвонка, нижняя брыжеечная артерия (НБА) с ветвями - формируют основную сеть, по которой происходит образование компенсаторного коллатерального кровообращения при окклюзирующих заболеваниях аорты и подвздошных артерий.

Рис. 236. Схема строения БА и ее ветвей: 1 - БА, 2 - чревный ствол, 3 - ВБА, 4 - почечные артерии, 5 - НБА, 6 - ОПА, 7 - НПА, 8 - ВПА, 9 - гастродуоденальные коллатерали, 10 - брыжеечные коллатерали, 11 - сигмовидные артерии.

Рис. 237. Схема путей коллатерального кровообращения из системы висцеральной циркуляции к подвздошной зоне: 1 - правая кишечная артерия, 2 - левая кишечная артерия, 3 - ВБА, 4 - подчревная артерия, 5 - верхняя пузырная артерия, 6 - нижняя пузырная артерия, 7-9 - верхняя, средняя и нижняя геморроидальные артерии.
ОПА на расстоянии примерно 5 см от бифуркации разделяются на наружную подвздошную артерию (НПА) и внутреннюю подвздошную артерию (ВПА). ВПА формирует развитую коллатеральную систему с ветвями, отходящими от аорты, НПА - с поверхностной и глубокой бедренными системами. На рис. 237-239 схематично представлены пути формирования компенсаторного коллатерального кровообращения: а) из системы висцерального кровообращения к подвздошным сосудам (рис. 237); б) от поясничных артерий к ветвям НПА и ВПА (рис. 238); в) взаимосвязь коллатерального кровообращения верхних конечностей и грудной клетки с кровообращением нижних конечностей (рис 239).

Рис. 238. Схема путей коллатерального кровообращения из системы поясничных артерий к ветвям внутренних и наружных подвздошных артерий: 1 - нижняя надчревная. 2 - поясничная 3 - подвздошно-поясничная 4 - глубокая подвздошная огибающая 5 - верхняя ягодичная.

Рис. 239. Схема путей коллатерального кровообращения из системы верхних конечностей и грудной клетки к артериям нижних конечностей: 1 - левая подключичная 2 - внутренняя грудная 3 - межреберные. 4 - верхняя надчревная. 5 - нижняя надчревная 6 - наружная подвздошная.

Рис. 240. Схема глубокобедренно-коленной группы коллатералей при окклюзии ПБА: 1 - ГБА 2 - нисходящая ветвь наружной огибающей артерии 3 - коллатеральная сеть коленной артерии
Бедренно-подколенный сегмент. НПА, отдав две важные для коллатерального кровообращения ветви (нижнюю надчревную и глубокую артерию, огибающую бедро), переходит на уровне пупартовой связки в общую бедренную артерию (ОБА). ОБА на 4 см ниже пупартовой связки делится на поверхностную (ПБА) и глубокую (ГБА) бедренные артерии (рис. 240). До бифуркации ОБА отдает одну латеральную ветвь и две медиальные, каждая из которых является подкожным сосудом.

Рис. 241. Схема коленно-голенной группы коллатералей при окклюзии ПкА: 1 - ОБА 2 - ГБА, 3 - коллатеральная сеть коленной артерии, 4 - нисходящая ветвь наружной огибающей артерии

Рис. 242. Схема глубокобедренно-коленноголенной группы коллатералей при окклюзии ПБА и ПкА: 1 - восходящая ветвь наружной огибающей артерии, 2 - ГБА, 3 - нисходящая ветвь наружной огибающей артерии, 4 - внутренняя ветвь верхней коленной артерии, 5 - ПББА, 6 - запирательная артерия, 7 - верхняя коленная артерия, 8 - подкожная ветвь верхней коленной артерии, 9 - нижняя коленная артерия, 10 - ЗББА, 11 – МБА.

Рис. 243. Схема плантарного кровообращения: 1 - ПББА, 2 - ЗББА, 3 - АТС, 4 - глубокая подошвенная артерия, 5 - подошвенная дуга, 6 - внутренняя подошвенная артерия, 7 - наружная подошвенная артерия, 8 - дугообразная артерия.
ПБА продолжается в дистальные отделы бедра без деления до уровня гунтерова канала. Покидая канал, ПБА отдает нисходящую коленную артерию и становится подколенной артерией (ПкА). От ПБА в дистальном отделе отходят маленькие мышечные ветви. ГБА направляется задне-латерально от устья и заканчивается в дистальной трети бедра 4 перфорантными артериями. По ходу ГБА отдает наружную, огибающую бедро артерию с восходящей, поперечной и нисходящими ветвями и 3 перфорантные артерии. Имеются также мышечные ветви, которые могут формировать пути коллатеральной компенсации при обструкции ПБА и ПкА (рис. 241-243).
Голенной сегмент. Подколенная артерия спускается вниз с легким латеральным изгибом и на уровне щели коленного сустава или ниже ее делится на переднюю большеберцовую артерию (ПББА) и берцовоперонеальный ствол. ПкА по ходу отдает две или три мышечные ветви, ветви к костным и мягким тканям коленного сустава, участвующим в формировании коллатерального кровообращения (рис. 242).
ПББА проходит в переднелатеральном направлении, располагаясь в дистальном своем отделе по передней поверхности большой берцовой кости, и после пересечения лодыжки становится артерией тыла стопы (АТС). Берцовоперонеальный ствол делится на заднюю большеберцовую артерию (ЗББА) и малоберцовую артерию (МБА). Все три артерии: ПББА, ЗББА и МБА - отдают мышечные, коммуникантные и перфорантные ветви широко анастомозирующие между собой.
Концевые отделы ПББА и ЗББА образуют систему плантарного кровообращения (рис. 243). ЗББА в пяточном канале распадается на две ветви-медиальную и латеральную подошвенные артерии Медиальная орошает медиальную поверхность стопы, а латеральная анастомозирует с глубоким подошвенным разветвлением АТС, образуя подошвенную дугу. От подошвенной дуги отходят подошвенные предплюсневые артерии, переходящие в подошвенные пальцевые артерии, и проксимальные и дистальные прободающие артерии, которые переходят через межкостные пространства и анастомозируют с соответствующими артериями тыльной поверхности стопы.
АТС располагается от середины межлодыжечного пространства в первом межкостном промежутке. Часто наблюдают аномалии положения АТС, обычно двусторонние, с отклонением ее на 2-2 5 см латеральнее обычного расположения. От АТС отходит дугообразная артерия, участвующая в образовании тыльной сети стопы. Из дугообразной артерии формируются тыльные плюсневые артерии и тыльные артерии пальцев стопы, которые широко анастомозируют с соответствующими подошвенными артериями и перфорантными ветвями концевых отделов МБА.
Описанные особенности плантарного кровообращения объясняют, почему изолированное поражение одной из артерий голени не сопровождается тяжелыми ишемическими расстройствами и только выключение из кровообращения всех трех артерий приводит к развитию тяжелой ишемии конечности.
1.1. Этиология и патогенез поражений артерий нижних конечностей
Известно, что наиболее частыми причинами хронической ишемии нижних конечностей являются атеросклероз и сахарный диабет Значительно реже, примерно у 1-2% больных, развивается облитерирующий эндартериит, тромбангиит. неспецифический аортоартериит [2] Сахарный диабет характеризующийся развитием медиасклероза и диабетическои ангиопатии. в сочетании с атеросклерозом приводит к наиболее тяжелым формам ишемии конечностей.
Патогенез эндартериита и тромбангиита до конца не ясен. Вероятно, процесс начинается с ангиита или панангиита артерии и вен, что приводит к облитерации вовлеченных сегментов. Эти процессы в определенной степени связаны с курением табака и охлаждением конечностей и начинаются с поражения мелких артерий, таких как артерии стоп и пальцев Прогрессирование заболевания происходит в проксимальном направлении.
Острая ишемия имеет, как правило, эмбологенныи, тромбоэмбологенный или посттравматический генез
Атеросклероз хотя и является диффузным процессом, тем не менее, поражает определенные участки сосудистой системы с наибольшей частотой, в то время как другие редко подвержены поражению Изгибы отдельных сегментов и места деления артерии являются типичными областями наибольшего поражения. Наиболее вероятной причиной возникновения и формирования атеросклеротических бляшек в указанных зонах являются турбулентность и гемодинамическии удар.
В аорте наиболее ранимым оказывается инфраренальный сегмент, где аорта существенно суживается ниже отхождения почечных артерий. С наибольшей частотой атероматозом поражаются устья ОПА. их бифуркации. ОБА, устья ПБА и ГБА В более дистальных отделах ПБА имеет тенденцию к окклюзии при входе в гунтеров канал ПкА - непосредственно в подколенной ямке. Устье главных ветвей ПкА также являются типичным местом локализации стенозов окклюзии.
Анализ частоты поражения отдельных сегментов сосудистой системы нижних конечностей показал, что наиболее частым и характерным местом поражения сосудов при атеросклерозе, как в сочетании с диабетом, так и без него, является ПБА в гунтеровом канале (рис 244). Поражение, локализованное в этом сегменте, вызывает незначительную или умеренную клаудикацию (перемежающуюся хромоту) в связи с хорошо развитой коллатеральной компенсацией и системы ГБА и тазовых артерий. Вторым по частоте является поражение АПС, редко встречающееся у больных диабетом. В этом случае клаудикация значительно выражена, несмотря на достаточность коллатерального кровообращения в покое. Наличие окклюзии в проксимальном по отношению к ГБА сегменте существенно ограничивает возможности коллатерального притока в нагрузке и вызывает клаудикацию.
Поражение артерий ниже колена долго может оставаться незамеченным из-за хорошо развитых коллатеральных связей между ПББА, ЗББА и МБА, но только до того времени, пока в процесс не окажутся вовлеченными все три артерии.

Рис. 244. Частота поражения отдельных сегментов сосудистой системы нижних конечностей при атеросклерозе. I - бедренно-подколенный сегмент, И - аорто-подвздошный сегмент. Ill - артерии голени; IV - подколенная артерия; V - подвздошно-бедренный сегмент.
Наиболее тяжелая ишемия конечностей развивается при множественных многосегментных поражениях, так как высокое сопротивление кровотоку в результате включения в компенсацию нескольких коллатеральных систем приводит к заметному падению перфузионного давления и кровотока в конечностях, что характеризуется проявлением болей в покое, преимущественно в ночное время и при горизонтальном положении конечности. Перевод ноги в вертикальное положение приводит к уменьшению болей вследствие улучшения кровенаполнения за счет гидростатического фактора.
Перемежающаяся хромота не всегда сопровождается болевым синдромом в сегментах конечности, располагающихся непосредственно вслед за уровнем окклюзии. Так, при окклюзии подвздошного сегмента боли могут возникать только в икроножных мышцах голени вследствие хорошо развитой коллатеральной компенсации кровотока в более высокорасположенных сегментах. Появление болей в области бедра, возникновение так называемой «высокой перемежающейся хромоты» при окклюзии подвздошных артерий указывают на недостаточность коллатерального кровообращения аорто-подвздошной зоны.
Перемежающаяся хромота, развивающаяся при эндартериитах, обычно локализуется в стопе и носит название плюсневой клаудикации.
2. Метод ультразвуковой допплерографии в комплексной диагностике поражений артерий нижних конечностей
2.1. Методика УЗДГ при обследовании нижних конечностей
Для исследования поражений артериального сосудистого русла нижних конечностей могут быть использованы все виды ультразвуковых допплеровских систем, от аускультативных анализаторов звуковых сигналов с графической регистрацией их и без нее до систем дуплексного сканирования, включающих визуализацию сосудов в В-режиме, цветовое и энергетическое картирование и допплеровский анализ кровотока. Объем получаемой информации связан с техническими возможностями используемой допплеровской аппаратуры. Наибольшее распространение получили направленные флоуметры с системой незатухающей волны, компактные, недорогие и простые в употреблении, позволяющие выполнять комплексное ультразвуковое допплеровское исследование.
Комплексная УЗДГ нижних конечностей включает локацию периферических артерий и аускультативный анализ сигналов кровотока в них, регистрацию и интерпретацию кривых скорости кровотока на основе качественного (морфологического) и количественного анализа в сочетании с измерением сегментарного систолического давления (ССД); при необходимости УЗДГ дополняется различными функциональными тестами [17, 18].
Исследование проводят в положении пациента лежа на спине (рис. 245) (за исключением исследования подколенной артерии в положении лежа на животе) в комфортных условиях - после 10-15 мин. отдыха. Этот интервал времени необходим для стабилизации показателей гемодинамики, и его можно использовать для сбора анамнеза, осмотра и аускультации сосудов. Последнюю целесообразно проводить в подвздошно-бедренной зоне в покое и после физической нагрузки - 5 подъемов разогнутых в коленном суставе конечностей.
Наличие трофических язв в местах локации сосудов затрудняет выполнение исследования и должно быть деликатным, нетравматичным и с использованием стерильного акустического геля.

Рис. 245. Локация основных артерий нижних конечностей методом УЗДГ а – ОБА, б - ПкА в - АТС, г - ЗББА.
Исследование кровотока в крупных сосудах нижних конечностей (подвздошные, бедренные, ПкА) выполняют датчиками 4-5 МГц; для оценки кровотока в сосудах мелкого и среднего калибра (артерии голени и стопы) используют датчики 8-10 МГц. Датчик устанавливают по оси сосуда по направлению к кровотоку под углом в 45°-60° к предполагаемой оси сосуда, при этом производят легкое продольное и поперечное смещение датчика, погруженного в акустический гель, с одновременным изменением угла наклона, добиваясь получения высокого чистого акустического сигнала без шумовых помех и четкого графического изображения на экране монитора, после чего включают запись допплерограммы.
Исследование артерий нижних конечностей проводят в определенных для каждого сосуда точках, где сосуды максимально приближены к поверхности кожи (рис. 246), что обеспечивает минимальное искажение сигнала. Невозможность локации сосуда на всем протяжении из-за различной глубины залегания отдельных участков сосуда является недостатком и ограничением метода УЗДГ.
Обычно исследование начинают с НПА, располагая датчик в ее проекции на 1-3 см выше паховой складки, и продолжают в дистальном направлении в следующих стандартных точках: ОБА - в ее проекции на 1-2 см ниже паховой складки и латеральнее сигнала общей бедренной вены; ПкА - в ее проекции в подколенной ямке; ЗББА - тотчас кзади от медиальной лодыжки; ПББА - по передней поверхности нижней трети голени над областью голеностопного сустава; АТС - в первом межпальцевом промежутке. Локация проксимальных отделов артерий голени достаточно сложна из-за многовариантности анатомии дистального отдела ПкА и ее ветвей, затрудняющей идентификацию получаемых сигналов кровотока от конкретной артерии (рис. 247).
У части больных удается лоцировать ПБА (в нижней трети бедра на выходе из гунтерова канала). Отдельными авторами описаны попытки локации ГБА. Однако высокая вариабельность развития последней, нередко рассыпной тип ее, а также различная глубина ее залегания вследствие различной степени развития мышечной массы бедра и подкожно-жировой клетчатки приводят к значительному разбросу получаемых данных и невозможности формирования четких концепций по диагностике заболеваний ГБА. В то же время удачная в отдельных случаях локация ГБА или ее ветвей может дать ценную информацию о состоянии ГБА. Для локации ГБА используют датчик 4 МГц, располагая его в проекции предполагаемого анатомического хода артерии или ее ветвей по передне-верхней поверхности бедра.

Наружная подвздошная артерия Общая бедренная артерия
Глубокая артерия бедра
Поверхностная бедренная артерия
Подколенная артерия Артерии голени (проксимальный отдел)
Артерии голени (дистальный отдел)
Артерия тыла стопы Пальцевые артерии
Рис. 246. Точки локации артерий нижних конечностей.

Рис. 247. Анатомические варианты (а-г) деления ПкА: 1 - ПкА, 2 - ПББА, 3 - берцовоперонеальный ствол, 4 - МБА, 5 - ЗББА.
Нередко при затруднении локации артерий нижних конечностей (чаще всего при нарушении артериального кровообращения вследствие окклюзирующего поражения) полезным ориентиром может оказаться вена. Характерная звуковая характеристика венозного кровотока с преобладанием низких частот, напоминающая «шум бури», и связь ее с дыхательным циклом, а также знание анатомических взаимоотношений «вена-артерия» способствуют успешной локации артерий. Так, например, ОБА находят при латеральном по отношению к общей бедренной вене размещении датчика. Влияние дыхательного цикла на венозный кровоток позволяет дифференцировать артериальный и венозный кровоток в дистальных отделах конечности при низкой ЛСК в артериях голени, близкой к величине ЛСК венозного кровотока вследствие выраженного артериального окклюзирующего поражения.
2.2. Анализ аудиохарактеристик допплеровских сигналов кровотока в артериях нижних конечностей
У здоровых лиц, по нашим данным, локация НПА, ОБА, ПкА была выполнена у всех обследованных. При поражении сосудов не получены сигналы кровотока в НПА у 1,7% обследованных, в ОБА - у 2,6%, в ПкА - у 3,7%, что у 96% обследованных было следствием окклюзии сосуда в исследуемой зоне, подтвержденной по данным ангиографии. Сигналы одной из артерий: ЗББА или ПББА (АТС) - не получены у 1,8% здоровых лиц, а у больных частота локации артерий голени резко снижалась в зависимости от распространенности поражения.
В норме артериальный сигнал короткий и трехкомпонентный. Начальный звук громкий и высокочастотный, а два последующих имеют меньшую громкость и более низкую тональность. Изменение звуковой характеристики сигналов кровотока над зоной стеноза связано с повышением скорости кровотока
через суженную зону и с сопутствующей турбулентностью. По мере нарастания стеноза характеристики допплеровского сигнала меняются: снижается частота, нарастает продолжительность, исчезает трехкомпонентность При окклюзии изменения те же, что и при выраженном стенозе- но более резко выражены, сигналы имеют еще более низкую тональность и продолжаются в течение всего сердечного цикла.
Аускультативный анализ допплеровских сигналов кровотока является начальным этапом ультразвукового исследования и при определенном опыте дает хорошую возможность локации сосудов и дифференцирования нормальных и патологических сигналов кровотока. Особое значение метод приобретает при пользовании ультразвуковыми стетоскопами, не имеющими регистрирующих устройств.
2.3. Оценка допплеровских кривых скорости кровотока по артериям нижних конечностей
Регистрация допплеровских сигналов кровотока в виде аналоговых кривых скорости (допплерограмма) дает возможность провести качественный и количественный анализ скорости кровотока в исследуемых сосудах.
2.3.1. Качественный анализ допплеровских кривых скорости кровотока
Нормальная кривая периферического артериального кровотока (рис. 248 а), так же как и аускультативный сигнал, состоит из трех компонентов 1 - наибольшее отклонение в систоле обусловленное прямым кровотоком: 2 - обратный кровоток в ранней диастоле, связанный с артериальным рефлюксом из-за высокого периферического сопротивления. 3 - отклонение в поздней диастоле, вызванное кровотоком вперед за счет эластичности стенок артерий.
По мере прогрессирования стенозирующего заболевания изменяется форма пульсовой волны, трансформируясь из магистрального типа в коллатеральный (рис 248 б-е) Главными критериями нарушения формы волны является исчезновение компонента обратного кровотока, притупление пика скорости и удлинение времени подъема и спада скорости пульсовой волны. На рис 249 представлены допплерограммы ОБА, ПкА ЗББА и АТС в норме и при окклюзии ПБА и ОПА.
В норме (рис. 249 а) для всех кривых характерным является крутой подъем и спуск, острая вершина первого компонента и выраженная волна обратного кровотока. При окклюзии ПБА (рис. 249 б) деформацию допплерограмм выявляют с уровня ПкА, а при окклюзии ОПА коллатеральный тип кривой регистрируют во всех точках локации (рис 249 в).
2.3.2. Количественный и полуколичественный анализ допплеровских кривых скорости кровотока в артериях нижних конечностей
Количественную оценку допплерограмм можно проводить на основе анализа, как аналоговых кривых скорости кровотока, так и данных спектрограмм допплеровских сигналов кровотока в реальном масштабе времени. При количественной оценке анализу подвергаются амплитудные и временные параметры допплерограммы, а при полуколичественной - ее расчетные индексы [19, 20].

Рис. 248. Допплерограммы кровотока по ОБА в норме (а) и при прогрессировании окклюзирующего процесса (б-е); пунктирной линией на б-е показана норма, на б-г - стеноз, на д, е - окклюзия.
Однако из-за наличия факторов, изменяющих форму допплеровской кривой скорости, существуют проблемы, связанные с интерпретацией и количественной оценкой допплерограмм. Так, амплитуда кривой зависит от положения датчика и угла наклона его относительно оси кровотока, глубины проникновения ультразвука в ткани, удаленности датчика от основного участка сужения, установки усиления, фоновых помех наложения венозных шумов и т. д. Если пучок ультразвука пересекает сосуд частично (не по всей оси) и, особенно если он направлен к оси сосуда под углом, приближающимся к 90°, получаются ошибочные результаты. В связи с этим рядом исследователей был предложен (как более предпочтительный) полуколичественный метод оценки допплерограммы - расчет отношений, характеризующих форму волны и представляющих собой относительные индексы (например, индекс пульсации, демпинг-фактор), на величину которых влияние указанных выше причин не распространяется. Однако и этот метод ряд авторов подвергает критике, отдавая предпочтение количественной оценке сигналов кровотока поданным спектрального анализа; другие исследователи надежность неинвазивной оценки сосудистого поражения связывают только с дуплексным сканированием, при котором определение и анализ сигналов кровотока проводится в визуализируемом участке сосудистой системы.

Рис. 249. Допплерограммы кровотока в норме (а) и при окклюзии ПБА (б) и ОПА (в): 1 - ОБА, 2 ПкА, 3 - ЗББА, 4 - АТС.
В то же время существует ряд ситуаций, когда единственно возможным и диагностически значимым неинвазивным методом оценки сосудистого поражения становится анализ формы и количественная оценка допплерограммы: когда
ограничены возможности измерения ССД при невозможности наложения манжеты в положении проксимально к датчику, когда место наложения манжеты совпадает с хирургической раной, при оценке состояния подвздошных артерий, а также когда в несжимаемых в результате кальцификации или склероза артериальной стенки сосудах определяют ложно высокое ССД, несмотря на наличие артериального заболевания. По удачному выражению J. Уао et al. [21], регистрация пульсовой волны периферических артерий позволяет распознавать ишемию конечностей, подобно тому, как ЭКГ используют для диагностики ишемии миокарда.
При количественном анализе допплерограммы (рис. 250) определяются: ![]() - пиковая скорость прямого кровотока; vi- пиковая скорость обратного кровотока; vm- средняя скорость; Тy — время ускорения - время от начала подъема допплерограммы до ее пиковой точки; Т3 - время замедления - время от максимального пика допплерограммы до ее спада к изолинии; Тв - время возникновения - время от зубца R ЭКГ до появления сигнала скорости; скорости измеряются в см/с, временные интервалы - в с.
- пиковая скорость прямого кровотока; vi- пиковая скорость обратного кровотока; vm- средняя скорость; Тy — время ускорения - время от начала подъема допплерограммы до ее пиковой точки; Т3 - время замедления - время от максимального пика допплерограммы до ее спада к изолинии; Тв - время возникновения - время от зубца R ЭКГ до появления сигнала скорости; скорости измеряются в см/с, временные интервалы - в с.
При полуколичественном анализе определяют: А - ускорение (в см/с2), т. е. отношение![]() к Тy; D - замедление (в см/с2), т. е. отношение vi к T3; A/D - отношение ускорения к замедлению; IPGK - индекс пульсации Гёслинга-Кинга, рассчитываемый по формуле
к Тy; D - замедление (в см/с2), т. е. отношение vi к T3; A/D - отношение ускорения к замедлению; IPGK - индекс пульсации Гёслинга-Кинга, рассчитываемый по формуле ![]() .
.

Рис. 250. Диаграмма ЭКГ (а) и нормальная допплерограмма (б) за один сердечный цикл.
Заметим, что по существу эта формула совпадает с определением индекса пульсации Гёслинга РI, введенного в главе 1. Однако допплерограммы периферического кровотока имеют особенность, а именно: часть кривой проходит ниже изолинии (отрицательные скорости), а программы автоматического расчета PI в современных аппаратах не учитывают кровоток ниже изолинии - для этого требуется ручная обводка кривых и маркировка положительного и отрицательного пиков скорости. Поэтому в данной главе, чтобы подчеркнуть особенности расчета индекса пульсации для периферического кровотока, мы используем обозначение IPGK и приведенную выше расчетную формулу. Для оценки гемодинамических различий между сегментами конечности рассчитывали демпинг-фактор (ДФ) - отношение дистального IPGK к проксимальному IPGK. В норме IPGK увеличивается в дистальном направлении, а ДФ превышает 1. При окклюзирующих заболеваниях дистальный IPGK снижается, а ДФ становится меньше 1 (рис. 251). Таким образом, в наших исследованиях определяли:

Рис, 251 Пример измерений IPGK в неизмененной артерии (а) и в артерии дистальнее окклюзирующего поражения (б) и расчета демпинг-фактора (ДФ)

В табл. 55, 56 представлены параметры количественной и полуколичественной оценки допплерограмм артерий нижних конечностей в норме, полученные в контрольной группе.
Таблица 55. Параметры количественной оценки допплерограмм артерий нижних конечностей в норме (М ± ![]() )
)
|
Артерия |
|
|
Vm |
Ту |
Т3 |
Тв |
|
ОБА |
52, 8±15,7 |
13,7 ±5, 7 |
9,0 ± 3,7 |
0,11 ± 0,01 |
0,16 ± 0,03 |
0,14 ± 0,02 |
|
ПкА |
32,3 ± 6, 5 |
11,4 ± 4,1 |
4,1 ± 1,3 |
0,10 ± 0,01 |
0,14 ± 0,03 |
0,18 ± 0,02 |
|
ЗББА |
20,4 ± 6,5 |
7,1 ±2,5 |
2,2 ±0,9 |
0,13 ± 0,03 |
0,13 ± 0,03 |
0,22 ± 0,02 |
Таблица 56. Параметры полуколичественной оценки допплерограмм артерий нижних конечностей в норме (М ± ![]() )
)
|
Артерия |
А |
D |
A/D |
IPGK |
ДФ1 |
ДФ2 |
ДФ3 |
|
ОБА |
375,6 ± 129,9 |
341,3 ± 106,1 |
1,3 ± 0,3 |
8,4 ± 3,7 |
1,2 ±0,5 |
- |
- |
|
ПкА |
317,8 ± 61,1 |
243,7 ± 74,1 |
1,4 ± 0,4 |
11,6 ± 3,8 |
- |
1,4 ± 0,05 |
- |
|
ЗББА |
205,5 ± 64,8 |
169,3 ± 67,0 |
1,2 ± 0,2 |
13,7 ± 5,4 |
- |
- |
1,2 ± 0,4 |
По данным рентгеноконтрастной ангиографии (табл. 57), конечности с артериальными и окклюзирующими заболеваниями разделены на 5 групп. Как видно из табл. 3 в 1-4 группах имелось изолированное поражение одного сегмента, а в 5 группе - сочетанное поражение всех трех сегментов, при этом стенозирующие и окклюзирующие поражения АПС выделены в отдельные группы (1,2).
Результаты анализа допплерограмм в указанных пяти группах представлены в табл. 58, 59.
Таблица 57. Распределение по группам нижних конечностей в зависимости от ангиографической картины поражения сегментов
|
Сегмент конечности |
Данные ангиографии о поражениях артерий в группах | ||||
|
1 (n=38) |
2 (n=40) |
3 (n=23) |
4 (n=20) |
5 (n=30) | |
|
Ао рто-подвздошный Бедренно-подколенный Голенной |
стеноз норма норма |
окклюзия норма норма |
норма окклюзия норма |
норма норма стеноз окклюзия |
окклюзия окклюзия стеноз окклюзия |
Таблица 58. Параметры количественной оценки допплерограмм при поражении артерий нижних конечностей (М ± ![]() )
)
|
Артерия |
Группа |
|
|
Vm |
Ту |
Т3 |
Тв |
|
ОБА |
1 |
53,5 ± 15,9 |
7,4 ± 5, 9 |
11, 2 ±3,7 |
0,11 ± 0,02 |
0,25 ± 0,14 |
0,13 ± 0,02 |
|
|
2 |
21,4 ± 9,6 |
0 |
13,9 ±6,6 |
0,15 ± 0,03 |
0,59 ± 0,16 |
0,15 ± 0,03 |
|
|
3 |
58, 2 ± 18,9 |
4,4 ±3,7 |
0,6 ±4,5 |
0,10 ± 0,01 |
0,21 ± 0,07 |
0,12 ± 0,01 |
|
|
4 |
53,4 ± 13,1 |
9,0 ±5,2 |
9,9 ±4,6 |
0,11 ± 0,01 |
0,18 ± 0,04 |
0,12 ± 0,02 |
|
|
5 |
13,7 ± 4,2 |
0 |
12,8 ±5,5 |
0,17 ± 0,04 |
0,56 ± 0,14 |
0,17 ± 0,02 |
|
ПкА |
1 |
30,0 ± 11,3 |
6,7 ±4,8 |
5,7 ±2,5 |
0,12 ± 0,02 |
0,20 ± 0,09 |
0,17 ± 0,01 |
|
|
2 |
13,6 ± 5,3 |
0 |
5,8 ±2,8 |
0,15 ± 0,03 |
0,39 ± 0,18 |
0,21 ± 0,02 |
|
|
3 |
17,1 ± 5,3 |
0 |
5,3 ±1,9 |
0,12 ± 0,02 |
0,33 ± 0,15 |
0,18 ± 0,01 |
|
|
4 |
31,4 ± 9,6 |
7,1 ±3,5 |
4,5 ± 1,8 |
0,10 ± 0,01 |
0,17 ± 0,05 |
0,17 ± 0,02 |
|
|
5 |
6,5 ± 2,9 |
0 |
7,9 ±4,1 |
0,21 ± 0,04 |
0,54 ± 0,15 |
0,25 ± 0,03 |
|
ЗББА |
1 |
17,7 ± 6,4 |
3,2 ±2,7 |
2,9 ± 1,6 |
0,12 ± 0,05 |
0,17 ± 0,06 |
0,21 ± 0,02 |
|
|
2 |
8,0 ± 4,5 |
0 |
3,6 ±2,9 |
0,15 ± 0,04 |
0,42 ± 0,21 |
0,24 ± 0,04 |
|
|
3 |
13,3 ± 5,3 |
0 |
4,1 ±2,3 |
0,13 ± 0,03 |
0,33 ± 0,19 |
0,22 ± 0,01 |
|
|
4 |
14,2 ± 1,8 |
0,9 ± 1,7 |
4,0 ± 3,0 |
0,12 ± 0,03 |
0,27 ± 0,16 |
0,22 ± 0,04 |
|
|
5 |
4,1 ± 3,3 |
0 |
5,6 ± 3,0 |
0,26 ± 0,09 |
0,54 ± 0,18 |
- |
При сравнении данных контрольной группы с результатами исследования, проведенного при различных вариантах поражения сосудов нижних конечностей, мы убедились, что одни параметры (IPGK, ДФ) имеют большую ценность в сравнении с другими. На величину исследуемых показателей оказывает влияние поражение как проксимальных, так и дистальных сегментов. И если часть анализируемых показателей дополняет, а не определяет диагностику поражения, то изучение их способствует пониманию механизмов гемодинамических расстройств при данном виде поражения. Особенности развития коллатерального кровообращения и различная степень его участия в компенсации нарушенного магистрального кровотока также оказывают влияние, как на величину, так и на разброс получаемых результатов.
Таблица 59. Параметры полуколичественной оценки допплерограмм артерий нижних конечностей (М ± ![]() ).
).
|
Арте- |
Груп- |
|
D |
AID |
IPGK |
ДФ1 |
ДФ2 |
ДФ3 |
|
рия |
па |
|
|
|
|
|
|
|
|
ОБА |
1 |
504,6 ± 174,5 |
268,8 ± 113,3 |
2,2 ± 1,3 |
5,9 ± 0,4 |
0,8 ± 0,4 |
- |
- |
|
|
2 |
142,0 ±70,0 |
39,0 ±25,0 |
3,9 ± 1,2 |
1,6 ± 0,7 |
0,2 ± 0,1 |
- |
- |
|
|
3 |
573,7 ± 200,7 |
313,3 ± 165,6 |
2,1 ± 0,8 |
6,1 ± 1,5 |
0,8 ± 0,2 |
- |
- |
|
|
4 |
489,0 ± 143,0 |
305,0 ± 75,0 |
1,5 ± 0,4 |
8,4 ± 4,0 |
1,1 ± 0,4 |
- |
- |
|
|
5 |
86,8 ± 39,9 |
29,6 ± 9,6 |
3,3 ± 1,3 |
0,2 ± 0,6 |
0,2 ± 0,1 |
- |
- |
|
ПкА |
1 |
277,0 ± 99,1 |
195,5 ±86,7 |
1,6 ± 0,6 |
7,5 ± 3,2 |
- |
1,3 ± 0,6 |
- |
|
|
2 |
93,7 ± 40,0 |
41,6 ±24,7 |
2,6 ± 0,9 |
2,6 ± 1,0 |
- |
1,6 ± 0,6 |
- |
|
|
3 |
149,2 ±42,5 |
66,5 ± 40,6 |
2,8 ± 1,1 |
3,2 ± 0,8 |
- |
0,5 ± 0,1 |
- |
|
|
4 |
30,4 ± 7,9 |
197,0 ±81,7 |
1,7 ± 0,6 |
9,3 ± 3,7 |
- |
1,2 ± 0,4 |
- |
|
|
5 |
37,3 ±21, 7 |
14,4 ±7,3 |
2,6 ± 0,6 |
1,0 ± 0,6 |
- |
0,9 ± 0,6 |
- |
|
ЗББА |
1 |
11 2,7 ±50,7 |
112,7 ±50,7 |
1,5 ± 0,6 |
8,1 ± 3,1 |
- |
- |
1,1 ± 0,4 |
|
|
2 |
22,9 ± 17,0 |
22,9 ±17,0 |
2,8 ± 1,1 |
2,7 ± 1,6 |
- |
- |
1,0 ± 0,4 |
|
|
3 |
49,9 ± 37,0 |
49,9 ± 37,0 |
2,5 ± 1,1 |
3,8 ± 1,3 |
- |
- |
1,2 ± 0,4 |
|
|
4 |
58,0 ± 39,0 |
58,0 ± 39,0 |
2,2 ± 1,0 |
4,6 ± 2,6 |
- |
- |
0,5 ± 0,2 |
|
|
5 |
7,3 ±3,9 |
7,3 ± 3,9 |
2,3 ± 0,9 |
0,8 ± 0,7 |
- |
- |
0,8 ± 0,3 |
2.4. Спектральный анализ допплеровских сигналов кровотока
Спектральный анализ допплеровских сигналов кровотока получил большое распространение при работе с непрерывноволновыми допплеровскими системами для оценки окклюзирующих поражений экстракраниальных отделов каротидного бассейна, когда зона исследования находится в непосредственной близости от расположения датчика и можно исследовать сосуды на протяжении.
Доступность периферических артерий для локации кровотока лишь в отдельных точках, где они максимально приближены к поверхности тела, и различная степень удаления основных участков поражения от точки исследования снижают значение спектрального анализа для оценки периферических поражений. Так, по данным [22], запись сигналов допплеровского спектра дистальнее основного участка поражения более чем на 1 см является диагностически незначимой и практически не отличается от допплеровских сигналов, записанных проксимально к участку стеноза. На рис. 252 представлены спектры допплеровских сигналов кровотока общих бедренных артерий при 50%-м монофокусном стенозе подвздошных артерий различной локализации - видно, что корреляция данных спектрального анализа со степенью стеноза отсутствует: спектральное расширение (SB) - основной показатель стеноза, характеризующий турбулентный профиль потока, - колеблется в широких пределах - от 19 до 69%.

Рис. 252. Спектрограммы кровотока по общим бедренным артериям при различных локализациях 50% стеноза подвздошной артерии а- спектральное расширение (SB) = 19%, б - SB = 27%, в - SB = 38% г - SB = 69%.
Причина столь широкого разброса величин SB при одной и той же степени сужения становится понятной если вспомнить схему возникновения турбулентности потока (глава 1) В сосуде поток крови имеет ламинарный характер. Уменьшение поперечного сечения при стенозе приводит к увеличению скорости потока. Когда после сужения сосуд резко расширяется, наблюдается «отрыв потока», движение у стенок затормаживается, возникают обратные потоки, формируется турбулентность. Далее поток вновь приобретает ламинарный характер Поэтому спектр полученный тотчас после сужения сосуда и имеющий спектральное расширение 69%, является в данном случае единственно диагностически значимым.
В табл. 60 представлены средние данные параметров спектрального анализа ультразвуковых допплеровских сигналов кровотока общих бедренных артерий при различных вариантах поражения АПС.
Из табл. 60 видно, что максимальный допплеровский сдвиг частот в систолу, определяющий скорость кровотока, возрастает при стенозе и снижается при окклюзии. Индекс сосудистого сопротивления уменьшался при переходе от стеноза к окклюзии, а спектральное расширение при этом возрастало. Наибольшие изменения наблюдались для индекса пульсации при переходе от нормы к окклюзии.
Таблица 60. Анализ спектрограмм кровотока по ОБА при стенозах и окклюзиях АПС (М ± т).
|
Группа |
Максимальный допплеровский сдвиг частот в систолу, кГц |
RI |
'Рок |
SB |
|
Контроль (n = 38) Норма (n = 15) Стеноз (n = 53) Окклюзия (n = 53) |
2,67 ± 0,12 2,61 ± 0,29 3,02 ± 0,11 1,52 ± 0,13 |
0,85 ± 0,01 0,84 ± 0,03 0,84 ± 0,01 0,73 ± 0,02 |
11,91 ± 0,84 9,79 ± 1,49 5,86 ± 0,49 1,85 ± 0,09 |
21,61 ± 1,4 23,21 ± 3,16 30,05 ± 1,45 40,78 ± 1,66 |
Примечание. Контрольная группа подбиралась из лиц без признаков сосудистых заболеваний; группа «норма» подбиралась из пациентов с непораженным АПС.
При сравнительной оценке данных спектрального анализа ультразвуковых допплеровских сигналов каротидной и бедренной локализации мы использовали принципиально различные подходы к оценке получаемых результатов. Если при локации сонных артерий основными показателями диагностики будут величина максимального систолического допплеровского сдвига частот, индекс сопротивления и спектрального расширения, то при локации периферических артерий имеет значение форма максимального систолического допплеровского сдвига частот и индекс пульсации.
Сравнительная оценка данных спектрального анализа допплеровских сигналов кровотока и аналоговых кривых скорости показала, что наиболее чувствительными признаками развития окклюзирующего заболевания оказались: уменьшение или исчезновение волны обратного кровотока, увеличение соотношения A/D (преимущественно за счет удлинения фазы замедления), снижение IPGK и появление ДФ<1. Так, реверсивный кровоток в ОБА отсутствовал у всех больных при окклюзии подвздошной артерии и стенозе >75%. Однако при окклюзии ПБА мы наблюдали реверсивный кровоток в артериях голени у 14% больных и в подколенной артерии у 4,3% больных. Такие же наблюдения описаны М. Hirai, W. Schoop [18]. По нашему мнению, появление реверсивной фазы кровотока дистальнее окклюзии обусловлено хорошо развитым коллатеральным кровообращением и сохраняющейся проходимостью артерий голени. Наиболее показательным, а потому получившим наибольшее распространение индексом окклюзирующего заболевания является индекс пульсации Гёслинга-Кинга - IPGK. Изменения IPGK в норме и при односегментарном проксимальном поражении выражались в нарастании величины IPGK в дистальном направлении; при этом значение IPGK OБA в норме было наиболее высоким, составляя в среднем 8,45 ± 3,71, а индивидуальные колебания находились в пределах 5,6-17,2. IPGK достоверно снижался при окклюзии и резко падал при стенозе. Снижение IPGK OБA по сравнению с нормой отмечено нами при окклюзии ПБА, а более дистально расположенное поражение артерий голени не влияло на этот показатель. Полученные данные согласуются с результатами других авторов [23, 24], которые показали зависимость IPGK как от проксимального, так и от дистального поражения [25]:

Рис. 253. Показатели IPGK при различных вариантах окклюзирующих поражений нижних конечностей: 1 - норма, 2 - стеноз АПС, 3 - окклюзия АПС, 4 - окклюзия бедренно-подколенного сегмента, 5 - окклюзия артерий голени, 6 - многосегментное поражение.
При изолированных поражениях ПБА или артерий голени падение IPGK на соответствующих уровнях также оказалось высокодостоверным. При многоуровневых поражениях динамика IPGK имела важное значение для диагностики прежде всего дистальных поражений (рис. 253).
2.5. Сегментарное систолическое артериальное давление в нижних конечностях
Для возникновения кровотока между двумя точками сосудистой системы необходимо существование разницы давлений (градиента давления). В то же время по мере продвижения артериальной пульсовой волны к периферии нижних конечностей систолическое давление увеличивается. Это увеличение является следствием отражения волны от области с относительно высоким периферическим сопротивлением и различий в податливости (compliance) стенок у центральных и периферических артерий. Таким образом, систолическое давление, измеренное на лодыжке, в норме будет выше, чем на плече. В этой ситуации для поддержания кровотока в дистальном направлении необходимо, чтобы диастолическое и среднее давление постепенно снижались. В то же время исследования физиологов показали, что при окклюзирующих заболеваниях существенное падение диастолического давления в нижних конечностях наступает только при наличии тяжелого проксимального стеноза, тогда как максимальное систолическое давление уменьшается при меньших степенях заболевания [26-28]. Поэтому определение максимального систолического артериального давления является более чувствительным неинвазивным методом диагностики артериального сужения.
К настоящему времени мнение большинства специалистов сводится к тому, что ССД, измеренное с помощью УЗДГ, является количественным объективным
и чувствительным показателем окклюзирующего процесса и может отражать степень функциональной недостаточности в исследуемом сегменте конечности.
Первым измерение ССД при окклюзирующих заболеваниях нижних конечностей предложил Т. Winsor в 1950 г. [29], а неинвазивное измерение ССД с помощью допплеровского метода впервые описано в 1967 г. R. Ware и С Laenger [30]. Метод включает применение пневматической манжеты, которую плотно накладывают вокруг исследуемого сегмента конечности, и может быть использован там, где возможно наложение манжеты. Давление в манжете, при котором восстанавливается кровоток (что регистрируют при допплерографии), в дистальном по отношению к манжете участке конечности при декомпрессии представляет собой систолическое АД на уровне манжеты или ССД Необходимыми условиями для получения точных результатов являются достаточная скорость декомпрессии манжеты, проведение повторных (до трех раз) измерении и соответствующая длина и ширина манжеты.
Размеру манжет для измерения ССД зарубежные исследователи уделяют особое внимание. После длительной и широкой дискуссии по этому вопросу Американская ассоциация кардиологов разработала рекомендации, согласно которым ширина пневматической манжеты должна составлять 40% окружности в исследуемом сегменте или превышать на 20% диаметр исследуемого участка конечности, а длина манжеты должна вдвое превышать ее ширину.
В своих исследованиях мы использовали манжеты фирмы «Hokanson» (США) с размерами пневматической камеры бедренных манжет 11,5 х 40 см и плечевых манжет 10 х 40 см, с размером чехлов 12,5 х 80 и 11 х 80 см соответственно.

Рис 254. Методика наложения пневматических манжет для измерения сегментарного АД нижних конечностей
Для проведения многоуровневой манометрии необходимо иметь 10 манжет 6 плечевых и 4 бедренных. Плечевые манжеты накладывают на оба плеча для определения давления в плечевых артериях и на обе голени ниже коленного сустава и над лодыжкой, а бедренные манжеты накладываются на бедро в верхней и нижней трети (рис 254) Измерение ССД на всех четырех уровнях нижней конечности проводят по сигналам от дистальных отделов сосудистой системы ЗББА - у лодыжки или АТС - в первом межпальцевом промежутке В расположенную вокруг конечности манжету нагнетают воздух до уровня, превышающего на 15-20 мм рт ст. систолическое артериальное давление Допплеровский датчик устанавливают над артерией дистальнее манжеты. Затем начинают медленно выпускать воздух из манжеты до момента восстановления допплеровских сигналов кровотока. Давление, при котором восстанавливается кровоток в точке регистрации дистальнее манжеты, представляет собой систолическое давление на ее уровне. Вначале определяют давление на верхних конечностях на уровне плеча по сигналам от плечевой артерии. Нередко в норме - при отсутствии поражений артерий, снабжающих кровью верхние конечности, - выявляют умеренную асимметрию АД, равную 10-15 мм рт. ст. (подробно в главе 2).

Рис. 255. Сегментарные измерения ИД нижних конечностей в норме и при вариантах облитерирующих поражений артерий: 1 - норма. 2 - стеноз АПС, 3 - окклюзия АПС, 4 - окклюзия бедренно-подколенного сегмента, 5 - окклюзия артерий голени, 6 - многосегментное поражение.
В связи с этим системным давлением считают большее АД. Затем проводят измерение ССД на всех четырех уровнях нижней конечности, начиная с нижней манжеты по сигналам от дистальных отделов сосудистой системы (как уже говорилось, ЗББА - у лодыжки или АТС - в первом межпалыцевом промежутке). При отсутствии сигналов от АТС, что может быть связано с анатомическими вариантами ее развития, например, при рассыпном типе, можно лоцировать ПББА над областью голеностопного сустава. При наличии сигналов кровотока от обеих артерий измерение давления проводят по той, на которой получено большее значение ССД на всех четырех уровнях, а по второй артерии измерение ССД проводят на двух уровнях голени - для исключения возможного поражения артерии. Целесообразно соблюдать последовательность измерений от дистальной манжеты к проксимальной, так как иначе измерение давления в дистальных манжетах будет проходить в условиях постокклюзионной реактивной гиперемии.
Для того чтобы исключить влияние на профиль ССД индивидуальных отличий, по величине системного давления рассчитывают предложенный в 1950 г. Т. Winsor [29] индекс давления (ИД) для каждого уровня манжеты. ИД представляет собой отношение давления, полученного на конкретном уровне, к системному давлению, измеренному на плече (в отечественной литературе ИД еще называют лодыжечным индексом давления (ЛИД), хотя, если быть точным, последний отражает лишь отношение давления на лодыжке (IV манжета) к системному давлению. Обычно формируют полный профиль ССД для каждой конечности на основе абсолютных величин ССД и ИД на всех уровнях конечности.
В норме ССД, измеренное в верхней трети бедра, может превышать плечевое на 30-40 мм рт. ст., что обусловлено необходимостью подачи избыточного давления в манжету для компрессии мышечной массы бедра.
ИД превышающий 1.2, указывает на отсутствие гемодинамически значимого поражения АПС Если ИД, находится в пределах 0.8-1.2 то весьма вероятно наличие стенозирующего процесса в АПС При ИД1 менее 0,8 имеет место окклюзия АПС (рис. 255).
Разность ССД между конечностями в верхней трети бедра, равная или превышающая 20 мм рт. ст. позволяет предположить наличие окклюзирующего заболевания выше паховой складки на стороне с меньшим давлением. В то же время подобное снижение давления в верхней трети бедра может иметь место при сочетанном поражении ПБА и ГБА В этих ситуациях для выявления распространения заболевания на АПС полезен метод компрессионного измерения ССД в ОБА наряду с анализом допплерограмм кровотока по ОБА.
В норме градиент ССД между двумя соседними манжетами при четырех-манжеточной методике измерения не должен превышать 20-30 мм рт. ст. Градиент, превышающий 30 мм рт. ст, позволяет предполагать наличие выраженного стенозирующего процесса, а при окклюзии он равен или превышает 40 мм рт. ст.
Пальцевое давление нижних конечностей обычно определяют при подозрении на окклюзию пальцевых артерий или подошвенной дуги. В норме систолическое давление в пальцах составляет около 80-90% от плечевого давления. ИД палец/плечо ниже 0,6 считают патологическим, а значение его ниже 0 15 (или абсолютное значение давления меньше 20 мм рт. ст.) обычно имеет место у пациентов с болями в покое. Принцип измерения пальцевого давления тот же, что и на остальных уровнях нижних конечностей, а специальные пальцевые манжеты должны иметь размер 2,5 х 10 см или превышать диаметр исследуемого пальца в 1,2 раза.
Измерение пальцевого давления в клинической практике с помощью УЗДГ используют редко в связи с затруднениями в локации пальцевых артерий стоп, в особенности дистальнее места наложения пальцевой манжеты Проблема локации пальцевых артерий существует и у здоровых лиц, а у больных с декомпенсацией артериального кровообращения в связи с редукцией кровотока, облитерацией дистальных сосудов, явлениями гиперкератоза и другими причинами локация дистальных сосудов методом УЗДГ становится трудновыполнимой. Поэтому для измерения пальцевого давления обычно используют метод фотоплетизмографии [31]
Несмотря на успехи неинвазивной диагностики в установлении факта артериального окклюзирующего заболевания, сохраняются трудности в точном определении уровня поражения.
Наиболее сложной остается проблема точной локализации и количественной оценки поражений АПС, особенно в сочетании с поражением ПБА. Как показали наши исследования и исследования зарубежных клиник, успешная диагностика таких сочетанных поражений с помощью допплеровского метода достигается только у 71-78% больных [32]. В Brener et al. [33] показали, что у 55% больных с ангиографически доказанным поражением аорто-подвздошного сегмента ССД в верхней трети бедра (I манжета) было нормальным, а у 31 %
больных с окклюзией ПБА без поражения подвздошных артерий ССД на манжете было выше системного.
В табл. 61 представлены данные измерения ССД в верхней трети бедра, расчета градиента бедренноплечевого давления и ИД, в зависимости от степени окклюзирующего поражения АПС по ангиографическим данным.
Таблица 61. ССД в верхней трети бедра, градиент бедренно-плечевого давления и ИД., в зависимости от степени окклюзирующего поражения АПС.
|
Группа |
Степень |
ССД в верхней |
ССД бедро-плечо |
ид, |
|
|
стеноза, % |
трети бедра |
(М ± a; min-max) |
|
|
I |
0 |
145, 95 ± 9,77 |
15,71 ± 3,09 |
1,11 ± 0,026 |
|
|
|
95-190 |
(-5)-45 |
0,95-1,36 |
|
II |
50 |
140,70 ± 5,00 |
6,21 ± 1,97 |
1,04 ± 0,016 |
|
|
|
90-180 |
(-20)-30 |
0,88-1,21 |
|
III |
51-75 |
136,21 ± 5,03 |
(-10,94) ± 2,36 |
0,93 + 0,029 |
|
|
|
95-225 |
(-5)-60 |
0,63-1,48 |
|
IV |
76-90 |
101,11 ± 3,80 |
(-39,03) ± 3,40 |
0,73 ± 0,022 |
|
|
|
50-140 |
(-5)-95 |
0,42-0,98 |
|
V |
91-100 |
84,78 ± 3,36 |
(-66,91) ± 3,24 |
0,56 ± 0,017 |
|
|
|
40-100 |
(-5)-140 |
0,25-0,81 |
Видно, что, несмотря на имеющуюся тенденцию к снижению исследованных параметров по мере нарастания степени окклюзирующего заболевания АПС, в каждой группе определяется большой разброс данных, что, бесспорно, влияет на достоверность диагностики. Различная степень развития мышечной массы бедра, ригидность артериальной стенки наличие дистальных поражений и другие факторы могут быть причиной полученной вариабельности данных.
2.5.1. Компрессионное измерение артериального давления в общей бедренной артерии
В практике сосудистой хирургии при решении вопроса о выборе необходимого уровня реконструкции требуется оценка состояния общих бедренных и подвздошных артерий, в первую очередь на основании такого важного гемодинамического параметра, как АД. Однако даже наиболее проксимально накладываемая на бедро манжета отражает давление в дистальных отделах ОБА и проксимальных отделах ее основных ветвей. В связи с этим нами была использована методика измерения компрессионного артериального давления (КАД) в ОБА которая представлена на схеме (рис. 256 а) Пневматическую камеру педиатрической манжеты размером 5,0 х 9,0 см накладывают на место проекции бедренной артерии под пупартовой связкой после предварительной пальпации пульса ОБА или локации сигналов кровотока в ОБА В камере создают давление в 10 мм рт. ст. выпускники перекрывают так, что создают замкнутый контур между манжетой и измерительной системой. В период исследования проводят постоянную локацию сигналов кровотока по ЗББА или АТС. Бедренную манжету постепенно придавливают ладонью руки исследователя до исчезновения сигналов кровотока (когда компрессия ладонью не давала эффекта, применяли изготовленную из плотной пластмассы пластину, соответствующую по размеру манжете которую накладывали на пневматическую камеру, что обеспечивало ее равномерное сжатие) Давление, при котором возникают сигналы кровотока (после декомпрессии), равно давлению в ОБА.

Рис. 256. Измерение компрессионного АД. а - схема измерения, б в - сопоставление компрессионного АД пунктирная линия) и прямого пункционного измерения АД сплошная линия» в ОБА у больного с синдромом Лериша б - правая ОБА (компрессионный метод: АД=120 мм рт. ст. ИД=0,69 пункционное измерение: систолическое АД=110 мм от ст. ИД=С 69) в - левая ОБА (компрессионный метод АД=175 мм рт. ст. ИД=1,0, пункционное измерение систолическое АД=160 мм рт. ст. ИД= 1,0),
Метод компрессионного измерения ССД в ОБА впервые описан J. Colt [34]; дальнейшее развитие метод получил в работах [35. 36]. Он апробирован на группе здоровых лиц; обследовано 15 человек в возрасте от 26 до 54 лет (средний возраст 38 6 года) без признаков сердечно-сосудистой патологии. Величина КАД в ОБА сопоставлена с системным артериальным (плечевым) давлением, при этом индекс КАД составил 1.14 ± 0 18 (колебания 1,0-1,24). На рис. 256 б представлен пример сопоставления КАД и прямого пункционного измерения АД в обеих ОБА у больного с синдромом Лериша, иллюстрирующий хорошее соответствие полученных результатов. Подобные результаты
при сопоставлении КАД, ССД в верхней трети бедра и интраоперационного измерения давления в ОБА получены В. Brener et al. [33].
2.5.2. Функциональные пробы с вазодилатацией артерий нижних конечностей
Измерение АД у лодыжки в покое с целью выявления артериальной недостаточности нижних конечностей во многих клинических наблюдениях оказывается достаточным тестом. Большую проблему представляют больные с жалобами на перемежающуюся хромоту при наличии у них в покое нормальных или пограничных показателей. В таких случаях необходимо изучение периферической гемодинамики в условиях нагрузочного, или так называемого стресс-теста, в основе которого лежит эффект вазодилатации в ответ на физическую нагрузку, постокклюзионную гипоксию или использование фармакологических агентов, в частности, нитроглицерина.
Ценность нагрузочных проб определяется возможностью обнаружить гемодинамически значимые поражения артерий, не выявляемые в покое, и оценить функциональное состояние кровообращения конечностей [37-43].
Эффект стресс-теста лучше всего демонстрируется при анализе измерений у больного с одной здоровой конечностью и другой конечностью, пораженной окклюзирующим процессом. Артериальный кровоток в здоровой ноге определяется сопротивлением сосудов оттока (концевые артерии, артериолы, капилляры и венозное русло); на пораженной конечности кровоток определяется наряду с сопротивлением русла оттока сопротивлением в проксимальных отделах на уровне стеноза. В покое обе конечности имеют одинаковый базальный кровоток для поддержания обмена в мышцах, коже и костях. На пораженной стороне эффект проксимального сопротивления компенсируется умеренной вазодилатацией так, что кровоток становится сопоставимым с нормальной стороной. Однако стеноз является причиной турбулентности с потерей кинетической энергии и приводит к снижению дистального давления.
При нагрузке возрастающие метаболические потребности приводят к выраженной дилатации мышечных артериол и увеличению артериального кровотока. На здоровой стороне он может увеличиваться в 5 раз в сравнении с базовым уровнем. В пораженной конечности увеличение кровотока лимитировано проксимальным сопротивлением на уровне стеноза. Когда метаболические потребности работающей мускулатуры не удовлетворяются ограниченным артериальным кровотоком, развиваются симптомы клаудикации. Помимо этого, наступает дальнейшее падение артериального давления на уровне артериального стеноза, поскольку сопротивление на нем возрастает при увеличении скорости кровотока. Это падение давления измеряется как падение систолического давления на лодыжке. Степень его снижения и длительность восстановления тесно связаны с тяжестью артериальной недостаточности.
Самой простой формой стресс-теста является ходьба по ступенькам вверх и вниз, пока не возникнут симптомы клаудикации и не исчезнет пальпируемый в покое пульс; феномен «исчезновения пульса» указывает на наличие артериального окклюзирующего заболевания.
В клинической практике в качестве стресс-теста большое распространение получили 2 варианта нагрузки: дозированная ходьба по бегущей дорожке (тредмил-тест) и тест сгибания и разгибания нижней конечности.
Тредмил-тест. Бегущую дорожку устанавливают рядом с кушеткой, на которую пациент может лечь после окончания теста. Используют угол наклона полотна дорожки 12°, скорость движения около 3 км/ч. Продолжительность теста - до появления признаков клаудикации или 5 мин. при их отсутствии. По окончании нагрузки проводят измерение лодыжечного ССД каждые 30 сек. в течение первых 4 мин. и далее ежеминутно до восстановления исходных данных. Тест оценивают по трем показателям: 1) длительность нагрузки; 2) максимальное падение лодыжечного ИД; 3) время, необходимое для возврата к исходному уровню. Обычно восстановление происходит до окончания 10 мин. Однако при тяжелых степенях ишемии оно может длиться 20-30 мин.
Тест со сгибанием и разгибанием конечности. Обследуемый в положении лежа на спине выполняет полное сгибание и разгибание нижней конечности в коленном суставе (30 раз в минуту) или максимальное тыльное сгибание и разгибание стопы (60 раз в минуту) раздельно для каждой конечности с интервалом 10-15 мин. Упражнения продолжают до тех пор, пока пациент не будет вынужден прекратить их из-за болей в конечности. Если клинические симптомы ишемии не возникнут в течение 3 мин., то пробу считают нормальной и прекращают. Оценивают тест по тем же показателям, что и при тредмил-тесте (табл. 62).
Таблица 62. Динамика лодыжечного ИД до и после теста со сгибанием и разгибанием конечности в норме и при вариантах окклюзии сосудов нижних конечностей.
|
Норма или окклюзированный сегмент |
Лодыжечный ИД в состоянии покоя |
Лодыжечный ИД после теста сгибания-разгибания | |
|
в коленном суставе |
в голеностопном суставе | ||
|
Норма Аорто-подвздошный Бедренно-подколенный Аорто-подвздошный + бедренно-подколенный |
1,17 ± 0,08 0,58 ± 0,07 0,67 ± 0,13 0,37 ± 0,11 |
1,10 ± 0,16 0,50 ± 0,15 0,49 ± 0,1 5 0,26 ± 0,17 |
1,12 ± 0,14 0,44 ± 0,1 7 0,55 ± 0,17 0,30 ± 0,19 |
В то же время при выполнении нагрузочных проб необходимо наличие мониторного наблюдения ЭКГ, специального оборудования и обученного персонала для оказания помощи в случаях острого нарушения сердечной деятельности. Кроме того, применение пробы ограничивает ряд общих и местных факторов: неврологические нарушения, отсутствие одной конечности, тяжелая ишемия конечностей и др. Нагрузочные тесты не лишены также субъективности в оценке максимального времени ходьбы, что значительно затрудняет их стандартизацию.
Постокклюзионная реактивная гиперемия (ПОРГ) - распространенный и альтернативный нагрузочному «стрессовый» тест - вызывает изменения, аналогичные постнагрузочным. Будучи эквивалентной физической нагрузке, ПОРГ обладает несомненным преимуществом перед ней, так как является объективным, легко воспроизводимым тестом, не имеющим указанных выше ограничений. Кроме того, ПОРГ позволяет оценить состояние кровообращения в каждой конечности в отдельности, не требует больших затрат времени и может быть выполнена в раннем послеоперационном периоде.
Как и нагрузочные тесты, ПОРГ позволяет установить наличие гемодинамически значимых поражений, не проявляющихся при исследовании в покое, помогает в диагностике на ранних этапах заболевания, что делает этот тест обязательным у больных с подозрением на окклюзирующее заболевание.
ПОРГ может быть использована в двух вариантах.
I вариант. Пневматические манжеты накладывают на плечо, на верхнюю треть бедра и нижнюю треть голени у лодыжки. Измеряют давление на этих уровнях по ранее описанной методике. Затем в бедренную манжету на 4 мин. подают давление, превышающее на 40-50 мм рт. ст. исходное для этого уровня давление. После декомпрессии бедренной манжеты измеряют давление у лодыжки и рассчитывают ИД через 30, 60 с и затем в течение 9 мин. ежеминутно. Полученные нами результаты ПОРГ при различных вариантах поражения сосудов нижних конечностей представлены на рис. 257. Реакция сосудов здоровой конечности проявляется в незначительном падении лодыжечного давления по отношению к исходному и быстрому (в течение 1 мин.) его восстановлению. Изменения при монофокальном стенозе более выражены. Проксимальная монофокальная окклюзия приводит к более выраженным изменениям в сравнении сдистальной. Наиболее выраженные изменения наступают у больных с поражением во всех трех сегментах сосудистой системы нижних конечностей и достигают крайних степеней при вовлечении в процесс ГБА.

Минуты постокклюзионной гиперемии
Рис. 257. Измерения лодыжечного давления в % к исходному в ответ на реактивную постокклюзионную гиперемию при различных вариантах поражения сосудов нижних конечностей'. 1 - здоровая конечность, 2 - изолированный стеноз НПА, 3 - изолированная окклюзия ПБА, 4 - изолированная окклюзия НПА. 5 - сочетанная окклюзия НПА и ПБА, 6 - сочетанная окклюзия НПА и ПБА + стеноз артерий голени, 7 - сочетанная окклюзия НПА, ПБА, стеноз артерий голени + поражения ГБА.
II вариант. Реактивную гиперемию получают аналогично I варианту. До начала процедуры выполняют запись средней скорости кровотока в ОБА в покое. После декомпрессии проводят постоянную запись средней скорости кровотока в ОБА до тех пор, пока амплитудные значения скорости не вернутся к доокклюзиовному уровню.

Рис. 258. Реакция кровотока по ОБА на тест реактивной гиперемии после декомпрессии в норме, vi - начальная скорость, vp - пиковая скорость после окклюзии, Т1/2 - время, в течение которого скорость возвращается к 50% от ее пиковой величины, ![]() - относительный рост скорости в процессе гиперемии.
- относительный рост скорости в процессе гиперемии.
Полученную в ходе теста допплерограмму оценивают по двум параметрам: а) по относительному росту (![]() ) средней скорости в процессе гиперемии по отношению к покою (в процентах); б) по интервалу времени, за которое средняя скорость кровотока возвращается к 50% от своего пикового значения (индекс Т1/2) (рис. 258).
) средней скорости в процессе гиперемии по отношению к покою (в процентах); б) по интервалу времени, за которое средняя скорость кровотока возвращается к 50% от своего пикового значения (индекс Т1/2) (рис. 258).
Нитроглицериновую пробу применяют как один из основных тестов фармакологической вазодилатации с целью улучшения выявления кровотока в дистальных отделах артерий голени. Проходимость дистальных отделов сосудов нижних конечностей является одним из факторов, определяющих успех реконструктивной операции. На рентгеноконтрастных ангиограммах, особенно при наиболее часто применяемом транслюмбальном методе, артерии голени и стопы визуализируются плохо, в связи, с чем в оценке дистального русла возрастает роль УЗДГ. Основной вопрос состоит в дифференциальной диагностике анатомического поражения и функциональной гемодинамической недостаточности периферических сосудов. Последняя связана с тем, что поражение проксимальных отделов сосудистой системы (в особенности многосегментное, с плохо развитым коллатеральным кровотоком) и появление вазоспастических реакций, в частности, холодовых, приводят к недостаточности перфузии непораженных дистальных сосудов. Локация сосудов при УЗДГ становится невозможной, так как происходит снижение параметров кровотока до величин, лежащих за пределами разрешающей способности метода (ЛСК < 1 см/с, ССД (10-15 мм рт. ст.). В таких случаях показанной может стать проба с вазодилатацией (согревание конечности, фармакологические агенты), когда за счет снижения периферического сопротивления достигается увеличение периферического кровотока.
Мы применяли фармакологическую вазодилатацию нитроглицерином (1 таблетка сублингвально) у больных с различной степенью ишемии с локацией кровотока (до приема нитроглицерина и через 1-3 мин. после его приема) в ЗББА и АТС (табл. 63).
Таблица 63. Локация кровотока в ЗББА и АТС до и после приема нитроглицерина.
|
|
|
Число |
До приёма |
После приёма | ||
|
Степень |
Число |
исследо |
нитроглицерина |
нитроглицерина | ||
|
ишемии |
больных |
ванных |
Число лоци- |
% локали |
Число лоци- |
% локали |
|
конечности |
|
артерии |
рованных |
зации |
рованных |
зации |
|
|
|
|
артерий |
|
артерий |
|
|
II |
22 |
66 |
59 |
88,39 |
63 |
95,45 |
|
III |
14 |
46 |
34 |
73,91 |
39 |
84,78 |
|
IV |
14 |
52 |
28 |
53,84 |
35 |
67,30 |
|
Всего |
50 |
164 |
121 |
73,78 |
137 |
83,53 |
Таблица 64. Кровоток в артериях голени по данным УЗДГ до и после нитроглицериновой пробы и по данным интраоперационной ангиографии.
|
Стадия ишемии |
Число больных |
Число исследо ванных |
Число артерий, в которых отсутствует кровоток | ||
|
Данные УЗДГ до пробы |
Данные УЗДГ после пробы |
Данные ангиографии | |||
|
II |
3 |
6 |
4 |
3 |
3 |
|
III |
5 |
10 |
8 |
6 |
6 |
|
IV |
7 |
14 |
13 |
11 |
9 |
|
Всего |
15 |
30 |
25 |
20 |
18 |
Как видно из табл. 63, частота локации артерий прогрессивно снижается в зависимости от степени ишемии конечностей. Прием нитроглицерина повышает частоту локации артерий независимо от степени ишемии. У 15 больных результаты пробы с вазодилатацией были сопоставлены с результатами интраоперационной ангиографии (табл. 64). Из 12 проходимых по ангиографическим данным артерий методом УЗДГ кровоток установлен в 5 артериях (41,6%), а после приема нитроглицерина - в 10 (83,3%).
На основании проведенного исследования мы считаем, что пробу с вазодилатацией нитроглицерином следует применять в целях повышения разрешающей способности метода УЗДГ и улучшения выявления кровотока в дистальных отделах артерий голени, особенно при тяжелой степени ишемии конечностей. Неудача выявления какой-либо из артерий голени после приема нитроглицерина с высокой степенью достоверности может указывать на ее окклюзию.
2.6. Ультразвуковая допплерография в оценке степени ишемии нижних конечностей
Тяжесть ишемического синдрома нижних конечностей при окклюзирующих заболеваниях брюшной аорты и ее ветвей обусловлена недостаточностью периферического кровообращения и зависит от локализации окклюзии или стеноза, наличия многоэтажных поражений, проходимости дистального сосудистого русла и степени развития коллатерального кровообращения.
Клиническое описание тяжести сосудистого заболевания конечностей было впервые предложено R. Fontaine [44], который выделял 3 стадии: перемежающаяся хромота (I), боль в покое (1|) и гангрена или язвы конечностей (111). Позднее эта градация была расширена разделением больных с перемежающейся хромотой в зависимости от дистанции ходьбы. На этом принципе построена классификация, разработанная А.В. Покровским в 1979 г. [2]. которую используют и в настоящее время. Согласно этой классификации, I стадия заболевания - боли в нижних конечностях - возникает после прохождения более 1000 м; НА-дистанция 200-1000 м: МБ - дистанция 25-200 м; III - дистанция менее 25 м или боль в покое; IV - наличие гангрены или язв конечностей.
Степень ишемических проявлений в нижних конечностях определяют суммацией гемодинамического эффекта выраженности и этажности поражения сосудистой системы нижних конечностей на периферическом уровне, и потому изменения регионарной гемодинамики в дистальных отделах могут быть критериями в оценке степени ишемии нижних конечностей.
Проведенное раздельно для больных с одно- и многоэтажными окклюзия- ми при одной и той же степени ишемии изучение регионарной гемодинамики показало, что достоверной разницы параметров регионарной гемодинамики между этими группами больных нет Несомненно, архитектоника тромбооблитерирующего поражения оказывает влияние на течение и сроки хронической артериальной недостаточности Однако стадию заболевания определяет функциональное состояние регионарного кровообращения
В клинической практике наиболее принятом является оценка степени ишемии нижних конечностей по величине основных параметров УЗДГ (ССД и ИД на уровне лодыжки ЛСК) в сопоставлении с формой допплерограммы. В то же время полезным оказывается сопоставление параметров артериального и венозного давления на основе определения постокклюзионного венозного давления на уровне лодыжки (ПОВД) и расчетного артерио-венозного индекса (АВИ), вычисляемого по формуле АВИ=ПОВД/ССД х 100%,
Методика определения ПОВД та же, что и ССД: при снижении компрессионного давления в IV манжете на лодыжке первые пульсовые удары соответствуют ССД а при дальнейшем снижении давления регистрируют низкочастотный венозный шум, момент появления которого отражает величину ПОВД.
В табл. 65 представлены параметры периферического кровотока нижних конечностей на уровне лодыжки и стопы в зависимости от степени ишемии нижних конечностей. Из нее видно, что изменения регионарной гемодинамики при переходе от нормы ко II и III стадиям ишемии характеризуются последовательным и достоверным снижением показателей гемодинамики, при IV стадии выявляют большой разброс данных и отсутствие достоверных различий с III стадией ишемии. Сопоставление данных ультразвуковых методов с изучением микроциркуляции кожи ног по результатам лазерной допплерометрии и чрескожного мониторирования парциального давления 02 и СО показало, что у некоторых больных, отнесенных к IV стадии, показатели регионарной гемодинамики соответствуют II стадии а трофические язвы возникали в результате травматического повреждения целостности кожных покровов в условиях нарушенного кровообращения-" и не являлись истинными ишемическими язвами [45]. Таким образом, оценка степени ишемии нижних конечностей при наличии язвенно-некротических изменений является наиболее сложной задачей, требующей комплексного подхода на основе изучения состояния макро- и микрогемодинамики.
Таблица 65. Параметры периферического кровотока нижних конечностей в зависимости от степени их ишемии.
|
Показатель |
Норма |
Стадия ишемии | |||
|
|
и 1 стадия |
II А |
II Б |
III |
IV |
|
ССД, мм рт. ст. |
138,9 ±3,14 |
74,8 ±2,18 |
71,6+1,57 |
54,3 ± 1,12 |
50,5 ± 1,69 |
|
ИД |
1,11 ±0,08 |
0,69 ± 0,21 |
0,56 ±0,14 |
0,38 ±0,13 |
0,35 ± 0,46 |
|
ПОВД, мм рт. ст. |
18,9 ±2,1 |
23, 8 ±1,6 |
25, 6 ± 1,9 |
19,4 + 1,4 |
20,7 ± 1,9 |
|
АВИ, % |
13,6 ± 1,7 |
31,8 ±4,4 |
35, 9 ±5,1 |
35,4 ±3,6 |
Т 40,8 ±7,1 |
Повышение ПОВД и АВИ на фоне снижения ССД достоверно отмечают во N стадии ишемии, что обусловлено результатом сброса артериальной крови из артериол непосредственно в венулы минуя капиллярное ложе. Целесообразность артерио-венозного шунтирующего кровотока заключается в том, что он способствует увеличению скорости кровотока по магистральным артериям ниже уровня окклюзии и тем самым, предотвращает их закупорку.
Уменьшающийся по мере нарастания ишемии артериальный приток приводит к снижению значений ПОВД Однако величина АВИ, отражающего состояние шунтирующего кровотока, практически не меняется (табл. 65) а нарастающая гипоксия тканей является результатом снижения кровообращения мягких тканей стопы на фоне нарастающего истощения второго механизма компенсации - дилатации системы микроциркуляции с угнетением вазоконстрикторных реакций [45].
Измерение ПОВД и АВИ позволяет понять процессы развития хронической ишемии нижних конечностей и формирования механизмов компенсации кровообращения, к которым относят артерио-венозный шунтирующий кровоток и вазодилатацию в системе микроциркуляции.
При оценке степени ишемии по данным неинвазивной диагностики необходимо принимать во внимание этиологию заболевания. Так, при сахарном диабете (а также при облитерирующем эндартериите, тромбангиите) показатели гемодинамики могут значительно отличаться от таковых при атеросклерозе особенно в начальный период заболевания сахарным диабетом, что связано с преимущественным поражением артерий стопы при сохраняющейся проходимости артерий голени до уровня лодыжки в течение длительного времени. При сахарном диабете показатели ИД у лодыжки будут соответствовать норме или превышать ее а изменения допплерограмм у лодыжки и на уровне тыла стопы будут незначительными и не соответствующими тяжести ишемических поражений в пальцах стопы. В этих условиях диагностическую значимость приобретают методы изучения микроциркуляции, такие как лазерная допплерфлоуметрия и чрескожное мониторирование парциального давления О2 и СО2.
2.6.1. Алгоритм исследования больных с Поражением артерий нижних конечностей
УЗДГ для диагностики хронических окклюзирующих заболеваний периферических артерий нижних конечностей применяется в НЦССХ им А.Н. Бакулева

Рис. 259. Схема информативности определения пульса, ИД и постнагрузочного лодыжечного давления в диагностике заболевания у больных с жалобами на перемежающуюся хромоту.
РАМН с 1978 г. Обследовано более 20 тыс. больных с различными вариантами поражения периферических артерий, а метод УЗДГ стал неотъемлемой частью системы обследования больных с указанной патологией. Накопленный опыт позволил определить рациональный диагностический комплекс на различных этапах отбора и лечения больных с поражением периферического кровообращения нижних конечностей [46]. На рис. 258 схематично изображены наши представления об информативности определения пульса, ИД в покое и в ответ на нагрузку при диагностике артериального заболевания у больных с жалобами на перемежающуюся хромоту. Скрининговое исследование на догоспитальном этапе позволяет дифференцировать обструктивное поражение периферических артерий от нейроортопедических нарушений. Установленный факт артериального заболевания определяет необходимость проведения полного комплекса неинвазивного обследования периферических артерий, позволяющего выявить локализацию и протяженность поражения, степень гемодинамических расстройств, вид поражения. При необходимости хирургического лечения показано аорто-артериографическое исследование для определения возможности проведения и необходимого объема хирургической реконструкции.
3. Дуплексное сканирование артерий нижних конечностей
Реальная локализация поражения сосудов нижних конечностей и оценка гемодинамических последствий стенозирования на основе неинвазивных методик стали возможны с развитием технологий ультразвукового исследования. Надежды, связанные с получением двухмерного черно-белого изображения сосуда в В-режиме в реальном масштабе времени, не оправдались.

Рис 260 Цветовое дуплексное сканирование бифуркации общей бедренной артерии в норме, а - режим ЦДК. 6 - режим ЭДК.
Оказалось, что некоторые атеросклеротические бляшки и внутрисосудистые тромбы дают такое же акустическое отражение как и кровь, из-за чего они не могут быть выявлены Дуплексное сканирование с ЦДК, реализованное в современных ультразвуковых сканерах [47 48] является современной и информативной диагностической технологией, позволяющей получить объективную информацию о состоянии структуры крупных, средних и мелких сосудов и их функциях.
По мнению многих авторитетных специалистов, отраженному в материалах Международного конгресса по ангиологии, состоявшегося в Лондоне в 1995 г., дуплексное сканирование должно стать основным методом диагностики сосудистой патологии и «золотым стандартом» для других методик.
Изображение в В-режиме позволяет выявить исследуемую артерию, оценить анатомические особенности, установить обызвествление стенки сосуда и направить допплеровский датчик в центр потока по визуализированной артерии для анализа характеристик кровотока При ЦДК красный цвет указывает на поток направленный к датчику синий - от него. Поскольку цветное изображение накладывается на черно-белое в реальном масштабе времени, артерия может быть видна как пульсирующий красный просвет, тромб или атероскле-ротическая бляшка - в виде черного участка, выдающегося в просвет, а плотный стеноз - как белый выступ. Для пересчета допплеровского сдвига частот в скорость необходимо знать угол между ультразвуковым пучком и кровеносным сосудом Большинство современных дуплексных систем обеспечивает измерение значений угла непосредственно с черно-белого изображения сосуда Курсор выравнивают по оси сосуда, и прибор автоматически рассчитывает скорость кровотока.
Диагностические возможности дуплексного сканирования расширены за счет введения метода ЭДК. Метод основан на анализе амплитуды ультразвуковых колебаний, отраженных от движущихся объектов. В отличие от ЦДК, метод ЭДК мало зависим от угла между ультразвуковым лучом и кровотоком. более чувствителен, особенно к медленным потокам, и более помехоустойчив.
Дуплексный датчик содержит раздельные кристаллы для построения
изображения и допплеровского определения скорости. Низкочастотные датчики способны визуализировать структуры на глубине до 20 см. Поэтому для исследования аорто-подвздошной зоны необходимы датчики с частотой 2,5 и 3,5 МГц. Однако такие датчики имеют ограниченную разрешающую способность и низкую чувствительность при редукции кровотока. При исследовании поверхностно расположенных сосудов нижних конечностей рекомендуют использование линейных датчиков с частотой 5, 7 и 10 МГц.

Рис. 261. Цветовое дуплексное сканирование ОБА и ее бифуркации, а - 50% стеноз левой ОБА (режим 5 АЩК): 1 - атеросклеротическая бляшка по задней стенке, переходящая на устье ГБА (2), 3 - окклюзия в устье ПБА. 6 - окклюзия правой ГБА (4) дистальнее устья (режим ЭДК).

Рис. 262. Цветовое дуплексное сканирование ОБА. Гиперэхогенные атеросклеротические бляшки (стрелки), дающие выраженную акустическую тень, а - ОБА (стеноз 50%), б - устье ПБА (стеноз 90%).

Рис. 263. Цветовое дуплексное сканирование ПкА. а - норма: наблюдается трехфазный кровоток, открыто спектральное окно, б-проксимальный стеноз: двухфазный кровоток, спектральное окно закрыто и расширено, в - окклюзия: кровоток коллатерального типа.
Дуплексное сканирование артерий нижних конечностей проводят в горизонтальном положении пациента на спине. Многие предпочитают начинать исследование с поперечного сканирования для получения изображения ОБА у паховой складки. Обычно хорошо визуализируются ОБА, ПБА и начальный сегмент ГБА. Подколенную артерию лоцируют при положении пациента лежа на животе. Заднюю и переднюю большеберцовые артерии хорошо визуализируют ниже подколенной ямки, однако эти ветви узкие и потому во многих случаях труднодоступны для хорошей визуализации. Также трудно получить в этих сосудах адекватные допплеровские сигналы. Поэтому ценность дуплексного сканирования падает при локации ниже уровня подколенной области.

Рис. 264. Цветовое дуплексное сканирование ПкА а - тромбоз подколенной артерии (стрелка), коллатеральная компенсация формируется через коленную артерию, б - атеросклеротическая гиперэхогенная бляшка в подколенной артерии (стрелка) и острый тромбоз проксимального отдела ПкА выше отхождения коленной артерии (отсутствие цветового картирования потока) - тяжелая ишемия нижней конечности.

Рис. 265. Цветовое дуплексное сканирование артерий голени, а, б - норма (магистральный тип кровотока). а - ЗББА, 6 - АТС. в, г - проксимальная окклюзия - хорошая визуализация артерий с коллатеральным типом кровотока по ним в - ЗББА г - АТС,
Наибольшее распространение в клинике при поражении артерий нижних конечностей дуплексное сканирование получило для оценки аорто-подвздошного, бедренно-подколенного сегментов и глубокой артерии бедра [49, 50]. В работах [51, 52] выделены основные параметры спектрального анализа общий контур (форма) волны, пиковая систолическая скорость (ПСС) и спектральное расширение. Наибольший акцент делается на анализ ПСС и отношения ПСС на участке стеноза к ПСС в пре- и постстенотическом участке. Отношение ПСС 2 0-2 5 оказалось критическим диапазоном для разграничения стенозов до 49% и стенозов 50-99%. Дополнительную информацию могут предоставлять субъективные критерии такие как общий контур формы волны и степень спектрального расширения. Наличие «окна» в систолическом спектре характерно для нормальной или минимально измененной артерии, а исчезновение спектрального «окна» при сохраняющемся двух- или трехфазном сигнале чаще имеет место при уменьшении диаметра сосуда менее чем на 50%. Следует иметь в виду, что спектральное расширение и, соответственно, уменьшение «окна» может иметь место и в нормальных сосудах в случаях глубокого их залегания или у тучных больных.
Несмотря на целый ряд ограничений возможностей дуплексного сканирования для характеристики расстройств периферического кровообращения [53], неинвазивность безопасность для больного, возможность повторных исследований, большой объем и высокое качество информации о характере и степени поражения сосудистого русла известные преимущества по сравнению с рентгеноконтрастной ангиографией делают этот метод приоритетным в клинике периферических сосудистых нарушений. На рис. 260 представлено дуплексное сканирование бифуркации ОБА в норме, а на рис. 261-265 - при различных вариантах поражения артерий нижних конечностей.
4. Ошибки и недостатки методов ультразвуковой неинвазивной диагностики заболеваний артерий нижних конечностей
Ультразвуковое допплеровское исследование периферических артерий, как и любой другой инструментальный диагностический метод, содержит потенциальные возможности для диагностических ошибок, как объективного, так и субъективного характера [54 55]. К последним относится квалификация и опыт исследователя, точность расчетов педантичность при соблюдении всех условий методики Объективные причины достаточно разнообразны и требуют специального рассмотрения.
- Невозможность обследования сосудов на протяжении - это возможно только в фиксированных точках, что исключает точную топическую диагностику поражения. Дуплексное сканирование решает проблему лишь частично, так как отдельные участки сосудистой системы нижних конечностей, такие как средняя треть ПБА область трифуркации подколенной артерии и проксимальные отделы артерий голени, остаются недоступными для визуализации у большинства обследуемых из-за глубинного залегания сосудов и мощной мышечной массы в этих зонах.
- Ошибки при измерении артериального давления в нижних конечностях.
А. У тучных больных вследствие избыточной подкожно-жировой клетчатки и мышечной массы бедра измеряемое ССД оказывается ложновысоким из-за необходимости под большим давлением накачивать бедренную манжету для полной компрессии артерий; при этом различия плечевого и бедренного давления могут достигать 50-60%, тогда как прямое пункционное измерение давления на тех же уровнях не выявляет существенных различий Поэтому у данной категории больных рекомендуют измерять давление на голени
Б. У больных диабетом или с хронической почечной недостаточностью сосудистая стенка может быть пропитана солями кальция настолько, что становится несжимаемой, и потому измерение ССД у данной категорий больных теряет смысл. Так. мы наблюдали больных сахарным диабетом и диабетической ангиопатией, у которых ССД|у при локации в артериях голени у лодыжки остаточного кровотока в виде коллатерального шума достигало 200 мм рт. ст., а ИДIV =1,4-16.
В Нередко может иметь место завышенное давление в верхней трети голени, существенно превалирующее над давлением в нижней трети бедра и связанное с особенностями развития костных образовании в этой зоне и с необходимостью создания повышенного давления в компрессионной манжете.
- Имеются затруднения при измерении пальцевого давления на стопах методом УЗДГ так как локация пальцевых артерий дистальнее наложенной пальцевой манжеты редко оказывается выполнимой. Обычно в этих целях используется метод фотоплетизмографии.
- В последнее время была показана нелинейная зависимость лодыжечного ССД от плечевого (системного) при системном давлении ниже 100 и выше 200 мм рт ст. лодыжечное ССД было ниже нормы (до 25%), а в интервале 100-200 мм рт ст. оно было равно или выше плечевого Таким образом, при гипо- и гипертензии ИД может быть меньше единицы.
- При интерпретации формы волны допплерограммы для избежания ошибок следует помнить, что в норме может отсутствовать компонент обратного кровотока в подколенных артериях в 10-11% случаев в задней большеберцовой - в 4% и артерии тыла стопы - в 8%. Третий компонент допплерограммы сохраняется в подвздошных и общих бедренных артериях у всех здоровых лиц, в подколенных, задних большеберцовых и артериях тыла стопы он может отсутствовать в 22, 4 и 10% соответственно В норме в 2-3% случаев также возможно отсутствие локации одной из артерий голени из-за анатомических особенностей их развития (рассыпной тип строения).
- Особенности развития компенсаторного коллатерального кровообращения, осуществляющего коррекцию артериальной недостаточности, могут быть причиной как ложноположительных, так и ложноотрицательных диагностических ошибок.
А. Хорошо развитые коллатеральные сосуды с высокой ЛСК в подвздошно-бедренной зоне при окклюзии подвздошной артерии могут быть причиной ошибочной диагностики. Такой вариант мы наблюдали у 7 больных у которых при ангиографии выявлена окклюзия подвздошной артерии, при УЗДГ у всех больных в проекции ОБА в области скарповского треугольника регистрировали допплерограммы с высокой ЛСК, морфологически соответствовавшие стенозированному потоку а ИД верхней трети бедра превышал 0,8. У3 больных этой группы УЗДГ проводили синхронно с записью ЭКГ. что позволило определить феномен «запаздывания» допплеровского сигнала при оценке временного интервала Тв - от момента регистрации зубца R до времени возникновения пульсовой волны. Этот интервал был увеличен на стороне окклюзии. На рис. 266 представлены допплерограммы обеих ОБА больного Ч. (при ангиографии установлена окклюзия правой подвздошной артерии и стеноз левой подвздошной артерии), ЛСК справа и слева составляет 32 см/с, морфология кривых также сходна, и только показатель Тв справа увеличен на 0.08, что соответствует различиям в скорости магистрального и коллатерального кровотока
Анализ подобных ошибок показал, что в их основе лежит хорошо развитое коллатеральное кровообращение подвздошно-бедренной зоны. Использование синхронной записи ЭКГ может оказаться полезным в сложных случаях диагностики поражений подвздошных артерий.
Б. Хорошо развитое коллатеральное кровообращение в бассейне артерий голени является частой причиной ложноположительной оценки состояния артерии голени и ошибочных показаний к проведению реконструктивных операций в аорто-подвздошной и бедренно-подколенной зонах. Это важно, так как эффективность хирургического лечения зависит от состояния путей оттока функцию которого осуществляют артерии голени. Ошибочная дооперационная диагностика дистального сосудистого русла конечностей ограничивает операцию лишь ревизией сосудов с проведением интраоперационной ангиографии.

Рис. 266 Окклюзия правой и стеноз левой подвздошных артерий (больной Ч. 51 год), а - ангиограмма. б - схема взаимосвязи ЭКГ и УЗДГ. в г - допплерограммы ОБА с синхронной регистрацией ЭКГ при окклюзии правой (в) и стенозе левой (г) подвздошных артерий
В. Декомпенсация коллатерального кровообращения, в особенности при многоуровневых поражениях, затрудняет диагностику поражения нижележащих сегментов артерий нижних конечностей. Трудности в оценке состояния

Рис. 267. Допплерограммы кровотока по нижним конечностям до и после повторных реконструктивных операций (больной В , 54 года), а - до повторной операции, б - после повторной операции.
артерий ног при окклюзии брюшной аорты и подвздошных артерий, сопровождающейся выраженной недостаточностью коллатерального кровообращения, отмечены разными исследователями у 15-17% больных. Значимость этой проблемы возрастает у больных, нуждающихся в повторных операциях. Количество этих больных в связи с широким развитием реконструктивной сосудистой хирургии возрастает с каждым годом, а повторные операции нередко приводят к повреждению путей компенсирующего коллатерального кровообращения. На рис. 267 представлены данные УЗДГ и значения ИД до и после повторной операции, резкая декомпенсация кровообращения при тромбозе основной бранши аорто-бедренного бифуркационного протеза и восстановление магистрального кровотока в обеих нижних конечностях после операции.
7. Отсутствие информации об объемном кровотоке, суммирующем магистральное и коллатеральное русло, при использовании УЗДГ затрудняет диагностику поражения ПБА при окклюзиях АПС. Количественный анализ допплерограмм с использованием индекса пульсации и демпинг-фактора оказывается чувствительным в подобной ситуации только у 73% больных. Включение в комплекс неинвазивной диагностики плетизмографических методик, таких как объемная сегментарная сфигмография (иногда ее называют «объемная сегментарная плетизмография»), включенная в обязательный перечень методов ангиологических лабораторий ведущих зарубежных клиник [56, 57], но незаслуженно обойденная вниманием специалистов в нашей стране, повышает чувствительность диагностики поражения указанной локализации до 97%.
8. Возможности УЗДГ в определении только гемодинамически значимых (>75%) поражений уже недостаточны в современных условиях, когда в связи с появлением щадящего и сосудосохраняющего ангиопластического лечения стенозирующих поражений созданы условия для профилактического лечения, более эффективного на ранних стадиях развития заболевания.
Поэтому будет значительно возрастать необходимость внедрения в клинику метода дуплексного сканирования, позволяющего выявлять заболевание на ранних стадиях, определять вид и характер поражения сосудов, показания к выбору того или иного метода лечения у большинства больных без предварительной ангиографии.
9. Возможности УЗДГ в определении поражения ГБА, даже гемодинамически значимого, ограничены, и у большинства больных диагноз поражения ГБА ставится только предположительно или является случайной ангиографической находкой. Поэтому успешная неинвазивная диагностика поражения ГБА и степени ее гемодинамической недостаточности возможна только с помощью дуплексного сканирования.
В заключение необходимо отметить, что внедрение метода УЗДГ в клиническую диагностику ишемии нижних конечностей имело неоценимую и революционную по своей сути значимость, хотя не нужно забывать и об ограничениях и недостатках метода. Дальнейшее повышение диагностической значимости ультразвуковой диагностики связано как с использованием всего арсенала возможностей ультразвуковых методов, так и с комплексированием их с другими неинвазивными методами диагностики сосудистых заболеваний с учетом клиники и этиологии заболевания у каждого конкретного больного, широким распространением нового поколения ультразвуковой аппаратуры, реализующей новейшие технологии трехмерного сканирования сосудов.
Однако оценка возможностей диагностики поражений сосудов нижних конечностей может оказаться недостаточно полной, так как поражения артерий зачастую сочетаются с заболеванием вен нижних конечностей. Поэтому ультразвуковая диагностика поражений ног не может быть полной без оценки анатомо-функционального состояния их обширной венозной системы, к изучению особенностей которой мы предлагаем приступить в следующей главе.
ГЛАВА 17
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ВЕН НИЖНИХ КОНЕЧНОСТЕЙ
Ультразвуковое исследование сосудов нижних конечностей - одно из ведущих в клинической практике. Традиционная физикальная или инструментальная диагностика в указанном сосудистом регионе либо малоинформативна (мануальные пробы, измерение объема конечности и т. д.), либо связана с эндовазальной инвазией и лучевой нагрузкой на пациента и медицинский персонал (рентгеноконтрастная ангиография). Однако до настоящего времени остается малоизученной проблема ультразвуковой диагностики заболеваний венозной системы.
Система нижней полой вены - основной источник фатальной тромбоэмболии легочной артерии. Более 35 млн. россиян необходима специализированная флебологическая помощь, оказание которой невозможно без применения ультразвуковых методов исследования и изучения этой диагностической проблемы [1].
Однако проблема использования ультразвуковых технологий, ультразвуковая семиотика острых венозных тромбозов сосудов системы нижней полой вены, хронической недостаточности вен нижних конечностей изучена недостаточно и требует сопоставления с данными референтных методов исследования.
1. Анатомия и физиология вен нижних конечностей
Классическая анатомия объединяет пути оттока крови из нижних конечностей в две системы: поверхностную и глубокую (рис. 268). С позиции сосудистой хирургии целесообразно выделить третью систему - перфорантные вены.
Поверхностная венозная система нижних конечностей состоит из большой подкожной вены (v. saphena magna) и малой подкожной вены (v. saphena parva). Клиницисты часто имеют дело еще с одной подкожной веной — латеральной, отличительной чертой которой является наличие многочисленных связей с глубокими венами. Латеральная поверхностная вена может впадать в большую подкожную вену, но может самостоятельно дренировать в бедренную вену или нижнюю ягодичную вены. Частота ее наблюдений не превышает 1%. Она может поражаться одновременно с большой и малой подкожной венами, но мы наблюдали и изолированный патологический процесс в ее бассейне.
Большая подкожная вена является продолжением внутренней краевой вены стопы. Кпереди от медиальной лодыжки ствол большой подкожной вены располагается тотчас под кожей и у подавляющего большинства здоровых и
больных людей в вертикальном положении хорошо визуализируется и пальпируется. Проксимальнее большая подкожная вена уходит под поверхностную фасцию и у здоровых людей не видна. У больных в связи с расширением сосуда и с наличием динамической гипертензии уменьшается тонус его стенок, большая подкожная вена яснее просматривается и лучше ощущается пальпаторно. Однако если поверхностная фасция плотная, то даже большая вена скрывается под ней. Тогда возможны диагностические ошибки за ствол большой подкожной вены принимают ее приток, лежащий ближе к коже и лучше определяемый.
На своем протяжении большая подкожная вена принимает значительное количество притоков, которые не равнозначны в хирургическом плане. Среди них следует отметить часто встречающуюся вену, начинающуюся в ямке за внутренней лодыжкой, следующую параллельно основному стволу большой подкожной вены на голени и сливающуюся с ним на разных уровнях. Особенность этого сосуда заключается в его многочисленных связях с глубокими венами по перфоранстным венам.
Рис. 268. Схема строения венозного кровоснабжения нижних конечностей. 1. - аорта; 2 - нижняя полая вена; 3 - общая подвздошная вена; 4 - наружная и внутренняя подвздошные вены; 5 - общая бедренная вена; 6 - поверхностная бедренная вена; 7 - глубокая вена бедра; 8 - подколенная вена; 9 - суральные вены; 10 - передние большеберцовые вены; 11 - икроножные вены; 12 - задние большеберцовые вены; 13 — малоберцовые вены; 14 - большая подкожная вена; 15 - малая подкожная вена.
Существует большое число вариантов впадения притоков в приустьевой отдел большой подкожной вены. Число их колеблется от 1 до 8. Наиболее постоянным притоком большой подкожной вены в этой зоне является поверхностная эпигастральная вена (v. epigastrica superficialis). Она впадает в большую подкожную вену сверху и наиболее близко к ее устью. Сохранение этой вены неперевязанной, во время операции, является самой частой причиной восстановления патологического сброса из бедренной вены в подкожные вены бедра и рецидив заболевания. Из остальных притоков следует упомянуть еще о наружной срамной вене (v. pudenda) и поверхностной окружающей подвздошную кость (v circumflexa ilium superficialis). Поверхностная добавочная и передняя бедренная подкожные вены (v saphena accessoria, v. femoralis anterior) сливаются со стволом большой подкожной вены в 5-10 см дистальнее сафено-бедренного анастомоза и часто труднодостижимы для перевязки в операционной ране. Данные вены анастомозируют с другими подкожными венами и поддерживают варикозные изменения в ней.
Малая подкожная вена является продолжением латеральной краевой вены стопы. К анатомическим особенностям этого сосуда относится расположение его средней трети интрафасциально, а верхней - субфасциально что делает недоступным осмотр о пальпацию ствола через кожу и затрудняет диагностику ее поражений. Хирургический интерес представляет анатомия проксимального отдела малой подкожной вены. Она не всегда заканчивается в подколенной ямке. В работах [2] наблюдали варианты, когда устье малой подкожной вены смещалось кверху и она впадала в бедренную вену, или книзу тогда ее принимала одна из глубоких вен голени. В других случаях малая подкожная вена имеет сообщение с одной из суральных вен. При несостоятельности последней может наблюдаться сброс не из подколенной, а из мышечной вены, что необходимо знать до операции, чтобы клипировать этот анастомоз. Один из сосудов в зоне сафено-подколенного анастомоза заслуживает особого внимания - эта вена является прямым продолжением ствола малой подкожной вены на бедро, сохраняет туже направленность кровотока и представляет собой естественную коллатераль для оттока крови из голени. Благодаря этому малая подкожная вена может заканчиваться в любой точке бедра. Незнание этого до операции служит причиной неэффективной операции. По клиническим признакам удается поставить правильный диагноз в исключительных случаях. Некоторую помощь может оказать флебография. Но основную диагностическую роль играет ультразвуковое ангиосканирование. Именно с его помощью и были открыты сафено-суральные анастомозы, а описанная ветвь получила имя Джиакомини.
Глубокие венозные магистрали нижних конечностей представлены парными задними и передними большеберцовыми и малоберцовыми венами и непарными подколенной, бедренной, наружной и общей подвздошными и нижней полой венами. Однако можно наблюдать и удвоение подколенной, бедренной и даже нижней полой вен. О возможности подобных вариантов следует помнить, чтобы правильно интерпретировать полученные результаты.
Третья система - перфорирующие или перфорантные вены Число перфорирующих вен может колебаться от 53 до 112 [3]. Клиническое значение имеют от 5 до 10 таких сосудов располагающихся преимущественно на голени Перфорантные вены голени в норме имеют клапаны пропускающие кровь только в сторону глубоких вен. После тромбоза клапаны разрушаются. Несостоятельным перфорирующим венам приписывают основную роль в патогенезе трофических расстройств кожи.
Перфорирующие вены голени достаточно хорошо изучены, в норме имеют клапаны, пропускающие кровь только в сторону глубоких вен. По локализации их делят на медиальную, латеральную и заднюю группы. Медиальные и латеральные группы являются прямыми, то есть сообщают поверхностные вены с задними большеберцовыми и малоберцовыми соответственно. В отличие от этих групп перфорирующие вены задней группы не впадают в глубокие венозные магистрали, а замыкаются на мышечных венах. Их называют непрямыми.
И.В. Червяков [4] подробно описал локализацию перфорантных вен голени: по медиальной поверхности - на 4,9-11 см и 13-15 см выше медиальной лодыжки и на 10 см ниже коленного сустава; по латеральной поверхности - на 8-9, 13 и 20-27 см выше латеральной лодыжки; по задней поверхности - на границе средней и верхней третей (внутри от средней линии).
Нахождение перфорирующих вен на бедре менее постоянно, и они, видимо, редко участвуют в патологии. Наиболее постоянной является вена в нижней трети внутренней поверхности бедра, называется по имени описавшего ее Додда.
Характерной особенностью вен являются клапаны. Части клапана образуют карман на стенке вены (клапанный синус). Он состоит из клапанной створки, клапанных валиков и части стенки вены. Створка имеет два края - свободный и прикрепленный к стенке, место ее прикрепления представляет собой линейное выпячивание стенки вены в просвете сосуда и называется клапанным валиком. По мнению В.Н. Ванкова [5], клапан в вене может иметь от одного до четырех карманов.
Число клапанов различно в разных венах и уменьшается с возрастом. В глубоких венах нижних конечностей наибольшее число клапанов на единицу длины сосуда. Причем чем дистальнее, тем больше. Функциональное назначение клапанов состоит в том, чтобы дать единственно возможное направление движению крови по сосудам. Как в поверхностных, так и в глубоких венах кровь у здоровых людей течет только к сердцу, по перфорантным венам - только из подкожных сосудов в субфасциальные.
В связи с прямохождением человека определение факторов венозного возврата - трудный и крайне важный вопрос физиологии кровообращения в нижних конечностях. Существует мнение, что если систему кровообращения рассматривать как ригидную U-образную трубку, на оба колена которой (на артерии и на вены) сила тяжести влияет одинаково, то небольшого прироста давления должно быть достаточно для возвращения крови к сердцу [6]. Однако одной проталкивающей силы сердца мало. На помощь приходят следующие факторы: давление окружающих мышц; пульс ближайших артерий; сдавление вен фасциями; артерио-венозные анастомозы; «активная диастола» сердца; дыхание.
В работах [7-9] придается большое значение еще венозному тонусу.
Перечисленные показатели можно разделить на центральные и периферические. К первым относят влияние фаз дыхания на кровоток в брюшном отделе нижней полой вены [10], важным центральным фактором венозного возврата является работа сердца.
Остальные из перечисленных выше факторов расположены в конечности и являются периферическими. Необходимым условием возврата крови к сердцу служит венозный тонус. Он обуславливает сохранение и регулирование венами своей емкости. Венозный тонус обуславливается нервно-мышечным аппаратом этих сосудов
Следующий фактор - артериоловенулярные анастомозы, которые, по мнению. В. В. Куприянова [11], не являются пороками развития сосудистой системы или результатом ее патологических преобразований. Назначение их заключается в разгрузке капиллярной сети и поддержании необходимого объема возвращающейся к сердцу крови Шунтирование артериальной крови по артериоловенулярным анастомозам называют юкстакапиллярным кровотоком. Если транскапиллярный кровоток - единственный способ обеспечения нужд тканевого и органного метаболизма, то юкстакапиллярный кровоток - средство защиты капилляров от застоя В нормальных условиях артериоловенулярные анастомозы открываются уже при переходе человека в вертикальное положение.
Все описанные периферические факторы, вместе взятые, создают условия для равновесия между артериальным притоком и венозным возвратом в горизонтальном состоянии или при спокойном состоянии Указанное равновесие изменяется с началом работы мышц нижних конечностей. К работающим мышцам значительно возрастает приток крови. Но и отток ее также увеличивается, так как включается активный фактор венозного возврата - «мышечно-венозная» помпа. По мнению J. Ludbrook [12], «мышечно-венозная» помпа есть система функциональных единиц, состоящая из миофасциальных образований, сегмента глубоких вен, связанного с соответствующим сегментом поверхностных вен. «Мышечно-венозная» помпа нижних конечностей представляет собой технический насос здесь есть внутренняя емкость - глубокие вены с капиллярами, строго ориентированными на единственное направление движения крови - к сердцу; мышцы же служат мотором так как сокращаясь и расслабляясь изменяют давление на глубокие вены, благодаря чему вместимость их то увеличивается, то уменьшается
G. Fegan [6] условно подразделяет «мышечно-венозную» помпу нижних конечностей на четыре отдела: стопная помпа, помпа голени; помпа бедра; абдоминальная помпа.
Плантарная помпа имеет большое значение. Хотя мышцы стопы относительно невелики по массе оттоку крови здесь способствует видимо, еще и воздействие массы всего тела Работа плантарной помпы повышает эффективность насоса голени, так как работает синхронно с ним
Наиболее изучена помпа голени. Ее емкость состоит из задних и передних болыиеберцовых и малоберцовых вен Кровь из артерий попадает в капиллярное русло мышц, подкожной клетчатки и кожи, откуда собирается венулами Во время мышечного сокращения благодаря присасывающему действию внутримышечных вен они заполняются кровью из капилляров и венул мышц, а также по непрямым перфорирующим венам из кожных вен. В то же время вследствие повышения давления, передаваемого соседними образованиями на глубокие вены, последние освобождаются от крови, которая при дееспособных клапанах уходит из берцовых вен в подколенную вену Дистальные клапаны не позволяют крови перемещаться в ретроградном направлении, В период расслабления мышц внутримускулярные вены сдавливаются мышечными волокнами Кровь из них благодаря ориентации клапанов выталкивается в берцовые вены. Непрямые перфорирующие вены закрыты клапанами. Из дистальных отделов глубоких вен кровь также насасывается в более проксимальные Открываются клапаны прямых перфорирующих вен, и кровь из подкожных вен перетекает в глубокие. В настоящее время в деятельности «мышечно-венозной» помпы различают как бы 2 функции - дренирующую и эвакуаторную.
Патология венозной системы конечностей сопровождается нарушением эвакуаторной способности «мышечно-венозной» помпы голени, что сопровождается снижением индекса эвакуации (отношение среднего времени транспорта в покое к среднему времени в нагрузке - радиометрический метод изучения эвакуаторной способности «мышечно-венозной» помпы) работа мышц либо вообще не ускоряет отток крови либо даже замедляет его Следствием этого является неполноценный венозный возврат нарушения не только периферической, но и центральной гемодинамики Степень дисфункции «периферического сердца» определяет характер хронической венозной недостаточности, сопровождающей как варикозную, так и посттромботическую болезнь нижних конечностей.
2. Ультразвуковое триплексное сканирование вен нижних конечностей
Обследованию с применением ультразвуковых технологий подлежит в обязательном порядке система глубоких и поверхностных вен обеих нижних конечностей. В системе глубоких вен это общая и глубокая бедренные вены, поверхностная бедренная вена, подколенная вена, все группы магистральных вен голеней и вены стопы. Сейчас, имея в наличии датчики, работающие в диапазоне 5-13 МГц. мы можем беспрепятственно осмотреть все глубокие вены нижних конечностей от паховой связки до вен тыльной и подошвенной поверхности стопы.
Для исследования вен бедра, подколенной вены, вен голени, а также большой и малой подкожных вен используют линейный датчик с частотой 5-15 МГц. Для визуализации подвздошных вен и нижней полой вены используют конвексный датчик с частотой 3 5 МГц При сканировании нижней полой вены, подвздошных, большой подкожной вены бедренных вен и вен голени в дистальном отделе нижних конечностей пациент находится в положении лежа на спине Исследование подколенных вен. вен верхней трети голени и малой подкожной вены проводят в положении лежа на животе. В последнем случае пациента просят поставить ноги на носок обеспечивая расслабление задней группы мышц голени и бедра. При выраженном болевом синдроме или невозможности больным принять необходимое положение исследование подколенной вены проводят с помощью медсестры (врача), который поднимает ногу больного. Гипсовые повязки перед исследованием разрезают.
Глубину сканирования усиление эхо-сигнала и другие параметры исследования подбирают индивидуально для каждого пациента и сохраняют неизменными в течение всего обследования, включая наблюдения в динамике.
2.1. Методика исследования вен нижних конечностей Акустический гель наносится на кожу над исследуемой веной.
При этом вены глубокой венозной системы анатомически соответствуют артериям нижних конечностей Поверхностные вены (большая и малая подкожные вены) не соответствуют артериям и лежат в фасции, разделяющей поверхностные и глубокие ткани.
Сканирование начинают в поперечном сечении, для исключения наличия флотирующей верхушки тромба о чем свидетельствовало полное соприкосновение венозных стенок во время легкой компрессии датчиком. Убедившись в отсутствии свободно флотирующей верхушки тромба компрессионную пробу датчиком проводят от сегмента к сегменту от проксимальных отделов к дистальным. Предлагаемая методика наиболее точна не только для выявления, но и определения протяженности тромбоза (исключая подвздошные вены и нижнюю полую вену, где для проходимости вен применяют ЦДК). Продольное сканирование вен подтверждает наличие и характеристики венозного тромбоза. Кроме того, продольное сечение используют для локации анатомического слияния вен.
Как правило, используют три режима для исследования вен нижних конечностей. В В-режиме оценивается диаметр вены, коллабирование стенок, просвет наличие клапанов. В цветовом (или энергетическом) режиме выявляют полное прокрашивание просвета вены, наличие турбулентных потоков. В режиме спектральной допплерографии определяют фазность кровотока.
В положении пациента лежа на спине в области паховой связки лоцируют общую бедренную вену ниже паховой связки визуализируют сафено-феморальное соустье общей бедренной и большой подкожной вен. При перемещении датчика вниз лоцируют слияние глубокой бедренной вены и бедренной вены в общую бедренную вену. При этом положении датчика глубокая бедренная вена обычно видна только в проксимальном отделе Бедренную вену определяют на всем протяжении по переднемедиальной поверхности бедра. Подколенную вену исследуют из области подколенной ямки. Перемещая датчик дистальнее, сканируют проксимальные отделы вен голени. Передние болыиеберцовые вены лоцируют на переднелатеральной поверхности голени, между большеберцовои и малоберцовой костями Задние болыиеберцовые вены визуализируют из переднемедиального доступа по краю болыиеберцовой кости. Малоберцовые вены лоцируют из того же доступа, что и задние болыиеберцовые вены, при смещении датчика ближе к икроножной мышце.
Исследование большой подкожной вены проводят от сафено-феморального соустья до уровня медиальной лодыжки по переднемедиальной поверхности бедра и голени. Начиная от уровня ахиллова сухожилия сканируют малую подкожную вену по средней линии голени вплоть до подколенной вены.
Обследование нижней полой вены начинают с ее проксимального отдела, от правого предсердия, смещая датчик дистальнее по ходу вены прослеживают её на всем протяжении. Для визуализации подвздошных вен датчик последовательно размещают над проекцией правых и левых сосудов. Для более детальной оценки нижней полой вены и левых подвздошных вен исследование дополняют (при возможности) поворотом больного на левый бок.
В норме просвет вены анэхогенный стенки вены эластичные, тонкие, спадаются при выполнении компрессионных проб. В просвете лоцируют венозные клапаны, может определяться «эффект спонтанного эхоконтрастирования». В режиме цветового и энергетического кодирования просвет вен полностью прокрашивается (рис. 269) При спектральной допплерографии регистрируют фазный синхронизированный с дыханием кровоток.
После исключения нарушения проходимости вен в системе нижней полой вены проводят анализ функционирования клапанного аппарата и выявления всех вено-венозных рефлюксов Обследование выполняют в горизонтальном и вертикальном положениях пациента. Используют пробу Вальсальвы со стандартными показателями экспираторного давления и пробу с проксимальной компрессией Обследование выполняют линейным датчиком с частотой 7,5-10 МГц. При определении функции клапанного аппарата проводят пробу Вальсальвы Больного просят выполнить максимальный вдох с одновременным натуживаем в течение 0,5-1,0 с и удерживанием внуртибрюшного давления в течение 10 с. У здоровых людей происходит ослабление венозного кровотока при вдохе, полное его исчезновение при натуживании и усиление кровотока при последующем выдохе (рис. 270). На недостаточность клапанов обследуемой вены указывает появление ретроградного кровотока при натуживании.
Проксимальная компрессия дает информацию, аналогичную пробе Вальсальвы в случаях затруднительного выполнения пробы Вальсальвы или при исследовании отделов подколенной вены производят сдавливание участка вены проксимальнее клапана в течение 5-6 с. При недостаточности клапанов возникает ретроградный кровоток
Для выявления признаков клапанной недостаточности можно использовать дыхательную и кашлевую пробы. При дыхательной пробе пациент делает максимально глубокий вдох, при кашлевой пробе - серию кашлевых движений, что приводит к появлению ретроградного кровотока при наличии патологии клапанного аппарата,

Рис. 269 Продольная эхограмма сосудов бедра в режиме ЦДК: 1 Бедренная артерия 2 Бедренная вена. Полное прокрашивание сосудов.

Рис. 270. Продольная эхограмма сосудов бедра в триплексном режиме. Фазный синхронизированный с дыханием кровотока в неизменной вене (1).
В поверхностных венах оценивают в первую очередь состояние остального клапана большой подкожной вены и затем всех остальных клапанов в этой вене на всем ее протяжении. В малой подкожной вене - состояние клапанов в ее устье и на всем протяжении сосуда
В глубокой венозной системе обследуют клапанный аппарат в поверхностной бедренной вене подколенной вене, суральных венах, глубоких венах голени. То есть целесообразно обследовать те клапанные структуры вен нижних конечностей, которые подлежат хирургической коррекции. Естественно, что все выявленные при обследовании перфорантные вены также изучают на предмет их клапанной недостаточности.
3. Ультразвуковая диагностика острых венозных тромбозов
Острые венозные тромбозы системы нижней полой вены делят на эмболо-геноопасные (флотирующие или неокклюзивные) и окклюзивные Неокклюзивный тромбоз является источником тромбоэмболии легочной артерии. Система верхней полой вены дает только 0,4% тромбоэмболии легочной артерии, правые отделы сердца - 10,4%, тогда как нижняя полая вена является основным источником этого грозного осложнения (84 5%) [13].
Прижизненный диагноз острого венозного тромбоза может быть установлен только у 19,2% больных, погибших от тромбоэмболии легочной артерии [14]. Данные других авторов [13] свидетельствуют, что частота правильной диагностики венозного тромбоза перед развитием смертельной эмболии легочной артерии низкая и составляет от 12,2 до 25%.
Послеоперационные венозные тромбозы представляют собой очень серьезную проблему. По данным B.C. Савельева [14], послеоперационный венозный тромбоз развивается после общехирургических вмешательств в среднем у 29% больных, в 19% случаев после гинекологических вмешательств и в 38% - чреспузырных аденомэктомий. В травматологии и ортопедии этот процент еще выше и достигает 53-59%. Особая роль отводится ранней послеоперационной диагностике острых венозных тромбозов. Следовательно, всем больным, представляющим определенный риск в плане послеоперационного венозного тромбоза, следует проводить полное обследование системы нижней полой вены как минимум дважды перед и после оперативного вмешательства.
С нашей точки зрения, принципиально важным считается выявление нарушений проходимости магистральных вен у пациентов с артериальной недостаточностью нижних конечностей. Особенно это необходимо больному, у которому предполагают оперативное вмешательство с целью восстановления артериального кровообращения в конечности эффективность такого хирургического вмешательства снижается при наличии различных форм непроходимости магистральных вен. Поэтому всем пациентам с ишемией конечностей следует обследовать как артериальные, так и венозные сосуды.
Несмотря на достигнутые за последние годы значительные успехи в диагностике и лечении острых венозных тромбозов нижней полой вены и периферических вен нижних конечностей, интерес к этой проблеме за последние годы не только не уменьшился а постоянно возрастает. Особая роль по-прежнему отводится вопросам ранней диагностики острого венозного тромбоза [14].
Острые венозные тромбозы по своей локализации подразделяют на тромбозы иликавального сегмента, бедренно-подколенного сегмента и тромбозы вен голени. Кроме этого, тромботическому поражению могут быть подвержены большая и малая подкожные вены.
Проксимальная граница острого венозного тромбоза может находиться в инфраренальном отделе нижней полой вены, супраренальном, достигать правого предсердия и находиться в его полости (показана эхокардиография). Поэтому обследование нижней полой вены рекомендуют начинать с области правого предсердия и затем постепенно спускаться вниз к инфраренальному ее отделу и месту впадения в нижнюю полую вену подвздошных вен (рис. 271). Следует отметить, что самое пристальное внимание необходимо придавать не только осмотру ствола нижней полой вены, но также вен, впадающих в нее. В первую очередь к ним относятся почечные вены. Обычно тромботическое поражение почечных вен обусловлено объемным образованием почки. Не следует забывать, что причиной тромбоза нижней полой вены могут быть яичниковые вены или яичковые вены. Теоретически считается, что эти вены ввиду небольшого их диаметра не могут привести к тромбоэмболии легочной артерии, тем более что распространенность тромба до левой почечной вены и нижней полой вены по левой яичниковой или яичковой вене в силу извитости последней выглядит казуистически. Однако необходимо всегда стремиться к осмотру этих вен, по крайней мере их устьев. При наличии тромботической окклюзии эти вены немного увеличиваются в размерах просвет становится неоднородным и они неплохо лоцируются в своих анатомических областях.
При ультразвуковом триплексном сканировании венозные тромбозы подразделяют по отношению к просвету сосуда на пристеночные, окклюзирующие и флотирующие тромбы [15].
Ультразвуковыми признаками пристеночного тромбоза считают визуализацию тромба с наличием свободного кровотока в этой области измененного просвета вены, отсутствие полного спадения стенок при компрессии вены датчиком, наличие дефекта заполнения при ЦДК, наличие спонтанного кровотока при спектральной допплерографии (рис. 272).
Окклюзирующим считают тромбоз, признаками которого является отсутствие спадения стенок при компрессии вены датчиком, а также визуализация в просвете вены включений различной эхогенности, отсутствие кровотока и прокрашивания вены в режимах спектральной допплерографии и ЦДК (рис. 273).

Рис. 271. Продольная эхограмма нижней полой вены в режиме ЦДК (1), неокклюзирующий тромбоз.

Рис. 272. Продольная эхограмма подколенной области в режиме ЦДК. Просвет подколенной вены (маркеры) почти на 2/3 тромбирован, огибающий кровоток (1).

Рис. 273. Продольная эхограмма общей бедренной вены в режиме ЦДК. Отсутствует кровоток и прокрашивание вены - окклюзирующий тромбоз.

Рис. 274. Эхограмма продольного сканирования вены в В-режиме. Флотирующий (красный «свежий») тромб в общей бедренной вене (конец показан стрелкой).

Рис. 275. Эхограмма продольного сканирования вены в В-режиме. Флотирующий (смешанный) тромб в общей бедренной вене (показан стрелками).

Рис. 276. Эхограмма продольного сканирования вены в В-режиме. Флотирующий (белый) тромб в общей бедренной вене (показан стрелками).
Ультразвуковыми критериями флотирующих тромбов считают визуализацию тромба, как эхогенной структуры, расположенной в просвете вены с наличием свободного пространства, колебательные движения верхушки тромба, отсутствие соприкосновения стенок вены при компрессии датчиком, наличие свободного пространства при выполнении дыхательных проб, огибающий тип кровотока при цветовом кодировании потока, наличие спонтанного кровотока при спектральной допплерографии.
Постоянный интерес вызывают возможности ультразвуковых технологий в диагностике давности тромботических масс. Выявление признаков флотирующих тромбов во всех стадиях организации тромбоза позволяет повысить эффективность диагностики. Особенно ценным является наиболее ранняя диагностика свежего тромбоза, что позволяет предпринять меры ранней профилактики тромбоэмболии легочной артерии.
После сопоставления ультразвуковых данных флотирующих тромбов с результатами морфологических исследований мы пришли к следующим выводам.
Ультразвуковыми признаками красного тромба являются - гипоэхогенный нечеткий контур, анэхогенность тромба в области верхушки и гипоэхогенность дистального отдела с отдельными эхогенными включениями, (рис. 274) Признаками смешанного тромба является неоднородная структура тромба с гиперэхогенным четким контуром. В структуре тромба в дистальных отделах преобладают гетероэхогенные включения, в проксимальных отделах - преимущественно гипоэхогенные включения (рис. 275). Признаками белого тромба - флотирующий тромб с четкими контурами, смешанной структуры с преобладанием гиперэхогенных включений, и при ЦДК регистрируют фрагментарные потоки через тромботические массы (рис. 276).
4. Ультразвуковая диагностика хронической венозной недостаточности и варикозной болезни
Наиболее распространенной формой хронической венозной недостаточности является варикозная болезнь. Причиной возникновения болезни является несостоятельность клапанного аппарата поверхностных и глубоких вен нижних конечностей с возникновением патологического венозного рефлюкса [16]. Обязательным признаком варикозной болезни являются специфические изменения подкожных вен нижних конечностей: расширение, выбухание через кожу и извитость, видимые в вертикальном положении и исчезающие в горизонтальном. Другими клиническими симптомами могут быть отек, увеличение объёма, цианоз кожи дистальных отделов ноги, трофические расстройства кожи преимущественно нижней трети медиальной поверхности голени.
Между тем следует подчеркнуть, что все перечисленные признаки присущи и другой хронической патологии венозной системы нижних конечностей - пост-тромботической болезни. Различия касаются локализации варикозных вен и сроков появления клинических признаков. Практически у всех больных варикозной болезнью сначала появляются изменения подкожных вен и только через три и более лет другие симптомы болезни. Как показывает опыт, в случае развитой клинической картины постановка диагноза варикозной болезни несложна. Более трудная задача заключается в диагностике начальных форм заболевания и атипичных проявлений ее. В такой ситуации необходимы специальные методы исследования, они показаны и в тех случаях, когда хирургу трудно ответить на вопросы, касающиеся патогенетических факторов, среди которых наиболее важны: клапанная недостаточность глубоких вен; ретроградный кровоток по стволам большой и малой подкожных вен; вено-венозный сброс через перфорантные вены голени.
Обследование проводят в положении пациента лежа, а также стоя, без усиленной опоры на одну или другую нижнюю конечность. Всем пациентам проводят оценку состояния кровотока в большой и малой подкожных венах, перфорантных венах, а также глубоких венах нижних конечностей. Для этого применяют В-режим, режимы цветового и энергетического картирования, спектральную допплерографию, используя датчики с частотой 5-13 МГц.
При варикозной болезни стенка вены не утолщена и на всем протяжении одинакова. Вену легко сдавить датчиком, меняется внутренний диаметр при натуживании исследуемого. Как правило, визуализируются варикозно расширенные подкожные вены (рис. 277).
Внутри вены отсутствуют какие-либо образования, кроме клапанов. Последние представлены, как правило, двумя полукруглыми тенями, изменяющими положение в просвете вены в зависимости от дыхательных движений. На высоте пробы Вальсальвы створки клапана при эктазии вены не смыкаются и даже пролабируют (рис. 278).
Уточнение локализации клапана ускоряет его поиск во время хирургических вмешательств. Кроме того, хирургу необходимо дать сведения не только о наличии рефлюкса. но и его характере и протяженности
Дальнейшее описание поверхностных вен нижних конечностей приводим на примере большой подкожной вены, так как изменения кровотока, выявленные в ней, полностью совпадают с данными кровотока полученными при исследовании малой подкожной вены
В норме кровоток в стволе большой подкожной вены с использованием цветового и энергетического картирования легко лоцируют на всем протяжении вены от остиального клапана до медиальной лодыжки.
С применением этих режимов визуализации кровотока в просвете вены не представляет никаких проблем выявить любой рефлюкс через остиальный клапан, рефлюксы на протяжении всего ствола большой подкожной вены, рефлюксы из притоков и перфорантных вен.
Использование режима B-flow существенным образом изменило эхографическую картину известных нам ранее вариантов потоков крови в системе большой и малой подкожных вен. Оказалось, что в норме большая подкожная вена синхронно работает со своими притоками только в 68% случаях. У этих пациентов кровоток одновременно движется как в стволе большой подкожной вены, так и поступает в него из ее притоков.

Рис. 277 Эхограмма продольного сканирования
вены в В-режиме. Варикозное расширение ствола большой подкожнои вены.

Рис. 278. Цветовая допплеровская эхограмма в триплексном режиме (продольное сканирование). Ретроградный кровоток в проекции остиального клапана при выполнении пробы Вальсальвы.
В 32% наблюдений поток крови движется по стволу большой подкожной вены, но из притоков в нее не поступает. В этой ситуации кровоток в притоках большой подкожной вены отсутствует. Просвет их просто пуст. Кровоток определяют только в стволе большой подкожной вены. После того как весь объем кровотока из ствола большой подкожной вены поступает в общую бедренную вену, ствол большой подкожной вены становится совершенно пуст. Видны только стенки сосуда и его анэхогенный просвет. После того как ствол большой подкожной вены освободился от кровотока, в пустой ствол вены синхронно, из всех видимых притоков поступает кровь, которая постепенно заполняет просвет ствола большой подкожной вены от медиальнои лодыжки до остиального клапана. В это же время большая подкожная вена начинает заполняться и из вен стопы. Причем в первую очередь заполняется часть большой подкожной вены, расположенная на голени, а затем более проксимальные отделы ствола большой подкожной вены.
Если в бедренной части большой подкожной вены имеется в наличии ее приток или притоки, то кровь может заполнить только определенный участок ствола большой подкожной вены непосредственно в том месте, где имеется впадение притока или притоков в основной ствол вены. Проксимальнее и дистальнее впадения притока или притоков ствол большой подкожной вены не заполняется потоком. Работает этот приток или притоки, расположенные в области бедра, синхронно с притоками большой подкожной вены в области голени, но не со стволом вены. Постепенно кровоток из ствола большой подкожной вены в области голени доходит до части ствола большой подкожной вены, который заполнен кровотоком из притока в области бедра, затем дальше распространяется до остиального клапана, и весь его объем одномоментно поступает в общую бедренную вену. В момент, когда весь объем крови начинает поступать в общую бедренную вену, притоки полностью опорожняются, и уже их просвет становится анэхогенным. Дальше все происходит снова.
Притоки одновременно заполняются кровью (первая фаза), из них она поступает в ствол большой подкожной вены (вторая фаза), ствол полностью заполнен (третья фаза), и весь объем крови из ствола большой подкожной вены одновременно поступает в общую бедренную вену (четвертая фаза).
Роль притоков большой подкожной вены в развитии варикозной болезни весьма значительна. Характер кровотока в стволе большой подкожной вены зависит от угла впадения притока в ствол большой подкожной вены. Чем меньше угол (по отношению к антеградному направлению кровотока в стволе большой подкожной вены), образующийся при впадении притока в ствол большой подкожной вены, тем направление двух кровотоков более совпадает друг с другом и не возникает турбулентных потоков в месте слияния притока и ствола вены. Это было отмечено в тех случаях, когда угол впадения притока в ствол вены не превышает 70°. Если угол между впадающим притоком и стволом большой подкожной вены достаточно велик и превышает 70°, то в стволе большой подкожной вены появляется турбулентный кровоток, который не может пробиться вверх в проксимальном направлении. Кровоток в стволе большой подкожной вены раздваивается, а перед раздвоенной его частью отчетливо определяется турбулентный кровоток.
Развитие варикозной болезни можно прогнозировать в доклинической стадии заболевания. Основным фактором здесь является не первичная клапанная недостаточность, а направление кровотока в притоках систем большой и малой подкожных вен при слиянии с магистральным кровотоком в стволах большой и малой подкожных вен.
Роль перфорантных вен в возникновении горизонтального рефлюкса полностью доказана. Ультразвуковые исследования позволяют визуализировать перфорантные вены диаметром 1,5-2,3 мм. При таких размерах перфорантную вену легко выявить, дополняя В-режим исследованием в режиме ЦДК или ЭДК (рис. 279).
Целесообразно у пациентов с варикозной болезнью ультразвуковое исследование перфорантных вен нижних конечностей выполнять вместе с сосудистым хирургом. Обычно это делают накануне дня операции. Присутствие сосудистого хирурга в кабинете ультразвуковой диагностики преследует важную цель - совместный поиск и маскировку несостоятельности перфорантных вен. Кроме выявления перфорантных вен, сосудистому хирургу дают полную информацию о состоянии всей системы поверхностных и глубоких вен нижних конечностей с локализацией вено-венозных сбросов и проходимости вен во всех отделах нижних конечностей, подвздошных и нижней полой вены.
Несостоятельность перфорантов диаметром 1,5-2 мм и более нетрудно выявить с применением цветового картирования, дополненного спектральной допплерографией Что же касается перфорантов диаметром 1 мм и меньше, здесь для этих ультразвуковых методов в плане обнаружения несостоятельности перфорантных вен возникают определенные трудности. В перфорантной вене диаметром 0,5 мм уже непросто выявить направление кровотока и. главное установить несостоятельность венозного сосуда данного диаметра. В перфорантной вене диаметром 0,2-0,4 мм это сделать еще сложнее. Используя режим B-flow в перфорантной вене совершенно отчетливо видно, как или каким образом кровоток движется по сосуду.
Необходимо помнить, что важную роль в возникновении несостоятельности перфорантных вен играет угол слияния направлений кровотока из перфорантной вены и кровотока в глубокой вене нижней конечности. Чаще всего несостоятельные перфоранты лоцируют в тех случаях, когда угол между слиянием антеградных направлений кровотоков из перфорантной вены и в глубокой вене был больше 70о Вероятно, угол соединения кровотоков из перфорантной и глубокой вен больше 70о является одним из определяющих факторов в последующим развитии несостоятельности перфорантной вены.
Совпадение направлений кровотоков не приводит к образованию турбулентных частей кровотока в глубокой вене в месте впадения в нее перфорантной вены Тем самым в данных случаях такой перфорант, при отсутствии других предрасполагающих факторов, не теряет свою состоятельность.

Рис 279. Цветовая допплеровская эхограмма голени в режиме ЦДК. Перфорантная вена голени.
Поверхностные вены могут заполнять кровоток несихронно с глубокими венами Первыми заполняются стволы поверхностных вен. Наступает кратковременный момент, когда давление в поверхностных венах превышает давление в глубоких венах нижних конечностей. За счет повышения давления в поверхностных венах заполняются перфорантные вены. В это время глубокие вены имеют пустые стволы, без признаков их кровенаполнения (фаза диастолы «мышечно-венозной помпы») Кровоток из перфорантных вен поступает в пустые глубокие вены. Одновременно с началом опорожнения перфорантных вен стволы глубоких вен начинают заполняться и из других источников. Дальше происходит следующее: глубокие вены полностью заполняются потоком крови и после этого мгновенно весь объем кровотока из глубоких вен нижних конечностей поступает в проксимальном направлении
Посттромбофлебитическая болезнь развивается как результат перенесенного острого тромбоза глубоких вен. Исход тромботического процесса зависит от степени выраженности ретракции кровяного сгустка и спонтанного лизиса тромба. В одних случаях наступает полная реканализация, в других - полная облитерация, в третьих - проходимость сосуда восстанавливается частично. Наиболее часто после тромбоза магистральных вен происходит частичная реканализация просвета сосуда с флебосклерозом и клапанной недостаточностью. В результате этого в конечности развиваются грубые нарушения гемодинамики: венозная гипертония, патологический сброс крови в подкожные вены и варикозное расширение их, выраженное изменение в системе микроциркуляции [17]. Исходя из этих предпосылок, ультразвуковое обследование пациента должно дать ответ на следующие вопросы: 1) проходимы ли глубокие вены? 2) на каком протяжении поврежден клапанный аппарат глубоких вен? 3) в каком состоянии находятся клапаны поверхностных вен? 4) где локализуются недостаточные коммуникантные вены?
Посттромботическое поражение магистральных вен имеет ряд принципиальных ультразвуковых особенностей. Органическая авальвуляция пораженного венозного сегмента не позволяет визуализировать в нем функционирующие створки клапанного аппарата. Последние полностью разрушены или адгезированы к стенкам вены. Асептическое воспаление приводит к перивазальной реакции, вследствие которой стенка сосуда утолщается в несколько раз по сравнению с интактной. Ультразвуковое исследование выявляет неоднородность просвета вены за счет наличия тромботических масс разной степени организации. Пораженный венозный сегмент становится ригидным и перестает реагировать на компрессию.
Исследование в режимах ЦДК и ЭДК позволяет выявить несколько типов реканализации венозного сегмента (рис. 280). Наиболее часто встречается кабельный тип, характеризующийся тем, что в просвете вены определяют несколько каналов самостоятельного кровотока. Реже реканализация протекает по одноканальному типу. При этом обычно по передней и задней стенке появляется канал с кровотоком, занимающий от одной трети до половины просвета сосуда. Остальная часть просвета заполнена организованными тромботическими массами. Показательно, что в зоне окклюзированной вены визуализируют большое количество компенсаторных коллатералей.

Рис. 280. Цветовая допплеровская эхограмма бедра в режиме ЦДК. Тромбоз глубокой бедренной вены, стадия выраженной реканализации.
В заключение необходимо подчеркнуть, что применение современных ультразвуковых технологий в диагностике заболеваний вен нижних конечностей значительно расширяет сегодняшние представления врачей о патофизиологии и гемодинамике по венам ног, способствует переходу к адекватному выбору хирургического лечения и физиологически обоснованных способов коррекции венозной недостаточности нижних конечностей.
Необходимо отметить, что ультразвуковая оценка венозной и артериальной системы нижних конечностей может показаться незавершённой, если бы без внимания остались вопросы функционального изучения допплеровским ультразвуком артериальной недостаточности нижних конечностей и прямо связанной с ней протезно-реабилитационной помощи что и будет освещено в последней главе.
ГЛАВА 18
ОЦЕНКА АРТЕРИАЛЬНОЙ НЕДОСТАТОЧНОСТИ НИЖНИХ КОНЕЧНОСТЕЙ В ТРЕДМИЛ-ТЕСТЕ С ИСПОЛЬЗОВАНИЕМ УЛЬТРАЗВУКОВОЙ ДОППЛЕРОГРАФИИ
Ультразвуковая допплерография, цветовое дуплексное сканирование направлены на решение задач диагностики и оценки выраженности нарушений проходимости артерий. В то же время конечным результатом окклюзирующего поражения артерий нижних конечностей является артериальная недостаточность (АН), которая ограничивает ходьбу из-за ишемии работающих мышц ног. Это собственно и беспокоит больного.
Известно, что одинаковая выраженность нарушения проходимости артерий может приводить к индивидуально различному ограничению ходьбы. Поэтому истинную «тяжесть» заболевания нельзя оценить без определения степени АН. Целью любого вида лечения больных с поражением артерий нижних конечностей является не только нормализация гемодинамических параметров (чаще измеряемых в состоянии покоя), но и устранение или уменьшение вероятности появления ишемии тканей. Например, нормально функционирующий шунт в состоянии покоя не гарантирует отсутствие ишемии при нагрузках. Следовательно, для полноценного определения эффекта любого вида лечения перемежающей хромоты (и особенно консервативных), помимо традиционных ультразвуковых и ангиографических методов, необходимы методы оценки степени тяжести АН.
Под АН понимают синдром, связанный с окклюзирующим поражением артерий и проявляющийся периодически или постоянно ишемией тканей, то есть несоответствием между артериальным притоком и метаболической потребностью тканей в кровоснабжении. В связи с этим для оценки степени тяжести АН нижних конечностей необходимо нагрузочное воздействие на метаболические потребности мышц (энерготраты). При этом величина нагрузки в момент появления ишемии (критическая нагрузка) может являться количественной мерой оценки степени тяжести АН: чем меньше нагрузка, при которой возникает ишемия, тем тяжелее степень артериальной недостаточности. Такой подход обусловливает необходимость использования нагрузочного теста с серией возрастающих нагрузок.
Однако наиболее распространенные в настоящее время тесты на бегущей дорожке (тредмил-тесты) включают всего один уровень нагрузки (одноступенчатые тесты), например ходьбу со скоростью 3 км/час [1,2]. При этом в одних тестах определяют безболевую и максимальную дистанции ходьбы (по жалобам больного) [1], в других - оценивают степень падения лодыжечно-плечевого индекса после достижения перемежающей хромоты [2]. Существуют варианты тредмил-теста, объединяющие эти подходы [3].
Недостаток первых тестов заключается в субъективности определения момента возникновения ишемии по болевому синдрому, на который оказывают влияние различная болевая чувствительность, волевые качества больного и т. д. Снижение лодыжечно-плечевого индекса - это уже следствие возникшей ишемии, а не характеристика момента ее возникновения, определение которого является обязательным для выявления критического уровня нагрузки. Одноступенчатость тестов не позволяет использовать величину нагрузки в качестве меры оценки тяжести АН, так как она в течение теста не меняется. Все это делает указанные тредмил-тесты только диагностическими, степень АН по ним можно оценить очень приблизительно.
В связи с этим нами был разработан многоступенчатый тредмил-тест с серией возрастающих нагрузок и объективными допплерографическими критериями ишемии тканей [4-8].
Для реализации такого тредмил-теста необходима следующая аппаратура: 1) бегущая дорожка (тредмил), позволяющая плавно увеличивать скорость и менять угол наклона, 2) ультразвуковой допплеровский прибор, позволяющий длительно записывать допплерограмму, то есть мониторировать скорость кровотока. Наилучшие возможности для этого имеют приборы НФП «БИОСС» (Россия), которые позволяют одновременно регистрировать кровоток в двух конечностях (двухканальные).
Помимо указанной аппаратуры необходимо иметь электрокардиограф, так как согласно рекомендациям ВОЗ [9] нагрузочные тесты следует проводить под контролем ЭКГ, и обычный тонометр для контроля артериального давления в течение нагрузочного воздействия.
1. Методика тредмил-теста
Нагрузка на бегущей дорожке дозируется двумя способами: повышением скорости ходьбы и увеличением угла наклона тредмила (имитация ходьбы «в гору»), В связи с этим каждая нагрузочная ступень характеризуется либо только скоростью ходьбы, либо одновременно скоростью и углом наклона тредмила.
Длительность каждой ступени равна 3 минутам. Это время, необходимое для достижения нового установившегося состояния параметров кровообращения при нагрузочном режиме.
Дозировка нагрузки в тредмил-тесте следующая.
На первых пяти ступенях скорость ходьбы составляет 1, 2, 3,4 и 5 км/час соответственно. Начиная с шестой ступени скорость движения ленты фиксируют на величине 5,4 км/час и уровень нагрузки повышают увеличением угла наклона тредмила на 2% (имитация «горы») на каждой последующей ступени.
После каждой ступени тредмил-теста следует период отдыха, длительность которого обусловлена временем восстановления регистрируемых показателей кровотока (от 2 до 10 мин.).
Полная методика тредмил-теста состоит из 12-14 нагрузочных ступеней, охватывающих диапазон от малых до максимальных нагрузок здорового человека. Однако больной с окклюзирующим поражением артерий нижних конечностей чаще всего может выполнить не более 4-5 ступеней и нагрузочная часть теста занимает 15-35 мин.
Величину нагрузки, при которой возникает ишемия тканей (критическая нагрузка), оценивают как по величине внешнего воздействия (количеству выполненных ступеней тредмил-теста, скорости ходьбы, пройденному расстоянию), так и по метаболическому уровню этой нагрузки (мышечным энерготратам), определяемому по величине потребления кислорода. Оценка по количеству метров, пройденных в тредмил-тесте, введена из-за ангиологической традиции, когда степень ишемии конечностей оценивают по расстоянию, пройденному больным до возникновения перемежающей хромоты. В нашем тредмил-тесте это расстояние измеряем до возникновения объективных инструментальных признаков ишемии. Расстояние, проходимое больным на первой ступени, составляет 50 м, на второй - 100 м, на третьей - 150 м и на четвертой - 200 м. Расстояния суммируют в зависимости от количества выполненных ступеней. Например, если больной до появления признаков ишемии конечностей выполнил 2 ступени тредмил-теста, то расстояние будет равно 150 м, если 3 ступени, то 300 м и т. д. Для больных, которые смогли выполнить первые шесть ступеней тредмил-теста без ишемии нижних конечностей, пройденное расстояние как критерий оценки нагрузки лишается смысла. У таких больных нагрузку необходимо оценивать другими перечисленными выше параметрами: количеством выполненных ступеней тредмил-теста или метаболической стоимостью нагрузки.
Метаболический уровень нагрузки оценивают по величине потребления кислорода (П02) в течение тредмил-теста [9, 10]. При этом ПО2 измеряют за минуту, нормируют этот показатель по весу, но чаще всего используют наиболее унифицированный показатель - метаболическую единицу [9, 10]. Одна метаболическая единица (МЕТ) равна 3,5 мл ПО2 на 1 кг веса в 1 минуту.
Для измерения ПО2 необходим газоанализатор. Однако оценивать нагрузку в МЕТ можно и без этого прибора. В настоящее время проведено много сопоставлений уровня нагрузки в тредмил-тесте с ПО2. Согласно нашим результатам [7, 8] метаболическая стоимость каждой ступени тредмил-теста, определенной по ПО2 для мужчин 37-63 лет и весом от 59 до 95 кг, представлена в таблице 66.
Таблица 66. Метаболическая стоимость нагрузки в тредмил-тесте.
|
Номер нагрузочной |
Скорость ходьбы |
Угол наклона |
Метаболический |
|
ступени |
(км/час.) |
тредмила (%) |
уровень (МЕТ)* |
|
1 |
1.0 |
0 |
1,9-2,2 |
|
2 |
2.0 |
0 |
2,4-2,6 |
|
3 |
3.0 |
0 |
2,9-3,2 |
|
4 |
4.0 |
0 |
3,4-3,6 |
|
5 |
5.0 |
0 |
3,8-4.4 |
|
6 |
5.4 |
2 |
4,2-5,2 |
|
7 |
5.4 |
4 |
5,0-6,2 |
|
8 |
5.4 |
6 |
6,8-7,3 |
|
9 |
5.4 |
8 |
7,6-8,3 |
|
10 |
5.4 |
10 |
7,5-9,4 |
|
11 |
5.4 |
12 |
8,3-10,5 |
|
12 |
5.4 |
14 |
9,1-11,5 |
* интервал значений МЕТ на каждой ступени обусловлен различиями в возрасте и в массе тела больных.

Рис. 281. Допплерограммы кровотока по общей бедренной артерии после первых 3-х ступеней тредмил теста
По вертикальной оси - скорость в см/с, по горизонтальной - время в сек. Vd - скорость непрерывного диастолического кровотока, Тd - время существования непрерывного диастолического кровотока (возрастает с увеличением скорости ходьбы).
Критерии ишемии. Как уже было сказано ранее степень тяжести АН определяется по уровню нагрузки в момент возникновения ишемии тканей. Для этого необходимы объективные критерии ишемии конечности.
Возникновение ишемии тканей нижних конечностей при возрастающей физической нагрузке сопровождается образованием избыточного количества молочной кислоты - ишемическим лактат-ацидозом [10]. В связи с этим наиболее точно момент возникновения ишемии может быть определен по кривой динамики концентрации лактага крови в течение тредмил-теста. Однако выявление этого момента возможно по допплерограмме артериального кровотока нижней конечности [4-8] Для этого после каждой ступени тредмил-теста необходимо измерять кровоток в любой магистральной артерии бедренно-подколенного сегмента конечности с помощью ультразвукового допплеровского прибора. Наиболее удобно измерять кровоток в общей бедренной артерии.
Перед проведением теста ультразвуковой датчик (4 МГц) устанавливают в проекции выбранной артерии (больной при этом стоит на бегущей дорожке). Регистрируют первую допплерограмму и определяют наилучшую точку локации кровотока. Далее проводят серию нагрузок по представленной выше методике тредмил-теста и после каждой ступени сразу после прекращения ходьбы регистрируют кровоток (рис. 281).
Постнагрузочный кровоток, в отличие от кровотока в покое, характеризуется появлением диастолического компонента скорости (Vd). Этот непрерывный диастолический кровоток после прекращения ходьбы постепенно уменьшается до полного исчезновения или до вновь установившегося состояния.
Для определения момента возникновения ишемии тканей конечности необходимо измерить время существования непрерывного диастолического кровотока (Td) после каждой ступени тредмил-теста.
В результате измерений каждой ступени теста соответствует одно значение времени существования диастолического кровотока. Далее необходимо построить график, откладывая по вертикальной оси эти значения (в секундах), а по горизонтальной - величину нагрузки на каждой ступени (например, в количестве выполненных ступеней или метаболических единицах - МЕТ) Окончательным результатом является типичная зависимость Td от роста нагрузки в тредмил-тесте показанная на рис. 282. Сначала Td увеличивается медленно, а затем, с определенной ступени, начинает бурно нарастать. Перелом динамики Td в сторону резкого увеличения совпадает с возникновением ишемического лактатацидоза, то есть резкого увеличения концентрации молочной кислоты в результате возникновения ишемии. Кривая лактата крови у этого же больного показана на рис. 283, где можно наблюдать, что перелом динамики этого показателя также наступил после третьей ступени тредмил-теста. Следовательно, критическая нагрузка у данного пациента равна трём ступеням тредмил-теста (расстояние 300 м) или приблизительно трем метаболическим единицам.

Рис. 282. График динамики времени существования непрерывного диастолического кровотока (Td) в тредмил-тесте у больного с окклюзией наружной подвздошной артерии.
По вертикальной оси - время существования непрерывного диастолического кровотока (Td) в сек, по горизонтальной оси - ступени тредмил-теста. Стрелкой указан момент возникновения ишемии.

Рис. 283. График динамики концентрации лактата крови в тредмил-тесте у больного с окклюзией наружной подвздошной артерии. По вертикальной оси - концентрация лактата в ммоль/л, по горизонтальной оси - ступени тредмил-теста. Стрелкой указан момент возникновения ишемии.
Таким образом, момент возникновения ишемии тканей нижней конечности в многоступенчатом тредмил-тесте определяют по перелому динамики Td в сторону резкого увеличения. Количественным признаком перелома кривой является увеличение значения Td на последующей ступени по сравнению с предыдущей ступенью не менее чем на 60 секунд. Например, на рис. 281 показано, что на первых трех ступенях теста это время соответствует 87, 97 и 120 секундам, а на четвертой, пятой - 216 и 320 секундам соответственно. Следовательно, определяемое визуально на графике изменение динамики Td можно расценивать как перелом, поскольку на четвертой ступени Td увеличилось по сравнению с предыдущей на 96 секунд (то есть больше, чем на 60 секунд).
Интерпретация результатов. Для клинического применения метода необходима классификация степени тяжести АН по его результатам. С этой целью удобно использовать международно признанную метаболическую классификацию, применяемую для оценки функционального состояния кардиологических больных [9].
Известные четыре функциональных класса этой классификации нами были модифицированы, и третий класс разделен на два подкласса - III а и III б [5, 8]. Класс тяжести конкретного больного устанавливается по метаболическому уровню критической нагрузки (энерготратам), при которой развилась ишемия тканей. Например, если перелом динамики времени существования диастолического кровотока появляется при нагрузке в 4 МЕТ (5-я ступень тредмил- теста) то тяжесть АН соответствует III а функциональному классу. Полностью модифицированная классификация представлена в табл. 67.
Таблица 67. Метаболическая классификация для оценки тяжести артериальной недостаточности нижних конечностей.
|
Функциональный класс тяжести АН |
Критическая ступень |
МЕТ |
|
I (латентная) |
9 и более |
>7,0 |
|
II (легкая) |
7-8 |
5 0-6 9 |
|
III а (средняя) |
4-6 |
3,3-4,9 |
|
III б (тяжелая) |
2-3 |
2 ,1-3 2 |
|
IV (крайне тяжелая) |
1 |
<2,0 |
Метаболическая стоимость I функционального класса соответствует большим физическим нагрузкам Ишемия конечности в тредмил-тесте возникает не ранее чем на 9-й ступени тредмил-теста, а в обычной жизни проявляется при беге трусцой со скоростью более 8 км/ч, или при езде на велосипеде (19 км/ч) Естественно, что подобные больные редко обращаются к врачу, а мышечный дискомфорт при больших нагрузках связывают с усталостью. Результаты ультразвуковой допплерографии артерий нижних конечностей у больных, относящихся к этому классу полностью соответствуют норме, но на рентгеноконтрастных ангиограммах или при дуплексном сканировании выявляют стенозы не более 50% просвета магистральной артерии. В связи с этим, I функциональный класс интерпретируют как латентную артериальную недостаточность.
При возникновении ишемии конечности на 7 и 8 ступенях больного относят ко II функциональному классу Ишемия конечности у таких пациентов проявляется при меньших физических нагрузках: при быстрой ходьбе в гору или при катании на коньках. Это соответствует легкой степени артериальной недостаточности. Критическая нагрузка 4-6 ступеней соответствует III а классу. При этом метаболическая стоимость бытовой критической нагрузки еще ниже и соответствует ходьбе по ровной местности со скоростью не более чем 4 км/ч, медленной езде на велосипеде или игре в волейбол без элементов соревнования. Это средняя степень тяжести артериальной недостаточности.
Если больной принадлежит к III б классу (2 или 3 ступень теста), артериальная недостаточность является тяжелой, клинически проявляясь ишемией при медленной ходьбе или при стоячей работе. При крайне тяжелой степени артериальной недостаточности (IV класс) ишемия возникает при энерготратах, соответствующих физическому покою или ходьбе со скоростью не более 1,0-1,5 км/час.
Может возникнуть вопрос: как соотносится представленная классификация с известными клиническими классификациями степени ишемии нижних конечностей по R. Fontaine [11] или А.В. Покровскому [12]? Не следует искать точных совпадений объективно определенных классов тяжести АН по результатам тредмил-теста и клинически определенных по жалобам больного степеней выраженности ишемии. Однако проведенные исследования показали, что в I и II функциональных классах АН более чем у 76% больных клинически диагностировали 1-ю степень ишемии конечностей. При III а классе - у 80% больных выявлена ишемия 2 а и у 20% - 2 б степеней. При III б классе - у 86% больных обнаруживали клиническую картину ишемии 2 б степени. При IV функциональном классе - у более чем половины больных диагностировали 3, а у остальных - 2 б степени ишемии конечности. Очевидно, что существует определенная корреляция между клиническими проявлениями и предлагаемой классификацией. Однако, если проводить тредмил-тест по описанной методике, то целесообразнее использовать предлагаемую классификацию. Преимущество заключается в том, что метаболическая классификация позволяет использовать в ангиологии разработанные рекомендации по реабилитации и безопасной бытовой активности для больных с кардиологической патологией [9]. Другим преимуществом является и то, что при сочетании окклюзирующих поражений периферических артерий с заболеваниями сердца тяжесть каждой из патологий может быть выражена функциональными классами единой классификации.
2. Клиническое применение
Метод успешно применяют в клинической практике для решения задач сосудистой хирургии [7, 8], консервативного печения АН [7, 8, 13], а также задач протезирования нижних конечностей после ампутаций [7, 8, 14-16].
В сосудистой хирургии шунтирующие операции являются одним из радикальных способов лечения артериальной недостаточности нижних конечностей. При этом если артерии окклюзированы в одном сегменте конечности, то достигается полная нормализация гемодинамики.
Результаты оценки тяжести АН нижних конечностей в тредмил-тесте до и после аорто-бедренного шунтирования при окклюзии артерий только в подвздошном сегменте (у 36 больных) представлены в таблице 68.
До операции тяжесть АН нижней конечности у большинства больных соответствовала III б и IV функциональным классам. После операции АН нижних конечностей не выявили только у половины больных, у которых ишемического лактат-ацидоза не наблюдалось при достижении больших нагрузок, свойственных совершенно здоровым людям. У другой половины больных (55%) диагностирована АН, соответствующая либо 1-11 (18%) или даже III а (27%) функциональному классу.
Таблица 68. Распределение больных (в %, М ± m) по степени тяжести АН, определенной в тредмил-тесте до и после аорто-бедренного шунтирования.
|
Степень тяжести АН |
До операции |
После операции |
|
Нет АН |
0±0 |
55 ±10* |
|
АН (по функциональным классам) | ||
|
I-II |
0±0 |
18 ± 8 |
|
III а |
19 ± 8 |
27±9 |
|
III б |
59 ±9 |
0±0* |
|
IV |
19 ± 8 |
0±0 |
Достоверные различия (р<0,05) отмечены звездочкой (*).
Результаты оценки тяжести АН нижних конечностей в тредмил-тесте при бедренно-подколенном шунтировании при окклюзии только поверхностной бедренной артерии (31 чел.) представлены в таблице 69
Таблица 69. Распределение больных (в %, М±m) по степени тяжести АН, определенной в тредмил-тесте до и после бедренно-подколенного шунтирования.
|
Степень тяжести АН |
До операции |
После операции |
|
Нет АН |
0±0 |
35 + 11* |
|
АН (по функциональным классам) | ||
|
I-II |
0±0 |
18 ± 9 |
|
III а |
0± 0 |
47 ± 12* |
|
III б |
71 ± 10 |
0±0* |
|
IV |
29 ± 10 |
0±0* |
Достоверные различия (р<0,05) отмечены звездочкой (*).
До шунтирования у большинства больных тяжесть артериальной недостаточности соответствовала Ill б (71%) и IV (29%) функциональным классам. После операции только у трети больных (35%) в тредмил-тесте не обнаружили ишемического лактат-ацидоза. У пятой части пациентов (18%) ишемия проявлялась при больших и средних нагрузках (I-II классы), и практически у половины больных (47%) ишемия возникала при малых нагрузках, соответствующих III а функциональному классу.
Таким образом, с помощью тредмил-теста было выявлено, что, несмотря на полное хирургическое восстановление проходимости артериального русла и полную нормализацию гемодинамики в покое у части больных сохраняется артериальная недостаточность, которая проявляется при физической нагрузке.
На практически полную нормализацию гемодинамики в покое после операции указывал магистральный тип кровотока на допплерограмме и восстановление лодыжечно-плечевого индекса до 0,96 ± 0,02 после аорто-бедренного и до 0.95 ± 0,03 после бедренно-подколенного шунтирований.
Полученные результаты свидетельствуют о том, что ультразвуковой допплерографии в покое недостаточно для оценки результатов хирургической реваскуляризации нижних конечностей. Для оценки эффекта сосудистой хирургии в полной мере необходимо обязательно использовать многоступенчатый тредмил-тест с объективными критериями ишемии тканей. Тредмил-тест позволяет выявить больных с сохраняющейся АН нижних конечностей после шунтирующих операций. Выявление таких больных практически важно для назначения дополнительной послеоперационной терапии и активной реабилитации.
Необходимость использования предлагаемого тредмил-теста в оценке результатов сосудистой хирургии может быть продемонстрирована на клиническом примере исследования больного через 3 месяца после операции на артериях. Приводим заключение по результатам этого тредмил-теста.
Б-ной М-в А.И., 64 г., рост 179 см, вес 85 кг. Диагноз: Атеросклероз артерий нижних конечностей. Окклюзия левых поверхностной бедренной и подколенной артерий. Окклюзия левой задней тибиальной артерии в дистальном отделе. После аутовенозного бедренно-переднетибиального шунтирования, нормальная проходимость шунта (лодыжечно-плечевой индекс 1,0).
В тредмил-тесте мониторировали кровоток по общей бедренной артерии обеих конечностей с использованием двухканального прибора НФП «БИОСС».
Ишемический лактатацидоз (перелом динамики Тd) левой нижней конечности возник на 4 ступени (3,6 МЕТ). Дискомфорт в левой икроножной мышце появился на следующей ступени теста. В правой нижней конечности признаков ишемии не было. Признаков ишемии миокарда, нарушений сердечного ритма не наблюдали. Максимально достигнутая частота сердечных сокращений: 108 уд/мин, максимальные величины АД: 160/80 мм. рт. ст.
Заключение: Ишемия левой нижней конечности возникает через 500 метров ходьбы. Артериальная недостаточность соответствует III а функциональному классу средняя степень тяжести. Артериальная недостаточность может быть обусловлена либо окклюзией задней тибиальной артерии, либо повышенным сопротивлением шунта. Необходимо назначение консервативной терапии и реабилитационных мероприятий (физических тренировок, электростимуляции мышц в ходьбе и т. д.). Повторное обследование через 4-5 недель.
Таким образом, до операции у больного была диагностирована окклюзия левой поверхностной бедренной (в нижней трети) и подколенной артерий, окклюзия задней тибиальной артерии в нижней трети голени. В связи с этим было возможным выполнение только бедренно-переднетибиального шунтирования. После операции самочувствие больного значительно улучшилось. До операции перемежающая хромота возникала через 50-70 м ходьбы, после операции больной мог ходить на большие расстояния и только при интенсивной ходьбе в гору или подъеме по лестнице ощущал быструю утомляемость икроножных мышц левой конечности. При ультразвуковой допплерографии шунта и передней тибиальной артерии были получены нормальные допплерограммы и нормальный лодыжечно-плечевой индекс. Кровоток по задней тибиальной артерии определить не удалось Таким образом послеоперационные клинические данные и результаты допплерографии свидетельствовали о благополучном состоянии периферического кровообращения. В то же время в тредмил-тесте была выявлена артериальная недостаточность, требующая обязательного лечения и реабилитации больного.
Консервативное лечение артериальной недостаточности нижних конечностей применяется при подготовке к операции, послеоперационной реабилитации или как терапевтическая альтернатива восстановительной хирургии сосудов
Приводим результаты оценки консервативного лечения сосудорасширяющими препаратами 40 больных с окклюзирующим поражением артерий нижних конечностей, которые в течение 10 дней внутривенно капельно получали либо ксантинол-никотинат (600 мг в сутки), либо папаверин (2.40 мг в сутки).
После лечения увеличение критической нагрузки наблюдали у трети больных (13 человек), у которых тредмил-тест до терапии приводил к ишемии на 1,6 ± 0,2 ступени в среднем (проходимое расстояние -119 + 26 м). После курса лечения этот уровень повысился до 31 ± 0,2 ступеней (332 ± 48 м, р<0,05).
Также у трети больных (14 человек) лечение привело к уменьшению выраженности ишемии (лактат-ацидоза) периферических тканей, без увеличения критической нагрузки (2.9 ±03 ступени 321 ± 49 м до и после лечения). На уменьшение выраженности лактат-ацидоза указывало достоверное уменьшение абсолютных величин Td на последних ступенях тредмил-теста.
Отсутствие какого-либо эффекта фармакологического лечения наблюдалось также у трети больных (13 человек), где не менялась ни критическая нагрузка (2,0 ± 0 3 ступени) ни выраженность ишемии
Следовательно по результатам тредмил-теста положительный эффект фармакологического лечения наблюдался у 67% больных. В то же время достоверных изменений результатов стандартной ультразвуковой допплерографии до и после лечения не наблюдалось ни в одной группе.
Таким образом, для оценки эффекта консервативных методов лечения еще в большей степени необходим предлагаемый тредмил-тест. Это обусловлено тем, что нагрузочный тест отражает в естественной взаимосвязи множество факторов - это и проходимость магистрального русла, состояние коллатералей, реологию крови, потребность тканей в кислороде и т. д. Консервативные методы лечения в отличие от хирургии, направлены не на восстановление проходимости артериального русла, а на другие перечисленные факторы.
Протезирование нижних конечностей. Необходимость применения тредмил-теста в этой области связана с тем, что количество ампутаций в результате критической ишемии нижних конечностей остается высоким. При этом значительная часть больных не пользуется протезами, а у тех, кто их использует нередко развивается ишемия культи, способствующая болезням культи и создающая основу для развития патологии других органов и систем. Ограничения использования протеза для ходьбы могут быть связаны и с ишемией сохранившейся конечности
Тредмил-тест для больных, ходящих на протезе, должен состоять из серии нагрузок с минимальным приростом от ступени к ступени. В связи с этим скорость на первой ступени составляет 0,5-1,0 км/ч, увеличиваясь на 0,5 км/ч на каждой из восьми (2-9) последующих ступеней. На десятой ступени скорость ходьбы составляет 5,4 км/ч. При необходимости, дальнейшую нагрузку можно наращивать путем увеличения угла подъема тредмила без изменения скорости ходьбы (5,4 км/ч): по описанной выше методике.
Использование такого тредмил-теста показало, при окклюзии подвздошной или общей бедренной артерий ишемия культи бедра возникает при ходьбе со скоростью 0,86 ±0,17 км/ч. Более того, у части больных после ампутации конечности в результате артериальной недостаточности, но с нормальной проходимостью артерий усеченной конечности ишемия культи также провоцируется ходьбой (1,23 ± 0,18 км/ч). Лишь у 17,5% ишемию культи не наблюдали и тредмил-тест прекращали при ходьбе со скоростью 3,28 ± 0,21 км/ч (р<0,05) в связи с трудностью управления протезом.
Похожая картина свойственна и инвалидам с культей голени: ишемия культи появляется при ходьбе со скоростью 1,64 ± 0,65 км/ч и не возникает при нормальной проходимости артерий (3,86 ± 0,49 км/ч), когда тестирование прекращали из-за биомеханических трудностей ходьбы на протезе.
Было выявлено, что реконструктивные сосудистые операции, проводимые до ампутации бедра, не гарантируют хороших результатов ходьбы на протезе в последующем. Если у таких больных нет окклюзий или стенозов оставшихся магистральных артерий, ишемия культи при ходьбе все равно может развиться при низкой критической скорости (1-3 км/ч). Ишемия здесь является результатом прессорного действия протеза на выраженные послеоперационные рубцовые изменения области сосудистого пучка на культе. При этом давление приемной гильзы протеза приводит к нарушению кровообращения, соизмеримого с окклюзией артерий. Этот неприятный эффект может быть устранен специфическими подходами реконструктивной сосудистой хирургии и щадящими принципами конструкции протеза.
Считается установленным, что ограничение ходьбы на протезе в большей степени зависит от поражения артерий сохранившейся конечности и это может являться даже противопоказанием к протезированию. Однако результаты тредмил-теста показали, что ишемия сохранившейся конечности провоцируется ходьбой со скоростью 1,49 ± 0,28 км/ч у тех больных, у которых ишемия культи развивается на одну-две ступени раньше (0,86 км/ч, р<0,05).
Следовательно, традиционный взгляд на поражение сосудов сохранившейся конечности, как фактор, наиболее ограничивающий ходьбу инвалида, неправомерен - прежде всего в лечении артериальной недостаточности нуждается культя.
Тредмил-тест позволяет оценивать различные виды протезов. У одних и тех же больных с культей бедра сравнили широко распространенный протез с коленным модулем РКК «Энергия» и разработанный в Центральном НИИ протезирования и протезостроения протез с коленным модулем, создающим наиболее близкую к естественной биомеханику ходьбы (с зарессоренным подгибанием «колена»). Использование последнего протеза увеличило критическую нагрузку для культи и сохранившейся конечности на 0,5 км/ч, что существенно расширило неишемический диапазон ходьбы на протезе [7,15].
ПОСЛЕСЛОВИЕ
Сомневались в необходимости написания послесловия, но вовремя поняли, что без него книга осталась бы незавершенной. При завершении редактирования последней главы, а с ней и всей монографии по использованию допплеровского ультразвука в клинической практике, стало очевидным, что в книге подведены итоги новейших достижений и успехов ученых нашей страны и мировой науки за последние 5-7 лет в применении ультразвуковой допплеровской диагностики при поражениях сосудов органов и систем. Необходимо отметить широту диапазона возможного проникновения врача-практика с ультразвуковым датчиком в изучение сосудистых поражений почти всех органов больного человека, еще недавно недоступных для ультразвуковых исследований. Проанализированы диагностические возможности и перспективы допплеровского ультразвука, намечены пути его возможного развития и совершенствования. Показан огромный прогресс ультразвука во всех областях медицины.
Однако, судя по той стремительности развития новейшей ультразвуковой техники, ежегодным фантастическим открытиям новых технологий, большому технологическому успеху отечественных ультразвуковых фирм («БИОСС», «Спектромед»), можно с уверенностью утверждать, что новые свершения и победы допплеровского ультразвука в нашей стране еще впереди. Всё это позволяет с оптимизмом смотреть в будущее ультразвуковой допплеровской диагностики и ее применения в клинической медицине.
Ю.М. Никитин, А.И. Труханов
СПИСОК ЛИТЕРАТУРЫ
К главе 1
- Doppler J С. Uber das farbige Licht der Dopplersterne und einiger anderer Gestirne des Himmels // Abhandlungten der Koniglichen Bohemischen Gessellschaft der Wissenschaften. 1842. Bd. 11. S. 466—482.
- Buys Ballot C.H.D. Akustische Versuche auf der Niederlandishen Eisenbahn, riebst gelege- ntlichen Bemerkungen zurTheorie des Hrn. Prof. Doppler// Pogg. Ann. 1845. Bd. LXVI-11. S. 321-351.
- Eden A. The search for Christian Doppler. Vien: Springer-Kerlag, 1992.
- Satomura S. A study on examining the heart with ultrasonics. I. Principles; II. Instrument // JPN. Circ.J. 1956. V. 20. P. 227-241.
- Важнов Ю.С., Веневцев M.K., Никитин Ю.М. и др. Ультразвуковой допплеровский измеритель скорости кровотока / Авторское свидетельство СССР, № 1215659.
- Ультразвуковой допплеровский измеритель скорости кровотока Диск-01 // Электронная промышленность. 1976. вып. 4 (52). С. 12.
- Кудрявцев П.С. Алгоритмическое и программное обеспечение комплексов для допплерографического ультразвукового экстра- и интракраниального исследования мозгового кровообращения // Медицинская техника. 1994. № 1. С. 7-11.
- Труханов А.И., Нагулин Н.Е. Проектирование семейства ультразвуковых диагностических комплексов на базе современных компьютерных технологий // Медицинская техника. 1996. № 1. С. 29-35.
- Рекламный проспект прибора Биомед. Зеленоград: БИОСС, 1995.
- Namekawa К., Kasai С., Tsakamoto М., Koyano A. Real-time blood flow imaging system utilizing autocorrelation techniques // Ultrasound:82 / Ed. R.A. Lerski. New York: Pergamon Press, 1982. P. 203-208.
- Arenson J , Allison J. New technology shows promise of improving the doppler image / Medical Imaging Int. 1994. Sept. P. 16.
- Arenson J., Peressini C., Jackson J. Convergent TM Colour Doppler / Acuson Corp. 10/09/1996.
- Bach B.S. Quantitative Doppler tissue imaging as a correlate of left ventricular contractivity // Int. J. of cardiac Imaging. V. 12. 1986. P. 191-195.
- Lange A. et ai. A comparative study of grey scale versus Doppler tissue imaging left ventricular volume measurements using three dimensional reconstruction // Eur. Heart J 1995. V. 16. P. 266.
- Halter P. Advances in ultrasound imaging // Medical Imaging International. 1996. № 1. P. 4.
- Burns P.N. Ultrasound contrast agents in radiological diagnosis // La Radiologia Medica. 1994. V. 87. № 1. P. 71-82.
- Advances in echo imaging using contrast enhancement / Ed. N. Nanda, R. Schlief. В.: Kluwer Academic Publ., 1993.
- Труханов А.И., Нагулин H.E., Кудрявцев П.С. Компьютерные комплексы для ультразвукового допплеровского исследования кровотока // Медицинская техника. 1994. № 1. С.15—18.
- Oates С.P. Classification of Doppler Ultrasound Waveforms as an Aid to Clinical Diagnosis // Physics in Medical Ultrasound / Ed. D.H. Evans. 1988. P 125-133
- Evans D.H. Principal component analysis applied to the diagnosis of arterial disease // Diagnostic Vascular Ultrasound / Ed. K.H. Labs et al. L.: Edward Arnold, 1992.
- Труханов А.И., Кудрявцев П.С. Аппаратное и программное обеспечение для интеграции диагностической информации на базе локальных сетей // Медицинская техника. 1994. № 1. С. 3-7.
- Evans D.H. McDicken W.N., Skidmore R., Woodcock J.P. Doppler ultrasound (Physics, Instrumentation and Clinical Applications). Colchester: John Wiley & Sons, 1989.
- Педли Т. Гидродинамика крупных кровеносных сосудов. Москва: Мир, 1983.
- Лищук В.А. Математическая теория кровообращения. Москва: Медицина, 1991.
- Кунцевич Г.И. Изменение кровотока в сонных артериях у больных с окклюзирующими поражениями магистральных артерий головного мозга // Дис. ... канд. мед. наук. М., 1987.
- Куперберг Е. Б. Диагностика синдромов подключичного обкрадывания методом УЗДГ // Тезисы докладов VIII съезда невропатологов. Москва, 1988.
- Минц А.Я., Грачев И.Д. Диагностические возможности УЗДГ // Материалы III республ. съезда невропатологов Грузии. Тбилиси, 1987.
- Клиническая УЗ диагностика: Руководство для врачей I Под ред. Н.М. Мухарлямова. Москва: Медицина, 1987.
- Парфенов В.А и др. Состояние сонных артерий и гемодинамика в них при ранних клинических формах цереброваскулярной патологии // Материалы 111 совещания невропатологов. Рига, 1989.
- Разуваева В.В. УЗДГ магистральных артерий головы у больных с малым инсультом // Сосудистые заболевания нервной системы. Москва, 1983. С. 123.
- Широков Е.А. УЗДГ в оценке состояния виллизиева круга при стенозах и окклюзиях сонных артерий // Тезисы докл. VIII съезда невропатологов. Москва, 1988.
- Грачев И.Д. УЗДГ при исследовании гемодинамики в общей сонной артерии у здоровых людей среднего и пожилого возрастов // Кровообращение. 1988. Т. 21. № 4.
- Никитин Ю.М. Поражение сосудов дуги аорты и их ветвей у больных с цереброваскулярными заболеваниями // Автореф. дис. ... докт. мед. наук, М.,1989. 32 с.
- The safe use of diagnostic ultrasound // The British Med. Ult. Soc. / Ed. M.F. Docker, F.A. Duck. London, 1991. P. 41
- Duck F.A., Starrit H.C., Anderson S.P. A survey of the acoustic output of ultrasonic Doppler equipment// Clin. Phys. Physiol. Meas. 1987. V. 8. № 1. P. 39-49.
- Evans D.H. Doppler Ultrasound: physics, instrumentation and clinical applications. Colchester: John Wiley & Sons, 1989. P. 297.
К главе 2
- Rubin J.M., Bude R.O., Carson P.L. et al. Power Doppler US: a potentially useful alternative to mean frequency-based color Doppler US. // Radiology. 1994. V. 190. P. 853-856.
- Зубарев A.B Новые ультразвуковые методики и эхоконтрастные препараты // Эхография. 2000. Т 1. № 1. С. 41-44
- Зубаре. А. В. Неинвазивная или малоинвазивная ультразвуковая ангиография // Кремл мед клин весг. 1998 № 4. С 68-71.
- Лелюк В. Г. Лелюк С.Э. Ультразвуковая ангиология. М.: Реальное Время. 1999 288 с.
- Campani R Bottinelli О.. CaNiada F. et al The latest in ultrasound three-dimensional imaging // Eur.J. Radiol. 1998. V. 27 Suppl. P 183-187
- Downey D.B Fenster A. Vascular imaging with a three-dimensional power Doppler system /; A JR. 1995. V 165. P. 665-668
- Зубарев А. В. Трехмерная и эхоконтрастная ангиография II Медицинская визуализация 1997. № 4. С. 3-8
- Lees W 3- and 4-dimensfanal ultrasound imaging II Medica mundi 1999 V. 43. №3 S. 23-30
- Gaionova V.. Zubarev A . Kozlov V 3D Powe. Doppler TRUS in the follow-up study of acute bacterial piostatitis and detection of prostatic abscess // Radiology 2001 Suppl. V 221. № 3 P 364.
- ZoubarevA Gajonova V Matyakin G. Chupnk-Maiinovskaya Т., Kislyakova M.. Malofievskaya E. 3D Tiansrectal Power Dopplei sonography in the follow up study of prostate cancer // RSNA 2000
- Kislyakova M. Gaionova V. ZoubarevA. 3D Power Doppler TRUS in the follow-up study of acute prostatitis II Ultrasound in Medicine and Biology 2000. V. 26 (Suppl. 2).
- Зубарев А.В. Гажонова B.E. Панюшкин C M Перепадя E В., Бошков В.Б. Трехмерная виртуальная эхоангиография почек// Эхография 2001. Т. 2. № 2 С. 124-130.
- Зубарев А. В., Гажонова В.Е Панюшкин С.М, Перепадя Е.В. Бошков В Б Михайлова RB Трехмерная виртуальная эхоангиография в выявлении добавочных почечиых артерий // Медицинская визуализация 2001 № 2 С. 78-85.
- Zubarev A Ultrasound of renal vesseis // European Radiology. 2001. V 11. Ns 10. P 1902- 1916.
- Зубарев А.В. Насникова И Ю. Козлов В. П. и др УЗ-ангиография; новью возможности диагностики объемных образований почек//Терапевтическии архив. 2001. Т 8 Ns 73. С 46-50.
- Зубарев А. В Гажонова В.Е. Насникова И.Ю. Шевченко Е.П. Сальников Д.В. Динамическая эхоконтрастная ангиография // Медицинская визуализаиия 1998. № 4. С. 24-30
- 17. Gajonova V. ZoubarevA Contrast enhanced 3D Power Doppler Sonogiaphy in evaluation Prostate Cancer II Ultrasound in Med. and Biol. 2000 V. 26 (Suppl 2).
- Jakobsen J Echo enhancing agents in the renal tract /? Clin Radiol 1996 V 51 P. 40-43.
- Haipern E J. Verkl L., Forsberg В. В. et al Initial expenence with contrast-enhanced sonography of the prostate II Prostate 1997. V. 32 P. 279-283
- Balen F G.. Allen С. M. Lees W R, Review: ultrasound contrast agents II Clin. Radiol. 1994. № 49 P 77-82.
- Brinkley J F Muramatsu S.K McCallum W.D. et al. In vitro evaluation of ultrasonic three dimensional imaging and volume system // Ultrasonic Imag. 1982, № 4. P. 126-139.
- Fenster A. Lee D. Sherebrin S. et ai. Three-dimensional ultrasound imaging of the vasculature II Ultrasonics 1998 V. 36 (1-5). P 629-633.
- Fenste. A, Downey D Rankin R. 3D allows intei active slicing of sonogramms // Diag. Imag Europe. 1995. № 5 P 11-14
- Fredfelt K.E, Holm Н.Н. Pedersen J.F Three dimensional ultrasonic scanning //Acta Radiol Diagn. 1984 V 25 P 237-24Г
- Kelly i,: Lees W R Three-dimensional imaging // Ad Hosp Technol, 1992. № 1 P. 53-58
- Nelson Г.Р. Downey D.B Pretorius D.H. et ai. Three-dimensional ultrasound // Lippincott: Williams & Wilkins, 1999. V. 11-69. P. 137-149
- Cosgrove D. Ultrasound contrast agents//Reflect'ons 1995 №1 R 6-7.
- Blomiey M., Corsgrove D IVlicrobubble echo-enhancers, a new direction for ultrasound // The Lancet. 1997 V. 349 P 1855-1856
- Зубарев А.В. Гажонова B.E , Кислякова M.B. Контрастная эхография // Медицинская визуализация 1998 №1 С. 5-31.
- Cosgrove D. Ultrasound contrast enhancement of tumors //Adv. Echo-Contrast. 1994 V 3 P 38-45
К главе 3
- Верещагин H.B . Моргунов В. А. Гулевская ТС Патология гоповного мозга при атеросклерозе и артериальной гипертензии. М Медицина, 1997. 287 с.
- Гусев Е.И Проблема инсульта в России // Журн невр. и психиат. им. С С. Корсакова 2003. Вып 9. с. 3-7.
- Яхно Н.Н.. Валенкова В. А. О. состоянии медицинской помощи больным с нарушением мозгового кровообращения II Неврологический журнал. 1999 № 4. С. 44-45
- Keller N.M Schubiger О., Krayenbuh С. Zumstein В. Cerebrovascular Doppler examination and cerebral angiography - alternative or complementary // Neuroradiology. 1978. V. 67. Ne 20 P. 140-144
- Никитин Ю.М. Метод ультразвуковой допплерографии в диагностике окклюзирующих поражений артерий основания мозга (доппперо-ангиографическое исследование) II Журн. неврол. и психиатр им С С. Корсакова. 1982. Т. 8. С 36-39.
- Никитин Ю.М. Поражение сосудов дуги аорты и их ветвей у больных с цереброваску- лярными заболеваниями (клинико-допплеро-ангиографическое исследование) // Дисс докт. мед наук. М. 1989 385 с.
- Aasiid R MarkwalderT Normes Н Noninvasive transcranial Doppler ultarasound recoding of flow velosities in basal cerebral arteries II J. Neurosurg. 1982. V. 57. P 769-774.
- Aasiid R. Huber P. Nornes H. Evaluation of cerebrovascular spasm with transcranial Doppler ultarasound//J. Neurosurg. 1984 V 60 P 37-41.
- Aasiid R. Transcranial Doppler sonography Vienn: Springer Verlad, 1986. 177 p
- Arnolds B. von Reutein G M. Transcranial Dopplei sonography: examination technique and normal reference values Ultrasound II Med. Biol. 1986, № 12. P. 115-123.
- Babikian VL Wechsier L R. Transcranial Doppier Ultrasonography. Mosby 1993 323 p
- Шмидт E В. Стеноз и тромбоз сонных артерии и нарушения мозгового кровообращения. М.: Медицина. 1963 275 с
- Колтовер А.Н, Верещагин Н В Людковская И Г, Моргунов В А. Патологическая анатомия нарушений мозгового кровообращения. М,: Медицина, 1975. 255 р.
- Никитин Ю.М Ультразвуковая допплерография Учебное пособие М.: Спектромед, 1996 47 с.
- Никитин Ю. М. Ультразвуковая допплерография в диагностике поражений артерий дуги аорты и основания мозга // Ультразвуковая допплеровская диагностика сосудистых заболеваний / под ред. Ю.М. Никитина А.И. Труханова М.: Видар 1998. С. 64-114.
- PourcelotL ApplicationscliniquesdeI examen Doppler//Seminaretechnologique INSERM, 1974 V 34 P. 213-240
- Franceschi C. L investigation vasculare par ultrasonographic Doppler. Masson, 1970 126 p.
- Beznstein E.F. Noninvasive diagnostic techniques in vascular disease. Mosby 1985 980 p.
- Аносов H.H. Значение феномена «обкрадывания» мозгового кровообращения в патогенезе инфаркта мозга // Журн. неврол, и психиатр 1972. N° 9 С. 1287-1292.
- Pourcelox L Ribadean-Duman J.Z., Fagret D, Pianiol Th Apport de I examin Doppler daus le diagnostic du vol susclavier/7 Revue Neuroloque 1977 V 133. Ns. 5 P. 309-323.
- Reutern voi G-M Pourcelot L. Cardiac cycle dependent alternating flow in vertebral arteries with subclavion artery stenosis // Stroke. 1978 V, 9 P. 2229-2232.
- Никитин Ю.М. Ультразвуковая диагностика в неврологии и нейрохирургии // Клиническая ультразвуковая диагностика (руководство для врачей) в двух томах / Под ред My харлямова Н.М. Москва 1987, T 2 С 133-216
- Брагина Л. К. О. закономерностях коллатерального кровобращения при окклюзирующих поражениях магистральных артерий головы в зависимости от состояния виллизиевого круга (ангиографическое изучение) // Журн. неврол и психиатр, 1967. Т. 67 №9 С.1293-1300,
- Ганнушкина И. В. Коллатеральное кровообрашение в мозге. М.; Медицина. 1973. 187 с.
- Верещагин Н. В. Патология вертебрально-базилярной системы и нарушения мозгового кровообращения М.: Медицина 1980. 321 с.
- Стулин И.Д, Карлов В А Костин А.В, Транскраниальная допплеросонография в сочетании с другими методами в диагностике инсульта Н Журн неврологии и психиатрии, 1989 T 89. вып 6. С, 98-105
- Grolimund P. et al Evaluation of cerebrovascular disease by combined exstracranial and transcranial Doppler sonography expiencewith 1039 patients//Stroke. 1987. V 18. P 1018— 1024
- Sloan M A et al. Seusitivity and specificity of transcranial Doppler ultrasonography in the diagnosis od vasospasm follow'ng subarachnoidia hemorrage II Neurology. 1989. V 39. P 1514-1518.
- Spenser M P. Intracranial carotid artery diagnosis with transorbital pulsed wave (CW) Doppler ultrasound // J of Ultrasound in Med Suppl. 1983. № 2 P 61-67.
- 30. Блинков C.M.. Глезер И. И. Мозг человека в цифрах и таблицах Л: Медицина, 1964. 471 с.
- Toole J F. Appiied anatomy of tne brain arteries II Cerebrovascular disorders 3d / Ed J F. Toole. New York: Raven Press, 1984 P 1-18
- Mitterwallner F Varionsstatistische Untersuchungen an den basalen Hirugefassen // Acta Anat, 1955. Bd 24 S 51-87
- Беленькая P.M. Инсульт и варианты артерий мозга. М Медицина. 1979. 179 с.
- Mall М Aulicli A., Hennentici М. Transcranial Doppler ultrasonography versus arteriography for assessment of the vertebrobasilar circulation // J. Clin Ultrasound 1990. V. 18. P. 539-549,
- Шахнович A P Шахнович В. А. Диагностика нарушений мозгового кровообращения. Транскраниальная допплерография М., 1996. 446 с
- Шахнович В.А, Ишемия мозга Нейросонолсгия М.. ACT. 2002. 306 с.
- Никитин Ю. М, Ультразвуковая диагностика // Нервные бопезни / Под ред Лузина М.Н. М.. Медицина, 2002. С. 62-92.
- Transcranial Doppler/Ed. D.W Newell R. Aasiid New York: Raven Press 1992 230 p.
- Rautenberg VV. Transcranials Dopplersonographie II Dureb.lutengs-storunden des Gehirn-sneue aiagnostike Moglichkeiten Dusseldorf 1987 S 30-55.
- Михайленко AA, Иванов ЮС. Семин ГФ. Ультразвуковая допплерография магистральных артерий головы и мозга в практике врача военного госпиталя (учебное пособие). СПб.. 1994. С 75
- Молотипов А М Ультразвуковая допплерография в оценке функционирования экстра- и интракраниальных микрососудистых анастомозов // XVI Республиканская научная конференция молодых медиков Грузии Материалы докладов (тезисы) Тбилиси, 1987. С 186-187.
- Harders A.G Neurosurgical applications of transcranial Doppler sonography Vienn 1986. 89 p.
- Lindegaard K.F. et al. Evaluation of cerebral AVM s using transcranial Doppler ultrasound // J Neurosurg 1986 V. 65. P. 335-344
- Barber FF Baker D W. Nation A.W et al. Ultrasonic duplex echodoppler scanner II IEEE Transaction au Biomedical Engineering. 1974, V, 21 P 109-113.
- Blackshear W.M Phillips D J. Thiele B.L, Hirsch J H Detection of carotid occlusive disease by Ultrasonic imaging and pulsed Doppler spectrum analysis II Siirdgery. 1979. V 86. P 698-706.
- Cooperberg PL. , Roberson N D. high resolution reai-time ultrasound of the carotid bifurcation II J Clin. Ultrasound, 1979 Ne 7 P. 13-17
- Gompels В. M. High definition of carotid arteries using a standard commercial ultrasound «А» A preliminary report // Br. J. Radiol. 1979 V. 52. P. 608-609
- Caplan L R. Ultiasound diagnosis of cerebrovascular disease Doppler Sonograrhy of the extra-and intracranial arteries, duplex scanning Sttutgart NY Georg Thieme Veriag 1993 397 p.
- Куликов В.П. Цветное дуплексное сканирование в диагностике сосудистых заболеваний. Новосибирск: СО РАМН, 1997. 204 с
- Кунцевич Г И. Ультразвуковые методы исследования магистральных артерий шеи и артерий виллизаева круга // Методы исследования в неврологии и нейрохирургии / Под ред. Е.И. Гусева. М. Нолидж 2000. С 145-209
- Лелюк С.Э. Лелюк В. Г. Основные принципы гемодинамики и ультразвукового исследования сосудов # Клиническое руководство по ультразвуковой диагностике / Под ред В. В. Митькова. М. Видар .1997 Т IV С. 185-194
- Лелюк В. Г. Лелюк С Е, Ультразвуковая ангиология М.. Реальное время. 1999, 286 с.
- Schoning М Walter J., Scheel Р. Estimation of cerebral blood flow through color duplex sonography of the carotid and vertebral arteries m healthy adults II Stroke. 1994 V. 25. P 17-22.
- Александров А, В., НоррисДж.В Ангиографическое измерения измерение стеноза внутренней сонной артерии II Ангиология и сосудистая хирургия 1996. № 4. С. 8-22.
- Barnett H.J.M, Warlow С. P. Carotid endarterectomy and the measurement of stenosis // Stroke, 1993. V. 24 P. 1281-1284
- Widder В. Pau.at К. Hackspacher J. Mayer E. Transcranial Doppler CO test for the detection of hemodynamically critical carotid artery stenosis and occlusions II Eur Arch, Psychiatry Neurol. Sci 1986 V. 236 P 162-168.
- Bladln C.F.. Alexandrov A.V. Murphy J. et al. Carotid Stenosis Index: a new method of measuring internal carotid artery stenosis // Stroke 1995. V 26. P. 230-234
- Rothwell PM Gibson R G . Slattery J et al Equivalence of measurements of carotid stenosis // Stroke, 1994 V 25, № 12. P 2435-2439
- Spenser M P. Reid J.M. Quantitation of carotid stenosis with continuous-wave (C-W) Doppler ultrasound II Stroke. 1979. V. 10. Na 3. P 326-330
- Steinke W Rautenberg W Schwartz A. Hennerici M. Noninvasive monitoring of internal carotid artery dissection // Stroke 1994, V 25 P 998-1005.
- Gray-Weaie A.C., Graham J.C., Burnett J.R Lusby R.J. Carotid artery atheroma: Comparison of preoperative B-mode ultrasound appearance with carotid endarterectomy specimen pathology II J. Caidivasc. Surgery. 1988. V 29, P 676-681
- Bartels E 1998.
- Seibler M., Sitzer M., Steinmetz H. Detection of intracranial emboli in patients with symptomatic extracranial carotid artery disease // Stroke. 1992. V. 23. P. 1652-1654.
- Seibler M., Sitzer M„ Rose G. et al. Microembolus detection in patients with high-grade internal carotid stenosis // Stroke. 1994. V. 25. 745 p.
- Sitzer M., Muller W., Siebler M. et al. Plaque Ulceration and Lumen Thombus Are the Main Sourrcet of Cerebral Microemboli in High-grade Internal Carotid Artery Stenosis // Stroke. 1995. V. 26. P. 1231-1233.
- Hennerici M., Hulsbauer H.B., Hefter H. et al Natural history of asymptomatic extracranial arterial disease: results of a long-term prospective study // Brain, 1987. V. 110. P. 777-791.
- Schoning M., Walter J., Scheel P., Estimation of cerebral blood flow through color duplex sonography of the carotid and vertebral arteries in heallthy adults // Stroke. 1994. V. 25. P. 17-22.
- Schoning M., Buchholz R., Walter J. Comparative study of transcranial color duplex sonography and transcranial Doppler sonography in adults // J. Neurosurg. 1993. V. 78. № 5. P. 776-784.
- Shakhnovich V.A. Periodic venous outflow in straight sinus in patients with intracranial hypertension // Stroke. 1994. V. 25. № 2. P. 397-400.
- Martin P.J. Evans D.H. Naylor A.R. Transcranial color-coder sonography of the basal cerebral circulation. Reference data from 115 volunteers // Stroke. 1994. V. 25. № 2. P 390-396.
- Лелюк В.Г., Лелюк С.Э. Дуплексное сканирование в диагностике поражений дуги аорты и основания мозга. // Ультразвуковая допплеровская диагностика сосудистых заболеваний / Под ред. Никитина Ю.М., Труханова А.И. М.: Видар, 1998. С. 128-162.
- Tell G.S., Howard G., McKinney W.M. Risk factors for site-specific extracranial carotid artery plaque distribution as measured by B-mode ultrasound // J. Clin. Epidemiol. 1989. V. 42. P. 551-559.
- Salonen R., Salonen J.T. Determinants of carotid intima-media thickness: a population-based ultrasonographic study in eastern Finnish men // J. Intern. Med. 1991. V. 15. P. 151-158.
- OlLeary D.H., Polak J.F. et al. Distribution and correlates of sonographically detected carotid artery disease in the Cardivascular Health Study // Stroke 1992. V. 23. P. 1752-1760.
- Шутихина И.В. Оценка состояния артериальной стенки общих сонных артерий и эффективность антиатирогенного воздействия по данным ультразвукового исследования //Дис. ... канд. биол. наук. М., 1998. 125 с.
- Bots M.L., Hofman A., Grobbee D.E. Common carotid intima-media thickness and lower extremity arterial atherosclerosis. The Rotterdam Study // Atherioscler. Tromb. 1994. V. 14. № 12. P. 1885-1891.
- Stary H.C. Natural history of atherosclerosis // Intima-Media Thickness and Atherosclerosis. Predicting the risk? / Ed. P.-J. Touboul. Paris, 1996. part 1. P. 1-18.
- Вознюк И.А. Острые и хронические нарушения мозгового кровообращения: гемодинамика и нейроморфология //Автор, дис. ... докт. мед. наук. СПб., 2000. 45 с.
- Лелюк С.Е. Автореф. дис. ... докт. мед. наук. 2002 47 с.
- Шидловский И.П. Дуплексное сканирование в диагностике расслоений экстракраниапьных отделов позвоночных артерий // Современное состояние методов неинвазивной диагностики в медицине. «Ангиодоп-98». Отрадное, 1998. С. 18-19.
- Калашникова Л.А., Кадыков А.С., Добрынина Л.А., Кротенкова М.В. Расслаивающая гематома (диссекция) стенки внутренней сонной артерий и ишемические нарушения мозгового кровообращения // Неврологический журнал. 2000. Т. 5. № 6. С. 13-15.
- Bogousslavsky J., Regli F., Uske A. Leukoencephalopathy in patients with ischaemic stroke // Stroke. 1987. V. 18. P. 896-899.
- Warlow C.P., Dennis M.S., Gijn J. et al. Stroke: a practical guide to management. СПб.: Политехника 1998. 670 с
- Silbert P L Mokri В. Schievmk W.I. Headache and neck pain in spontaneous internal carotid and vertebral artery dissections II Neurology. 1995. V. 45. P. 1517-1522.
- Sturzenegger M. Spontaneous internal carotid artery dissection: early diagnosis and management in 44 patients [J. J. Neurol. 1995 V 242 P 231-238.
- Biousse V D Anglejan-Chatulon J. Touboul P-J et al. Time course of symptoms in extracranial carotid artery dissections. A series of 80 patients // Stroke. 1995 V 26 P. 235- 239
- Mullges W , Ringelstein E.B Leiboid M. Noninvasive diagnosis of internal carotid artery dissections//J. Neurol Neurosurg Psychiatr 1992. V 55 P. 98-104
- Rother J. Schwartz A., Rautenberg W., Hennenci M. Magnetic resonance angiography of spontaneous vertebral artery dissection suspected on Doppler ultrasonography // J. Neurol. 1995. V. 242. P. 430-436
- Никитин Ю.М. Ультразвуковая диагностика сосудистых заболеваний нервной системы II Функциональная диагностика нервных болезней Руководство для врачей / Под ред. Л.Р.Зенкова М.А Ронкина. М. Медпресс-информ, 2003. С 384-435,
К главе 4
- Барашнев Ю.И. Перинатальная неврология. М.. Триада-Х 2001 638 с
- Пальчик А.Б, Шабалов Н. П. Гипоксически-ишемическая энцефалопатия новорожденных. СПб., 2000 56 с.
- Бондаренко Е С, Зыков В.П. Перинатальная гипоксическая энцефалопатия II Рус. мед журнал. 1999. № 7. С. 169-173,
- Neonatal Echoencephalography / Warren P. Garrett W. Lam A Berry A II Ultrasound in Med. and Biol, 1984 V, 10 № 1 P, 117-134
- Levene M I Williams J L. Fawer С. L. Ultrasound of the Brain. Philadelphia: I B Lippincott Co. 1985 148 p.
- Зубарева E.A. Зубарев A.P Патрушева E H, Неиросонография- итоги и перспективы развития II Ультразвуковая диагностика 2000 №2 С 99-112.
- Гаврюшов В.В, Мачинская Е.А., Хрусталева О П Диагностические возможности нейросонографии у недоношенных детей // Вестник рентгенологии и радиологии 1987. № 3 С 52-57
- Зубарева Е А. Неижко Л.Ю. Клиническая неиросонография новорожденных и детей раннего возраста II Клиническое руководство по ультразвуковой диагностике / Под ред В В. Митькова, М.В. Медведева. М.. Видар 1997. Т. 3. С 9-24
- Grant Е. J. Neurosonography of the preterm neonate. N.Y. Springer-Verlag 1986 116 p
- Мозговое кровообращение у новорожденных детей в норме и патологии: Науч. обзор / Под ред. Т.П. Жуковой. М ВНИИМИ, 1983. 64 с,
- СюткинаУВ Сафин LLI.R Григорьев Ф Э Мозговой кровоток у новорожденных детей// Физиология человека. 1995, № 3. С. 142-161.
- Зубарева Е. А. Дворяковский И В. Зубарев А.Р. Сугак А.Б Допплерография перинатальных поражений головного мозга. М.; Видар. 1999. 92 с.
- Зубарева Е. А. Современные ультразвуковые технологии в диагностике перинатальных поражений головного мозга // Эхография. 2001 № 3. 324 с.
- Зубарева Е.А. Потапова О.В. Рогаткин С.О Методологические аспекты допплерографии в неиросонографии // Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии. 2000 № 3. 236 с.
- Grant E G. Tessler F Perellla R Dupplex sonography reveals blood flow in infant brain Diagnostic imaging international. 1988. Ns4 P. 52-56.
- Bode H. Pediatrics application of transcranial Dopplersonography. Vien, N Y. Springer-Verlag. 1988
- Бурцев E M. Нарушение мозгового кровообращения у новорожденных детей // Вестник Иванов, мед. академии. 1996. Т 1, № 3-4 С. 6-14,
- B.akenberg F.G., Loh N.N., Norbash A.M. Impaired cerebrovascular autoregulation afte hypoxic-ischemic injury in extremely low-birth-weight neonates: detection with power and pulsed wave Doppler US // Radiology. 1997. V. 205 № 2. P 563-568
- Аснис Н.П. Перинатальные нарушения мозгового кровообращения у плода и новорожденного //Автореф дис ... канд. мед наук М., 1994. 157 с.
- Барашнев Ю.И. Гипоксически-ишемическая энцефалопатия новорожденных: вклад перинатальных факторов патогенетическая характеристика и прогноз // Рос. вестник перинатологии и педиатрии, 1996. Т. 41 № 2 С 29-35
- Volpe J.J. Neurology of the newborn Philadelphia: I B. Lippincott Co 1995. 876 p.
- Ефимов IV) С. Хрусталева О П Зубарева Е.А Клинико-эхографические критерии ранней диагностики пери-интравентрикулярных кровоизлияний у недоношенных детей / Педиатрия. 1990 № 10 С. 52-57.
- Reuck J Chan+ia A. Richardson Е. Pathogenesis and evolutions of periventricular leuko- malacia in infancy//Arch. Neurol 1972. V. 27 № 9 P 229-236.
- Власюк В. В. Туманов В.H Патоморфология перивентрикулярной лейкомаляции. Ново сибирск- Наука 1985 95 с.
- Calvert S, A. Hoskins Е.М., Fong К. Ж. Forsyth S.C, Etiological factors associated with the deve lopmentof peliventricuiar leukomalacia //Acta Paediatr Scand, 1987. V. 76 Ne 1. P. 254-259,
- Takashima S Arnftrong D, Subcortical leukomalacia relationship to vascular supply // Arch Neuro. 1978 V. 35. № 5 P. 470-472
- BarkovichA SamesA Pediatric neuroimaging. New York. 1995 668 p.
- Зубарева Е.А. Ультразвуковое исследование кровоснабжения мозга у новорожденных детей II Ahi иодсп-97 Тр. конф С. 47-48.
- Гаврюшов В.В Алимов А.И. Миленин О.Б. Зубарева Е.А Газовый состав крови, ар териальное давление и мозговой кровоток при санации трахеобронхиального дерева у новорожденных детей II Анестезиология и реаниматология. 1988 Ne 3. С. 35-39.
- Зубарева Е.А. Мозговой кровотоку новорожденных детей с перинатальными поражениями головного мозга II Ангиодоп -97 Тр. конф. С. 50-51
- Зубарева Е. А . Лобанова Л. В. Оценка артериальное кровотока в остром периоде перинатальных поражении головного мозга: диагностическое и прогностическое значение метода II Ультразвуковая и функциональная диагностика 2002 № 3 С. 41—49.
- Зубарева Е А. Ильенко Л.И., Макарова А.В. Комплексное ультразвуковое исследование головного мозга в оценке эффективности гомеопатической терапии у детей с перинатальным поражением центральной нервной системы II Ультразвуковая и функциональная диагностика 2003. № 1 С. 59-67.
- Зубарева Е.А Дуплексное сканирование с цветовым допплеровским картированием в оценке венозного кровотока у детей раннего возраста // Ангиодоп. 2002 Тр. конф С 64-66
- Ефимов М.С. Нарушения церебральной гемоликвородинамики и теплопродукции мозга при его гипоксических поражениях у недоношенных детей и обоснование тактики интенсивной терапии в остоом периоде заболеваний // Автореф дис. докт мед. наук. НИИ педиатрии и дет хирургии М 1995 66 с
- Ильенко Л И Зубарева Е.А Холодова И.Н. Давыдова А.В. К вопросу о подходах к лечению и диагностике гипоксически-ишемических поражений ЦНС у доношенных детей первого года жизни II Педиатрия- 2002. № 3 С 35-41.
К главе 5
- Холоденко М.И. Расстройства венозного кровообращения в мозгу М, Медицина. 1963. 228 с
- Бердичевский М.Я Венозная дисциркуляторная патология головного мозга М_: Медицина, 1989 224 с
- Трошин В.Д Сосудистые заболевания нервной системы. Нижний Новгород 1992 304 с.
- Стули. И. Д.. Карлов В А., Скорунский И.А и др. О некоторых возможностях ультразвуковых методов в оценке состояния венозного компонента церебральной гемодинамики/. Журн. невропатол. и психиатр. 1981. №2 С 65-68.
- Андреев А. В. Системный подход к диагностике и лечению сосудистых головных болей у детей II Современное состояние методов неинвазивной диагностики в медицине: Материалы конференции Ангиодоп-99 СПб 1999 С.82-85
- Стулин И.Д. Особенности изучения венозной церебральной дисциркуляции в норме и патологии // Современные минимально-инвазивные технологии Материалы симпозиума СПб., 2001 С. 78-80.
- Андреев А.В. Ультразвуковая допплерография в детской неврологии // Ультразвуковая допплеровская диагностика сосудистых заболеваний / Под ред. Ю.М. Никитина и А И Труханова М 1998. С 115-127
- Бурцев Е.М., Малецг ая Е.В Клинические особенности и критерии диагностики доброкачественной внутричерепной гипертензии у детей // Журн. неврол. и психиатр. 1997. Ms 1 С 13-15.
- Деев А С. Карликов А В. Буршинов А О. Синдром доброкачественной внутричерепной гипергензии//Журн неврог и психиатр. 1995. № 3. С 70-72.
- Деев А.С. Карликов А.В. Доброкачественная внутричерепная гипертензия. Рязань, 1997. 104 с
- Никитин Ю.М ТрухановА.И Ультразвуковая доплеровская диагностика сосудистых заболеваний. М Видар 1998,430 с.
- Шахнович А.Р. Шахнович В.А. Диагностика нарушений мозгового кровообращения. Транскраниальная допплерография. М. 1996. 446 с.
- Андреев А.В Руководство по клинической ультразвуковой допплерографии в детской неврологии. СПб , 1995. 132 с
- Земцовский Э.В. Соединительнотканные дисплазии сердца. СПб Политекс, 1998. 94 с.
- Gascon G. G. Chronic and recurrent headaches in childhood and adolescents // Pediatr. Clin, North. Amer. 1984. V. 35. № 5
- Grant R. et al. Bening Intracranial Hipertension Brain swelling and craniai CSF volume // The 7 Intelnarionaal Simposium on Intracrnial Pressuieand Brain injuru Ann Arbor 1988. 145 p.
- Ратнер А. Ю. Родовые повреждения нервной системы. Казань: Изд-во Казанского университета 1985 332 с.
- Bensahel Н. Luxations et fractures du ruchls cervical ches I enfant // Rev. Chir Orthop 1968. V 54 № 8 P 765-780
- Бурцев E M, Андреев А.В Дьяконова E H., Кутин В.А. Функциональная допплерография в дегской ангионеврологии // Тезисы доклада на VIII Международной конференции: Современное состояние методов неинвазивной диагностики в медицине. Сочи. 2001. С. 151-160.
- Шток В.Н. Головная боль. М.: Медицина, 1988. 303 с.
- Ратнер А.Ю. Нарушение мозгового кровообращения у детей. Казань: Издательство Казанского университета, 1983. 143 с.
- Молотилова Т.Г. Клиника, диагностика и лечение натальных повреждений спинного мозга у детей // Автореф. дис. ... канд. мед наук. Казань, 1977. 28 с.
- Михайлов М.К. Рентгенодиагностика родовых повреждений позвоночника. М., 2001. с. 171.
- Демидов Е.Ю., Михайлов М.К. Причины мертворожденности ранней детской смертности по данным секционных исследований II Материалы 10 Всесоюз. съезда дет. врачей. М 1974. С. 104-105.
- Фаттахов В.В. Комплексная лучевая диагностика некоторых механизмов повреждений и нарушений кровообращения шейного отдела позвоночника и спинного мозга у детей в родах II Автор, дис. ... докт. мед. наук. Казань, 1999. 48 с.
- Ратнер А.Ю. Шейный остеохондроз и церебральные нарушения. Казань, 1970. 229 с.
- Осколкова М.К. Кровообращение у детей в норме и патологии. М., 1976. 231 с.
- Бурцев Е.М. Нарушение мозгового кровообращения в молодом возрасте. М.: Медицина, 1978. 200 с.
- Трошин В.М., Бурцев Е.М., Трошин В.Д. Ангионеврология детского возраста. Нижний Новгород, 1995. 476 с.
- Привес М.Т. Анатомия человека. М., 1974. 541 с
- Гусев Е.И., Боголепов Н.К., Бурд Г.С. Сосудистые заболевания головного мозга. М.: Медицина, 1979. 144 с.
- Верещагин Н.В. Патология вертебрально-базилярной системы и нарушение мозгового кровообрашения. М.: Медицина, 1980. 311 с.
- Fisher L., Comtet J.J., Chappuis J P. Particularies radiologiques des fractures tn luxations du rachis cervical ches 1 enfant// Maroc Med. 1970. V. 50. № 540. P. 672-678.
- Ситель А.Б. Мануальная терапия. M.: Русь, 1998. 340 с.
- Корниенко В.Н., Шубин B.C. Влияние положения головы на мозговое кровообращение у нейрохирургических больных // Вопросы нейрохирургии. 1978. № 4. С. 25-31.
- Bode Н. Pediatric aphlications of transcranial Doppler sonography. Vienn: Springer-Ver- lag, 1988. 231 p. Headache Classification Comittee of the International Headache Society. Classification and diagnostic criteria for headache disorders, cranial neurologias and facial pain // Cephalalgia. 1988. V. 8 (suppl. 7). P. 1-96.
- Ратнер А.Ю. Шейная мигрень. Казань: Изд-во Казанского университета, 1965 198 с.
- Ратнер А.Ю. Шейный остеохондроз и церебральные нарушения. Казань, 1970. 229 с.
- Вейн A.M. Гиперсомнический синдром. М., 1966. 156 с.
- Вейн A.M., Соловьева А.Д., Колосова О.А. Вегетососудистая дистония. М.: Медицина, 1981. 315 с.
- Бадалян Л.О., Берестов А.И., Дворников. Головные боли у детей и подростков. М., 1991. 59 с.
- Ситель А.Б., Нефедов А.Ю., Лесовой В.О. Журнал неврология и психиатрия. Специальный выпуск. Приложение. М., 2003.
- Веселовский В.П. Практическая вертеброневрология и мануальная терапия. Рига, 1991.
- Никитин Ю.М. Персональное сообщение. М., 2000.
- Siaastad 0.,Fredriksen Т. Cervicogenic headeache criteria,classification and epidemiology II Clin. Exp. Rheumatol 2000. V. 18. №2/19 P 3-6.
- Bono G., Antonaci F.; Dario A et al. Unilateral headaches and their relationship with cervico- genic headache // Clin Exp, Rheumatol 2000. V 18. №2/19 P. 11-15
- Deifini R Exp. Rheumatol 2000 V 18. № 2/19. P 29-32
- Jansen J. Surgical treatment of nonresponsive cervicogenic headache II Clin. Exp. Rheumatol 2000 V. 18. № 2 P 19-67
- Щепеткова E.P Неврологическая дисфункция у детей с аномалиями развития шейного отдела позвоночника // Тезисы доклада на VIII Всероссийском съезде неврологов Казань 2001 С 46—47.
- Холин А В Макаров А.Ю. Мазуркевич Е. А. Магнитно-резонансная томография позвоночника и спинного мозга. СПб.. 1995 132 с.
- Менделевич Е Г Михайлов М. К. Богданов Э. И. Сирингомиелия и мальформация Арнольда-Киари. Казань 2002 234 с.
- Tomlinson Р. Sugarman D Complications with stuns in adults with spina bifida // BMJ, 1995 V 311 P 286-287
- Weinberg J , Freed D.L et al Headache and Chiari I malformacion in the pediatric population // Pediatric Neurosurg 1998. V. 29 №1 P. 14-18.
К главе 6
- Capian L.R Clinical diagnosis of brain embolism H Cerebrovasc. Dis. 1995. V. 5, P 79-88,
- Austen W.G Howry D.H Ultrasound as a method to detect bubbles or particulate matter in the arterial line during cardiopulmonary bypass // J Surg. Res 1965. V. 5, P 283-284.
- Spencer M.P Campbell S D Development of bubbles in venous and arterial blood during hyperbaric decompression // Bull Mason. Clinic, 1968, V 22 P. 26-32.
- Aaslid R., MarkwalkerT M., Nornes H. Noninvasive transcranial Doppler ultrasound recording of flow velocity in basal cerebral arter ies // J Neurosurg 1982 V. 57 P 769-774
- Spencer M P., Thomas G I Nicholls S.C., Sauvage L R. Detection of middle cerebral artery emboli during carotid endarterectomy using transcranial Doppler ultrasonography // Stroke. 1990. V. 21. P. 415—423.
- Georgiadis D. Lindner A Manz M. et al. Intracranial microembolic signals in 500 patients with potential cardiac or carotid embolic source and in normal controls // Stroke. 1997 V 28 P. 1203-1207
- Consensus Committee of the Ninth Internationa1 Cerebral Hemodynamic Symposium / Basic identification criteria of Doppler microembolic signals//Stroke 1995 V. 26. P 1123.
- Markus H.S . Moiloy J Use of a decibel threshold in detecting Doppler embolic signals // Stroke 1997 V 28 P 692-695
- Ringelstem E.B , Droste D.W., Babikian VL. et al Consensus on microenibolus detection by TCD International Consensus Group on Microembolus Detection // Stroke 1998. V. 29. P. 725-729.
- Segura T. Serena J. Molins A. Davalos A. Clusters of microembolic signals: a new form of cerebral microembolism presentation in a patient with middle cerebral artery stenosis // Stroke 1998 V 29 P 722-724.
- Moiloy J. Markus H S. Multigated Doppler ultrasound in the detection of emboli iri a flow model and embolic signals in patients // Stroke. 1996. V, 27 P. 1548-1552.
- Smith J L. Evans D.H. Fan L. et ai Differentiation between emboli and artefacts using dual- gated transcranial Doppler ultrasound II Ultrasound Med Biol 1996. V 22 P 1031-1036
- Moehring M.A. Microembolus tracking with power M-mode transcranial Doppler ultrasound and simultaneous single gate spectrogram II Cerebrovasc. Dis. 2000. V. 10. Suppl. 1. P. 2.
- Smith J.L., Evans D.H., Naylor A.R. Signals from dual gated TCD systems: Curious observations and possible explanations // Ultrasound Med. and Biol. 1997. V 23. P. 15-24.
- Cullinane M., Reid G., Dittrich R. et al. Evaluation of new online automated embolic signal detection algorithm, including comparison with panel of international experts // Stroke. 2000. V. 31. P. 1335-1341.
- Fan L., Evans D.H., Naylor A.R. Automated emboli identification: Detection using a combination of time and frequency domain information//Cerebrovasc. Dis. 2000. V. 10. Suppl. 1. P. 1.
- Uhlmann F., Schulte-Mattler W.J., Georgiadis D. Postembolic spectral patterns of microemb- olic signals II Cerebrovasc. Dis. 2000. V. 10. Suppl. 1. P. 3.
- Smith J.L., Evans D.H., Bell P.R., Naylor A.R. A comparison of four methods for distinguishing Doppler signals from gaseous and particulate emboli // Stroke. 1998. V. 29. P. 1133-1138.
- Droste D.W., Hansberg Т., Kemeny V. et al. Oxygen inhalation can differentiate gaseous from nongaseous microemboli detected by transcranial Doppler ultrasound // Stroke. 1997. V. 28. P. 2453-2456.
- Russell D., Brucher R. Online automatic discrimination between solid and gaseous cerebral microemboli with the first multifrequency transcranial Doppler// Stroke. 2002. V. 33. P. 1975-1980
- Devuyst G., Vesin J.M., Despland P.A., Bogousslavsky J. The matching pursuit: Anew method of characterizing microembolic signals? II Ultrasound Med. and Biol. 2000. V. 26. P. 1051- 1056.
- Girault J.M., Kouame D., Ouahabi A., Patat F. Micro-emboli detection: An ultrasound Doppler signal processing viewpoint // IEEE Trans. Biomed. Eng. 2000. V. 47. P. 1431-1439.
- Palanchon P., Klein J., Bom N.. Dejong N. Emboli characterization using ultrasonic harmonic scattering // Cerebrovasc. Dis. 2001 V. 11. Suppl. 3. P 16.
- Palanchon P., Klein J., De Jong N. New ultrasonic transducer for characterization of microemboli // Cerebrovasc. Dis. 2002. V. 13. Suppl. 4. P. 10 (033).
- Futrell N. Pathophysiology of acute ischemic stroke: New concepts in cerebral embolism II Cerebrovasc. Dis. 1998. V 8. Suppl. 1. P. 2-5.
- Nabavi D.G., Arato S., Droste D.W. et al. Microembolic load in asymptomatic patients with cardiac aneurysm, severe ventricular dysfunction, and atrial fibrillation: Clinical and hemorh- eological correlates// Cerebrovasc. Dis. 1998 V. 8. P. 214-221.
- Zanella F.E., Berkefeld J. Carotid stenting with embolism prevention II Ztschr. Kardiol. 2000. Jg. 89. Suppl. 8. S. 47-52.
- Markus H.S., Brown M.M. Differentiation between different pathological cerebral embolic materials using transcranial Doppler in an in vitro model // Stroke. 1993. V. 24. P. 1-5.
- Кузнецов A.H. Кардиогенная и артерио-артериальная церебральная эмболия: Этиология, патогенез, клиника, диагностика, лечение и профилактика // Автореф. дис. ... докт. мед. наук. СПб., 2001 32 с.
- Censori В. Partziguian Т., Casto L. et al. Doppler microembolic signals predict ischemic recurrences in symptomatic carotid stenosis // Acta Neurol. Scand. 2000. V. 101. P. 327-331.
- Molloy J., Markus H.S. Asymptomatic embolization predicts stroke and TIA risk in patients with carotid artery stenosis // Stroke. 1999. V. 30. P. 1440-1443.
- Nabavi D.G., Georgiadis D., Mumme T. et al. Clinical relevance of intracranial microembolic signals in patients with left ventricular assist devices: A prospective study // Stroke. 1996. V. 27. P. 891-896
- Rapp J.H., Pan X.M. Sharp F.R. et al. Atheroemboli to the brain: Size threshold for causing acute neuronal cell death // J. Vase. Surg. 2000. V. 32. P. 68-76.
- Valton L., Larrue V., Pavy Le Traon A., Geraud G. Cerebral microembolism in patients with stroke or transient ischaemlc attack as a risk factor for early recurrence // J. Neurol. Neurosurg. Psychiatry. 1997 V. 63. P. 784-787.
- Thiel A., Kaps M. Circulating cerebral microembolisms: Detection with transcranial Doppler ultrasound //Anasthesiol. Intensivmed. Notfallmed. Schmerzther. 1996. Jg. 31. S. 127-131.
- Georgiadis D., Baumgartner R.W., Uhlmann F. et al. Venous MES in patients with artificial heart valves // Stroke. 1998. V. 29. P. 2238.
- Шевченко Ю. Л., Михайленко A.A., Кузнецов А.Н., Ерофеев А.А. Кардиохирургическая агрессия и головной мозг: Церебральная гемодинамика и неврологические исходы операций на сердце. СПб.: Наука, 1997. 152 с.
- Georgiadis D., Baumgartner R.W., Karatschai R. et al. Further evidence of gaseous embolic material in patients with artificial heart valves // J. Thorac. Cardiovasc. Surg. 1998. V. 115 P. 808-810.
- Georgiadis D., Lindner A., Zierz S. Intracranial microembolic signals in patients with artificial heart valves: Drowning in numbers // Europ. J. Med. Res. 1998. V. 3. P. 99-102.
- Georgiadis D. Microembolism in prosthetic valve patients // Stroke. 1998. V. 29. P. 2237.
- Georgiadis D., Preiss M., Lindner A. et al Doppler microembolic signals in children with prosthetic cardiac valves II Stroke. 1997. V. 28. P. 1328-1329.
- Droste D.W., Ringelstein E.B. Detection of high intensity transient signals (HITS): How and why? II Europ. J. Ultrasound. 1998. V. 7. P. 23-29.
- Sliwka U., Georgiadis D. Clinical correlations of Doppler microembolic signals in patients with prosthetic cardiac valves: Analysis of 580 cases // Stroke. 1998. V. 29. P. 140-143.
- Deklunder G., Prat A , Lecroart J.L. et al. Can cerebrovascular microemboli induce cognitive impairment in patients with prosthetic heart valves? // Europ. J. Ultrasound. 1998. V. 7. P. 47-51.
- Deklunder G., Roussel M., Lecroart J.L. et al. Microemboli in cerebral circulation and alteration of cognitive abilities in patients with mechanical prosthetic heart valves // Stroke. 1998. V. 29. P. 1821-1826.
- Devuyst G., DarbellayA., Kemeny V. et al Discrimination of the nature of microembolic signals in patients with mechanical prosthetic heart valves II Cerebrovasc. Dis. 2001. V. 11 Suppl. 3. P. 15.
- GeiserT., Sturzenegger M., Genewein U. et al. Mechanisms of cerebrovascular events as assessed by procoagulant activity, cerebral microemboli. and platelet microparticles in patients with prosthetic heart valves II Stroke. 1998. V. 29. P. 1770-1777.
- Hanzawa K., Furui E., Namura S. et al. Antiplatelets reduced non-gaseous HITS in patients with mechanical valve II Cerebrovasc. Dis 2000. V. 10. Suppl. 1. P. 4.
- Cullinane M.. Wainwright R., Brown A. et al Asymptomatic embolization in subjects with atrial fibrillation not taking anticoagulants: A prospective study // Stroke. 1998. V. 29. P. 1810- 1815.
- Nabavi D.G., Allroggen A., Reinecke H. et al. Absence of circulating microemboli in patients with lone atrial fibrillation II Neurol. Res. 1999. V. 21. P. 566-568.
- Babikian V.L., Hyde C., Pochay V., Winter M.R. Clinical correlates of high-intensity transient signals detected on transcranial Doppler sonography in patients with cerebrovascular disease// Stroke. 1994. V. 25. P. 1570-1573.
- Markus H.S., Thomson N.D., Brown M.M. Asymptomatic cerebral embolic signals in symptomatic and asymptomatic carotid artery disease // Brain. 1995. V. 118. P. 1005-1011.
- Orlandi G., Parenti G., Bertolucci A., Murri L. Silent cerebral microembolism in asymptomatic and symptomatic carotid artery stenoses of low and high degree // Europ. Neurol. 1997. V. 38. P. 39-43.
- Droste D.W., Sonne M., Siemens H.J., Kaps M. Asymptomatic circulating cerebral emboli and cerebral blood flow velocity under aspirin and ticlopidine in patients with cerebrovascular disease И Neurol. Res. 1996. V. 18. P. 449^53.
- Droste D.W., Dittrich R., Kemeny V. et al. Prevalence and frequency of microembolic signals in 105 patients with extracranial carotid artery occlusive disease // J. Neurol. Neurosurg. Psychiatry. 1999. V. 67. P. 525-528.
- Orlandi G., Parenti G., Bertolucci A. et al. Carotid plaque features on angiography and asymptomatic cerebral microembolism // Acta Neurol. Scand. 1997. V. 96. P 183-186.
- Valton L., Larrue V., Arrue P. et al. Asymptomatic cerebral embolic signals in patients with carotid stenosis: Correlation with appearance of plaque ulceration on angiography // Stroke. 1995. V. 26. P. 813-815.
- Sitzer M., Muller W., Siebler M. et al. Plaque ulceration and lumen thrombus are the main sources of cerebral microemboli in high-grade internal carotid artery stenosis // Stroke. 1995. V. 26. P. 1231-1233.
- Шахнович В.А. Ишемия мозга: Нейросонология. М.: ACT, 2002. 298 с.
- Mayor I., Fossati С., Sztajzel R. Carotid plaque morphology and micro-embolic signals (MES): A study of 38 patients with moderate or high-grade stenosis // Cerebrovasc. Dis. 2001. V. 11. Suppl. 3. P. 26.
- Nagatsuka K. , Kajimoto K., Nagano K. et al. Relationship between microembolic signal and carotid plaque echogenesity // Cerebrovasc. Dis. 2001. V. 11. Suppl. 3. P. 26.
- Siebler M. Kleinschmidt A., Sitzer M. et al. Cerebral microembolism in symptomatic and asymptomatic high-grade internal carotid artery stenosis // Neurology. 1994. V 44. P. 615-618.
- Sliwka U., Lingnau A., Stohlmann W.D. et al Prevalence and time course of microembolic signals in patients with acute stroke: A prospective study // Stroke. 1997. V. 28. P. 358-363.
- Van Zuilen E.V., Moll F.L. Vermeulen F.E. et al. Detection of cerebral microemboli by means of transcranial Doppler monitoring before and after carotid endarterectomy // Stroke. 1995. V. 26. P. 210-213.
- Goertler M., Baeumer M., Kross R. et al. Rapid decline of cerebral microemboli of arterial origin after intravenous acetylsalicylic acid // Stroke. 1999. V. 30. P. 66-69.
- Lennard N., Smith J.L., Hayes P. et al. Transcranial Doppler directed dextran therapy in the prevention of carotid thrombosis: Three hour monitoring is as effective as six hours // Europ. J. Vase. Endovasc. Surg. 1999. V. 17. P. 301-305.
- Takada Т., Akiyama H., Moriyasu H. et al. Disappearance of embolic signals on transcranial Doppler sonography following antiplatelet therapy in a patient with transient ischemic attacks II Rinsho Shinkeigaku. 1998. V. 38. P. 329-332.
- Spencer M.P. Transcranial Doppler monitoring and causes of stroke from carotid endarterectomy // Stroke. 1997. V. 28. P. 685-691.
- Gao M.Y., Sillesen H.H., Lorentzen J.E., Schroeder T.V. Eversion carotid endarterectomy generates fewer microemboli than standard carotid endarterectomy II Europ. J. Vase. Endovasc. Surg. 2000. V. 20. P 153-157.
- Levi C.R., Roberts A.K., Fell G. et al. Transcranial Doppler microembolus detection in the identification of patients at high risk of perioperative stroke // Europ. J. Vase. Endovasc. Surg. 1997. V. 14. P. 170-176.
- Muller M., Behnke S., Walter P. et al. Microembolic signals and intraoperative stroke in carotid endarterectomy//Acta Neurol. Scand. 1998. V. 97. P. 110-117.
- Smith J.L., Evans D.H., Gaunt M.E. et al. Experience with transcranial Doppler monitoring reduces the incidence of particulate embolization during carotid endarterectomy // Brit. J Surg. 1998 V 85. P. 56-59.
- Ackerstaff R.G Jansen C., Moll F.L et al The significance of microemboli detection by means of transcranial Doppler ultrasonograpny monitoring in carotid endarterectomy // J Vase Surg. 1995. V. 21. P. 963-969.
- Muller M Reiche W., Langenscheidt P et al. Ischemia after carotid endarterectomy: Comparison between transcranial Doppler sonography and diffusion-weighted MR imaging // Amer. J Neuroradiol. 2000 V 21 P. 47-54
- Van Gijn J.. Surgical complications of carotid endarterectomy // Stroke prevention / Ed. W. Dorndorf. P. Marx. Basel: Karger 1994. P 122-130
- Levi С. R. О Malley H.M., Fell G, et al. Transcranial Doppler detected cerebral microembolism following carotid endarterectomy High microembolic signal loads predict postoperative cerebral .schaemia II Brain 1997 V. 120, P. 621-629
- Van Zuilen E V Moll F.L Vermeulen F.E et al Detection of cerebral microemboli by means of transcranial Doppler monitoring before and after carotid endarterectomy II Stroke 1995 V. 26 P 210-213.
- Ohki T Roubm G,S. Veith F.J et al. Efficacy of a filter device in the prevention of embolic events dur,ng carotid angioplasty and stenting An ex vivo analysis II J. Vase. Surg 1999 V. 30, P. 1034-1044
- McCleary A.J. Nelson M Dearden N.M. et al. Cerebral haemodynamics and embolization during carotid angioplasty m high-risk patients // Brit. J. Surg. 1998. V. 85. P 771-774
- Rolke R. Hunsche S , Thomaiske С et al. Carotid angioplasty and stenting: Correlation of hemodynamic changes and embolic events by means of ultrasound and MRIII Cerebrovasc Dis 2001 V 11. Suppl. 3. P. 12
- Censori В , CamerSingo M., Casto L. el al Carotid stents are not a source of microemboli late after deployment//Acta Neurol Scand 2000 V 102 P 27-30.
- Henry M., Amor M Henry I. et al Carotid stenting with cerebral protection: First clinical experience using the PercuSurge GuardWire system // J Endovasc. Surg. 1999. V. 6, P 321-331.
- Sievert H. Pfeil W. Bosenberg I et al. Primary stent implantation in the internal carotid artery // Dt. Med Woch.-Schr. 1999. Jg 124 P 1262-1266
- Kay R WooKS.,TseK K etal. Cerebral microembolism detected by transcranial Doppler during percutaneous transvenous mitral commissurotomy //Amer J. Cardiol 1995. V 75. P. 189-190
- Gencbay M Turan F Degertekin M. et al Contrast echoes detected during percutaneous mitral balloon commissurotomy with Inoue balloons and their relation to cerebral microembolic signals II Angiology. 1998 V 49 P 909-914.
- Padayachee T S., Parsons F., Theobold R. et al. The detection of microemboli in the middle cerebral artery during cardiopulmonary bypass: A transcranial Doppler ultrasound investigation using membrane and bubble oxygenators//Ann Thorac. Surg. 1987 V. 44 P. 298-302,
- Van der Linden J. Casimir-Ahn H When do cerebral emboli appear during open heart operations? A transcranial Doppler study II Ann Thoiac. Surg, 1991. V 51 R 237-241.
- Georgiadis D Stets P Schorcht A. et al. Doppler microembolic signals during cardiac surgery II Cerebrovasc Dis. 2000. V. 10. Suppl. 1 P. 4
- Padayachee TS., Parsons S., Theobold R et al. The effect of arterial filtration on reduction of gaseous microemboli in the middle cerebral artery during cardiopulmonary bypass /Ann Thorac. Surg 1988. V 45. P 647-649
- Baker A.J , Naser B. Benaroia M., Mazer C.D Cerebral microemboli during coronary artery bypass using different cardioplegia techniques //Ann. Thorac. Surg. 1995. V. 59. P. 1187-1191.
- Braekken S.K., Russell D., Brucher R. et al. Cerebral microembolic signals during cardiopulmonary bypass surgery: Frequency, time of occurrence, and association with patient and surgical characteristics II Stroke. 1997. V. 28. P. 1988-1992.
- Barbut D., Lo Y.W., Hartman G.S. et al. Aortic atheroma is related to outcome but not numbers of emboli during coronary bypass II Ann. Thorac. Surg. 1997. V. 64. P. 454-459.
- Brown W.R., Moody D.M., Challa V.R. et al. Longer duration of cardiopulmonary bypass is associated with greater numbers of cerebral microemboli // Stroke. 2000. V. 31. P. 707-713.
- Russell D Cerebral monitoring using TCD during invasive cardiovascular investigations and operations II Cerebrovasc. Dis. 2002. V. 13. Suppl. 4. P. 15-16 (053).
- Braekken S.K., Reinvang I., Russell D. et al. Association between intraoperative cerebral microembolic signals and postoperative neuropsychological deficit: Comparison between patients with cardiac valve replacement and patients with coronary artery bypass grafting // J. Neurol. Neurosurg. Psychiatry. 1998. V. 65. P. 573-576.
- Никитин Ю.М. Ультразвуковая допплерография в диагностике поражений артерий дуги аорты и оснований мозга II Ультразвуковая допплеровская диагностика сосудистых заболеваний / Под ред. Ю.М. Никитина, А.И Труханова М.: Видар. 1998. С. 64-114.
- Томилин А.А. Церебральные микроэмболии у больных с атеросклеротическими поражениями сонных артерий. Кпинико-допплерографическое сопоставление II Автореф. дис. ... канд. мед. наук. Москва, 2000. 29 с.
- Кузнецов А.Л. Ишемический инсульт: риск церебральной эмболии при различных формах кардинальной патологии II Автореф. дис. ... канд. мед. наук. 2002. 24 с.
- Никитин Ю.М. Ультразвуковая диагностика сосудистых заболеваний нервной системы II Функциональная диагностика нервных болезней: Руководство для врачей / Под ред. Л.Р. Зенкова, М.А. Ронкина. М.: Медпресс-информ, 2003. С. 384-435.
К главе 7
- Куликов В.П., Хорев Н.Г., Герасименко И.Н., Смирнов К.В., Осинцева Л.В. Цветное дуплексное сканирование сосудов в диагностике патологической извитости сонных артерий II Эхография. 2000. Т. 1. № 2. С. 147-154.
- Смирнова Ю.В., Куликов В.П., Хорев Н.Г., Сидор М.В., Смирнов К.В. Нарушения мозгового кровообращения и гемодинамическая эффективность лечения патологической извитости внутренних сонных артерий у детей // Эхография. 2000. Т. 1. № 4. С. 452—457.
- Godin M.S., Rice J.С., Kerstein M.D. Tortuosity of the right common carotid artery simulating aneurism // South. Med. J. 1988. V. 81. № 11. P. 1382-1385.
- Fearn S.J., McCollum C.N. Shortening and reimplantation for tortuous internal carotid arteries // J. Vase. Surg. 1998. V. 27. P. 936-939.
- Quattelebaum J.K.Jr., Upson E.T., Neville R.L. Stroke associated with elongation and kinking of the carotid artery: long term follow-up II Ann. surg. 1973. V. 177. P. 572-579.
- Perdue G.D., Barreeca J.P., Smith R.B. The significance of elongation and angulation of the carotid artery: a regative view // Surgery. 1975. V. 77. P. 45-52.
- Najati H., Javid H., Due W.S. Kinked internal carotid artery. Clinical evaluations and surgical correction //Arch. Surg. 1964. V. 89. P. 134-143.
- British Medical Journal leading article: kinked carotid arteries // Br. Med. J. 1977. № 1. P. 1177.
- Boriorii R . Garofalo M.. Actis Dato G.M. Kinking of internal carotid artery: is it a risk factor for cerebrovascular damage in patients undergoing cardiac surgery? // J. Cardiovasc. Surg 1994, V 35. № 4. P 325-326.
- Huemer M., Emminger W. Trattnig S Kinking and stenosis of the carotid artery associated with homolateral ischaemic brain infarction in a patient treated with cyclosporin II A. Eur J Pediatr 1998. V 157 №7 P 599-601.
- Desai В Tooie J.R Kinks cons and carotids: a review/ Stroke. 1975. V 6. P. 649 -653
- Sarkari N.B S. Holmes J.M Bickerstaff E R, Neurological manifestations associated with internal carotid loops and kinks in children // J Neurol. Neurosurg. Psychiatry 1970. V. 33, P 194-200
- Riser MM Geraus J Ducoudray J Ribaunt L Doiicho-carotide interne avec synarome vertigneux II Neurology Paris, 1951. V. 85 P. 145.
- Prencipe G Pellegrino L. Tomaiuolo M Donchoarteriopatnies of the carotid arteries and atherosclerotic disease II J International Angiology. 1995. V. 14 P 212
- Pellegrino L.. Prencipe G Doiichoarteriopathies (kinking coiling tortuosity) of carotid arteries arid atherosclerotic disease, an ultrasonographic study II Caidiologia 1998 V. 43. № 9 P 959-966.
- Prencipe G. Pellegrino L Vairo F Dolichoarteriopathy (kinking coiling, tortuosity) of the carotid arteries and cardiovascular risk factors H Minerva Cardioangiol. 1998, V. 46 Ns 1-2. P 1-7
- Сосудистые заболевания нервной системы / Под ред. Е В Шмидт М.: Медицина, 1975 663 с.
- Weibel J.. Fields WS. Toriuosity coiling and kinking of the internal carotid artery. I. Etiology and radiographic anatomy//Neurology. Milmeap 1965 V. 15 P 7-18.
- Weibel J Fields W.S Tortuosity, coning and kinking of the interna) carotid artery II, Relationship of morphological variation to cerebrovascular insufficiency II Neurology, Minneap, 1965 V 15 P. 462-468
- Верещагин H.B Деформации магистральных артерий головы и их значение в развитии нарушений мозгового кровообращения в пожилом возрасте//Вестник АМН СССР 1980. № 10. С. 7-10
- Долматов Е.А Дюжиков А.А Хирургическое лечение патологической извитости внутренних сонных артерий // Кардиология. 1989. Т 29. № 3. С. 45^5-7.
- Покровский А.В. Атеросклероз аорты и ее ветвей II Чазов Е И Болезни сердца и сосудов Руководство для врачей. М Медицина 1992. С. 286-327
- Mascol. F Mari С Liboni A. The elongation of the internal carotid artery. Diagnosis and surgical treatment//J Cardiovasc. Surg. Torino. 1987. V 28. № 1. P. 9-11
- Metz H. Murray-Leslie R.M Bannister R.G Kinking of internal carotid artery in relation to cerebrovascular disease II Lancet 1961 V I P, 424-426.
- MillicanCH, Siebart P. G. Whisnant J P. The clinical pattern in certain types of occlusive cerebrovascular disease // Circulation. 1960. V 22. P 1002-1010.
- Vollmar J.. Nadjafi A S.. Stalker С G. Surgical treatment of kinked internal carotid arteries II Br J.Surg 1976 V. 63 P, 847-850,
- Suzuki J. Ohara I. Saso S improvement of convulsion by operation for kinked internal ca- rotid artery in an infant// Tohoku J. Exp. Med 1964 V. 84. P. 137-143.
- Гарасеферян PO. Патологическая извитость сонной артерии и её значение в нарушении мозгового кровообращения //Журн. невропатол и психиатр. 1965 Т 65 № 4 С.489-498
- FieemanTR LipittW H Carotid artery syndrome due to kinking surgical treatment in forty- four cases //Am. Surg. 1962. V. 28. 745-748.
- Henly W.S., Cooley D.A., Giordon W.B. Tortuosity of the internal carotid artery. Report of seven cases treated surgically // Postgrand. Med. 1962. V. 31. P. 133-144.
- Robicsek F., Daugherty H.K., Sanger P.W. Intermittent cerebrovascular insufficiency. A frequent and curable cause of stroke // Geriartric. 1967 V. 22. P. 96-108.
- Derrick J.R., Smith T. Carotid kinking as a cause of cerebral insufficiency//Circulation. 1962 V. 25. P. 849-853.
- Harrison J.H., Davalos P.A. Cerebral ischemia: surgical procedure in cases due to tortuosity and buckling of the cervical vesses //Arch. Surg. 1962. V. 84. P. 84-94.
- Parrott J.C. Internal carotid artery insufficiency //Am. J. Surg. 1964. V. 108. P. 777-784.
- Rundles W.R., Kimbell F.D. The kinked carotid syndrome //Angiology. 1969. V. 20. P. 177-194.
- Spence H.C. Pseudo stroke. Acute cerebral insufficiency with congenital carotid kinking // JAMA. 1963. V. 186. P. 76.
К главе 8
- Ганнушкина И.В., Лебедева Н.В. Гипертоническая энцефалопатия. М.: Медицина, 1987. 238 с.
- Шмидт Е.В. Вопросы эпидемиологии сосудистых заболеваний головного мозга. М.: Медицина, 1972. 204 с
- Шмидт Е.В. Сосудистые заболевания нервной системы. М.: Медицина, 1975. С. 663.
- Сепп Е.К., Цукер М.Б., Шмидт Е.В. Нервные болезни. М.: Медгиз, 1954. 555 с.
- Боголепов Н.К., Давиденков, С.Н. Раздольский, И.Я. Нервные болезни. М.: Медгиз, 1956. 517 с.
- Габибов Г.А., Шахнович А.Р. Клиника, диагностика и обоснование комплексного лечения больных с синдромом внутричерепной гипертензии неопухолевого генеза // Вопр. нейрохирургии. 1994 № 4. 36-39 с.
- Карпенко М.А. Особенности венозного кровообращения у больных нейроциркулятор- ной дистонией гипертензивного типа и гипертонической болезнью // Автореф. дис. ... канд. мед. наук. СПб., 1996. 20 с.
- Шахнович А.Р, Шахнович В.А. Диагностика нарушений мозгового кровообращения. Транскраниальная допплерография. М., 1996. 436 с.
- Karahalios D.G., Rekate, H.L., Khayata М.Н. Elevated intracranial venous pressure as a universal mechanism in pseudotumor cerebri of varying etiology// Neurology. 1996. 46 (1). P. 198-202.
- Kim A.W., Trobe J.D. Syndrome simulating pseudotumor cerebri caused by partial transverse venous sinus obstruction in metastatic prostate cancer //Am. J. Opthalmol. 2000. Feb. 129 (2). P 254-256.
- Kirch E., Kaim A., Engelter S. Internal carotid artery dissection: Diagnosis with MR-angiogra- phy with special apply of a caudal saturation pulse // Europ. congr. of radiology. Vienn, 1997. P. 11-70.
- Kabat, A.G. Intracranial hypertension II Optom. Clin. 1996. 5 (3^). P. 153-79.
- Тейлор Р.Б. Трудный диагноз. M.: Медицина, 1992. Т. 2. 591 с.
- Шахнович В.А., Бехтерева Т.Л., Серова Н.К. Нарушения венозного кровообращения головного мозга при внутричерепной гипертензии // Эхография. 2000. № 1. С. 80-82.
- Холоденко М И. Расстройства венозного кровообращения в мозгу. М.: Медицина, 1963. С. 228.
- Шмидт Е.В. Лунев Д.К. Верещагин Н.В. Сосудистые заболевания головного и спинного мозга. М- Медицина. 1976. 240 с
- Тимофеева ТВ Полунина И С., Щербакова Е Я Диагностика поражений венозных кол лекторов головного мозга И Воен.-мед. журн 1997 № 5. С 26-34
- Бердичевский М.Я. Венозная дисциркуляторная патология головного мозга. М : Медицина 1989.224 с.
- Labropouos N. Volteas N Leon М. The role of venous outflow obstruction in patients with chronic venous dysfunction//Arch, Surg. 1997 132 (1). P. 46-51.
- Болезни сердца и сосудов: Руководство для врачей / Под ред. Е.И Чазова, М.: Медицина 1992 Т 3 442 с.
- Ситковский Н Б Даныиин Т.И, Кисель Н.П. О патогенезе врожденной аневризмы внутренних яремных вен // Хирургия. 199? № 8 С. 22-25.
- Беков Д. Б. Атлас венозной системы головного мозга человека. М.: Медицина 1965. 358 с.
- Беков Д. Б., Михайлов С.С. Атлас артерий и вен головного мозга М Медицина 1979 287 с.
- Синельников РД. Атлас анатомии человека. М Медицина. 1979. Т 2. 472 с.
- Синельников Р.Д, Атлас анатомии человека. М.: Медицина 1974. Т. 3. 112 с.
- Вильховой В.Ф. Рентгеноанатомический атлас сосудов. Киев Здоровья, 1975 114 с.
- Савельев B.C., Думпе Э.П , Яблоков Е.Г. Болезни магистральных вен М. Медицина. 1972.440 с.
- Winter F. Persistent left superior vena cava. Survey of world literature and report of thirty additional cases // Angiology. 1954 V. 5, P 90
- Лущик У Б, Особенности изменений артериального и венозного кровообеспечения головного мозга в диагностике и лечении цереброваскулярных заболеваний у лиц разного возраста II Автореф. дис.... докт мед наук. Киев 1998. 37 с.
- Родионов А.А. Закономерности роста и развития внутренних позвоночных сплетений у плодов и новорожденных // Вопросы морфогенеза сосудистой системы Благовещенск, 1989 Вып. 3. С. 18-26.
- Бабский Е. Б. Зубков А.А. Косицкий Г, И Физиология человека. М. Медицина 1972 С 111-113
- Лелюк С.Э Лелюк В.Г. Закономерности изменения церебральной венозной гемодинамики при артериальной гипертензии // Эхография. 2000. № 1 С 84-89.
- Пироганов Ф.Ф Разумовский А.Ю. Перевязка внутренней яремной вены показания к операции и ее влияние на мозговое кровообращение //Хирургия 1995 № 4. С. 64-65.
- Wnite С. S MR Baffa J M, Haney PJ. Imaging of congenital anomalies of the thoracic veins // Radiographics. 1997 17. P 595-608
- Зубарев А.Р. Григорян PA. Ультразвуковое ангиосканирование. М.. Медицина 1991. 176 с.
- Карлов В.А. Стулин И.Д., Богин Ю.Н Ультразвуковая и тепловизионная диагностика сосудистых поражений нервной системы М.. Медицина 1986. 213 с
- Куликов В.П, Цветное дуплексное сканирование в диагностике сосудистых заболеваний. Новосибирск: СО РАМН, 1997. 204 с.
- Larcom PG Lotke Р.А., Steinberg М.Е Magnetic resonance venography versus contrast venography to diagnose thrombosis after joint surgery // Clin. Ortop. Hospital of the University of Pennsylvania-Philadelphia. USA. 1996. V. 331. P. 209-215.
- Кунцевич Г.И. Дан B.H., Маштакова Е.Ю. Комплексная ультразвуковая диагностика внеорганных опухолей шеи II Визуализация в клинике 1998. № 13 С. 14-18.
- Михайлов А.Н. Руководство по медицинской визуализаци. Минск, 1996. 506 с.
- Неймарк Е.З. Тромбозы внутричерепных синусов и вен. М.: Медицина, 1975. 174 с.
- Kondo Ch., Caputo G., Higgins Ch. Blood flow measurements with magnetic resonance imaging // Chest and card. Radiol. NICER, 1991. P. 321-342.
- Todini A.R., Strano Ed. A., Novo S. Color flow imaging in the venous disease //Advances in vascular pathology. EXCERPTA MEDICA, 1990. P. 469-470.
- Vazquez E., Enriques G., Castellote A. US, CT, and MR imaging of neck lesions in children. // Radiographics. 1995. 15. P. 105-22.
- Стулин И.Д., Карлов B.A., Скорунский И.А. О некоторых возможностях ультразвуковых методов в оценке состояния венозного компонента церебральной гемодинамики (кли- нико-экспериментальное исследование) // Журн. невропатол. и психиатр, им. С.С. Корсакова. 1981. Т. 81. № 2. С. 65-69.
- Чечеткин А.О., Варакин Ю.Я., Кугоев А.И., Никитин Ю.М. Ультразвук в исследовании кровотока по церебральным венам и синусам твердой мозговой оболочки. Обзор литературы // Ультразвук, диагност. 1999. № 1. С. 92-102.
- Лелюк В.Г., Лелюк С.Э. Ультразвуковая ангиология. М.. Реальное время, 2003. 322 с.
- Елисеева Н.М., Шахнович В.А., Серова Н.К. Результаты нейроофтальмологического обследования и транскраниальной доппперографии при изучении отдельных звеньев патогенеза застойных дисков зрительных нервов / Современные минимально-инвазивные технологии (Нейрохирургия, вертебрология, неврология, нейрофизиология): Материалы VI Международного симпозиума. СПб., 2001. С. 28-29.
- Слободин К.Э. Принципы, современные возможности и перспективы лучевой диагностики в офтальмологической практике// Вестн. рентгенологии и радиологии. 2001. № 1. С 55-61
- Асратян С.А. Особенности церебрального артериального и венозного кровообращения при хронических цереброваскулярных заболеваниях//Автореф. дис.... канд. мед. наук, 1999.20 с.
- Бокерия Л.А., Бузиашвили Ю.И., Шумилина М.В. Нарушения церебрального венозного кровообращения у больных с сердечно-сосудистой патологией (головная боль, ишемия, артериосклероз). М.: Издательство НЦССХ им. А.Н. Бакулева РАМН, 2003. 127 с.
- Корниенко В.Н. Функциональная церебральная ангиография. Л.: Медицина, 1981. С. 5-79.
- Кипервас И.П. Периферические нейроваскулярные синдромы. М.: Медицина, 1985. С. 5-64.
- Кривенко З.В., Рабкин Д.И. Минх Н.В. Комплексная диагностика синдрома верхней полой вены в определении показаний и оценке эффективности рентгеноэндокавальной реваскуляризации / Новые технологии в рентгенохирургии: Тез. 9 Всесоюз. симп. / Под ред. И.Х. Рабкина. М., 1989. С. 24-25.
- Абдрахманов Ж.Н., Бейсебаев А.А., Хамзин A.X. Ангиография в предоперационной диагностике синдрома верхней полой вены / Материалы Международного симпозиума по сосудистой и эндоваскулярной хирургии. Алма-Ата, 1991. С. 172-173.
- Warrell J.A. et al. Chest case of the day. Obstruction of the left brachiocephalic vein // Am. J. Roentgenol. 1992. 158 (6). P. 1358.
- Кулакова С.В., Кочкин Ю.Н. Визуализация венозных коллекторов головы и шеи (сину- сосцинтиграфия) при нейрохирургической патологии II Вестн. рентгенологии и радиологии. 1996. № 4 С. 28-29.
- Крылова Н.В. Венозная система: Анатомия человека в схемах и рисунках / Под ред. Н.В. Крылова, Н.И. Волосок. М.: Изд-во Рос. ун-та Дружбы народов 1997. С. 21-43
- Бурцев Е.М. Тромбозы внутричерепных венозных синусов // Журн. неврологии и психиатрии им С.С. Корсакова. 1999. № 7. С. 55-59.
- Дербенева M.J1. Клиника и лечение начальных проявлений отогенных внутричерепных осложнений // Вестн. оториноларингологии. 1999. № 3. С. 26-30.
- Anderson Ch. М., Edelman R.P., Turski Н. Clinical Magnetic Resonance Angiography. New York: Raven Press, 1993. 498 p.
- Hagen Т., Bartylla K„ Waziri A. Cerebral venous thrombosis: The diagnostic value of CT-an- giography / Europ. congr. of radiology. Vienn, 1997. P. 327.
- Bashist В., Parisi A., Frager D. Abdominal CT findings when the superior vena cava, brachiocephalic vein, or subclavian vein is obstructed //Am. J. Roentgenol. 1996. V. 167 (6). P. 1457-1463.
- Bongartz G. Imaging of atherosclerosis with MRI // Advances in vascular pathology. EXCERPTA MEDICA, 1990. P. 121-126.
- Макаренко B.H., Козлов В.В., Губская Н.В. Спиральная компьютерная томография в диагностике патологии сосудистого русла // Вестн. рентгенологии и радиологии. 1996. № 5. С. 21-25.
- Федоров В.Д., Кармазановский Г.Г. Перспективы применения спиральной компьютерной томографии в многопрофильной хирургической клинике / Современная компьютерная и магнитно-резонансная томография в многопрофильной клинике: Материалы международной конф. М., 1997. С. 15-16.
- Olszycki М., Goraj В. Spiral CT venography in imaging cerebral veins // Neuroradiology 1999. V. 41. Suppl. 1. P. 90.
- Манчакиди Г.А., Варваренко В.И., Федоров А.Ю. Системный подход к количественному анализу данных ангиографических исследований // Соврем, способы лучевой диагност, в кардиологии: Сб. науч. тр. Томск, 1990. С. 80-81.
- Гаспарян С.С., Туманова А.А. Качественная оценка ликвородинамики и венозного оттока у больных с синдромом «доброкачественной» внутричерепной гипертензии // Вестн. рентгенологии и радиологии. 1996. №4. С. 26-27
- Сергиевский С.Б., Сергиевская О.Ф., Асратян С.А. Венозное кровообращение головного мозга при цереброваскулярной патологии по данным радиоцеребрографии // Актуальные вопросы терапевтической клиники: Сб. науч. тр. Иваново, 1996. С. 107-110.
- Синицын В.Е., Терновой С.К., Стукалова О.В. Магнитно-резонансная флебография // Визуализация в клинике. 1997. № 11. С. 6-9.
- Farooki S , Curran J., Giza С. Magnetic Resonance Venography of Dural Sinus Thrombosis in Children //Am. Roentgen Ray Society Annual Meeting. 1997. P. 492-493.
- Dolz J.L., Hugiet M., Capdevila A. MRA: A tool to diagnose thoracic outlet syndrome. // Diag- nost. Imag. Europe. 2000. Jul-Aug. P. 23-27.
- Naidich D. Magnetic resonance imaging of mediastinal and hilar masses // Chest and card. Radiol. NICER, 1991. P. 126-145.
- Koito H , Suzuki J., Ohkubo N. Three-dimensional reconstructed magnetic resonance imaging for diagnosing persistent left superior vena cava: comparison with magnetic resonance angiography and plain chest radiography//J. Cardiol. 1996. 28. P. 161-70.
- Ринк П. Магнитный резонанс в Медицине: Основной учебн. Европейск. форума по магнит. резонансу. 1993. 228 с.
- Абрамова Н.Н., Беличенко О.И. Магнитно-резонансная томография и магнитно-резонансная ангиография в визуализации сосудистых структур // Вестн. рентгенологии и радиологии. 1997. № 2. С. 50-54.
- Белова Т.В., Петряйкин А.В., Фадеева Л.М. Влияние турбулентности потока на МРТ-сигнал (TOF-последовательности MP-ангиографии, результаты экспериментальных исследований) // Современная компьютерная и магнитно-резонансная томография в многопрофильной клинике: Материалы Международной конф. М., 1997. С. 3-4.
- Recio М., Viano J., Martinez V. Improved techniques boost pelvic MR angio // Diagnost. Imag. Europe. 2000. Nov. P. 29-35.
- Шагал Л.В., Музлаев Г.Г. Венозная офтальмодинамометрия в диагностике нарушений венозного кровообращения при дисциркуляторной энцефалопатии // Материалы VIII Всероссийского съезда неврологов. Казань, 2001. С. 314.
- Куликов В.П., Доронина Н.Л. Транскраниальная стресс-допплерография в оценке состояния мозгового кровообращения // Эхография. 2000. № 1. С 93-98.
- Шиллер Н., Осипов М.А. Клиническая эхокардиография. М., 1993. С. 260.
- Кинев Д.Н., Сумин А.Н. Феномен спонтанного эхоконтрастирования в полости левого предсердия при хронической мерцательной аритмии и факторы, влияющие на его выраженность // Тезисы доклад. 3-го съезда Российской ассоциации специалистов ультразвуковой диагностики в медицине. М., 1999. С. 53.
- Стулин И.Д. К методикам исследования венозного кровообращения головного мозга // Материалы VIII Всероссийского съезда неврологов. Казань, 2001. С. 299.
- Стулин И.Д. Особенности изучения венозной церебральной циркуляции в норме и патологии // Современные минимально-инвазивные технологии (Нейрохирургия, вертебрология, неврология, нейрофизиология): Материалы VI международного симпозиума. СПб., 2001. С. 78-80.
- Евдокимов А.Г. Болезни артерий и вен: Справочное руководство для практического врача / Под ред. А.Г. Евдокимова, В.Д. Тополянского. М., 2001. С. 156-158.
К главе 9
- Демченко И. Т. Кровоснабжение бодрствующего мозга. Л.: Наука, 1983. 148 с.
- Мчедлишвили Г.И. Микроциркуляция крови. Л , 1989. 285 с.
- Конради Г.П. Регуляция сосудистого тонуса. Л.: Наука, 1973. 325 с.
- Угрюмов В.М., Теплов С.И., Тиглиев Г.С. Регуляция мозгового кровообращения. Л.: Медицина, 1984. 135 с.
- Edvinsson L., Nielsen К.С., Owman С., West К.А. Sympathetic neural influence on norepinephrine vasoconstriction in brain vessels //Arch. Neurol. 1972. V 27. № 6. P. 492-495.
- Kawamura Y., Meyer J.S., Hiromoto H., Aoyagi M., Tagashira Y„ Ott E.O. Neurogenic control of cerebral blood flow in thq baboon. Effects of cholinergic inhibitory agent, atropine, oncer - bral autoregulation and vasomotor reactivity to changes in PaC02. (Cerebral autoregulation and COz responses with atropine) // J.Neurosurg. 1975. V. 43. Decembre. P. 676-688.
- Strandgaard S. Autoregulation of cerebral circulation in hypertension Copenhagen: Munksgaard, 1978. 82 p.
- Семенютин В.Б. Внутримозговые холинергические механизмы регуляции тонуса мозговых сосудов при стандартизированной психической нагрузке II Регионарное кровообращение и микроциркуляция. 2002. № 1. С. 47-51.
- Niwa К., Lindauer U., Villringer A. Dirnagl U. Blockade of Nitric oxide synthesis in rats strongly attenuates the CBF response to extracellular acidosis // J. of CBF and Met. 1993. V. 13. P. 535-539.
- Fog M. The relationship between the blood pressure and the tonic regulation on the pial arteries//J. Neurology and Psychiatry. 1938. V. 1. № 2. P. 187-197.
- Purves M.J. The physiology of the cerebral circulation. Cambridge, 1972. 226 p.
- Moncada S., Palmer R.M.G., Higgs E.A. Nitric oxide: physiology, pathophysiology and pharmacology// Pharmacol Rev. 1994. V. 43. P. 109-142.
- ladecola C., Beitz A.J., Renno W., Xu X., Mayer В., Zhang F. Nitric oxide synthase-containing neural processes on large cerebral arteries and cerebral microvessels // Brain Res. 1993. V. 606. P. 148-155.
- Kelly P.A., Ritchie I.M., Arbuthnott G.W. Inhibition of Neuronal Nitric Oxide Synthase by 7-Nitroindazole: Effects upon Local Cerebral Blood Flow and Glucose Use in the Rat//J. of CBF&M. 1995. V. 15. № 5. P. 766-773.
- Brierley J.B. Pathology of cerebral ischemia // Cerebral Vascular Diseases 8 Princeton Conference / Ed. F.H. McDowell and R.W. Brennan, Grune and Stratton Publ. New York, 1973. P. 59-75.
- Paulson O.B., Strandgaard S., Edvinsson L. Cerebral Autoregulation. Cerebrovascular and Brain Metabolism Reviews. New York: Raven Press, 1990. V. 2. P. 161-192.
- Langfitt Thomas W., Obrist Walter D. Cerebral blood flow and metabolism after intracranial trauma // Craniacerebral Trauma. Basel et al., 1981. P. 14-48.
- Sadoshima S , Fujii K., Yao H. et al. Regional cerebral blood flow autoregulation in normoten- sive and spontaneously hypertensive rats-effects of sympathetic denervation // Stroke. 1986. V. 17. № 5. P. 981-984.
- Ганнушкина И.В., Лебедева Н.В. Гипертоническая энцефалопатия. М.: Медицина, 1987. 224 с.
- Meinig G., Reulen H.J., Simon С., Hadjidimos A., Schurmann К. Cerebrale Vasoparalyse, arterielle Hypertension und Hirnodem // J. Neurol. 1975. V. 211. P. 25-38.
- Brierley J.B. The no-reflow phenomenon // Cerebr. Circ. and Metab. Berlin et al., 1975. P. 555.
- Miller J.D., Stanek A.E., Langfitt T.W. A comparison of autoregulation to changes in intracranial and arterial pressure in the same preparation // Europ. Neurolog. 1971. V. 6. № 1. P. 34-37.
- Hamer J., Hoyer S., Alberti E., Stoeckel H. CBF b metabolism at different levels of decreased cerebral perfusion pressure induced by raised intracranial pressure and normovolemic arterial hypertension // Cerebr. Circ. and Metab. Berlin et al., 1975. P. 184-187.
- Ingvar D., Haggendal E., Sourander P, Nilsson N., Wickborn J., Lassen N. Cerebral circulation and metabolism in comatose patient//Arch. Neurol. 1964 V. 11. P. 13-21.
- Marmarou A., Takagi H., Walstra G., Shulman K. Autoregulation of CBF in areas of brain edema //Acta neurol. Scand. 1979. Suppl. № 72. P. 368-369.
- Leninger-Follert E., Lubbers D.W. Interdependence of capillary flow of the brain // Internat. Symp. on Cerebral Blood Flow and Metabolism. Philadelphia: June 6-9. 1973. P. 109-114.
- Zwetnov N.N. Effects of increased cerebrospinal fluid pressure on the blood flow and on energy metabolism of the brain //Acta physiol. scand. 1970. Suppl. 339 p.
- Enevoldsen E.M., Jensen F.T. Autoregulation and C02 responses of cerebral blood flow in patients with acute severe head injury// J. of Neurosurg. 1978. V. 48. № 5. P. 689-703.
- Кондаков E.H., Семенютин В.Б., Гайдар Б.В. Тяжелая черепно-мозговая травма (функционально-структурный ореол очага размозжения и варианты хирургии). СПб., 2001. 216 с.
- Symon L. Regional cerebrovascular responses to ocute ischaemia in normocapnia and hypercapnia. An experimental study in baboons II J. Neurol. Neurosurg. Psychiat. 1970. V. 33. P. 756-762.
- Lassen N.A., Palvolgyi R. Cerebral steal during hypercapnia and the inverse reaction during hypercapnia observed by the 133 Xenon technique in men // Scand. J. Clin. Lab. Invest. 1968. V. 102 P 13-60
- Корниенко В.H. Функциональная церебральная ангиография. М. Медицина 1981.216 с.
- Markwalder Т.-М. Grolimund P., Sailer Р. et al. Dependency of blood flow velocity in the mid die cerebral artery on end-tidal carbon-dioxyde partial pressure - a transcranial ultrasound Doppler study It J Cerebral Blood Flow and Metab 1986 V 4. № 3. P 368-372.
- Sorteberg W., Lindegaard K.-F Rootwelt et al. Effect of acetazolamide on cerebral artery blood flow velocity and regional cerebral blood flow in normal subjects // Acta neurochirur- gica. 1989 Bd. 97 №341 P. 139-145
- Хилько В А, Москаленко Ю E Гайдар Б В Парфенов В Е. Реактивность мозговых сосудов по данным транскраниальнои допплерографии II Физиол журн. СССР. 1989 Т 75. № 11. С 1486-1500
- Lindegaard K.-F. Grolimund P., Aaslid R et al. Evaluation of cerebral AVMs using transcranial Doppler ultrasound//J Neurosurg. 1986. V. 65 №3 P. 335-344.
- Widder В. Pauiat K. Hackspacher J. Mayr E CO,-test for the detection of hemodynamically critical carotid artery stenoses and occlusions // Eur Arch. Psychiatr Neurol. Sci. 1986 V 236 №3 P 162-168
- Ringeistein E. В, Sievers С Ecker S et ai Noninvasive assessment of CO2-induced cerebral vasomotor response in normal individuals and patients with ICA occlusions // Stroke 1988. V. 19 №8 P 963-969.
- Лелюк В.Г Лелюк С Э Ультразвуковая ангиология М Реальное время, 1999. 288 с.
- Aaslid R. Lindegaard K.-F. Sorteberg W.. Nornes H. Cerebral autoregulation dynamics in humans//Stroke. 1989, V 20 № 1 P. 45-52
- Aaslid R Visually evoked dynamic blood flow response of the human cerebral circulation // Stroke 1987 V. 18 №6 P 771-775
- StoSI M . Seidel A Schimrigk K., Hamann G Hand gripping and acetazolamide effect in normal persons and patients with carotid artery disease II J. Neuroimaging 1998. V. 1. № 1. P 27-31.
К главе 10
- Уолкер Э.А. Смерть мозга М ; Медицина, 1988 287 с
- Budingen Н. et al. Diagnosis of cerebro-vaskular lesions by ultrasonic methods// Dtsch. med. Wschr 1979. Bd. 104. P. 1347-1351
- Nornes H et at Precerebral flow pattern in intracranial hypertension with cerebral flow arrest //Acta neurochir Vien 1978 V. 38. P. 187-194.
- Гурвич A.M. Тез докл Международного симпозиума «Центральная нервная система и постреанимационная патология организма». Москва 1989. С 48—49
- Попова Л.М Нейрореаниматология М. Медицина 1988 287 с.
- Arnold Н. et al. Neyroimaging method in brain death // Neuroradiology 1991 V 22 (3). P 129-132
- Huges J.R Limitation of EEG in coma and brain death //Ann N Y. Acad Sci. 1978 V 315. P 121-136
- Сумский Л.И. Нейрофизиологические механизмы церебральной комы // Дисс докт, мед наук 1986 310 с.
- Guerit J М. Evoked Potentials: a safe brain death Confirmatory tool II Eur. J. Med. 1994 № 1. P. 223-225.
- Корниенко В. H. Функциональная церебральная ангиография, М: Мецицина, 1981 216 с
- Bredac G,B, et al. Angiography in brein death H J Neurorad 1974. Ne 7. P. 25-28
- Gaidar B.V et al Modern diagnostic of progredient cerebral coma II 10-th European Congress of Neurosurgery Berlin 1995, P. 231
- Aasiid R etal. Noninvasive transcranial doppler ultrasound recording of cerebral flow velocity // J. Neurosurgery. 1982. № 57, P. 769-774
- Kirkham RJ. et al. Transcranial doppler in brainstem death II J. of Neurology Neurosurgery and Psychiatry. 1987 V, 50. P 1504-1513
- Ropper A.H. et al Transcranial doppler in brain death // Neurology. 1987 V. 37. P 1733- 1735.
- Petty G.W. et al The role of transcranial doppler in confirming brain death sensitivity, speciality and interpretation II Neurology 1990 V, 40, №4 P 300-304
- Assessment Transcranial Doppler Report of America Academy of Neurology II Neurology. 1990. V. 40 № 4. p. 288-303.
- Payen D M., Lamer С Piiorget A Moreau T Beloucif S Echter E Evaluation of pulsed Doppler common carotid blood flow as a noninvasive method for brain death diagnosis: a prospective study // Anesthesiology. 1990 Feb 72(2) P. 222
- 19 Карлов В.А, Стулин И Д., Теплова Л.Г. и др. Ультразвук в комплексной диагностике смерти мозга//Журнал невропатологии и психиатрии им.С.С. Корсакова. 1981 Вып 81 № 7 С.1074-1079
- Стулин И. Д. Ультразвук и другие неинвазивные методы в диагностике смерти мозга // Вестник медицины 1993. № 5 С.0-11.
- Стулин И.Д. Ультразвуковые методы в комплексной диагностике смерти мозга // Ультразвуковая допплеровская диагностика сосудистых заболеваний. Москва, 1998. С. 283-296
- Стулин И.Д.. Мнушкин А.О, Мусин PC., Шибалев A.J1 и др. Комплекс ультразвуковых, тепловизионных и нейрофизиологических методов в диагностике смерти мозга II EMS journel Neuiophysiology and Neurosonology St, Petersburg, 1995 P 60-61
- Стулин И.Д. Мусин PC. Шибалёв А. Л. и др. Можно и нужно ли совершенствовать диагностику смерти мозга // VI международный симпозиум Современные минимально-инвазивные технологии СПб. 2001. С 80-82.
- Стулин И.Д.. Мусин PC, Мнушкин А.О., Шибалев А.Л, и др. Клинико-инструментальная диагностика смерти мозга // Атмосфера. Москва. 2002 № 2. С. 32-38
- Ступин И.Д. Мусин Р.С., Шибалев А П., Мнушкин А.О и др. Диагностика смерти мозга: Методические рекомендации Москва 2003. 31 с.
- Lampl Y. et al. Diagnosing brain death using the transcranial doppler with a transorbital approach //Arch Neurol. 2002, № 59. 58-60
- Карлов В.А. Стулин И.Д., Богин Ю. Н. Ультразвуковые и тепловизионные методы диагностики сосудистых заболеваний мозга М.: Медицина. 1986. 260 с.
К главе 11
- Фридман Ф Е Эхоофтальмография // Фридман Ф Е, Гундорова Р.А.. Кодзов М Б. Ультразвук в офтальмологии М. Медицина. 1989 С, 30-121
- Fledelius Н. Ultrasound in ophthalmology II Ultrasound Med and Biol. 1997. V. 23 (3) P 365-375
- Слободин КЗ., Журавлев А.П., Цуканова И Н Рыбин П.Н. К вопросу о безопасности ультразвукового исследования глаз / Эхография. 2002. Т. 3. № 1 С 17-18
- Катькова Е.А. Диагностический ультразвук // Е А. Катькова. Офтальмология / Под рел А.В. Зубарева. М.. Стром. 2002, 120 с. (серия Диагностический ультразвук).
- Михайлова ГД. Ультразвуковая допплерография в оценке состояния кровотока в бассейне глазничной артерии при хирургическом лечении прогрессирующей близорукости и открытоугольной глаукомы / Автореф. дисс. канд. мед, наук М 1984,23 с.
- 6. Михайлова Г.Д. Ультразвуковая допплерография и дуплексное сканирование в диагностике и лечении глазных заболеваний // Ультразвуковая допплеровская диагностика сосудистых заболеваний / Под ред Ю.М Никитина. А,И. Трухановз. М.. Видар 1998. С. 261-282
- 7 Aburn N. Sergott R Orbital colour Doppler imaging // Eye 1993. Ne 7 (Pt. 5). F 639-647
- Barderstein D.. Herbenei T. Western M. Pover Doppler imaging of choroidal melanoma // International symposium on ocular tumors israel 1997 April 6-10. P 7
- Baxter G Williamson T. Color Doppler flow imaging in central retinal ve.n occlusion a new diagnostic technique//Radiology 1993 Jun. 187 (3). P 84/-850.
- Baxter G., Williamson T. Color Doppler imaging of the eye: normal ranges, reproducibility, and observer variation // J. Ultrasound Med. 1995 Feb, 14 (2). P. 91-96.
- Belden C. Abbitt P. Beadles K, Color Doppler US of the orbit// Radiographics, 1995 May. 15 (3). P 589-608
- Berrocal T de-Orbe A. Prieto C, et al US and color Doppler imaging of ocular and orbital disease in the pediatric age group // Radiograpnics. 1996 Mar. 16 (2). P. 251-272.
- Giovagnorio F. Quaranta L. Fazio Vetai Color Doppler echography of the orbit. Its normal aspects and pathological conditions with vascular involvement II Radiol Med Torino. 1994 Nov 88 15). P 588-593.
- GlasierC Brodsky M Leithiser R. et al. High resolution ultrasound with Doppler-a diagnostic adjunct in orbital and ocular lesions iri children // Pediatr Radiol 1992. V. 22 (3). P 174-178
- Guthoff R. Winkler P. Helmke К , Berger R, Diagnosis and treatment control of choroidal melanomas - the role of B-scan and Doppler-technique //Acta Ophthalmo Suppl 1992 (204) P 59-61
- Heggenck P. Hedges T. 3-rd Союг Doppler imaging of the eye and orbit//J Ophthalmic. Nurs. Technol. 1995. Nov. Dec 14 (6) P. 249-254,
- Lieb W.r Fiaharty P HoA Sergott R Color Doppler imaging of the eye and orbit. A synopsis of a 400 case experience //Acta Ophthalmol Suppl 1992 (204) P. 50-54.
- Lieb W. Cohen S Merton D. et al. Color Doppier imaging of the eye and orbit Technique and normal vascular anatomy//Arch Ophthalmol. 1991. Apr. 109(4). P 527-531.
- Mendivil CuarteroV Mendivil M. Color Doppler imaging of the ocular vessels//Graefes Arch Chn. Exp, Ophthalmol 1995. Mar. 233 (3) P. 135-139
- Munk P Downey D Nicolle D et al The role of colour flow Doppler ultrasonography in the investigation of disease in the eye and orbit // Can J Ophtnalmol. 1993 Jun. 28 (4). P 171-176.
- Ramji F, Slovis T Bakei J, Orbital sonography in children // Pediatr Radiol. 1996. 26 (4). P. 245-258.
- Stefanczyk L., Kaurzel Z. Kazanek M.. Jedrzejczyk S. Carotid-cavernous fistula-diagnostic possibilities of coloi doppler ultrasonography II Klin Oczna 1996 Jan 98 (1). P. 51-53
- Tacke J Dick A Kutschbach P et al. Color-coded duplex ultrasonography of the orbit in central vein thrombosis // Rofo. Fortschr Geb Rontgenstr. Neuen Bildgeb. Verfahr. 1997 Ар 166 (4). P 329-334
- Venturini M, Zaganelli E Angeli E. et al. Ocular color Doppler echography the examination technic identification and flowmetry of the orbital vessels//Radiol. Med, Torino 1996 Jan.-Feb. 91 (1-2). P 60-65.
- Williamson Т.. Harris A. Color Doppler ultrasound imaging of the eye and orbit // Surv, Ophthalmol. 1996. Jan.-Feb 40 (4). P. 255-267.
- Cennamo G. Rosa N Vallone G Smaltmo F First experience with a new echographic contrast agent// Br J. Ophthalmol 1994. Nov. 78 (11). P 823-826
- Coppola V Vallone G Verrengia D. et al Doppser color ultrasonography with contrast media in the study of eye and orbit neoplasms // Radiol Med. Torino. 1997 Apr 93 (4). P 367-373
- Lemke A J., Hosten N Richier M. et al Contrast-enhanced color Doppler sonography of uveal melanomas // J. Clin. Ultrasound. 2001, May. 29 (4) P 205-211.
- Romero J.M , Finger P.T Rosen R.B. lezzi R Three-dimensional ultrasound for the measurement of choroidal melanomas//Arch. Ophthalmol. 2001 Sep. 119 (9) P 1275-1282.
- Grasbon T Schriever S Hoops J.P., Mueller A.J. 3D ultrasound. Initial experiences in various eye diseases // Ophthalmologe. 2001. Jar 98 (1). P 88-93.
К главе 12
- Основные показатели состояния специализированной онкологической помощи населению России в 1998 году / Под ред. акад. РАМН В И. Чиссова. М. РАНКО-Пресс, 1999. 166 с.
- Бурдина Л М.. Маковкин Д.В Методы и средства современной рентгенодиагностики заболеваний молочной железы: Практическое руководство. М,: Фирма СТРОМ, 2003. 183 с.
- Friedrich М. Lehratlas der Mammasonographie // Stuttgart Wiss Ver. Ges., 1999 488 s
- Nishimura S., Matsusue S. Koizumi S Kashihara S. Architectural distortion of subcutaneous fascial layer in breast tumors ultrasonographic evaluation//Ultrasound Med and Biol. 1992. V. 18 (10). P. 815-820
- VentaL.A. Dudiak С M. Salomon C.G Flisak M E. Sonographic evaluation of the breast// Radiographics 1994 V. 14 (1). P. 29-50
- Madjar H . Mundinger A.. Lattermann U.. Gufler H„ Prompeler H J. Phantomuntersuchun gen von Ultraschallgeraten zur Qualitatsverbesserung in der Mammadiagnosiik// UltraschSII Med. 1996 V 17 (2). P. 85-95
- Hoicombe С Pugh N Lyons K. Douglas Jones A. Mansel R E Horgan K. Blood flow in breast cancer and fibroadenoma estimated by colour Doppler ultrasonography // Br. J, Surg. 1995. V 82 (6). P 787-788
- Lee W.J., Chu J.S Houng S J.. Chung M.F.. Wang S.M Chen K.M. Breast cancer angio- genesis: a quantitative morphologic and Doppler imaging study /7 Ann. Surg Oncol. 1995 V 2 (3). P. 246-251
- Madjar H., Sauerorei W Prompeler H.J. Wolfarth R. Gufler H Color Doppler and duplex flow analysis for classification of breast lesions // Gynecol Oncol, 1997 V. 64 (3). P. 392 403
- Teh W.. Wilson A.R.M. The Role of Ultrasound in Breast Cancer Screening / A Consensus Statement by the European Group for Breast Canser Screening // European J. of Cancer 1998 V. 34. №4 P. 449-450
- Дорофеев А.В Оптимизация диагностики и лечения больных отечно-инфильтративным раком молочной железы // Автореф. дисс. ... докт мед. наук. Уфа, 2003 45 с.
- Берзин С.А. Лисьева С.Д. Место УЗИ в комплексном инструментальном обследовании молочных желез // Современная лучевая диагностика и лучевая терапия. Материалы научно-практической конференции, посвященной памяти профессора Б.К Шарова. Челябинск, 1997 С. 13-15.
- Брежнева Л.Э. Методы лучевой диагностики в оценке состояния парастернальных лимфатических узлов при раке молочной железы // Современная лучевая диагностика и лучевая терапия: Материалы научно-практической конференции, посвященной памяти профессора Б.К. Шарова. Челябинск, 1997. С. 20-22.
- Шевченко Е.П. Рентгеновская и ультразвуковая диагностика непальпируемых образований молочной железы //Автореф. дисс. ... канд. мед. наук. М., 1997. 17 с.
- Germer U., Gembruch U., Bauer О., Diedrich К. Differenzierung von kleinen Mammalasionen mittels Dopplersonographie II Zentralbl. Gynakol. 1996. V. 118 (8). P. 453-457.
- Marquet K.L., Funk A., Handt S., Fendel H., Heindrichs U., Rath W. Der Verdrangungsrand- saum und die Randkontur. Sensible Dignitatskriterien in der Mammasonographie II Geburt- shilfe. Frauenheilkd. 1995. V. 55 (10). P. 548-552.
- Saitoh R„ Kojima R., Ito K., Saitoh Y., Tsuchigame Т., Takahashi M. Real-time high resolution ultrasonography of solid breast masses: use of a 10-MHz mechanical sector transducer with a water bag II Radiat. Med. 1994. V. 12 (5). P. 201-208.
- Cressa C., Gozzi G. Tonutti M. Macorig D., Tessa I. Contributo diagnostico dellingrandimento radiografico diretto e dellecografia nello studio delle neoplasie mammarie // Radiol. Med. Torino. 1994. V. 87 (4). P. 405-411.
- Ishii M. Ultrasonographic diagnosis of breast diseases: a review of diagnostic criteria of sonomammography on a real-time scanner// Nippon Igaku Hoshasen Gakkai Zasshi. 1993 V. 53 (10). P. 1141-59.
- Soo M.S., Kornguth P.J., Hertzberg B.S. Fat necrosis in the breast: sonographic features // Radiology. 1998. V. 206 (1). P. 261 269
- Ветшев П.С., Кузнецов Н.С., Бельцевич Д.Г., Озеров С.К. Возможности ультразвукового исследования в дифференциальной диагностике доброкачественных узловых образований и рака молочной железы // Хирургия. 1997. № 6. С.15-18
- Ozdemir A., Oznur I I., Vural G., AtaseverT., Karabacak N I., Gorcora N., Isik S., Unlu M. Mammography, ultrasonography and TL-201 scintighraphy in the evaluation of palpable and nonpalpable breast lesions: a correlative study II European J. of Radiology. 1997. V. 24. 2. P. 145-154
- Yang W.T., Suen M., Metreweli C. Sonographic features of benign papillary neoplasms of the breast: review of 22 patients // J. Ultrasound. Med. 1997. V. 16 (3). P. 161-168.
- Трофимова Е.Ю. Комплексная ультразвуковая диагностика заболеваний молочной железы //Автореф. дисс. ... докт. мед. наук. М., 2000. 50 с.
- Фисенко Е.П. Ультразвуковая диагностика опухолевых поражений молочной железы в хирургической клинике//Автореф. дисс. ... канд. мед. наук. М., 1999. 24 с.
- Cilotti A., Bagnolesi P., Moretti М., Gibilisco G., Bulleri A., Macaluso A.M., Bartolozzi С. Comparison of the diagnostic performance of high-frequency ultrasound as a first- or second-line diagnostic tool in non-palpable lesions of the breast // Eur Radiol. 1997. № 7 (8). P. 1240- 1244.
- Paramagul C.P., Helvie M.A., Adler D.D. Invasive lobular carcinoma: sonographic appearance and role of sonography in improving diagnostic sensitivity II Radiology. 1995. V. 195 (1). P 231-234.
- Ciatto S., Rosselli del Turco M., Catarzi S., Morrone D., Bonardi R. Ruolo diagnostico dellecografia mammaria II Radiol. Med. Torino. 1994. V. 88 (3). P. 221-224.
- Михайлов C.A., Скрынник Е.Б. Влияние гистоструктуры опухоли на эффективность ультразвуковой диагностики при узловых новообразованиях молочной железы // Современная лучевая диагностика и лучевая терапия: Материалы научно-практической конференции, посвященной памяти профессора Б.К. Шарова. Челябинск, 1997. С. 131-132.
- Путырский Л.А. Рак молочной железы. Минск: Вышейшая школа, 1998. 95 с.
- Ультразвуковое допплеровское картирование при раке молочной железы: Пособие для врачей МЗ РФ / МНИОИ им. П.А. Герцена. Сост. Трофимова Е.Ю. и др. М., 2002. 19 с.
- Рожкова И.И., Харченко В.П., Якобе Л.Ц. Современный взгляд на диагностику узловой мастопатии II Вестник рентгенологии и радиологии. 1995. № 6. С. 15-18.
- Оптимальный диагностический комплекс в ранней диагностике рака молочной железы: Метод, рекомендации / МНИОИ им. П.А. Герцена. Сост. В.М. Араблинский и др. М., 1992. 18 с.
- McNicholas М.М., Mercer P.M., Miller J.С., McDermott E.W., O. Higgins N.J., MacErlean D.P. Color Doppler sonography in the evaluation of palpable breast masses //AJR. 1993. V. 161 (4). P. 765-771.
- Castagnone D., Rescalli S., Rivolta R., Poma S. Color Doppler ultrasonography in the diagnosis of solid breast lesions. L'eco-color-Doppler nella diagnosi delle lesioni solide mammarie // Minerva. Chir. 1995. V. 50 (5). P. 475-479.
- Bader W., Degenhardt R Clinical significance of breast sonography. Klinische Bedeutung der Mammasonographie// Krankenpfl. J. 1995. V. 33 (9). P. 377-382.
- Корженкова Г.П. Диагностика листовидной опухоли молочной железы // Автореф. дисс. ... канд. мед. наук. М., 2000. 22 с.
- Ueno Е. Breast ultrasound // Gan. То. Kagaku. Ryoho. 1996. V. 23. Suppl. 1. P. 14-23.
- Peters Engl C., Medl M., Mirau M. Wanner C., Bilgi S., Sevelda P., Obermair A. Color-coded and spectral Doppler flow in breast carcinomas-relationship with the tumor microvas- culature. // Breast Cancer Res. Treat. 1998. V. 47 (1). P. 83-89.
- Buadu L.D., Murakami J., Murayama S., Hashiguchi N., Toyoshima S., Sakai S., Yabuuchi H., Masuda K., Kuroki S., Ohno S. Colour Doppler sonography of breast masses: a multiparameter analysis II Clin. Radiol. 1997. V. 52 (12). P. 917-923.
- Sohn C., Beldermann R, Bastert G. Sonographic blood flow measurements in malignant breast tumors. A potential new prognostic factor// Surg. Endosc. 1997. № 11 (9). P. 957-960.
- Sohn C., Thiel C., Baudendistel A., von Fournier D., Bastert G. Welche Sicherheit bietet die konventionelle Mammasonographie und farbcodierte Sonographie in der Diagnostik von Mammatumoren? // Zentralbl. Gynakol. 1996. V. 118 (3). 0. 142-147.
- Lee W.J., Chu J.S., Huang C.S. Chang M.F., Chang K.J., Chen K.M. Breast cancer vascularity: color Doppler sonography and histopathology study II Breast Cancer Res. Treat. 1996. V. 37 (3). 0. 291-298.
- Hollerweger A., Rettenbacher Т., Macheiner P., Gritzmann N. New signs of breast cancer: high resistance >ow and variations in resistive indices evaluation by color Doppler sonography II Ultrasound Med. and Biol. 1997. V. 23 (6). 0. 851-856.
К главе 13
- Karasch Th., Jakobs A.L., Strauss F.J. et al. Coarctation of the abdominal aorta-first experience with colour-coded duplex sonography// S. Vas. Invest. 1995. V. 1. P. 150-153.
- Покровский A.B. Заболевания аорты и её ветвей. М.: Медицина, 1979. 323 с.
- Kocthrein Н., Schuhmayer R., Judmaier G. Anderundendes Blutflusses in derarteria mesenteri- ca inferior bei entzundichen Darmerkrankungen II Ultraschall Klin. Prax. 1990. № 5. S. 187.
- Mirk P., Cotroneo A R., Palazzoni G. et al. Doppler ultrasonography assessment of the inferior mesenteric artery. Feasibility study and definition of morphologic and flowmetric characteristics // Radiol. Med. Torino. 1994. № 87. P. 275-282.
- Покровский А.В., Зотиков А.Е., Юдин В.И. Неспецифический аортоартериит. М.: Ирись, 2002. 222 с.
- Бордуновский В.Н. Хирургия селезёнки. Челябинск, 1997. 190 с.
- Хрусталёв А.Д. Кровоснабжение селезенки // Сб. науч. работ Ярославского медицинского инст. 1957. Т. 14. С. 13-15.
- Шмелев В П. О ветвлении сосудов селезенки // Труды Воронежского мед. инст. 1961. Т. 43. С. 44-45.
- Короткевич Н.С. Хирургическая анатомия селезенки. П., 1972. 11 с.
- Zwiebel W.J. Introduction to vascular ultrasonography II W.B. Saunders company. 2000. P. 505.
- Ромашин С.О. Особенности гемодинамики в чревном стволе у больных с абдоминальным болевым синдромом//Дисс. ... канд. мед. наук. 1998. 117 с.
- Кунцевич Г.И. Ультразвуковая диагностика в абдоминальной и сосудистой хирургии. Минск: Кавалер паблишере, 1999. 252 с.
- Tanaka К., Mitsui К., Morimoto М. et al. Increased hepatic arterial blood flow in acute viral hepatitis: Assessment by color Doppler sonography // Hepatology. 1993. № 18. P. 21-27.
- Kathrein H., Schuhmayer R., Judmaier G. Anderungen des Blutflusses in der Arteria rnesente- rica inferior bei entzundichen Darmerkrankungen // Ultraschall Klin. Prax. 1990. № 5. P 187.
- Пациора М.Д. Хирургия портальной гипертензии. М.: Медицина, 1974. 407 с.
- Шерлок Ш., Дули Дж. Заболевания печени и желчных путей. М.: Медицина, 1999. 859 с.
- Bernades P., BaetzA., Levy P. et al. Splenic aud portal venous obstruction in chronic pancreatitis. A prospective lougitudinal study of a medical-surgical series of 266 patients // Dig Dis. Sci. 1992. № 37. P. 340.
- Жестовская С.И. Комплексная ультразвуковая диагностика синдрома портальной гипертензии и малых форм очаговых поражений печени методом ультразвуковой ангиографии II Дисс. ... докт. мед. наук, 1999. 214 с.
- Kin J., Nimura J., Hayakawa N. et al. Doppler analysis of hepatic blood flow predicts liver dysfunction after major hepatectomy II World J. Surg. 1994. V. 18 (1). P. 143-149.
- Kawasaki Т., Moriyasee R, Kimura T. et al. Portial hemodynamic changes from partial hepate- ctomy-quantitative analysis of portal flow before, during and after hepatectomy, using an Doppler ultrasound system // Nippon Shokakibyo Gakkai Zasski. 1990. V. 87 (4). P. 979-988.
- Richter J., Zwingenberger K., Mohamed Ali Q. et al. Hepatosplenic schistosomiasis comparison of sonographic findings in Brazilian and Sudanese patients. Correlation of sonographic findings with clinical symptoms // Radiology. 1992, V. 184. P 711-716.
- Богер M.M., Мордвов C.A., Печенкина Л.Г. //Тер. архив. 1985. № 5. С. 91-95.
- Кунцевич Г.И., Белолапатко Е.А. Цветовое допплеровское картирование и импульсная допплерография абдоминальных сосудов // Ультразвуковая допплеровская диагностика сосудистых заболеваний / Под ред. Ю.М Никитина, А.И. Труханова. М.: Видар, 1998. С. 297-329.
- Митьков В.В. Допплерография в диагностике заболеваний печени, желчного пузыря, поджелудочной железы и их сосудов. М.: Видар, 2000. 146 с.
- Vilgrain V. Ultrasound of diffuse liver disease and portal hypertension // Ultrasound. 2002. P. 91-105.
- Gaiani S., Bolondi L., Li Bassi S. et al. Prevalence of spontaneous hepatofugal portal flow in liver cirrhosis. Clinical and endoscopic correlation in 228 patients // Gastroenterology. 1999. V. 100. P. 160-167.
- Wachsberg R.H., Simmons M.Z. Coronary vein diameter and flow direction in patients with portal hypertension: evaluation with duplex sonography and correlation with varicedl bleeding
- //Am J Roentgenol 1994, V. 162. P 637-641,
- Nelson R.C Sherbourne G M., Spencer H.B. et al. Splenic venous flow exceeding portal venous flow at Doppler sonoaiaphy: relationship to portosysteneic varices //Am. J. Roentgenol 1993. V. 161 P. 563-567
- Siringc S. Bolonai L Gaiani S et ai. Timing of the first variceai hemorrhage in cirrhotic patients: prospective evaluation of Doppler flowmetry, endoscopy and clinical parameters // Hepatology 1994 V. 20. P 66-73.
- Sato S Tsubaki T Kako M. et al. Measurement of portal and splenic venous flow volume (PV and SV). cougestion index (CI) and SV/PV% in various liver desease using by Doppler echo-sonography // Nippon Shokakibyo Gakkai Zasshi. 1996. V. 93. P. 331-337
- Moriyasu R, Nishida O., Ban N. et al. «Congestion index» of portal vein //AJR. 1986 V 146, P 735-739
- Siringo S., Bolondi L Gaiani S et al The relationship of endoscopy portal Doppler ultrasound flowmetry and clinical and biochemical tests in cirrhosis // J. Hepatol. 1994. V 20. P 11-18
- Saceidoti D Merkel C. Bolognesi M et al Hepatic arterial resistance in cirrhosis with and without portal vein thrombosis relationships with portal hemodynamics // Gastroenterology 1995 V. 108 P. 1152-1158
- Ohnishi K. Sato S, et ai Direction of splenic venous flow assessed by pulsed Doppler flowmetry in patients with a large splenorenal shunt: relaton to spontaneous hepatic encephalopathy//Gastroenterology. 1985.89 P. 180-185
- Brooke Jeffrey R.. Ralls P W. Sonography of the abdomen. New York: Raven Press, 1995 418 p.
- Grant G, E Schiller V.L. MiHener P et al Color Doppler imaging of the hepatic vasculature II AJR 1992 V. 159 P. 943-950
- Merritt Christopher R. B. Doppler Color imaging 1992.
- Sterneck M., Wiesnei R , Ascher N. et al Azathioprine hepatotoxicity afte. liver transplantation // Hepatology 1991. V 14 P. 806
- Katzka D A Saul S H. Jorkasky D et al. Azathioprine and hepatic venoocclusive disease in renal transplant patients // Gastroenterology. 1986. V 90 P 446
- Lemley D E DeLacy L.M Seeff L В et al. Azathioprine induced hepatic veno occlusive disease in rheumatoid arthritics It Ann Rheum Dis 1989 V. 48 P 342.
- Kazumitsu Koito. Tsutomo Namienc Tatsuya Nagakawa et al. Inflammatory Pancreatic Masses. Differentiation from Ductal Carcinomas with Contiast-Enganced Sonography Using Carbon Dioxide Microbubbies //Am J. Roentgenology. 1997 V 169. P. 1263-1267.
- Бабаджанян С С Клиника и диагностика первичных виеорганных забрюшинных опухолей таза II Дисс. ... канд. мед наук. М. 1978 218 с
- Сахипов С С. Отдаленные результаты хирургического лечения больных с неорганными забрюшинными опухолями //Дисс . канд мед наук. М 1993. 156 с
- Миронова Г.Т. Бачиашвили А.К . Мазаев А.П Ультразвуковая томография в диагностике забрюшинных неорганых опухолей // Медицинская радиология. 1986 № 7 С 45-48.
- Харченко В П. Котпяров П М Ультразвуковая семиотика и дифференциальная диагностика неорганных опухолей и кист брюшной полости 11 Клиническая физиология Диагностика - новые методы. М.: АИР-АРТ. 1998 С 164-168.
- Ермолов А С Бондаренко В.О., Шагиро Н.А. с соавт Возможности инвазивного ультразвука в диагностике внеорганных опухолей забюшинного пространства II Актуальные вопросы клинической железнодорожной медицины. Опыт диагностики и лечения больных М 1997. С. 137-138.
- Степанова Ю.А. Диагностика неорганных забрюшинных образований по данных комплексного ультразвукового исследования //Дисс. ... канд. мед. наук. 2002. 154 с.
- Цвиркун В.В. Неорганные забрюшинные образования (диагностика, хир. лечение) // Автореф. дис. ... докт. мед. наук. М., 2000. 37 с.
К главе 14
- McGahan J.P., Goldberg В.В. Diagnostic ultrasound. A logical approach // Lippincott Raven. 1998. P. 1288-1793.
- Krumme В., Kirschner Т., Gondolf D. et al. Altersabhanigkeit des intrarenalen Resistance Index (Rl) bei essentiellen Hypertonikern II Bildgebung Imaging. 1994. Suppl. 2. P. 55.
- Goscicka D. Szpinda M., Kochan J. Accessory renal arteries in human fetuses //Anat. Anz. 1996. V. 178 (6). P. 559-563.
- Кравцова Г.И. Патологичесая анатомия врожденных пороков развития почек у детей перинатального и раннего грудного возраста// Автореф. дисс. ... докт. мед. наук. 1981. 39 с.
- Debatin J.R, Spritzer С.Е., Grist Т.М. et al. (1991) Imaging of the renal arteries: value of MR Angiography//Am. J. Roentgenol. V. 157. P. 981-990.
- Postma C.T., van Aalen J., de Boo T. et al. Doppler US scanning in the detection of renal artery stenosis in hypertensive patients // Br J. Radiol. 1992. V. 65. P. 857-860.
- Robertson R., Murphy A., Dubbins PA. Renal artery stenosis: the use of dupplex ultrasound as a screening technique II Brit J. Radiol/ 1988. V. 61. P. 196-201.
- Berland L.L., Koslin D.B., Routh WD. et al. Renal artery stenosis: prospective evaluation of diagnosis with color duplex US compared with angiography. Work in progress II Radiology. 1990. V. 174. P. 421—424.
- Halpern E.J., Deane C.R., Needleman L. et al. Normal renal artery spectral Doppler waveform: A closer look II Radiology. 1995. V. 196. P. 667-73.
- Lencioni R.A., Pinto S., Napoli V et al. Detection of renal artery stenosis by time-intensity analysis of renal enhancement curve at harmonic power Doppler imaging: A pilot clinical study // Radiology. 1999. V. 213. P. 363-364.
- Kioumehr F., Cochran S.T., Layfield L. et al. Wilms tumor (nephroblastoma) in the adult patient: clinical and radiologic manifestations //AJR. 1989. V. 152. P. 299-302.
- Belli A.M., Josef A.E. The renal rind sign: a new ultrasound indication of inflammatory disease in the abdomen II Br. J. Radiol. 1988. V. 61 P. 806-810.
- Зубарев A.B., Гажонова B.E., Панюшкин C.M., Перепадя Е.В., Бошков В.Б. Трехмерная виртуальная эхоангиография почек // Эхография. 2001. Т. 2. № 2. С. 124-130.
- Зубарев А.В., Гажонова В.Е., Панюшкин С.М., Перепадя Е.В., Бошков В.Б., Михайлова Р.В. Трехмерная виртуальная эхоангиография в выявлении добавочных почечных артерий // Медицинская визуализация. 2001 № 2 С. 78-85.
- Zubarev A. Ultrasound of renal vessels // European Radiology. 2001. V. 11. № 10. P. 1902- 1916.
- Zubarev A., Gazhonova V. 3D Ultrasound angiography of renal vessels II Med. Im. Int. 2003. V. 13. №2. P. 15-19.
- Piatt J.F. Urinary tract obstruction//Radiol. Clin. North. Am. 1996. №34. P. 1113-1129.
- Piatt J.F , Rubin J.M., Ellis J.H. et al. Dupplex Doppler US of the kidney differentiation of obstructive from nonobstructive dilatation II Radiology. 1989. V. 171. P. 515-517.
- Piatt J.F., Rubin J.M., Ellis J.H. Distinction between obstructive and nonobstructive pyelocal- iectasis with duplex Doppier sonography // Am J Roentgenol- 1989 V. 153 P 997-1000.
- Renowden S.A., Cochlin D L. The potential use of diuresis Doppler sonography in UPJ obstruction // Clin Radiol. 1992. V 46. P. 94-96.
- Burge H.J. Middleton W.D., Mc Clennan B.L. et al Ureteral jets in hea'thy subjects and in patients with unilateral calculi: comparison with color Doppler ultrasound U Radiology 1991. V. 180. R 437—442.
- Лопаткин H А Руководство по урологии. M.: Медицина. 1998. Т. 2 768 с.
- Зубарев А.В Гажонова В.Е. Диагностический ультразвук. Уронефрология Фирма Стром 2002. 248 с.
- Trillaud Н, Merviile P. Li.nh PT.L et al Color Doppler sonography in early renal transplantation follow-up: Resistive index measurements versus power Doppler sonography И. Am. J Roentgenol. 1998. V. 171 P. 1611-15.
- Harris D C, Antico V , Allen S et al. Doppler assessment in renal transplantation // Transplant. Proc. 1989. V. 21 P. 1895-1896.
- Fluckiger F. Steiner S., Horn M, et al. Farbkodierte Dupplexsonographie und Widerstandsin- dex bei Nierentransplantat'on mit Dysfunktion II Fortschr. Rontgenstr. 1990 V 153 P 692- 697.
- Baxter G M Ireland H Moss J et al. Color Doppler US in renal transplant artery stenosis: Which Doppler index'' // Clin. Radiol. 1995. V 50. P. 618-622.
- Mallek P Mostbeck G , Kain R. et al Vaskulare Nierentransplantatabstossung - 1st eine du- plexsonographische Diagnose moglich?// Fortsch", Rontgenstr. 1990 V 152. P. 283-286
- Сандриков В А Садовников В.И Клиническая физиология трансплантированной почки М , Майк: Наука/Интерпериодика, 2001. 288 с.
- Grenier N Douws С Morel D et al. Detection of vascular complications in renal allografts with color Doppler flow imaging II Radiology. 1991 V 178. P 217-23.
- Meyer M.. Paushter D Stemmuller D. The use of duplex Doppler ultrasonography to evaluate renal allograft dysfunction//Transplantation. 1990 V 50 P 974-978.
- Лопаткин H.A. Руководство по урологии M. Медицина 1998 T 3. 672 с.
- Sakaraya M E., Arslan H , Van T.R. Investigation of bladder wall vascularization by Transrectal color Doppler sonography in patients with benign prostatic hyperplasia // Eur Radiol 1999, Suppl 1.P.456
- Зубарев А В., Гажонова В E.. Козлов В.П и др. Новые диагностические возможности ультразвука в уронефрологии И Визуализация в клинике. 1999. № 4 С 60-68.
- Rubin J.M., Bude R.O Carson PL et al. Power Doppler US. a potentiaily useful alternative to mean frequency-based color Doppler US // Radiology 1994 V. 190. P 853-856
- Hendrix A, Kiomp M Keyzer J et al The role of color velocity imaging (CVI) in prostate ultrasound // Eur. J. Ultrasound 1996 V 3 P 15-23
- Гажонова В.Е. Комплексная ультразвуковая диагностика и мониторинг лечения заболеваний предстательной железы // Дисс, докт. мед наук 2002
- Гажонова В.Е Значение ультразвуковой ангиографии в диагностике простатита // Эхография. 1999 № 1, С 104-109
- Янаков РВ Куликов В. П. Триплексное трансректальное сканирование в диагностике заболеваний предстательной железы Й Визуализация в клинике. 1995. С. 36-39.
- Гажонова B E Ультразвуковая диагностика и мониторинг лечения острого простатита. И Эхография 2002. Т 3. № 2 С. 175-189.
- Vespasiani G . B:telli М.. Mele G O Color Doppler echography in the diagnosis of nonspecific granulomatous prostatis: personal experience //Arch. Ital Urol. Androl 1996. Dec. 68 (Suppl 5) P 57-60
- Зубарев А.В., Гажонова В.Е., Козлов В.П. и др. Ультразвуковая диагностика и мониторинг лечения заболеваний предстательной железы // Медицинская визуализация. 2001 № 3. С. 6-20.
- Зубарев А.В., Гажонова В.Е. Ультразвуковая оценка сосудистого рисунка предстательной железы в норме и при аденоме // Визуализация в клинике. 1997. № 12. С. 14-37.
- Гажонова В.Е. Рак и доброкачественная гиперплазия предстательной железы. Сложности ультразвуковой диагностики при сочетанном поражении II Эхография. 2001. Т. 2. № 2. С. 163-175.
- Шолохов В.Н., Вишняков А.А. Современные методы ультразвуковые диагностики рака предстательной железы // Клин, онкология. 1999. Т. 1. № 1. С. 5-8.
- Newman J.S., Bree R.L., Rubin J.M. Prostate cancer: Diagnosis with color doppler sonography with histological correlation of each biopsy site II Radiology. 1995. № 1. P. 86-90.
- Гажонова В.Е. Значение ТРУЗИ сУЗ-ангиографией в дифференциальной диагностике гипоэхогенных участков предстательной железы // Медицинская визуализация. 2000. № 4. С. 28-34.
- Sauvain J.L., Palascak P., Bremon J.M. Power Doppler ultrasonography and hypoechoic nodules of the peripheral prostate: prospectives and limitations II J. Radiol. 1997. Jul. 78 (7): P. 491-497.
- Folkman J., Watson K., Ingber D. et al. Induction of angiogenesis during the transition from hyperplasia to neoplasia // Nature. 1989. V. 339. P. 58-61.
- Fenster A., Downey D., Rankin R. 3-D allows interactive slicing of sonogramms // Diag. Imag. Europe. 1995. V. 5. P. 11-14.
- Gajonova V., Zubarev A., Chuprik-Malinovskaya T. et al. 3D Power Doppler Contrast enhanced sonography with Levovist in the assesment of tumor neovascularity in prostate cancer// European Radiology. 1999. (Suppl. 1) V. 9. P. 164.
- Middleton W.D., Thome D.A., Melson G.L. Color Doppler US of the normal testis//AJR. 1989. V. 152. P. 69-76.
- Middleton W.D., Bell M.W. Analysis of intratesticular arterial anatomy with emphasis on trans- mediastinal arteries II Radiology. 1993. V. 189. P 157-60.
- Horstman W.G., Middleton W.D., Melson G.L. Color Doppler US of the scrotum // Radiographics. 1991. V. 11. P. 941-957.
- Brown J.M., Hammers L.W., Barton J.M. Quantitative Doppler assessment of acute scrotal inflammation // Radiology. 1995. V. 197. P. 421-37.
- Horstmann W.G. Middleton W.D., Melson G.L. Scrotal inflammatory disease: color Doppler US findings // Radiology. 1991. V 179 P. 55-59.
- Oyen R., Verbist В., Versvijvel G. Imaging of testiculart neoplasms II Carcinoma of the kidney and testis, and rare urologic malignancies / Ed. Z. Petrovich, L. Baert et al. Springer, 1990.
- Schwartz A.N., Wang K.Y., Mack L.A. et al. Evaluation of normal erectile function with color flow Doppler sonography//AJR. 1989. V. 153. P. 1155-1160.
- Herbener Т.Е., Seftel A.D., Nehro A. et al. Penile ultrasound // Seminars in urology. 1994. V. 12. P. 320-332.
- Benson C., Doubilet P., Vickers V. Sonography of the penis // Ultrasound Quart. 1991. V. 9. P. 89-109.
- Fitzgerald S., Erickson W., Foley W. et al. Color Doppler ultrasound in the evaluation of erectile dysfunction: prediction of venous incompetence // Radiology. 1990. V. 177. P. 129.
- Зубарев A.P., Митькова М.Д., Корякин M.B. и др. Ультразвуковая диагностика заболеваний наружных половых органов у мужчин. М.: Видар, 1999. 96 с.
- Strecker J.F., Devine C.J. Evaluation of erectile dysfunction in patients with Peyronie's disease//J. Urol. 1984. V. 132. P. 680-681.
К главе 15
- KurjakA., Predanic M., Kupesic-Urek S. et al. Transvaginal color and pulsed Doppler assessment of adnexal tumor vascularity II Gynecol. Oncol. 1993. V. 50. № 1. P. 3-9.
- Weiner Z., Thaler I., Beck D. et al. Differentiating malignant from benign ovarian tumors with transvaginal color flow imaging // Obstet. Gynecol. 1992. V. 79. P. 159-162.
- Guerriero S., Ajoss S., Risalvato A. et al. Diagnosis of adnexal malignancies by using color Doppler energy imaging as a secondary test in persistent masses // Ultrasound Obstet. Gynecol. 1998. V. 11. № 4. P. 277-283.
- Kurjak A., Kupesic S. The value of transvaginal color Doppler in preoperative assessment of ovarian tumors of borderline malignancy // Ultrasound Obstet. Gynecol. 1994. V. 4. Suppl. 1. R 51
- Hata K., Hata Т., Kitao M. Objective evaluation of adnexal tumors with transvaginal gray-scale and Doppler ultrasound // Ultrasound. Obstet. Gynecol. 1995. V. 6. Suppl. 2. P. 15.
- Alcazar J., Ruiz-Perez M.L., Errasti T. Transvaginal color Doppler sonography in adnexal masses: which parameter performs best? // Ultrasound Obstet. Gynecol. 1996. V. 8. № 2. P. 114-119.
- Stein S.M., Laifer-Narin S., Johnson M.B. et al. Differentiation of benign and malignant adnexal masses: relative value of gray-scale, color Doppler, and spectral Doppler sonography // Am. J Roentgenol. 1995. V. 164. № 2. P. 381-386.
- Leeners В., Funk A., Schroder W. et al. The current role of colored doppler sonography in the preoperative evaluation of adnexal masses: pulsatility index, (PI), resistance index, (Rl) and peak velocity, (Vmax) // Ultrasound Obstet. Gynecol. 1996. V. 8. Suppl. 1. P. 226.
- Хэм И. и Кормак Д. Гистологическая характеристика внутренних половых органов // Гистология. М.: Мир, 1983. 154 с.
- Савицкий Г.А., Савицкий А.Г. Миома матки. Проблемы патогенеза и патогенетической терапии. СПб.: ЭЛБИ, 2000. 236 с.
- Буланов М.Н., Зыкин Б.И. Допплерография в онкогинекологии // Тезисы 3 съезда Ассоциации специалистов ультразвуковой диагностики в медицине. М., 1999. С. 55.
- KurjakA., Kupesic S. Transvaginal color Doppler and pelvic tumor vascularity: lessons learned and feature challenges // Ultrasound. Obstet. Gynecol. 1995. V. 6. P. 145-159.
- Valentin L. Gray scale sonography, subjective evaluation of the color Doppler image and measurement of blood flow velocity for distinguishing benign and malignant tumors of suspected adnexal origin II Eur. J. Obstet. Gynecol. Reprod. Biol. 1997. V. 72. P. 63-72.
- Tekay A; Jouppila P. Controversies in assessment of ovarian tumors with transvaginal color Doppler ultrasound II Acta Obstet. Gynecol. Scand. 1996. V. 75. № 4. P. 316-329.
- Bromley В., Goodman H., Benacerraf B.R. Comparison between sonographic morphology and Doppler waveform for the diagnosis of ovarian malignancy// J. Obstet. Gynecol. 1994. V. 84 P 434-437.
- Jukic S , KurjakA., Babic D., Kupesic S. Histopathological aspects of neovascularisation in ovarian neoplasms// Ultrasound Obstet. Gynecol. 1995. V. 6. Suppl. 2. P. 14.
- Sladkevicius P., Valentin L., Marsal K. Transvaginal gray-scale and Doppler ultrasound examinations of the uterus and ovaries in healthy postmenopausal women // Ultrasound Obstet. Gynecol. 1995. V. 6. № 2. P. 81-90.
- Zalel Y., Caspi В., Tepper R. Doppler flow characteristics of ovarian dermoid cysts - the unique appe— ranee of struma ovarii // Ultrasound. Obstet. Gynecol. 1996. V. 8. Suppl. 1. P. 186.
- Zalel Y., Caspi В., Tepper R. Doppler flow characteristics of dermoid cysts: unique appearence of s:-_- ma ovarii II J. Ultrasound Med. 1997. V. 16. № 5. P. 355-358.
- Exacoustos С , Tallone E., Carusotti C. et al. Transvaginal sonographic and color flow Doppler appea-- ance of low malignant potential ovarian tumors II Book of Abstracts of Sixth World Congress on Ultrasound in Obstetrics and Gynecology. Washington, 1997. P. 124.
- Kurjak A., Predanic M. Ovarian cancer screening // Curr. Opin. Obstet. Gynecol. 1994. V. 6. Ns " P. 67-74.
- Bogner G., Gruber R., Steiner H. Is the assessment of ovarian masses with color Doppler ultrasci,-: dependent of training? // Ultrasound. Obstet. Gynecol. 1996. V. 8. Suppl. 1. P. 152.
- Tekay A., Jouppila P. Intraobserver variation in transvaginal Doppler blood flow measurements in nign ovarian tumors. Department of Obstetrics and Gynecology // Ultrasound Obstet. Gynecol. 199" V. 9. № 2. P. 120-124.
- Hata H., Hata K., Kitao M. Correlation between blood flow analysis and thymidine phosphorylase expression in tissue in the normal ovary and ovarian tumor// Ultrasound Obstet. Gynecol. 1996. V. 6 Suppl. 1 P. 10.
- Pascual A., Cameras O., Hereter L. et al. Can benign and malignant lesions be differentiated with colc Doppler? // Ultrasound Obstet. Gynecol. 1994. V. 4. Suppl. 1. P. 69.
- Aleem R, Zeitoun K., Calame R. et al. The characterization of flow signals from tubal and ovaris- arteries using intraoperative continuous wave Doppler // Ultrasound Obstet. Gynecol. 1994. V - P. 303-309.
- Kedar R.P., Bourne Т.Н., Powles T.J. et al. Effects of tamoxifen on the uterus and ovaries of postir- enopausal women in a randomised breast cancer prevention trial II Lancet. 1994. № 343. P. 1315
- Schieber M., Sohn Ch. Sonographic diagnosis of blood flow in tumors of uterus and ovary - a help iri diagnosis? // Ultrasound Obstet. Gynecol. 1995. V. 6. Suppl. 2. P. 104.
- Piatt L., Karlan B.Y., Lopez E. et al. Color Doppler and evaluation of ovarian masses // Ultrasounc Obstet. Gynecol. 1996. V. 8. Suppl.1. P. 243.
- Хмельницкий O.K. Патоморфологическая диагностика гинекологических заболеваний. СПб.: СС- ТИС, 1994.480 с.
- McKinlay S., Brambilla D., Posner J. The normal menopause transition // Maturitas. 1992. V. 1- P. 103-115.
- Hata K., Makihara K., Hata T. Transvaginal color Doppler imaging for hemodynamic assessment c~ reproductive tract tumors // Jpn. Int. J. Gynecol. Obstet. 1991. V. 36. P. 301-308.
- Kurjak A., Shalan S., Kupesic S. et al. Transvaginal color Doppler sonography in the assessment c" pelvic tumor vascularity// Ultrasound. Obstet. Gynecol. 1993. V. 3. P. 137-154.
- Сидорова И.С., Капустина И.А., Леваков С.А. Цветовое допплеровское картирование у больны-миомой матки II Ультразвуковая диагностика в акушерстве гинекологии и педиатрии. 1999. Т 7 №4. С. 308-311.
- Медведев М.В., Лютая Е.Н. Миома матки //Допплерография в гинекологии / Под ред. Б.И. Зыкина и М.В. Медведева. М.: Реальное время, 2000. С. 45-58.
- Лютая Е.Д. Допплерографическая диагностика миомы матки // Автореф. дисс. ... канд. мед нау- М., 1999. 20 с
- Matta W., Stabile I., Shaw R., et al. Doppler assessment of uterine blood flow changes in patients wit fibroids receiving the gonadotropine releasing hormone agonist buserelin // Fertil. Steril. 1988. V. 49 P. 1083-1085.
- Ximenes R., Acacio G., Rodrigues M The assessment of leyomioma vascularity and blood flov, characteristics by transvaginal color Doppler// Ultr. Obstet. Gynecol. 1996. V. 8. Suppl. 1. P. 54
- Hirai M., Shibata К., Sagai H. et al. Transvaginal pulsed and color Doppler sonography for the evaluation of adenomyosis // J. Ultr. Med. 1995. V. 14. P. 529-532.
- Jdrveld I., Tekay A., Joupilla P. The effect of a levonorgestrel-releasing intrauterine system on uterine artery blood flow in uterine artery in fertile women // Ultr. Obst. Gynecol. 1998. V. 8. Suppl. 1. P. 29.
- Szantho A., Szabo I. Nemet L. et al. Transvaginal color Doppler for assessment of uterine tumor vascularity // Ultr. Obstet. Gynecol. 1994. V. 4 Suppl. 1. P. 68.
- Aleem F., Predanic M., Calame R., et al. Transvaginal color and pulsed Doppler sonography of the endometrium: a possible role in reducing the number of dilatation and curettage procedures // J. Ultr. Med. 1995. V. 14. №2. P. 139-145.
- Липман А.Д. Диагностика и комплексное лечение больных гормонозависимыми заболеваниями матки с использованием эхографического мониторинга II Дисс.... докт. мед наук. М., 2000. 293 с.
- Kupesic S., Kurjak A. Doppler assessment of the normal endometrium and bening endometrial disorders // Doppler Ultrasound in Gynecology / Ed. A. Kurjak, A.C. Fleisher. The Parthenon Publishing Group, 1998. P. 89-99.
- Hata K., Hata Т., Kitao M. Intratumoral blood flow analysis in endometrium cancer: does it differ among individual tumor characteristics? // Gynecol. Oncol. 1996. V. 61. № 3. P. 341-344.
- Кателина С.Я., Сидоренков A.M. Сравнительная информативность трансвагинальной эхографии и допплерометрии в диагностике неопластических процессов эндометрия // Тез. докл. V съезда Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии. СПб., 1998. С. 73.
- Sheth S., Hamper U., McCollum M. et al. Endometrial blood flow analysis in postmenopausal women: can it help differentiate benign from malignant causes of endometrial thickening? // Radiology. 1995. V. 195. № 3. P. 661-665.
- Sladkevicius P., Valentin L., Marsal K. Endometrial thickness and Doppler velocimetry of the uterine arteries as discriminators of endometrial status in women with postmenopausal bleedingp. A comparative study //Am. J. Obstet. Gynecol. 1994. V. 171. № 3. P. 722-728.
- Carter J., Lau N., SaltzmanA. et al. Gray scale and color flow Doppler characterization of uterine tumors // J. Ultr. Med. 1994. V. 13. № 11. P. 835-840.
- Gonoscenti G., Meir Y., Fischer Tamaro L. et al. The diagnostic capacities of transvaginal echography and hysteroscopy in the characterization of endometrial pathology // Minerva Gynecol. 1995. V. 47. № 7-8. P. 293-300.
- Flam F., Almstrom H., Hellstrom A. et al. Value of uterine artery Doppler in endometrial cancer//Acta Oncol. 1995. V. 34. Ns 6. P. 779-782.
- El Ahmady O., Gad M., el Sheimy R. et al. Comparative study between sonography, pathology and UGP in women with perimenopausal bleeding //Anticancer Res. 1996. V. 16. № 4. P. 2309-2313.
- Vuento M., Pirhonen J., Makinen J. et al. Screening for endometrial cancer in asymptomatic postmenopausal women with conventional and color Doppler sonography // Br. J. Obstet. Gynecol. 1999. V. 106. № 1. P. 14-20.
- Проскурякова О.В. Эхографический и допплерографический мониторинг бессимптомного течения постменопаузы // Дисс. ... докт. мед. наук. М., 2002. 303 с.
- Зыкин Б.И. Стандартизация допплерографических исследований в онкогинекологии // Дисс. ... докт. мед. наук. М , 2001. 275 с.
- Hata К., Hata Т., Manabe A. et al. New pelvic sonoangiography for detection of endometrial carcinoma: a preliminary report // Gynecol. Oncol. 1992. V. 45. № 2. P. 179-184.
- Ашрафян Л.А., Харченко H.B., Огрызкова В.Л. и др. Реален ли скрининг рака эндометрия? II Тез. докл. 3 съезда Российской ассоциации специалистов ультразвуковой диагностики в медицине. Москва, 1999. С. 6.
- Fleischer A., Rodgers W., Kepple D et al. 3D Color Doppler sonography of ovarian masses: a multipa- rameter analysis // J. Ultr. Med. 1993. V. 12. № 1. P. 41-48.
К главе 16
- Покровский А.В., Лисицин Ю.П., Харченко В.И., Куперберг Е.Б., Акопян А.С., Осинов Н.Н. Ангио- графическая служба в системе практического здровоохранения России II Ангиология и сосудистая хирургия. 1997. Ne 2. С. 12-18.
- Покровский А.В. Заболевание аорты и ее ветвей. М : Медицина, 1979.
- Graor R.A. Occlusive and aneurysmal aortoiliak disease //Aortoiliak disease. 1984 V. 75. Ns 7. P. 61-72.
- Legemate D.A., Teeuwen C., Hoenveld H., Ackerstaff R.G.A. The potential of duplex scanning to replace aortoiliac and femoropoplitea angiography II J. Vase. Surg. 1989. V. 3. P. 49-54.
- Raines J., Traad E. Noninvasive Evaluation of Peripheral Vascular Disease II Med. clin. N. Amer. 1980. V. 64. № 2. P. 283-304.
- Агаджанова Л.П. Ультразвуковая допплерография в диагностике заболеваний сосудов нижних конечностей // Вестник Акад. мед. наук СССР. 1986. Ne 2. С. 83-89.
- Лапин М Д., Дудкин Б.П., Долгих В.А., Воронцов В.В Ультразвуковая ангиография в диагностике окклюзирующих заболеваний магистральных артерий нижних конечностей // Вестн. хир. 1988. № 9. С. 30-32.
- Зубарев А.Р., Григорян Р.А. Ультразвуковое ангиосканирование. М.: Медицина, 1991.
- Abu Rahma A.F., Duthrich Е.В., Reiling M. Doppler Testing of Peripheral Vascular Occlusive Disease // Surg. Obstet. 1980. V. 150. Ns 1. P. 26-28.
- Woodcock J P. Doppler altrasound in clinical diagnosis II British. Med. Bull. 1980. V. 36. Ne 3. P. 243-248.
- Strandness D.E., Sumner D.S Applicatios of Ultrasound to the study of Arteriosclerosis Obliterans // Angiology. 1975. V. 26. № 2. P. 187-198.
- Yao J.S.T. Hemodinamic Stadies in peripherial deasease II Br. J. Surg. 1970. V. 57. P. 761-766.
- Berntein E.R, Stuart S.H., Froner A. The predictive value of noninvasive testing in peripherial vascular disease // Noninvasive Diagnostic Techniques in Vascular Disease / Ed. E.R Berntein. St. Louis: Mosby Company, 1982. P. 396-403.
- Carter S.A. Detection of peripherial arterial disease: is the clinical diagnosis adequate? // Noninvasive Diagnostic Techniques in Vascular Disease I Ed. E.F. Berntein. St Louis: Mosby Company 1982. P. 301-310.
- Johnston K.W. Doppler signal processing and wave form analisis: problems and solutions // Noninvasive Diagnostic Techniques in Vascular Disease / Ed. E.F. Berntein. St. Louis: Mosby Company, 1982. P. 28-43.
- Theile B.L. Doppler in Peripheral Vascular Disease // Vascular and Doppler Ultrasound / Ed. Jaffe. New York, 1984. P 171-202.
- FronekA , Coel M., Berntein E.F The importence of combined multisegmental pressure and Doppler flow velocity study in the diagnosis of peripherial arterial occlusive disease // Surg. 1978. V. 84. P. 840-847.
- Hirai M., Schoop W. Clinical Significance of Doppler Velocity and Blood Pressure Measurements in Peripherial Arterial Occlusive Disease И Angiology. 1984. P. 45-53.
- Агаджанова Л.П. Количественная оценка ультразвуковых допплеровских сигналов скорости кровотока в норме и при заболевании периферических сосудов // Хирургия. 1988. Ne 10. С. 103-111.
- Fronek A., Coel М., Berntein Е F. Quantitative Ultrasonographic Studies of Lower Extremity Flow Velocities in Health and Disease // Circulation. 1976. V. 53. № 6. P. 957-960.
- Jao J.S.T., Flinn W.R., Bergan J.J. Progr. Cardiovasc. Dis. 1984. V. 26. Ns 6. P. 459-494.
- Bendick P.J., Glover J.L. Detection of subcritical stenoses by Doppler spectrum analysis // Surg. 1982. V. 91. №6. P. 707-711.
- Barrie W.E., Evans D M., Bell PR. The relationship between ultrasonic pulsatility index and proximal arterial stenosis // Brit. J. Surg 1979. V. 66. P. 366-369.
- Skidmore R., Woodcock J.P. Phisiological interpretations of Doppler shift waveforms // Ultrasound in Med. and Biol. 1980. V. 6. P. 227-231.
- Humphreies K.N. et al. Quantitative assessment of the common femoral-popliteal arterial segment using continuous wave Doppler ultrasound // Ultrasound in Med. and Biol. 1980. V. 6. P. 99-105.
- Carter S.A. Clinical Measurement of Systolic Pressure in Limbs with Arterial Occlusive Disease // JAMA. 1969. V. 207. № 10. P. 1869-1874.
- Sumner D.S. Hemodynamics and Pathophysiology of Arterial Disease // Vascular Surdery / Ed. R.B. Raterford. Phyloadelphia, 1984. V. 4. P. 19-44.
- Bridges R.A., Barnes R.W. Segmental Limb Pressure // Practical Noninvasive Vascular Diagnosis / Ed F.Kempczinski. Chicago, 1982.
- WinsorT. Influence of arterial disease on the systolic blood pressure gradients of the extremity//Am. J Med. Sci. 1950. V. 220. P. 117-120.
- Ware R.W., Laenger C.J. Inderect blood pressure measurement by Doppler ultrasonic kinetoarteriogra- phy // Med. Biol. 1967. V. 27. P. 3-7.
- Carter S.A., Lezack L.D. Digital systolic pressure in the lower limbs in arterial disease II Circulation. 1971. V. 43. P. 905-914.
- Hirai M., Schoop W. Hemodinamic assessment of the iliac disease by proximal thigh pressure and Doppler Femoral Flow Velocity // J. Cardivasc. Surg. 1984. V. 25. № 4. P. 365-369.
- Brener B.J., Tizo A.C., Alpert J. et al. Three techniques for assessing iliac artery stenosis: External femoral artery compression, segmental thigh pressures and intraarterial femoral pressure // Cardiovascular Diagnosis / Ed. E B. Duthrich. Baltimore: Universiti Park Press, 1981.
- Colt J.D New Doppler pressure indexes plottet as curves: curve configuration used to determine sites of arterial obstruction //Am. J. Surg. 1978. P. 198-201.
- Barringer M., Poole G. V., Shircliffe A.C., Meredith J.W. The Diagnosis of Aortoiliac Disease //Ann. Surg. 1983. V. 197. № 2. P. 204-209.
- Brose W.G., Pierce G.E. Noninvase Measurement of femoral Artery Pressure for Evaluating Aortoiliac Occlusive Disease II J. of Surg. Res. 1985. V. 38. P. 201-209.
- Gillespu J.A. An evaluation of vasodilator drags in occlusive vascular disease by measurement // Angi- ology. 1966. V. 17. P. 280-285.
- FronekA., Yohansen K., Diiley R.B., Bernstein E.F. Ultrasonographically Monitored Postocclusive Reactive Hyperemia in the Diagnosis of peripherial Arterial Occlusive Disease // Circulation. 1973. V. 48 Ns 1. P. 149-152.
- Brener B.J., Raines J.K., Darling R.C. et al. Measurement of femoral arterial pressure during reactive hyperemia: an estimate of aortoiliac disease II Circulation. 1974. V. 49. Ns 50. P. 259-267.
- Baun G.M., Porter J.M. Vasodilating agents in peripheral arteriosclerotic disease // Vascular surgery. Philadelphia, 1984. P. 328-331.
- Иванов С.В., Кудряшев В.Е., Белецкий Ю.В., Золичев Г.Е. Диагностика и оценка тяжести артериальной недостаточности нижних конечностей методом ультразвуковой флоуметрии в тредмил- тесте // Вестн. хир. им. И.И.Грекова. 1990. Ns 2. С. 47-51.
- Arfvidsson В., Wennmmalm A., Gelin J., Dahllof A., Jundholm К. Co-variation between walking ability an circulatory arterations in patients with intermittent claudication //Angiology. 1993. № 44. P. 1-10.
- Затевахин И.И., Цициашвили М 111., Золкин В.Н., Юдин Р.Ю. Использование тредмил-теста в диагностике и лечении хронической артериальной недостаточности (обзор литературы) II Ангиология и сосудистая хир. 1997. Ns 1. С. 141-145.
- Fontaine R. Les obliterations femoro-poplitees d'origine arteriosclereuse // J. Chiz. 1972. V. 104. Ns 6. P. 505-524.
- Хабазов Р.И. Лечение больных с «критической ишемией» нижних конечностей // Автореф. дисс. ... канд. мед. наук. М. 1987.
- Агаджанова Л.П. Программа ультразвукового обследования больных с хронической ишемией нижних конечностей в условиях современного ангиохирургического центра // Хирургия перитонита. Ультразвук в хирургии. Омск, 1986. С. 160-162.
- Barber F.E., Baker D.W., Nation A.W.S., Strandness D.E., Ried J.M. Ultrasound duplex echodoppler scanner// JEEE. Transactions on Biomedical Engineering. 1974 Ns 21. P. 109-113.
- Strandness D.E. Echo-Doppler (duplex) ultrasonic scanning // J. Vase. Surg. 1985. № 2. P. 341-344.
- Monetc G.L., Yeager R.A., Lee R.W., Porter J.M. Noninvasive localisation of arterial occlusive disease: A comparison of segmental Doppler pressure and arterial duplex mapping // J. Vase. Surg. 1993. Ns 17. P. 578-582.
- Ильинский О.Э., Швальт П.Г. Дуплексное сканирование - основной диагностический метод в определении показаний к операциям в регионе глубокой артерии бедра II Ангиол. и сосудистая хир. 1996. Ns 2. С. 18-23.
- Jager К.А., Phillips D.J., Martin R.L. et ai. Noninvasive mapping of lower limb arterial lesions // Ultra sound Med. and Biol. 1985. Ns 5. P. 515-521.
- Эльсман Б.Х.П., Экельбоум Б.К., Легемэйт Д.А., Майер Р. Цветовое дуплексное сканирование при заболеваниях артерий нижних конечностей // Ангиол. и сосудистая хир. 1996. Ns 1. С. 20-31.
- Mitchell D.G. Color Doppler Imaging Principles Limitations and artifacts II Radiology. 1990. Ns 177. P. 1-10.
- Johnston K.W., Maruzzo B.S., Cobbolt R.S.C. Errors and artifacts of Doppler flowmeters and Their solution //Arch. Surg. 1977. Ns 112. P. 1335-1342.
- Jaffe C. Doppler Application and Limits of the Method //Vascular and Doppler Ultrasound / Ed. C. Jaffe. N.Y., 1984. P. 1-10.
- Sumner D.S. Volume plethysmography in vascular disease: an overview II Noninvasive diagnostic techniques in vascular disease I Ed. E.R Bernstein. St. Louis: The C.V. Mosby Company, 1985. P. 97-118.
- Raines J.K. The pulse volume recorder in peripheral arterial disease // Noninvasive diagnostic techniques in vascular disease / Ed. E.R Bernstein. St. Louis: The C.V. Mosby Company, 1985. P. 563-574.
К главе 17
- Савельев B.C. Флебология. M.: Медицина, 2001. 660 с.
- Гейман Д.В К вопросу о клапанной системе вен нижних конечностей // Хирургия 1948. № 6. С. 32-40.
- Костромов И.А. Коммуникационные вены нижних конечностей и их значение в патогенезе варикозной болезни II Врачебное дело. 1951. № 1. С. 33-38.
- Червяков И.В. Диагностика недостаточности коммуникантных вен нижних конечностей // Вестник хирургии. 1973. Ns 8. С. 63-65
- Банков В.Н. Строение вен. М., 1974. С. 7-9.
- Fegan G. Variicose Veins. L. 1967. 89 p.
- Волчал Б.Е. Проблема венозного тонуса. М., 1966. С. 13-17
- Вельдман В.А. Заболевание венозный сосудистой системы. Л., 1967. С. 37-39.
- Данилов Н.В. Об активной функции вен // Вопр. коронарной и легочной патологии. Ростов-на- Дону, 1967. С. 28-30.
- Мамамтавришвили Д.Г. Болезни вен. М., 1964. С. 11-13.
- Куприянов В.В. Пути микроциркуляции. Кишинев, 1969. С. 23-27.
- Ludbrook J. Functional aspects of the veins of the Irg //Am. Heart J. 1966 V. 64, P 706-713
- Савельев B.C., Яблоков Е.Г. Кириенко А.И Тромбоэмболия легочных артерий. М Медицина, 1979 263 с
- Савельев B.C. Послеоперационные венозные тромбоэмболические осложнения: фатальная неизбежность или контролируемая опасность? // Хирургия 1999 № 6. С. 60-63
- Савельев В. С. Настоящее и будущее флебологии в России // Флеболимфология 1S98. № 9 С 2-4
- Яблоков Е. Г. Кириенко А.И Богачев В.Ю. Хроническая венозная недостаточность М.' Берег. 1999. 128 с
- Веденский А. Н. Варикозная болезнь J1 . Медицина. 1983 71 с.
- Лелюк В. Г Лелюк С Э Ультразвуковая ангиология. М Реальное время 1999. 238 с.
- Зубарев А.Р., Григорян РА. Ультразвуковое ангиосканирование. М.: Медицина, 1991. 175 с.
- Зубарев А. Р., Богачев В.Ю. Митьков В.В Ультразвуковая диагностика заболеваний вен нижних конечностей. М. Видар, 1999 104 с
- Константинова Г.Д, Зайцева Л А. Зубарев А.Р. и др. Неинвазивные методы диагностики хронической патологии вен нижних конечностей // Кардиология. 1988. № 6. С 76-79
- Алекперова Т. В. Ультразвуковая флебография - опыт применения в современной флебологическои практике // Ангиология сегодня. 1999. № 9. С. 2-9.
К главе 18
- Heidrich Н., Cachovan М„, Greutzig A, Rieger Н Trampisch Н. Guidelines for therapeutic studies in Fontaines stages ll-IV periferai arterial occlusive disease //VASA 1995 V 24 P 114-119.
- Zwiebei W J. Introduction to vascular ultrasonography. 3 th edition Philadelphia London Toronto, Montreal, Sydney, Tokyo: W.B. Saunders company, 1992. 405 p
- Затевахин И.И., Цициашвили М.Ш Юдин РЮ. Тредмип в диагностике и лечении хронической артериальной недостаточности. М , 1999 87 с
- Иванов С,В Кудряшев В.Э., Белецкий Ю.В., Золичев Г.Е Диагностика и оценка тяжести артериальной недостаточности нижних конечностей методом ультразвуковой допплеровской флоуметрии в тредмил-тесте // Вестн.хирургии им. И.И. Грекова 1990. № 2. С. 47-50
- Иванов С В , Кудряшев В Э , Белецкий Ю В , Белов Ю.В. Функциональная классификация степени тяжести артериальной недостаточности нижних конечностей по результатам многоступенчатого тредмил-теста // Вестн. хирургии 1993 № 7. С 117-119.
- Иванов С В. Кудряшев В.Э Белецкий Ю.В, Леонова С Ф Допплерографические критерии определения анаэробного порога и ишемии нижних конечностей // Мед. техника. 1995 Ns 5 С. 3-6.
- Иванов С.В Количественная оценка артериальной недостаточности в задачах протезирования нижних конечностей, хирургической и терапевтической коррекции нарушений периферического кровообращения //Дис докт мед. наук. М., 1996. 315 с.
- Кудряшев В.Э., Иванов С В., Белецкий Ю.В Количественная оценка нарушений кровообращения (пробы с физической нарузкой). М.. Медицина, 2000. 220 с.
- Myocardial Infarction. How to Prevent, How to Rehabilitate. Geneva: WHO 1973. 164 p.
- Wasserman K., Hansen J. Sue D., Cassaburi R Wipp В. Principles of Exercise Testing and Interpretation. 3 edition Philadelphia, Baltimore, New York, London Buenos Aires, Hong Kong Sydney Tokyo, 1999 556 p.
- Fontaine R. Les obliterations femoro-poplitiees о origine artemosklereuse//J. Chir Paris, 1972 V. 104. № 6. P. 505-524.
- Покровскии А.В. Клиническая ангиология М: Медицина, 1979, 340 с
- Иванов С.В., Кудряшев В.Э., Кириченко А.А. и др. Оценка фармакологической терапии периферической артериальной недостаточности с помощью многоступенчатого тредмил-теста // Ангиология и сосудистая хирургия. 1996. № 2. С. 62-67.
- Иванов С.В., Кудряшев В.Э., Андреева Е.В., Родников В.Ф. Оценка тяжести артериальной недостаточности культи нижней конечности (окклюзионная проба и тредмил-тест) // Ангиология и сосуд, хирургия. 1995. № 3. С. 113-118.
- Кудряшев В.Э., Иванов С.В., Иванов A.M., Белецкий Ю.В. и др. Очерки клинической физиологии в протезировании. Оценочные методы. М., 1997. 132 с.
- Иванов С.В., Уткин А.А. Влияние электростимуляции мышц при ходьбе на состояние периферического кровообращения культи бедра и сохранившейся конечности // Реабилитация инвалидов с культей бедра посредством программируемой электростимуляции мышц при ходьбе / Под редакцией А.С. Витензона. М.: Зеркало, 2001. С. 157-168.
Предметный указатель
|
А |
Б |
|
Акустическим импеданс среды 15 |
Безопасность УЗ-аппаратуры 57 |
|
Анализ допплерограммы 27 |
Бляшка атеросклеротическая 99, 123-124 |
|
Анастомоз 78 |
Бляшки |
|
Аномалии 179 |
- гетерогенные 123 |
|
- Арнольда-Киари 172, 179 |
- гомогенные 123 |
|
- Киммерле 172, 176, 179 |
- исследование в |
|
Артериальная гипертензия 134 |
- - В-режиме 61 |
|
Артериальный круг большого мозга (виллизиев |
--ЦДК 114 |
|
круг) 79 173 |
--ЭДК114, 115 |
|
Артерия |
- классификация 123 |
|
- внутренняя сонная 78 |
-локализация 123 |
|
- глазная и ее вет ви 78 |
- морфология 123 124 |
|
- подключичная 75 |
- мягкая 124 |
|
- позвоночная 78 |
- осложненная 125 |
|
Артерии |
- плотная 123 |
|
- брюшного отдела аорты 301 302 |
Брюшная аорта и ее ветви 301 |
|
- - окклюзия 302 |
- аневризмы 304 |
|
- магистральные головы 79 |
- окклюзии 301 |
|
- - окклюзия 83 84 |
- стенозы 301 |
|
- - стеноз 84. 85-87 |
- трехмерная реконструкция 308 |
|
- нижних конечностей 372 |
|
|
- - окклюзия 388 |
В |
|
- - стеноз 388 | |
|
- основания мозга 99-101 |
Вена - верхняя полая 219 225 |
|
--окклюзия 108-110 | |
|
--стеноз 108-110 |
- воротная 312 |
|
- трехмерная реконструкция 324 326 |
- Галена 216 |
|
- почечные 325 329 |
- нижняя полая 315 |
|
- - окклюзия 329 |
- - тромбоз и экстравазальная |
|
- - стеноз 330 |
компрессия 309 315 |
|
Артерио-венозные мальформации 110 111 |
- синдром Бадда-Киари 315 |
|
Ауторегуляция 242 |
Венозная |
|
|
- ангиодистония 166 |
|
- дисциркуляция 161 |
- классификация 37, 196-197 |
| |
|
-дисгемия 161. 166, 170 |
- патологическая извитость 196 | ||
|
- - допплеровский паттерн 171 |
- хирургическое лечение 212, 303 | ||
|
- - клинические 170 |
Допплеровская тканевая визуализация 46 | ||
|
Вены |
Допплеровский сдвиг частот 12, 18, 20 | ||
|
- верхние глазные 223 |
Допплерограммы анализ 27 | ||
|
- нижних конечностей 415 |
- аускультативный 379 | ||
|
- - тромбоз 423 |
- качественный 27, 28, 80, 383 | ||
|
- брахиоцефальные 219 |
- количественный 27, 29 80, 383 | ||
|
- типы строения 218 |
- спектральный 27 | ||
|
- тромбоз и экстравазальная компрессия 222 |
Допплерометрия 362 | ||
|
- яремные 219, 229 |
Дуплексный режим 37 | ||
|
- мозговые 215, 216 |
Дуплексное сканирование (см. цветовое дуплексное сканирование) 39, 75, 114 | ||
|
- почечные 325 |
| ||
|
- - артерио-венозные фистулы 332 |
- артерий и вен нижних конечностей 405 | ||
|
- - тромбоз и экстравазальная компрес |
- диагностические критерии 409 | ||
|
сия 332 |
- магистральных артерий головы 79, 118 | ||
|
- шеи 222 |
- сосудов | ||
|
Вертебрально-базилярная недостаточность 172 |
- - брюшного отдела аорты 304 | ||
|
Внутричерепное давление 164 |
--дуги аорты 115 | ||
|
|
- - основания мозга 126 | ||
|
|
- - шеи 116 | ||
|
Гемодинамика |
3 | ||
|
- отдельных структур глаза 269 |
| ||
|
- при внутреннем эндометриозе 364 |
Задняя трифуркация 109 | ||
|
- при миоме матки 362 |
Золотой стандарт в ангиологии 372, 406 | ||
|
- яичников 358 |
| ||
|
Гидроцефалия 160 |
И | ||
|
Гипоплазия артерий 329 |
| ||
|
Глазной анастомоз 78 |
Измерительный объем (см. Контрольный измерительный объем) 31, 35, 36 | ||
|
|
Измеритель потока крови с непрерывным излучением 19, 25, 26 | ||
|
Д |
| ||
|
|
| ||
|
Давление |
Импульсный допплеровскии прибор 20 | ||
|
Индекс | |||
|
- артериальное 392 |
- вазомоторной реактивности 249 | ||
|
- - асимметрия 88 |
- давления 394 | ||
|
- - градиент 87, 392 |
- реактивности при 247 | ||
|
- - компрессионное 397 |
- - апноэтической нагрузке 248 | ||
|
- - сегментарное систолическое 392 |
- - гиперкапнической нагрузке 248 | ||
|
- внутричерепное 244 |
- - гипокапнической нагрузке 249 | ||
|
- пальцевое 395 |
Индекс | ||
|
- сегментарное систолическое 379 |
- процент стеноза (STI) 29, 63 | ||
|
Деформации артерий 87, 196 |
- пульсации (PI) 29 | ||
К Каротидно-кавернозное соустье 277 Качественный анализ допплерограмм артерий нижних конечностей 383 Количественный анализ допплерограмм артерий нижних конечностей 383 Контрольный измерительный объем 31, 35, 36 Коэффициент овершута 250 Кровоток
большого мозга 94, 95
|
Л Локация артерий нижних конечностей 379 М «Манжеточное сдавливание» мостиковых вен 171 Математическая модель кровообращения 55 Мезенхимальная дисплазия 168 Мигрень 131, 176 Микроэмболия сосудов мозга 114, 181 Многооконный режим 51 Мобильная нейродиагностическая бригада 259 Мозговой кровоток 258 Молочная железа 283
Н Неспецифический аортоартериит 303, 377 Нейросонография 140
О Окклюзия
|
| |
Опухоли глаза 279 Острая ишемия нижних конечностей 377, 434 Ошибки техники исследования и диагностики при поражении 410
П Перегибы и извитости артерий (см. деформации) 87 Передняя трифуркация 104 Перемежающаяся хромота 379 Перинатальные поражения 146, 154
Перфузионное давление 243 Подключичный стил-синдром 88, 89 Портальная гипертензия 310 -диагностика методом ЦДС 311, 313 Поджелудочная железа 315 Половой член 347
|
Р Рак поджелудочной железы 315
С Сегменты сосудов нижних конечностей 373 Семенные пузырьки 339 Синдром
Стеноз артерий
|
|
|
Т Тест
сти 399
-интраоперационный 192 Трехмерная эхография 65 Триплексный режим 36, 118 Тромбоз
У Ультразвуковая ангиография 62 УЗИ структур глаза 269, 271 Ультразвуковая допплерография 12, 61 Ультразвуковые контрастные вещества 67 Ультразвуковые окна
|
-субокципитальное 99 Ф Функциональные пробы для артерий нижних конечностей (см. Тест для артерий нижних конечностей) 398 Фурье быстрое преобразование 21 Ц Цветовое допплеровское картирование 23, 36, 43, 46, 61, 62 Цветовое дуплексное сканирование (см. цветовая допплеровская сонография) 39-41
Э Экстра-интракраниальный анастомоз (ЭИКМА) 131 Элайзинг (aliasing) 38, 63 Эмболия сосудов мозга 181 -детекция микроэмболов 181
-- при ПНМК и ишемическом инсульте 144 Эндартериит 377 Энергетическое допплеровское картирование 43, 44, 63 Эффект Допплера 11, 12, 18 |




