Основы взаимодействия ультразвука с биологическими объектами
Под редакцией доктора технических наук, профессора С.И. Щукина
Авторы: Акопян Б.В., Ершов Ю.А.
ОГЛАВЛЕНИЕ
1. Физическая химия и биофизика ультразвука
1.5. Искажение формы ультразвуковой волны в реальных условиях
1.7. Коллоидный вибропотенциал в механизме биологического действия ультразвука
1.9. Ультразвуковые химические реакции
1.11. Влияние ультразвука на воду вводные растворы
1.12. Ультразвуковая кавитация в биологических средах
1.12.1. Кавитация в суспензиях клеток
1.12.2. Кавитация в тканях иод действием низкочастотного ультразвука
1.12.3. Кавитация в тканях под действием высокочастотного ультразвука
1.12.4. Кавитация в тканях под действием «диагностического» ультразвука
1.15. Визуализация ультразвукового ноля
2. Ультразвуковые методы диагностики
2.1.3. Одномерная эхолокация движущихся структур
2.1.4. Доплеровские методы в ультразвуковой диагностике
2.1.5. Трехмерные и движущиеся трехмерные изображения
2.2. Ультразвук в диагностике состояния костной ткани
2.3. Ультразвуковой метод оценки вязкоупругих свойств мягких тканей
2.4. Методы ультразвуковой цитолизометрии
2.5. Сонолюминесценция и ультразвуковой диагностике
3. Основы ультразвуковой стимуляции и ультразвуковой терапии
3.1. Организм - биологическая система
3.2. Влияние ультразвука па биомакромолекулы в растворах
3.3. Функциональные и морфологические изменения в клетках
3.3.1. Действие ультразвука на внутриклеточные структуры
3.3.2. Последействие ультразвука на жизнедеятельность клетки
3.3.3. Ультразвуковое воздействие на деление клеток
3.3.4. Хромосомные аберрации, индуцируемые ультразвуком
3.3.5. Комбинированное действие ультразвука и некоторых других физико-химических факторов на клетки
3.3.6. Разрушение клеток под действием ультразвука
3.3.7. Механизмы биологического действия ультразвука
3.4. Действие ультразвука на многоклеточные системы
3.4.1. Пороги биологического действия ультразвука
3.4.2. Ультразвуковые эффекты в мягких тканях
3.4.3. Действие ультразвука на кровь
3.4.4. Клеточные мембраны в механизме биологического действия ультразвука
3.4.5. Системная реакция организма на ультразвуковое воздействие
3.5. Ультразвук в физиотерапевтической практике
3.5.1. Общая неспецифическая стимуляция методом ультразвуковой аутогемотерапии
3.5.2. Действие ультразвука на биологически активные точки
3.5.3. Стимуляция и подавление воспроизводительных функций животных
3.5.4. Лечение заболеваний опорно-двигательного аппарата
3.5.5. Ультразвуковая терапия поражений покровных тканей
3.5.6. Влияние ультразвука на молочную железу и лечение ее заболеваний
3.5.7. Ультразвук в офтальмологии
3.5.8. Влияние ультразвука на внутренние органы
4.1. Инструментальная ультразвуковая хирургия
4.1.1. Принцип действия ультразвуковых инструментов
4.1.2. Влияние ультразвукового хирургического инструмента на рассекаемую ткань
4.2. Хирургическое воздействие фокусированным ультразвуком на внутренние структуры организма
4.2.1. Фокусирование ультразвука
4.2.2. Биологическое действие фокусированного ультразвука
4.2.3. Использование фокусированного ультразвука в экспериментальной биологии и медицине
5.1. Ультразвук в пищевом машиностроении
5.2. Приборы ультразвукового контроля
5.2.1. Определение содержания белка, жира и минеральных веществ в биологических средах
5.2.2. Определение качества мяса в процессе его созревания
5.4. Ультразвуковая интенсификация производственных процессов
5.5. Ультразвук в производстве кормов (предпосевная стимуляция семян ультразвуком)
5.6. Применение ультразвука в медицинской и ветеринарной биотехнологии
5.6.1. Ультразвук в криобиологии и криоконсервировании
5.6.2. Влияние ультразвука на биосинтез интерферона
5.6.3. Стимуляция роста клеток в культуре
5.6.4. Прединкубационная обработка яиц ультразвуком и введение лекарственных веществ через неповрежденную скорлупу
5.6.5. Снижение уровня иммунологической специфичности клеток
5.7. Получение кормовых добавок с помощью ультразвука
6.1. Интенсификация процессов приготовления лекарств
ВВЕДЕНИЕ
Ультразвуковая техника начала развиваться во время Первой мировой войны. Именно тогда, в 1914 г., испытывая в большом лабораторном аквариуме новый ультразвуковой излучатель, выдающийся французский физик-экспериментатор Поль Ланжевен обнаружил, что рыбы при воздействии ультразвука забеспокоились, заметались, затем успокоились, но через некоторое время стали гибнуть. Так случайно был проведен первый опыт, с которого началось исследование биологического действия ультразвука.
В конце 20-х годов XX в. были сделаны первые попытки использовать ультразвук в медицине. А в 1928 г, немецкие врачи уже применили ультразвук для лечения заболеваний уха у людей. В 1934 г. советский отоларинголог Е.И. Анохриенко ввел ультразвуковой метод и терапевтическую практику и первым в мире осуществил комбинированное лечение ультразвуком и электрическим током. Вскоре ультразвук стал широко применяться в физиотерапии, быстро завоевав главу весьма эффективного средства.
Прежде чем применить ультразвук для лечения болезней человека, действие его тщательно проверяли па животных, но новые методы в практическую ветеринарию пришли уже после того, как нашли широкое применение в медицине. Первые ультразвуковые аппараты были весьма дороги. Цена, конечно, не имеет значения, когда речь идет о здоровье людей» но в сельскохозяйственном производстве с этим пригодится считаться, поскольку оно не должно быть убыточным.
Первые ультразвуковые лечебные методы основывались на чисто эмпирических наблюдениях, однако параллельное развитием ультразвуковой физиотерапии разворачивались исследования механизмов биологического действия ультразвука. Их результаты позволяли вносить коррективы в практику применения ультразвука.
В 1940-1950 годах, например, полагали, что в лечебных целях эффективен ультразвук интенсивностью до 5…6 Вт/см2 или даже до 10Вт/см2. Однако вскоре применяемые в медицине и ветеринарии интенсивности ультразвука стали уменьшаться. Так в 60-е годы XX в. максимальная интенсивность ультразвука, генерируемого физиотерапевтическим и аппаратами, уменьшилась до 2...3 Вт/см2, а выпускаемые в настоящее время аппараты излучают ультразвук с интенсивностью, не превышающей 1 Вт/см2. Но сегодня в медицинской и ветеринарной физиотерапии чаще всего используют ультразвук с интенсивностью 0,05...0,5 Вт/см2.
Создание электронных быстродействующих импульсных систем обработки радиолокационных сигналов в период Второй мировой войны стимулировало развитие ультразвуковой диагностики. В настоящее время ультразвуковое обследование ежегодно проходят около 60млн пациентов. В ветеринарной практике ультразвуковые методы позволяют проводить раннюю диагностику беременности животных, определять толщину жира и мышц, визуализировать внутренние органы и т, д.
Около 40 лет насчитывает история ультразвуковой хирургии, основанной на результатах исследований и разработок советских ученых. Сегодня ультразвуковые скальпели и специальные ультразвуковые инструменты широко используются для рассечения мягких, хрящевых и костных тканей, для удаления катаракты и лишних жировых отложений, для санации ран и полостей. Фокусированный ультразвук успешно применяется для разрушения опухолевых образований в глубине организма без нарушения целостности покровных тканей, для раздражения или разрушения отдельных нервных структур и т. д.
Ультразвуковые методы стали настолько привычными, что в последнее время в продаже появились домашние ультразвуковые приборы для лечения «от всех болезней, для глубокого массажа, для стирки белья, для отпугивания грызунов и пр. Некоторые из них в принципе не могут обеспечить обещанный и рекламных проспектах эффект, применение других для самолечения просто опасно, так как при неправильном применении они могут нанести вред организму.
Многие ультразвуковые методы, прочно занявшие свое место в медицине, уже используются в практической ветеринарии, другие, разработанные и опробованные, по разным причинам еще не нашли широкого распространения. Об одних пока еще мало знают специалисты, применение других задерживается из-за высоких (для сельскохозяйственного производства) цен на современное ультразвуковое оборудование.
В лабораториях научно-исследовательских учреждений создаются новые методы, цель которых - упростить методы и существенно сократить сроки лечения человека и животных, увеличить продуктивность животных, улучшить условия труда врачей и ветеринарных специалистов. Исследования дают новые результаты, и не исключено, что, воздействуя ультразвуком на отдельные участки мозга и биологически активные точки животных, человек в будущем сможет управлять их поведением и регулировать их продуктивность.
В прошлые годы было издано немало книг, посвященных применению ультразвука в медицине, и лишь единицы, в которых рассматривались вопросы использования ультразвуковых методов в ветеринарной практике и биотехнологии. В большинстве из этих книг основное место занимает описание экспериментальных данных.
В предлагаемом учебном пособии предпринята попытка с позиций современной биофизической акустики проанализировать результаты многочисленных исследований и практического использования ультразвука в медицине и ветеринарии, а также показать пути оптимизации известных ультразвуковых методов и возможности новых областей применения ультразвука в диагностике, хирургии, терапии. Рассмотрены также задачи биотехнологии, экологии, кормопроизводства, фармации, которые эффективно решаются с использованием ультразвуковых методов.
Ввиду отсутствия специальных учебных курсов или даже разделов по биофизике ультразвука и ультразвуковым методам, а также учебных пособий и справочной литературы по этой теме потребовалось введение в книгу разделов, посвященных элементам физики ультразвука, взаимодействию ультразвука со средой, механизмам его биологического действия.
Данное учебное пособие призвано помочь будущему исследователю, инженеру и врачу лучше разобраться в механизмах лечебного действия ультразвука, глубже понять возможности диагностических ультразвуковых методов, природу ультразвукового ускорения биотехнологических процессов и т. д. Тема находится на стыке ряда научных дисциплин, где нередко одни и те же термины обозначают разные понятия. Не установилась окончательно терминология и в бурно развивающейся биофизике ультразвука.
Поскольку достаточно подробно осветить материалы всех предшествующих работ не представлялось возможным из-за ограниченности объема, в книге приведены ссылки на публикации, обобщающие результаты оригинальных приоритетных исследований, или аналитические обзоры.
Учебное пособие рекомендовано студентам и аспирантам, изучающим курс «Биомедицинская техника», а также специалистам, работающим в области ультразвуковой физиотерапии, хирургии, диагностики, биотехнологии, экологии, физикам-акустикам, биофизикам, физиологам, инженерам-исследователям, разработчикам ультразвуковой аппаратуры.
Авторы выражают глубокую признательность рецензентам - доктору химических наук, профессору И.Л. Крылову и доктору химических наук, профессору Н.В. Макарову.
1. ФИЗИЧЕСКАЯ ХИМИЯ И БИОФИЗИКА
УЛЬТРАЗВУКА
Раздел физики, посвященный получению, распространению и взаимодействию с веществом ультразвуковых, звуковых и инфразвуковых волн, называется акустикой7 а эти волны - акустическими.
Ультразвук - колебания и волны в упругих средах г частотой, превышающей верхнюю границу слышимого звука.
Но своей природе ультразвуковые волны не отличаются от звуковых, а также инфразвуковых волн, имеющих частоту ниже нижней границы слышимого звука.
Деление на ультразвук, звук и инфразвук условно. В основе такого деления - свойство человеческого уха воспринимать упругие колебания среды только в ограниченном диапазоне частот.
1.1. ВОЛНЫ В УПРУГИХ СРЕДАХ
Акустические волны способны распространяться в средах, состоящих из упругого вещества. Упругость обеспечивает возвращение в исходное положение частиц среды, смещенных под воздействием каких-либо внешних сил.
Если поршень в упругой среде сместить па небольшое расстояние, то слой вещества перед поршнем, испытывая давление, сожмется, а затем начнет расширяться, сдавливая соседний слой, тот, в свою очередь, расширяясь сдавит следующий слой. В результате в среде возникает последовательность сжатий и разрежений, которые и представляют собой акустические волны, распространяющиеся в среде и передающие все новым и новым слоям вещества возмущение, возникающее у поршня (рис. 1.1). Частицы среды при этом не переносятся в направлении распространения волн, а лишь колеблются около положения равновесия.
Волны называются продольными, если направление колебаний частиц совпадает с направлением распространения волн. Если эти направления взаимно перпендикулярны, то волны называются поперечными.
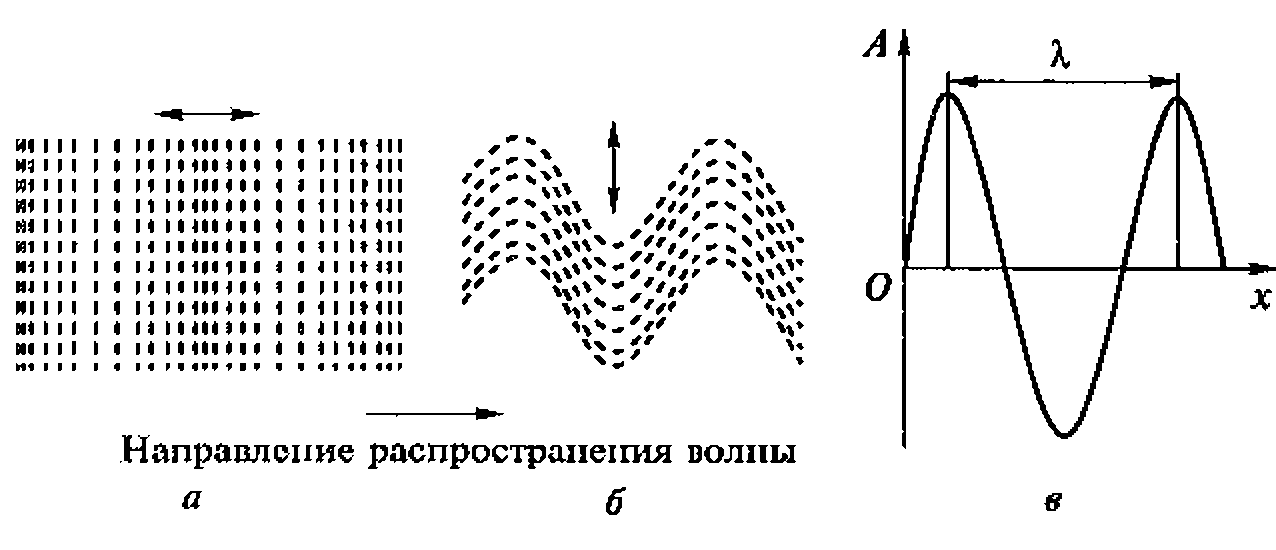
Рис. 1.1. Акустические упругие волны в среде:
а - продольные; б - поперечные; в - графическое изображение полны; стрелки и ![]() и
и ![]() указывают направление колебания частиц
указывают направление колебания частиц
Если амплитуда колебания частиц в волне невелика и не меняется со временем, в среде распространяется плоская акустическая полна, которая описывается уравнением
![]()
где s - смещение частицы среды от положения равновесия;
А - максимальное смещение частицы относительно положения равновесия (амплитуда);
t - время;
х - положение частицы на оси координат, в направлении которой распространяется волна;
- - циклическая частота колебаний,
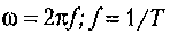 - частота колебаний (число колебаний за единицу времени), Т - период колебания;
- частота колебаний (число колебаний за единицу времени), Т - период колебания;
![]() - волновое число, где
- волновое число, где ![]() - длина волны (расстояние между двумя соседними сжатиями или разрежениями);
- длина волны (расстояние между двумя соседними сжатиями или разрежениями);
![]() - начальная фаза.
- начальная фаза.
Движение частиц, описываемое приведенной формулой, подчиняется синусоидальному закону и называется гармоническим колебанием.
В газообразных и жидких телах, и том числе и в мягких тканях животных, содержащих до 75 % воды, распространяются продольные волны. Исключение составляют волны на поверхности жидкостей. В твердых телах, в частности в костях скелета человека и животных, наряду с продольными, могут возникать и поперечные, сдвиговые волны.
Частота колебаний ![]() измеряется в герцах. Один герц равен одному колебанию в секунду. Для удобства пользуются кратными единицами измерения: 1000 Гц= 103 Гц = 1 кГц; 1000000 Гц - 106 Гц = 1 МГц; 103 МГц - 1 ГГц (гигагерц).
измеряется в герцах. Один герц равен одному колебанию в секунду. Для удобства пользуются кратными единицами измерения: 1000 Гц= 103 Гц = 1 кГц; 1000000 Гц - 106 Гц = 1 МГц; 103 МГц - 1 ГГц (гигагерц).
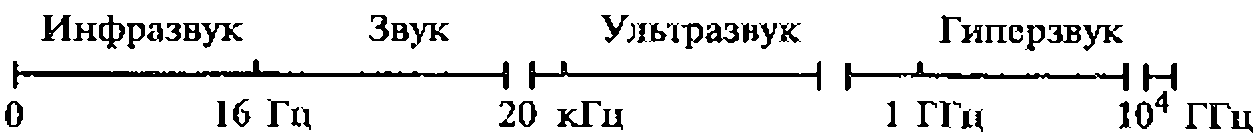
Рис. 1.2. Условное деление акустических колебаний и вола на диапазоны
В зависимости от частоты акустические колебания делят на несколько диапазонов (рис. 1.2).
Границы, разделяющие отдельные диапазоны акустических колебаний, достаточно условны. Граница между звуком и ультразвуком, например, зависит от индивидуальных особенностей человеческого слуха. Одни люди не слышат звуки с частотой и 10 кГц, другие могу т воспринимать звуки с частотой до 25 кГц.
Многие животные слышат звуки значительно более высоких частот, чем человек. Собаки улавливают звуковые колебания до 44кГц, крысы - до 72 кГц, летучие мыши - до 115 кГц. Верхняя граница звукового восприятия в определенной степени зависит от расстояния между ушами. Чем ближе уши, тем более высокие звуки различает животное. Слон, например, ощущает звуковые колебания только до 12 кГц.
Верхняя граница ультразвукового диапазона обусловлена физической природой упругих волн, которые могут распространяться в среде лишь при условии, что длина волны больше средней длины свободного пробега молекул в газах или межмолекулярных (межатомных) расстояний в жидкостях и твердых телах. Исходя из этого, нетрудно рассчитать, что верхняя граница ультразвукового диапазона в газах составляет около 1 ГГц (109 Гц), а в твердых телах - примерно 1013 Гц.
Ультразвук с частотой более 1 ГГц иногда выделяют в отдельный диапазон и называют гиперзвуком.
Очевидно, что скорость частицы, совершающей гармонические колебания, также меняется по гармоническому закону. Нетрудно показать, что амплитуда колебательной скорости - максимальная скорость, с которой движутся частицы среды при колебаниях ![]() . При этом скорость движения колеблющейся частицы периодически меняется с той же частотой от 0 до vm. Аналогично меняется и ускорение движения частицы. При этом амплитуда ускорения
. При этом скорость движения колеблющейся частицы периодически меняется с той же частотой от 0 до vm. Аналогично меняется и ускорение движения частицы. При этом амплитуда ускорения ![]() .
.
Вышеприведенный пример с поршнем показывает, что возмущение от частиц, колеблющихся в каждом слое около положения равновесия, передается от слоя к слою по направлению распространения волны х. Таким образом, в акустической волне происходит перенос энергии без переносу вещества.
где ![]() - плотность жидкости;
- плотность жидкости;
В твердых телах скорость продольных волн равна:
![]()
![]() - коэффициент адиабатической сжимаемости, равный относительному изменению объема
- коэффициент адиабатической сжимаемости, равный относительному изменению объема ![]() при изменении давления на
при изменении давления на ![]() . Коэффициент
. Коэффициент ![]() рассчитывают по формуле
рассчитывают по формуле
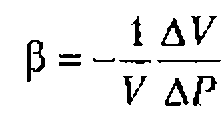
где Е модуль Юнга, характеризующий упругие свойства вещества.
Скорость распространения упругих (акустических) воли в воздухе при 25°С составляет 333 м/с, в воде и мягких биологических тканях - около 1500 м/с, в костной ткани - примерно 3500 м/с.
Скорость распространения упругой волны практически не зависит от частоты и связана с длиной волны ![]() простым соотношением:
простым соотношением:
![]()
т. е. чем больше частота ![]() , тем меньше длина волны.
, тем меньше длина волны.
Так, при распространении в воде ![]() 1500 м/с) ультразвука с частотой 1 МГц длина его волны
1500 м/с) ультразвука с частотой 1 МГц длина его волны ![]() , составит 1,5
, составит 1,5![]() 10 3 м, или 1,5 мм.
10 3 м, или 1,5 мм.
Благодаря малым длинам волн ультразвук распространяется в среде, подчиняясь законам геометрической оптики. Так же, как и свет, ультразвук распространяется прямолинейно в однородной среде, отражается и преломляется на границах сред с разными акустическими свойствами. Его можно фокусировать, используя линзы и сферические зеркала.
Пространство, заполненное веществом, в котором распространяется акустическая волна, называется акустическим полем.
Акустическое поле характеризуется переменным звуковым давлением в каждой точке и интенсивностью распространяющейся волны.
Периодические сжатия и расширения каждого слоя вещества, в котором распространяется упругая волна, можно рассматривать как результат действия переменного давления, амплитуда которою равна:
![]()
гдe ![]() i - амплитуда колебательной скорости частиц.
i - амплитуда колебательной скорости частиц.
Величина vm всегда значительно меньше скорости распространения самой волны с.
Величина ![]() характеризует рассеяние энергии волны в акустическом поле и называется акустическим сопротивлением среды. Единица
характеризует рассеяние энергии волны в акустическом поле и называется акустическим сопротивлением среды. Единица
измерения - кг/м2 . с.
Связь между акустическим сопротивлением, переменным акустическим давлением и амплитудой колебательной скорости можно представить в виде R = P/vm. Это выражение является акустическим аналогом закона Ома (Р - аналог электрического напряжения, а vm - силы тока).
Акустическая волна, распространяясь в среде, переносит с собой энергию.
Величина, численно равная энергии W, переносимой волной в единицу времени через единичную площадку, перпендикулярную направлению распространению волны, называется интенсивностью ультразвука, ![]() Единица измерения Вт/м2. Легко показать, что интенсивность плоской синусоидальной волны составляет;
Единица измерения Вт/м2. Легко показать, что интенсивность плоской синусоидальной волны составляет;
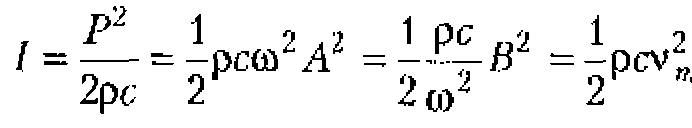
Из предыдущего выражения следует:
![]()
Таким образом, зная интенсивность ![]() волны, ее частоту
волны, ее частоту ![]() и акустическое сопротивление
и акустическое сопротивление ![]() среды, можно вычислить амплитуду А смещения частиц, их колебательной скорости vm, колебательного ускорения и переменного давления в плоской упругой волне.
среды, можно вычислить амплитуду А смещения частиц, их колебательной скорости vm, колебательного ускорения и переменного давления в плоской упругой волне.
Так, в ультразвуковой волне с частотой 1 МГц, распространяющейся в воде или средах с близким акустическим сопротивлением, при интенсивности Вт/м2 (1 Вт/см2) частицы колеблются с амплитудой А = 0,02 мкм, амплитуда скорости колеблющихся частиц достигает 0,1 м/с, а ускорение - 700 м/с2 , что примерно в 70 раз превышает ускорение свободного падения тел на Земле. Амплитуда акустическою давления в ультразвуковой волне при этих условиях оказывается равной 1,8 . 105 Па (~1,8 атм).
Приведенные цифры, однако, ничего не говорят о воздействиях на биологическую клетку в звуковом поле. Значения этик воздействий нетрудно определить, учитывая размер клетки и то, что расстояние, на которое приходится максимальная разность величин, характеризующих ультразвуковую волну, равно половине длины волны ![]() /2 . Полагая, что смещение, скорость, ускорение и давление линейно меняются в зависимости от расстояния на отрезке
/2 . Полагая, что смещение, скорость, ускорение и давление линейно меняются в зависимости от расстояния на отрезке ![]() /2, можно оценить их градиенты:
/2, можно оценить их градиенты:
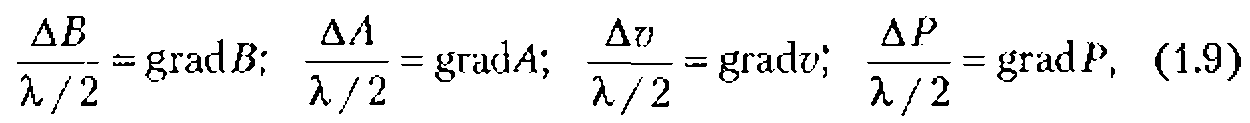
где ![]() - амплитуды смещений, скоростей, ускорений и давлений на отрезке длиной
- амплитуды смещений, скоростей, ускорений и давлений на отрезке длиной ![]() /2.
/2.
Умножая grad A, grad v, grad В и grad Р на размер клетки, получают соответственно разность смещения, скорости, ускорения и давления на расстоянии, равном размеру клетки.
Согласно приведенным формулам, при частоте ультразвука 1 МГц и интенсивности 1 Вт/см2 амплитуда смещения в биологических средах А ![]() 2 -10-6 см, grad А
2 -10-6 см, grad А ![]() 8 . 10-5. При таких условиях каждая клетка размером 5 . 10-3 см (например, эритроцит) периодически испытывает деформацию порядка 5 -10-7 см. Такая деформация по порядку величины совпадает с пороговыми смещениями, вызывающими появление импульсной биоэлектрической активности механорецепторов.
8 . 10-5. При таких условиях каждая клетка размером 5 . 10-3 см (например, эритроцит) периодически испытывает деформацию порядка 5 -10-7 см. Такая деформация по порядку величины совпадает с пороговыми смещениями, вызывающими появление импульсной биоэлектрической активности механорецепторов.
Экспериментально показано, что ультразвук вызывает возбуждение изолированных механорецепторов - телец Пачини при амплитуде переменных смещений А = 2 10~б см (0,4...2,5 Вт/см2; 0,48 МГц) и тактильные ощущения на руке человека при А ![]() 10 5 см (8...10 Вт/см2, 0,48 МГц). Из приведенных выше расчетов следует, что ультразвуковая волна (1 Вт/см2, 1 МГц) может оказывать заметное влияние по крайней мере на специализированные клетки - механорецепторы.
10 5 см (8...10 Вт/см2, 0,48 МГц). Из приведенных выше расчетов следует, что ультразвуковая волна (1 Вт/см2, 1 МГц) может оказывать заметное влияние по крайней мере на специализированные клетки - механорецепторы.
При тех же условиях (1 Вт/см2, 1 МГц) амплитуда vm переменной скорости примерно равна 12 ем/с, agradv 500 с-1 . Учитывая, что вязкость биологической среды в среднем в 25 раз выше вязкости воды, можно показать, что амплитуда сдвигового усилия, действующего на клетку, составит примерно 10 Н/м2, Эта величина намного меньше величины усилий, необходимых для разрушения клеток,
Эритроциты, например, при температуре, не превышающей 37°С, разрушаются при сдвиговых усилиях, превосходящих 40H/м2. Однако менее прочные структуры, по-видимому, могут испытывать существенные изменения и при значительно меньших усилиях. Так, тиксотропные явления в клетке - обратимые изменения вязкости при разрушении гелеобразной структуры - наблюдаются уже при интенсивностях ультразвука порядка 0,04 Вт/см2.
Амплитуда беременного ускорения в ультразвуковой волне с частотой 1 МГц и интенсивностью 1 Вт/см составит 700 м/с2 a grad В - 2,8 10-6с-2 Таким образом, разность ускорений противоположных полюсов клетки размером 5.10-3 см будет равна 1,4 -104 см/с2. Если предположить, что вся масса клетки разделена поровну и сконцентрирована на ее противоположных полюсах, то и тогда максимальная разность сил, приложенных к полюсам, составит 0,5.10-13 Н и очевидно не сможет сколько-нибудь заметно влиять на клетку. Следует отметить, что в реальных условиях при учете равномерного распределения массы клетки эта разность сил оказывается значительно меньшей.
Амплитуда звукового давления в этих условиях (1 МГц; 1 Вт/см2) составит 18 Н/м2, grad ![]() 2,6. 10-4 Н/м3, а амплитуда силы, действующей на клетку, будет равна 2 10-10 Н. Эта величина значительно меньше значений, характеризующих прочность клетки, и не окажет существенного влияния на ее структуру и функции.
2,6. 10-4 Н/м3, а амплитуда силы, действующей на клетку, будет равна 2 10-10 Н. Эта величина значительно меньше значений, характеризующих прочность клетки, и не окажет существенного влияния на ее структуру и функции.
Постоянное (радиационное) давление, возникающее в ультразвуковом поле за счет нелинейных эффектов, составит 10 Н/м2 при интенсивности ультразвука 1 Вт/см2 , т. с. сила, действующая на клетку, не превышает 10-7 Н.
Сравнение результатов расчетов показывает, что при интенсивностях ультразвука, используемых в физиотерапии, лишь смещения и сдвиговые усилия, возникающие в градиенте скорости, могут оказывать непосредственное влияние на клетку. Однако в некоторых условиях даже слабые радиационные силы способны обусловить определенные биологические эффекты, например образование сгустков крови в сосудах лягушки и куриного эмбриона.
Интервал интенсивностей ультразвука, применяемого в ветеринарной и биомедицинской практике, весьма широк: от 10-3 Вт/см2 в поле излучателей диагностических аппаратов, до 104 Вт/см2 в фокальной области фокусирующих излучателей, используемых для разрушения глубинных структур без повреждения окружающих тканей.
Общепринятый интервал интенсив посте й ультразвука, используемою в физиотерапии, -- 0,05... 1 Вт/см2, реже до 2,..3 Вт/см2. В исключительных случаях, например при лечении болезни Миньера или обеспложивания животных, интенсивности повышают до 10 Вт/см2, При интенсивностях ниже 0,05 Вт/см2 ультразвук практически неэффективен для лечения, а при интенсивностях, превышающих 1 Вт/см2, может вызвать нежелательные эффекты, такие, как подавление физиологических функций организма, перегрев тканей, деструкцию клеток и клеточных органелл.
В диагностических целях используют как непрерывный ультразвук низкой интенсивности, так и импульсный ультразвук довольно большой интенсивности, но с короткими импульсами и невысокой частотой их следования (табл. 1,1).
Имеются отдельные сообщения о применении в диагностике ультразвука значительно более высоких интенсивностей. Известен опыт использования для визуализации полостей во внутренних органах ультразвук с интенсивностью до 500Вт/см2 в импульсе. Однако такие попытки исключительны, так как возможная опасность применения ультразвука в диагностических целях обусловливает постоянную тенденцию к снижению его интенсивности.
Таблица 1.1
|
Методы |
Частота ультразвука, МГц |
Интенсивность в импульсе, Вт/см2 |
Частота следова- ния им- пульсов, кГц |
Длительность им- пульсов, МКС |
Усреднен- ная интен- сивность, мВт/см2 |
Полное время измерения, мин |
|
Импульсные методы эхографии и визуализации внутренних органов |
2-10 |
10-150 |
1-2 |
1-5 |
10-100 |
5-15 |
|
Методы, основанные на эффекте Доплера (непрерывный ультразвук) |
1-5 |
- |
- |
- |
50-500 |
1-5 |
Характерные параметры диагностического ультразвука
В зависимости от условий задачи и режима воздействия ультразвук характеризуют либо максимальной в облучаемом объеме (Space Peak - SP), либо усредненной по пространству (Space Average - SA) интенсивностью.
Аналогично ультразвук характеризуют максимальной при воздействии (Time Peak - TP) или усредненной по времени (Time Average - ТА) интенсивностью, а также интенсивностью, усредненной по пространству и времени (SATA), максимальной во времени и пространстве (SPTP), максимальной во времени, усредненной по пространству (SATP) или максимальной по пространству, усредненной по времени (SPTA).
Интенсивностью, усредненной по пространству (![]() ), называют величину, измеряемую отношением всей энергии переносимой за единицу времени через площадку, перпендикулярную распространению волны, ко всей поверхности этой площадки.
), называют величину, измеряемую отношением всей энергии переносимой за единицу времени через площадку, перпендикулярную распространению волны, ко всей поверхности этой площадки.
Очевидно, что на разных участках площадки интенсивность ультразвука может быть неодинаковой.
Так, перед центром плоских пьезокерамических излучателей, используемых в биомедицинской и ветеринарной практике, интенсивность обычно значительно выше, чем на краях излучателя, и в 3-4 раза выше (теоретически ![]() чем усредненная по пространству.
чем усредненная по пространству.
Интенсивностью, усредненной по времени 1(га), называют величину, измеряемую энергией} перенесенной через единичную, перпендикулярную направлению распространения волны площадку за единицу времени, без учета режима излучения.
Усредненная по времени интенсивность будет одинакова, если в течение первой половины секунды она вдвое превысит среднее значение, а в течение второй половины будет равна нулю, или если в течение секунды будет излучаться серия импульсов с суммарной энергией, равной энергии непрерывного излучения.
Нетрудно рассчитать, что при высокой интенсивности импульсов диагностического ультразвука усредненная по времени и пространству (SATA) интенсивность составит лишь тысячные доли Вт/см2. Это значение намного ниже значения интенсивностей, применяемых в терапии.
1.2. УЛЬТРАЗВУКОВОЕ ПОЛЕ
Решение ряда задач, связанных с практическим применением ультразвука, невозможно без знания характера акустического ноля, т.е. распределения в пространстве звукового давления или интенсивности.
Известно, например, что скорость разрушения клеток крови в суспензии под действием ультразвука зависит от его интенсивности. Однако даже плоский излучатель, используемый в установке для определения скорости ультразвукового цитолизиса, дает весьма неоднородное поле.
В медицине, ветеринарии и экспериментальной биологии нашел широкое применение плоский высокочастотный излучатель. Для практических целей можно принять, что амплитуда колебаний на его поверхности всюду постоянна, а диаметр D намного больше длины ультразвуковой волны. Идеализированная форма звукового поля этого излучателя представлена на рис. 1.3.
Вблизи поверхности плоского высокочастотного излучателя ультразвуковое поле сосредоточено в цилиндрическом объеме диаметром D и длиной Z0.
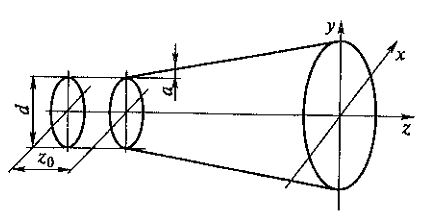
Рис. 1.3. Идеализированное поле плоского акустического излучателя
Начиная с расстояния Z0 = D/![]() , поле конусообразно расширяется. Интервал от излучателя до Z0 называется ближней зоной, или зоной Френеля. Область, где Z > Z0, называется дальней зоной, или зоной Фраунгофера. В этой зоне амплитуда давления падает пропорционально расстоянию от излучателя. Угол
, поле конусообразно расширяется. Интервал от излучателя до Z0 называется ближней зоной, или зоной Френеля. Область, где Z > Z0, называется дальней зоной, или зоной Фраунгофера. В этой зоне амплитуда давления падает пропорционально расстоянию от излучателя. Угол ![]() между направлением распространения ультразвуковой волны и образующей пучка определяется условием
между направлением распространения ультразвуковой волны и образующей пучка определяется условием
![]()
Для круглой пластинки А = 1,22, D - диаметр круга; для квадратной пластинки A = 1, D сторона квадрата.
Распространено представление о плоском характере волны в ближней зоне. В действительности поле в этой зоне имеет весьма сложный характер, что объясняется наложением волн, излучаемых отдельными участками поверхности излучателя. Анализ показывает, что интенсивность ультразвука в ближней зоне периодически меняется в интервале от излучателя до Z0 (рис. 1.4). Последний максимум находится на расстоянии Z0. Далее амплитуда звукового давления монотонно уменьшается.
Распределение интенсивности ультразвука в поперечном к оси сечении также неоднородно и зависит от расстояния до излучателя.
В ближней зоне, при Z < Z0, интенсивность может иметь несколько максимумов. В дальней зоне, при Z > Z0, интенсивность имеет один максимум и монотонно надает по мере удаления от оси пучка.
Эти зависимости легко проверить, измеряя, например, распределение интенсивности вдоль диаметра плоского круглого излучателя, излучающего ультразвук в воду или другую жидкость.
Следует отмстить, что распределение интенсивностей в плоскостях, перпендикулярных к направлению распространения ультразвуковых волн, будет меняться в зависимости от расстояния до излучателя, однако характер этого распределения сохранится, по крайней мере, на расстояниях, сравнимых с диаметром излучающей поверхности.
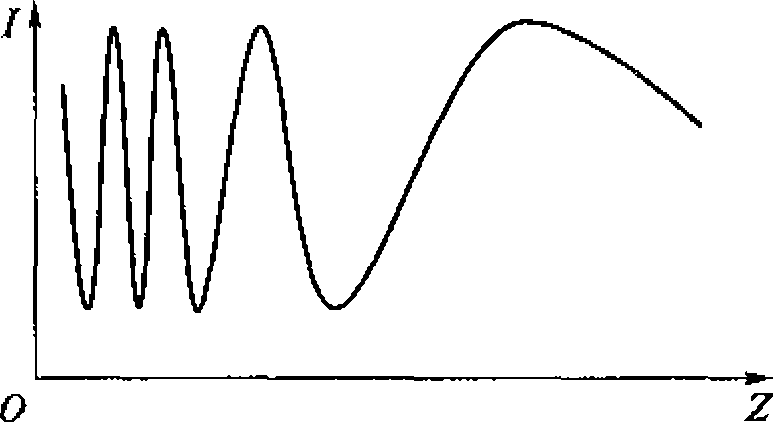
Рис. 1.4. Изменение интенсивности колебаний в упругой волне в зависимости от расстояния до излучателя
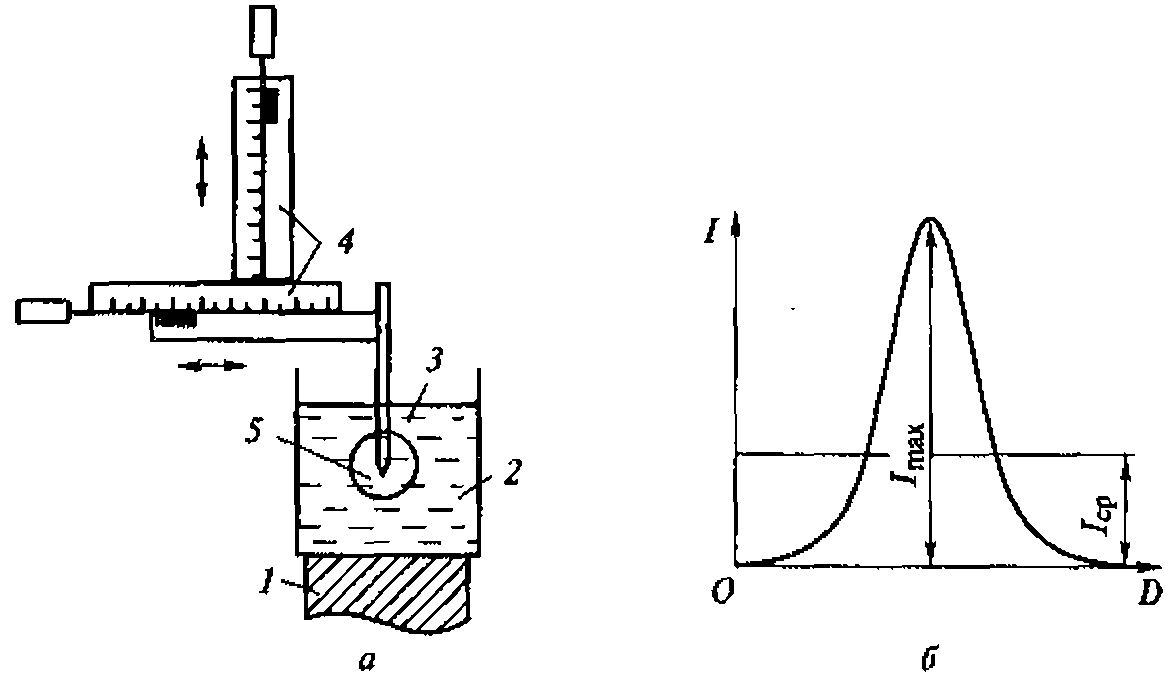
Рис. 1.5. Метод регистрации распределения интенсивности ультразвука вдоль диаметра высокочастотного излучателя:
а - схема регистрации (1 - излучатель ультразвука; 2 - кювета с жидкостью; 3 - ультразвуковой зонд 4- координатной устройство; 5- чувствительный элемент зонда - дифференциальная термопара, один из спаев которой сенсибилизирован эпоксидной смолой); 6- распределение интенсивности для плоского излучателя
Для оценки распределения интенсивностей в ультразвуковом ноле удобно воспользоваться любым точечным приемником ультразвука и простым координатным устройством из двух взаимно перпендикулярных линеек (рис. 1.5, а). Площадь под экспериментальной кривой на приведенном рисунке пропорциональна энергии ультразвука. Средняя интенсивность соответствует высоте прямоугольника, построенного на том же основании, что и экспериментальная кривая, и имеющего площадь» ограниченную экспериментальной кривой (рис. 1.5, б).
Более точные измерения распределения интенсивностей позволяют выявить также и добавочные максимумы (лепестки) интенсивности. Зависит распределение интенсивностей в поле и от соотношения размеров излучателя с длиной волны излучаемого ультразвука, и от свойств самого излучающего элемента, и от способа его крепления в излучателе.
Таким образом, даже в идеальных условиях, поле в ближней зоне излучателя весьма неоднородно, и максимальные значения интенсивности могут в 3-4 раза отличаться от средних значений. Это следует учитывать при определении порогов физико-химического и биологического действия ультразвука.
Следует отметить, что далеко не все исследователи учитывают особенности распределения интенсивностей в поле используемых ими ультразвуковых излучателей и это может быть одной из причин расхождения в полученных ими результатах.
1.3. ЗАТУХАНИЕ УЛЬТРАЗВУКА
Распространяясь в среде, ультразвуковые волны затухают, и их интенсивность, а следовательно, и амплитуда колебания частиц среды уменьшаются с увеличением расстояния от источника.
Затухание обусловлено поглощением звука средой, т.е. переходом звуковой энергии в другие виды энергии, в частности в тепловую, рассеянием звука на неоднородностях среды, в результате чего уменьшается поток энергии в первоначальном направлении распространения волны, а также расхождением звукового луча по мере удаления от источника.
Плоская волна в однородной среде затухает в основном в результате поглощения ультразвука. Амплитуда колебания частиц и интенсивность ультразвука уменьшаются с расстоянием согласно уравнениям
![]()
где ![]() и А0 - интенсивность ультразвука и амплитуда колебания частиц вблизи источника;
и А0 - интенсивность ультразвука и амплитуда колебания частиц вблизи источника;
![]() и А0 - интенсивность и амплитуда на расстоянии х от источника;
и А0 - интенсивность и амплитуда на расстоянии х от источника;
![]() - коэффициент поглощения;
- коэффициент поглощения;
е - число Непера (е = 2,72).
Коэффициент поглощения, в жидких средах пропорционален их вязкости ![]() и квадрату частоты колебаний:
и квадрату частоты колебаний:
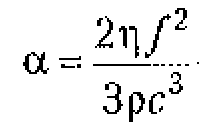
Коэффициент поглощения быстро увеличивается с возрастанием частоты, зависит от свойств вещества, в котором распространяется волна, а также температуры, давления и других условий.
Величина 1/![]() , обратная коэффициенту поглощения, определяет расстояние, на котором амплитуда колебаний частиц уменьшается и е раз, т. е. примерно в 3 раза.
, обратная коэффициенту поглощения, определяет расстояние, на котором амплитуда колебаний частиц уменьшается и е раз, т. е. примерно в 3 раза.
Затухание ультразвука в биологических тканях значительно больше, чем в воде. Так, затухание в жировой ткани в 4 раза, в мышце в 10 раз, а и костной ткани примерно в 75 больше, чем в воде или в жидких биологических средах - крови и лимфе.
Б терапевтических целях для эффективного воздействия на ткани чаще всего используют ультразвук с частотой 0,7 МГц и выше. Ультразвук в диапазоне 0,7...1 МГц обычно применяют для воздействия на глубоколежащие ткани и внутренние органы. Для лечения кожных заболеваний частоту повышают до 2,5...3 МГц.
Б диагностике, в частности для визуализации внутренних органов, применяют интенсивный импульсный ультразвук с частотой 6...10 МГц, так как разрешающая способность диагностической аппаратуры пропорциональна частоте ультразвука. При более высоких частотах поглощение ультразвука значительно увеличивается. Поэтому для получения сигнала, отраженного от внутренних органов, пришлось бы применять слишком высокие интенсивности ультразвука, опасные для жизнедеятельности организма.
Поглощенная веществом, в частности биологическими средами, ультразвуковая энергия выделяется в основном в виде тепла, что приводит к повышению температуры вещества. Это повышение температуры неоднократно измеряли экспериментально и рассчитывали теоретически. Теплопродукция в разных тканях неодинакова из-за различий в их коэффициентах поглощения (табл. 1,2),
Таблица 1.2
Акустические свойства некоторых тканей и воды
|
Ткань |
Скорость ультразвука, м/с |
Акустическое сопротивление, кг/м2с |
Коэффициент поглощения, дБ/см, при |
|
Кровь |
1570 |
1,61 |
0,1 |
|
Мозг |
1541 |
1,58 |
0,85 |
|
Жир |
1450 |
1,38 |
0.G3 |
|
Почка |
1561 |
1,62 |
1.0 |
|
Печень |
1549 |
1,65 |
0 № |
|
Мышца: вдоль фибрилл поперек фибрилл |
1585 - - |
1,70 - - |
1,30 3,30 |
|
Кости черепа |
4080 |
7,80 |
13 |
|
Вода |
1480 |
1,48 |
0,0022 |
Можно показать, что в мышечной ткани толщиной в 1 см при интенсивности 1 Вт/см2 в течение секунды поглощается около 0,3 Вт. Этому соответствует выделение тепла, достаточное для нагревания 1 см3 воды на 0,1. Полагая, что теплоемкость мышечной ткани и воды примерно одинакова, легко подсчитать (без учета рассеивания тепла), что мышечная ткань в этих условиях нагревается па 1°С за 10 с. Экспериментально повышение температуры в тканях наблюдали многие авторы. Однако результаты их исследований существенно различаются, что может быть обусловлено неравномерностью ультразвукового поля разных излучателей, различной степенью неоднородности исследованных тканей, разными условиями рассеивания теплоты.
При облучении, например, брюшной полости собаки ультразвуком (0,5 Вт/см2; 0,88 МГц) температура в жировой ткани за 10 мин повышается на 3...4 0С, а в печени и на передней стенке желудка - на 0,5,..0,8. В икроножной мышце лягушки, облучаемой ультразвуком (1 Вт/см2; 0,88 МГц) в течение 5 мин, температура повышается не более, чем на 5...7 0С.
Порог теплового повреждения тканей мало зависит от их начальной температуры, режима облучения и частоты ультразвука. Если температура ткани в ультразвуковом поле не превышает 42…43°С, то, по данным некоторых авторов, морфологические изменения в ней не наблюдаются даже после 8-часового облучения.
Значительно больше, чем в объеме однородной ткани, выделяется теплота на границах раздела тканей с отличающимися акустическими сопротивлениями или на неоднородностях структуры ткани. Возможно, именно этим объясняется и го, что ткани со сложной архитектоникой (например, легкие) более чувствительны к ультразвуку, чем однородные ткани (например, печень).
Дополнительная разность температур между соседними тканями может возникнуть также из-за различий в их коэффициентах теплопроводности (табл. 1,3), в насыщенности кровеносными сосудами и т.д.
Таблица 1.3
Коэффициенты теплопроводности различных тканей
|
Ткань |
Теплопроводность, Вт/см.К |
|
Жир |
0,017-0,021 |
|
Эпидермис |
0,025 |
|
Мышца |
0,05-0,06 |
|
Кровь, вода |
0,058 |
|
Кость |
1,16 |
Полагают, что нагревание тканей и градиенты температур на границах раздела разных тканей в основном и обусловливают биологическое действие ультразвука. Однако имитация ультразвукового нагревания тканей с помощью других термогенных воздействий - инфракрасным излучением, высокочастотными электромагнитными волнами, горячим парафином и пр. не дает того биологического и терапевтического эффекта, которого удается достичь с помощью ультразвука.
Реакция биологической системы на повышение температуры обусловлена разными причинами: первичными повреждениями клеточных элементов; совокупностью нарушений, вторично развивающихся в клетках и прямо или косвенно зависящих от первичных повреждений; синтезом термотоковых белков, обеспечивающих реактивное повышение стабильности клеточных компонентов и ответ на повышение температуры; репарацией повреждений, осуществляемой не только после прекращения нагревания, но и во время него.
Кроме того, градиент температур между содержимым клетки и внеклеточной средой, возникающий при ультразвуковом воздействии с частотой 1 МГц и интенсивностью 1 Вт/см2, достигает 2…5 град/см. При таком градиенте температуры в результате термодиффузии через мембрану будет ускоряться транспорт веществ в одну сторону и замедляться их перенос в противоположном направлении. С увеличением интенсивности ультразвука или его частоты градиент температур на мембране возрастает.
1.4. ОТРАЖЕНИЕ УЛЬТРАЗВУКА
Ультразвуковые волны, как и любые другие волны, при падении на границу раздела двух сред с разными акустическими свойствами частично отражаются, а частично преломляются и переходят в другую среду. Доля энергии волн, перешедшей из одной среды в другую, зависит от соотношения между акустическими сопротивлениями этих сред.
Коэффициент отражения акустических волн от границы двух сред равен отношению интенсивностей отраженной и падающей волн. Если волна падает па поверхность перпендикулярно к ней, то коэффициент отражения может быть вычислен по формуле Релея:
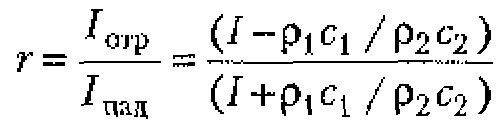
где ![]() и
и ![]() - акустические сопротивления, соответственно, первой и второй сред.
- акустические сопротивления, соответственно, первой и второй сред.
Из формулы Рэлея следует, что чем больше различаются между собой акустические сопротивления, тем меньше доля энергии, переносимой волной через границу раздела. Так, интенсивность ультразвуковой волны, перешедшей из воды в воздух, составляет веет ОД % интенсивности волны, падающей на поверхность воды, а 99,9 % отразится от границы вода-воздух. Именно поэтому при терапевтическом воздействии ультразвуком или его применении в диагностических целях необходимо следить, чтобы между излучателем ультразвука и поверхностью тела всегда была прослойка жидкости - специального геля, воды, глицерина, вазелинового масла, раствора лекарства. В противном случае акустический кот-акт будет нарушен, и ультразвуковая волна не дойдет до биологических тканей, так как она практически целиком отразится от прослойки воздуха. Отражение ультразвука наблюдается также на границах тканей с различными акустическими свойствами, например на границе мышцы и надкостницы, на поверхности полых органов и в ряде других случаев.
Если ультразвуковая волна отражается от поверхности, перпендикулярной к направлению ее распространения, то падающая и отраженные волны накладываются друг на друга. В случаях, когда между излучателем и отражающей поверхностью укладывается целое число полуволн, в среде возникает так называемая стоячая волна.
Падающая и отраженная волны переносят энергию в противоположных направлениях, поэтому в стоячей волне нет суммарного переноса энергии. Энергия распределяется между пучностями и узлами колебаний, В этом случае действие ультразвука можно оценить по амплитуде переменного давления, которое в пучностях стоячей волны вдвое превышает давление и исходных бегущих волнах. Давление в пучностях стоячей волны
![]()
где ![]() - интенсивность излучения, т. е. количество энергии, излучаемой с единицы поверхности излучателя;
- интенсивность излучения, т. е. количество энергии, излучаемой с единицы поверхности излучателя;
![]() - акустическое сопротивление среды.
- акустическое сопротивление среды.
Стоячие волны в жидкостях, содержащих взвешенные в них мелкие частицы (например, тушь) водном растворе желатина или капельки масла в водной эмульсии), легко наблюдать невооруженным глазом. Частицы, в зависимости от их свойств, концентрируются либо в пучностях, либо в узлах стоячей волны, образуя слои, расположенные на расстоянии, равном половине длины полны.
Если при отражении часть энергии ультразвука рассеивается или переходит в среду, составляющую преграду, то амплитуда отраженной волны оказывается меньше, чем амплитуда падающей, и в жидкостях (или биологических тканях, близких по свойствам к жидкостям) сочетаются стоячая и бегущая волны.
В биологических объектах также могут возникать стоячие волны в результате отражения от границ между тканями с различными акустическими свойствами. В реальных условиях образование стоячих волн можно ожидать при воздействии ультразвуком на ушную раковину, брюшной пресс, мышечные слои, на кровеносные сосуды и т. д. Возможно именно за счет стоячих волн эритроциты под действием ультразвука с частотой 1 МГц и интенсивностью излучения ОД Вт/см2 образуют в кровеносных сосудах лягушки и куриного эмбриона сгустки, расположенные на расстоянии, равном половине длины волны.
Можно показать, что скорость перемещения отдельных эритроцитов как в бегущей, так и в стоячей волне, невелики и сами по себе не могут обеспечить быстрое сближение эритроцитов и образование агрегатов, тем более что силам, обеспечивающим взаимное сближение, противодействуют силы отталкивания между одноименно заряженными клетками. Именно эти силы электростатического отталкивания препятствуют слипанию эритроцитов в нормальных условиях. Однако поверхностный заряд клеток под действием ультразвука заметно уменьшается, что способствует образованию агрегатов. Сила взаимодействия между частицами в ультразвуковом поле пропорциональна кубу их линейных размеров, поэтому начавшаяся агрегация идет с возрастающей скоростью. Эти агрегаты, очевидно, будут перемещаться и зону низкого давления и концентрироваться в узлах стоячей волны, образуя сгустки, что и подтверждается модельными опытами.
В зависимости от того, стоячая или бегущая волна возникает в биологическом объекте, меняется и его реакция на ультразвук. Так, 30 % яиц дрозофилы в гелеобразной среде погибает при 10-мипутном воздействии ультразвука с интенсивностью излучения 3 Вт/см2 и поле бегущей волны и интенсивностью излучения 1 Вт/см2 , если создаются условия, способствующие возникновению стоячих волн.
1.5. ИСКАЖЕНИЕ ФОРМЫ УЛЬТРАЗВУКОВОЙ ВОЛНЫ
В РЕАЛЬНЫХ УСЛОВИЯХ
Ультразвуковая волна, распространяясь, остается синусоидальной только в том случае, если свойства среды не меняются под влиянием распространяющейся в ней волны. Такое условие приближенно выполняется только при весьма низких интенсивностях ультразвука.
Скорость ультразвука и коэффициент его поглощения существенно зависят от температуры. В слое, где температура повышена, возмущение передается быстрее, чем в слое, где температура понижена, поэтому профиль волны немного искажается.
Ультразвуковая волна, падающая на границу твердого тела и жидкости, возбуждает на поверхности твердого тела поперечные поверхностные волны. Энергия этих волн локализуется в тонком приповерхностном слое с толщиной, не превышающей две длины волны. Коэффициент затухания поверхностных волн значительно выше коэффициента поглощения плоских волн той же частоты в однородных средах. Именно поэтому под действием ультразвука, например, в надкостнице, выделяется много тепла, что при достаточно высокой интенсивности может привести к болевым ощущениям, к отслоению мышечной ткани или другим нежелательным эффектам.
1.6. АКУСТИЧЕСКИЕ ТЕЧЕНИЯ
Ультразвуковая волна, распространяясь в среде, теряет часть своей энергии. Эта энергия частично переходит в теплоту, а частично передается массе вещества в виде механического импульса, что приводит в жидких и газообразных средах к возникновению регулярных течений. Эти течения называются акустическими и легко возникают в неоднородном ультразвуковом ноле или около различных препятствий.
При ультразвуковом воздействии важно учитывать течения в пограничном слое у поверхности препятствий, помещенных в ультразвуковое поле. В последнем случае характерные масштабы акустических потоков определяются толщиной акустического пограничного слоя, где амплитуда колебания частиц жидкости меняется от 0 у самой поверхности до 0,63 амплитуды а свободном объеме.
Толщина пограничного слоя h зависит от вязкости ![]() и плотности
и плотности ![]() жидкости, а также от частоты
жидкости, а также от частоты ![]() ультразвука. Она намного меньше длины волны ультразвука и рассчитывается по формуле
ультразвука. Она намного меньше длины волны ультразвука и рассчитывается по формуле
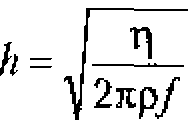
Например, для биологических жидкостей (![]() ) при частоте ультразвука 1 МГц толщина пограничного стоя составит примерно 4.10-6м (0,004 мм), что значительно меньше длины волны (
) при частоте ультразвука 1 МГц толщина пограничного стоя составит примерно 4.10-6м (0,004 мм), что значительно меньше длины волны (![]() = 1,5 мм).
= 1,5 мм).
Отношение разности скоростей на границах слоя к его толщине (градиент скорости) может в биологической среде достигать весьма значительной величины. Например, при интенсивности ультразвука 1 Вт/см2 и частоте 1 МГц градиенты скорости 104…105с-1. Этого более чем достаточно для разрыва клеточных мембран, нарушений внутриклеточной структуры, для деградации вирусов, молекул ДНК, РНК и пр.
Особое внимание привлекают вихри, рождающиеся вблизи пульсирующего газового пузырька. Если этот пузырек находится вдали от границ и в процессе пульсаций не меняет своей формы (остается сферическим), вокруг него не могут возникнуть вихревые потоки. Потоки возникают, если пузырьки находятся вблизи поверхности жидкости, около твердой стенки или если форма пузырьков периодически изменяется. Такие пузырьки в огромном количестве появляются в жидкости при кавитации.
Предельную скорость течения вблизи колеблющегося у твердой стенки пузырька можно оценить, пользуясь выражением
![]()
где Us ~ радиальная скорость границы пузырька;
а - средний радиус пузырька;
![]() - круговая (циклическая) частота.
- круговая (циклическая) частота.
В воде, облучаемой ультразвуком с частотой 1 МГц, средний радиус пузырька составляет 2 мкм, ![]() 4м/с, максимальная скорость микропотоков вблизи него равна примерно 1 м/с.
4м/с, максимальная скорость микропотоков вблизи него равна примерно 1 м/с.
Микропотоки могут возникать и при взаимодействии ультразвуковой волны с микронеоднородностями, имеющими отличную от среды плотность, например, при взаимодействии с органеллами клеток.
Весьма вероятно, что многие биологические эффекты, наблюдаемые под действием ультразвука, - уменьшение числа гранул гликогена в клетках, разрушение лизосом, изменения в ультраструктуре мышц, в свойствах клеточных мембран и др. - обусловлены и основном ультразвуковыми микропотоками.
1.7. Коллоидный вибропоткнциал в механизме
биологического действия ультразвука
Если ультразвуковая волна распространяется в однородной среде, например в чистой воде, то все частицы среды колеблются около своих положений равновесия с одинаковой амплитудой. Если же в среде присутствуют частицы другой природы ионы, коллоидные частицы, клетки, - то амплитуда их колебаний будет тем меньше, чем больше масса (и, следовательно, инерция) частицы и чем больше коэффициент трения между частицей и средой.
В растворах электролитов или коллоидных растворах, а также в суспензиях заряженных частиц ври распространении ультразвуковой волны амплитуды и фазы колебаний разноименно заряженных частиц могут быть различными, В среде возникает переменный электрический потенциал, который называют вибропотенциалом, или в честь ученого, обнаружившего этот эффект, - потенциалом Дебая.
Вибропотенциал характеризуют отношением переменной разности потенциалов между двумя произвольными точками, расположенными в направлении распространения волны к амплитуде скорости. При частотах, превышающих 0,5 МГц, вибропотенциал мало зависит от частоты.
Для растворов хлористого натрия и других 1-иалентиых электролитов вибропотенциал весьма мал и равен 3...10 мкВ . с/см. Более высокие значения наблюдаются в полиэлектролитах, а в коллоидных растворах эффект достигав) значения 1...10 мкВ . с/см.
Предполагается, что коллоидный вибропотенциал обусловлен периодическим нарушением структуры двойного электрического слоя вследствие того, что массивная, несущая заряд коллоидная частица обладает значительно большей инерцией, чем окружающие ее легкие противоионы.
Коллоидный вибропотенциал можно оценить по формуле
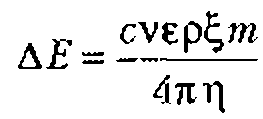
где с - скорость ультразвука в среде;
v - амплитуда скорости;
![]() - диэлектрическая проницаемость среды;
- диэлектрическая проницаемость среды;
![]() - электрокинетический потенциал;
- электрокинетический потенциал;
m - масса коллоидных частиц в единице объема;
![]() - удельное электрическое сопротивление среды;
- удельное электрическое сопротивление среды;
![]() - вязкость среды.
- вязкость среды.
Подставляя в эту формулу (при v=10-3 м/c; c=1,4.103 м/с; ![]() 50...60 Ф/м для водных растворов) значения, характерные для биологических объектов
50...60 Ф/м для водных растворов) значения, характерные для биологических объектов ![]() клеток примерно 50 мВ;
клеток примерно 50 мВ; ![]() - 104 Ом/м;
- 104 Ом/м; ![]() примерно 0,25 Пз), и учитывая, что масса клетки
примерно 0,25 Пз), и учитывая, что масса клетки ![]() , где средняя плотность клетки d= 1,1 -103 кг/м3, радиус клетки а= 5мкм и клетки занимают примерно 0,9 объема всей ткани, получают
, где средняя плотность клетки d= 1,1 -103 кг/м3, радиус клетки а= 5мкм и клетки занимают примерно 0,9 объема всей ткани, получают ![]() 10мВ. Это значение сравнимо по величине с мембранными потенциалами клетки (10…50 мВ),
10мВ. Это значение сравнимо по величине с мембранными потенциалами клетки (10…50 мВ),
Действие вибропотенциала прекращается сразу после выключения ультразвука. Однако и повышенная проницаемость, и пониженная электропроводность мембран сохраняются в течение 20...30 мин после ультразвукового воздействия. Такое последействие может быть обусловлено сдвигами в процессах функционирования клетки, например нарушением метаболизма, при изменении (под влиянием ультразвука) соотношения ионов внутри и вне клетки. Время, необходимое для восстановления нормального функционирования клетки, может измеряться десятками минут.
1.8. УЛЬТРАЗВУКОВАЯ КАВИТАЦИЯ
Ультразвуковая кавитация - возникновение в жидкости, облучаемой ультразвуком, пульсирующих и захлопывающихся пузырьков) заполненных паром} газом или их смесью.
Кавитационные пузырьки в распространяющейся в жидкости ультразвуковой волне возникают и расширяются во время полупериодов разрежения и сжимаются после перехода в область повышенного давления.
В идеальных однородных жидкостях пузырьки могут возникнуть лишь при весьма высоких растягивающих усилиях (отрицательных давлениях), превосходящих прочность жидкости.
Прочность реальных жидкостей довольно низка из-за того, что в них всегда достаточно много зародышей кавитации - микропузырьков газа, пылинок гидрофобных частиц и т. д. Возможно также, что зародыши кавитации непрерывно возникают при прохождении через жидкость космических частиц, а затем снова растворяются. Пузырьки газа с диаметром 10-5 см, по-видимому, могут сколь угодно находиться в иоде, если их поверхность стабилизирована органическими загрязнениями, обычно присутствующими в «чистой» воде.
Кроме того, предполагается, что микропузырьки газа, даже не стабилизированные органикой, в принципе, не могут раствориться из-за особенностей структуры воды в межфазном слое жидкость - газ, ограничивающем пузырек.
Порогом кавитации называется интенсивность ультразвука, ниже которой не наблюдаются кавитационные явления.
Порог кавитации зависит от параметров, характеризующих как ультразвук, так и саму жидкость.
Для воды и водных растворов пороги кавитации возрастают с увеличением частоты ультразвука и уменьшением времени воздействия.
При импульсном ультразвуковом воздействии порог зависит от длительности импульса и достигает максимума при 0,06...0,6 мкс. Порог кавитации повышается и при уменьшении объема жидкости, так как, чем меньше объем, тем меньше в нем зародышей кавитации. Этим, очевидно, и объясняются высокие значения порогов для фокусированного ультразвука. Микронеоднородности в виде пылинок, микроорганизмов, молекул растворенного газа или ионов снижают порог кавитации в жидкой среде.
При интенсивностях ультразвука, не намного превышающих порог кавитации, микропузырьки газа в жидкости пульсируют относительно равновесного радиуса и постепенно увеличиваются в объеме.
При расширении пузырьков-зародышей, попадающих в область пониженною давления, в пузырек испаряется жидкость и диффундирует растворенный в жидкости газ. Если температура жидкости значительно ниже точки кипения, то пузырьки растут главным образом в результате диффузии.
При повышении давления в следующую половину периода колебания пузырек сжимается, направление диффузии меняется, и молекулы диффундируют из пузырька в жидкость. Количество продиффундировавшего газа пропорционально площади поверхности пузырька. Эта площадь в стадии сжатия меньше, чем в стадии расширения. Поэтому количество газа, попадающего в пузырек при расширении, несколько больше количества газа, выходящего из пузырька при его сжатии. Поэтому после каждого цикла сжатия-растяжения в пузырьке остается избыток газа.
Накопление газа а пузырьке, обусловливающее рост среднего размера пузырька в поле переменного давления, называется выпрямленной, или направленной, диффузией.
Диффузионный механизм обеспечивает сравнительно медленный рост зародышей, и при высокой частоте ультразвука они успевают совершить значительное число пульсаций, прежде чем достигнут резонансных размеров. Амплитуда пульсации пузырька с резонансными размерами (для данной частоты ультразвука) будет максимальной.
Размер резонансной полости в воде для частоты ультразвука в диапазоне 500... 1000 кГц можно рассчитать по формуле
![]()
где ![]() - резонансный радиус пузырька, мкм;
- резонансный радиус пузырька, мкм;
![]() частота ультразвука, кГц,
частота ультразвука, кГц,
Для частот, превышающих 1МГц, значения![]() в связи с возрастающей ролью поверхностного натяжения оказываются несколько выше, чем вычисленные но приведенной формуле.
в связи с возрастающей ролью поверхностного натяжения оказываются несколько выше, чем вычисленные но приведенной формуле.
Так, при частотах 1, 5 и 10 МГц и воде ![]() равен 3,6; 0,95 и 0,56 мкм соответственно, в то время как, рассчитывая по формуле, получаем величины, равные 3,0; 0,6 и 0,3 мкм.
равен 3,6; 0,95 и 0,56 мкм соответственно, в то время как, рассчитывая по формуле, получаем величины, равные 3,0; 0,6 и 0,3 мкм.
Необходимо отметить, что на частотах, превышающих 1 МГц, резонансные эффекты проявляются слабее, чем в диапазоне более низких частот.
Колебательная скорость стенки пузырька, размеры которого близки к резонансному, может намного превышать колебательную скорость частиц в ультразвуковой волне, что позволило назвать кавитационные пузырьки усилителями скорости.
Если ультразвуковое поле неоднородно, то пузырьки не только пульсируют, но и движутся поступательно.
В стоячей волне, например, пузырьки движутся к пучностям давления, если их размеры меньше резонансного, и к узлам давления, если они превышают по размеру резонансные пузырьки. Нередко пузырьки в ультразвуковом поле осциллируют - колеблются около некоторого положения равновесия.
Пульсирующие в течение многих периодов пузырьки называются стабильными полостями, а само явление, связанное с существованием в жидкости таких пузырьков, - стабильной кавитацией.
Повышение интенсивности ультразвука приводит к нестабильной кавитации: пузырьки довольно быстро (за несколько периодов) достигают резонансного размера, стремительно расширяются, после чего резко захлопываются.
Предполагается, что при захлопывании содержащаяся в пузырьке парогазовая смесь, адиабатический (не успевая обменяться теплом с окружающей средой) сжимается до давления 105 Па (300 атм) и нагревается до температур порядка 8000... 12000 К. Известно, что уже при 2000 К около 0,01 % молекул Н2О внутри пузырька диссоциируют на водородные II и гидроксильные ОН свободные радикалы. Эти радикалы могут рекомбинировать с образованием электронновозбужденных состояний молекул H2O*:
![]()
При переходе молекул Н2О* из электронновозбужденного состояния в основное высвечивается квант света - происходит сонолюминесценция.
Свободные Н и ОН радикалы могут диффундировать в раствор и вступать в реакции с растворителем или растворенными веществами, инициируя радикальные химические процессы.
Захлопывающиеся кавитационные пузырьки порождают в жидкости мощные импульсы давления и ударные волны.
Кавитация в жидкости сопровождается различными явлениями:
- характерным шумом во всем диапазоне частот и сильным акустическим сигналом на частоте, равной половине частоты ультразвука, вызвавшего кавитацию;
- ускорением одних химических реакций и инициированием других;
- интенсивными микропотоками и ударными волнами, способными перемешивать слои жидкости и разрушать поверхности граничащих с кавитирующей жидкостью твердых тел;
- ультразвуковым свечением а также различными биологическими эффектами.
Вследствие концентрирования энергии в очень малых объемах ультразвук может вызывать такие явления, как разрыв химических связей макромолекул, инициирование химических реакций, эрозию поверхностей твердых тел и свечение.
1.9. УЛЬТРАЗВУКОВЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ
Химические реакции в воде, водных и неполных растворах, облучаемых ультразвуком, обнаружены давно. Множество экспериментов позволяет сделать вывод, что химические эффекты ультразвука связаны с кавитацией, хотя имеются данные, что некоторые эффекты механохимической природы, например деполимеризация ДНК в растворе или изменения в свойствах жидких кристаллов, наблюдают при интенсивностях ультразвука, лежащих ниже порога кавитации.
Подъем температуры (-103 К) и давления (-108 Па) при захлопывании кавитационных пузырьков даже в чистой, дегазированной воде инициирует образование внутри пузырьков и в их окрестности свободных водородных Н и гидроксильных ОН радикалов:
![]()
Эти радикалы рекомбинируют, возбуждая сонолюминесценцию:
![]()
или диффундируют в объем и вступают в реакции с растворителем или растворенными веществами, инициируя радикальные химические процессы.
При рекомбинации радикалов ОН образуется пероксид водорода Н2О2:
![]()
Хорошо известно, что водородпероксид - активный инициатор окислительно-восстановительных реакций с различными веществами в растворах.
Убедительным доказательством образования свободных радикалов является их регистрация методами электронного парамагнитного резонанса (ЭПР) и спиновых ловушек (радикал-скавенджеров).
Косвенным доказательством существования свободных радикалов при кавитации является образование водородпероксида.
Накопление водородпероксида при воздействии на растворы ультразвуком наблюдают с помощью подходящего окислительно-восстановительного индикатора, например калий йодида KI, в присутствии катализатора - молибдата аммония;
![]()
Концентрацию ![]() измеряют спектрофотометрически на длине полны 350 нм (коэффициент экстинкции 25000 л.моль/см). Количество йода равно количеству образовавшегося водородпероксида.
измеряют спектрофотометрически на длине полны 350 нм (коэффициент экстинкции 25000 л.моль/см). Количество йода равно количеству образовавшегося водородпероксида.
Концентрация водородпероксида пропорциональна времени ультразвукового воздействия, поскольку рекомбинация радикалов ОН является реакцией первого порядка по ОН радикалам. Накопления водородпероксида удобно использовать для ультразвуковой дозиметрии.
По данным разных авторов, акустико-энергетический (химико-акустический) выход водородпероксида имеет значение порядка 1020 молекул/кДж, т. е. на 1 кДж поглощенной звуковой энергии образуется примерно 10 4 моль Н2О2.
Для оценки интенсивности ультразвука могут быть использованы и другие простые реакции.
Так, скорость образования азотистой HNO2 и азотной HNO3 кислот в воде, насыщенной воздухом, прямо пропорциональна интенсивности ультразвука в диапазоне от 0,6 до 4 Вт/см2. Более сложные реакции, например реакции с биополимерами, непригодны для этой цели, так как зависимости скоростей ультразвуковых химических реакций с участием макромолекул ог интенсивности ультразвука имеют сложный характер.
Образование азотистой HNO2 и азотной НNОз кислот в присутствии растворенного азота весьма существенно при ультразвуковом воздействии на биологические объекты. Эти кислоты и их ангидриды могут активно реагировать с биоорганическими молекулами и оказывать сильное повреждающее действие.
Одним из вероятных механизмов образования кислородсодержащих соединений азота является взаимодействие молекулярного азота N2 с продуктами сонолиза поды.
Экспериментально показано, например, что при температурах порядка 600К в автоклаве (без ультразвука) идет реакция связывания молекулярного азота:
![]()
Предположение, выдвигаемое в некоторых работах, о распаде молекулярного азота N2 на атомы:
![]()
не имеет достаточных экспериментальных доказательств.
Возникшие при сонолизе свободные водородные Н и гидроксильные ОН радикалы в присутствии кислорода инициируют окисление биоорганических соединений в организме, подвергаемом ультразвуковым воздействиям.
Окисление органических соединений в жидкой фазе хорошо изучено. Этот процесс является сложной радикально-цепной реакцией с вырожденным разветвлением. При действии ультразвука процесс описывается следующей принципиальной схемой (здесь RH - соединение с органическим радикалом R и подвижным атомом водорода Н):
Зарождение цепи, или образование радикалов (Wi - скорость образования радикалов Н и OH под действием ультразвука на водные растворы);
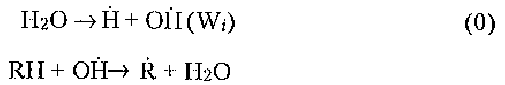
Продолжение цепи:
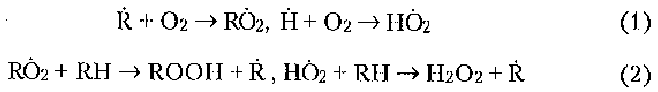
где RO2 - органический пероксидный радикал;
ROOH - органический пероксид;
Разветвление цепи:
![]()
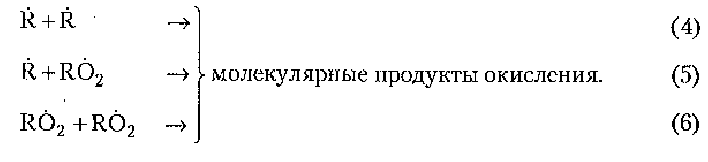
Совокупность реакций (1 -6) представляет общую схему окисления органических веществ.
В зависимости от природы биоорганических соединений RH и условий окисления (скорость Wi и концентрации RH, О2, ROOH) механизм и скорость процесса могут значительно различаться. Особенно легко окисляются липиды клеточных мембран. Поэтому рассмотренный механизм широко известен как пероксидное окисление липидов (ПОЛ). Соответственно под RH и ROOH следует понимать липид и его пероксид.
По механизму взаимодействия с радикалами биоорганические соединения RH можно разбить па три основных класса.
К первому классу относят соединения R1H, взаимодействующие с пероксидными радикалами RO2:
![]()
К этим соединениям относятся фенилаланин, триптофан, токоферолы. Скорость реакции этих веществ с RO2 зависит от константы скорости ![]() реакции (7) и стехиометрического коэффициента
реакции (7) и стехиометрического коэффициента ![]() - числа цепей, которые обрывает одна молекула ингибитора. Очень часто
- числа цепей, которые обрывает одна молекула ингибитора. Очень часто ![]() =2. Механизм реакции (7) зависит также от радикала R1. Если этот радикал достаточно активен и до того, как прореагирует с RO2 (или с R) вступит в реакцию с RH или ROOH с образованием активных R или RО2, то это ослабит его взаимодействие с RO2;
=2. Механизм реакции (7) зависит также от радикала R1. Если этот радикал достаточно активен и до того, как прореагирует с RO2 (или с R) вступит в реакцию с RH или ROOH с образованием активных R или RО2, то это ослабит его взаимодействие с RO2;
![]() (реакция, обратная 7)
(реакция, обратная 7)
![]()
К второму классу относят соединения R1H, взаимодействующие с гидропероксидом ROOH с образованием свободных радикалов:
![]()
Обычно эта реакция протекает медленно, но в некоторых случаях ее необходимо учитывать.
Реакция соединения R1H с кислородом
![]()
протекает очень медленно из-за высокой эндотермичности (105...150кДж/моль) и низкой концентрации растворенного в окисляющемся веществе кислорода.
К третьему классу относят соединения, обрывающие цепи в результате взаимодействия с алкильными радикалами. К таким соединениям относятся хиноны, йод. Например:
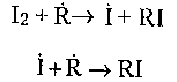
Соединения, разрушающие гидропероксиды без образования свободных радикалов, например, метионин, дисульфиды пептидов, тормозят пероксидное окисление:
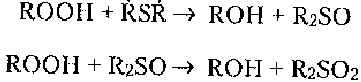
Смесь таких веществ-антиоксидантов в клетке может привести к сильному тормозящему действию. При этом тормозящий эффект смеси может превосходить сумму эффектов тормозящего действия каждого из компонентов. Данное явление называется синергизмом.
Характер влияния ультразвука на химические реакции зависит от многих факторов: от частоты и интенсивности акустических колебаний, от температуры и давления, от природы и концентрации растворенных газов.
Некоторые реакции лишь ускоряются в ультразвуковом поле, другие же без воздействия ультразвука вообще не происходят.
Реакции, протекающие лишь при ультразвуковом инициировании в гомофазных растворах, представляют особый интерес и могут быть условно разделены на несколько классов.
- Реакции между газами, парами воды и веществами с высокой упругостью пара в газовой фазе внутри кавитационной полости.
При схлопывании внутри кавитационного пузырька и в малой окрестности вокруг него температура и давление значительно выше критических для растворителя. Следовательно, локально достигаются сверх критические состояния, В таких условиях молекулы как растворителя, так и растворенных веществ, подвергаются термическому распаду с образованием атомов и радикалов. Наиболее детально изучен распад воды с образованием радикалов H и ОН Установлено эффективное разложение четыреххлористого углерода при ультразвуковой обработке.
Менее 10% радикалов Н и ОН, образующихся в кавитационном пузырьке из-за процессов рекомбинации, достигают жидкой фазы. При взаимодействии радикалов (при отсутствии молекул-захватчиков или частиц твердой фазы) образуется Н2О2. Образующийся при рекомбинации радикалов ОН водород пероксид ответственен за большинство реакций окисления, изучавшихся в водных растворах при ультразвуковой обработке. Сюда можно отнести, например, реакции окисления; ![]() .
.
Многие авторы отмечают, что заметному разложению при ультразвуковой обработке подвергаются вещества, летучесть которых несколько выше или сравнима с летучестью растворителя при данной температуре. Тогда внутри кавитационного пузырька давление пара растворенного вещества будет больше или сравнимо с давлением пара растворителя.
Если летучесть вещества значительно меньше летучести растворителя, то воздействие ультразвука может осуществляться только через другие механизмы.
- Окислительно-восстановительные реакции, которые идут в жидкой фазе между растворенными веществами и образующимися в пузырьках продуктами ультразвукового расщепления молекул воды, газов и проникающих в кавитационную полость веществ с высокой упругостью парой.
- Цепные реакции в растворе, инициируемые не радикальными продуктами Н и ОН распада молекул НзО, а каким-либо другим веществом, присутствующим в растворе и расщепляющимся в кавитационной полости.
4. Ультразвуковые химические реакции с участием синтетических и биологических полимеров.
Энергетический выход продуктов химических реакций, инициируемых ультразвуком, как правило, невелик. Поэтому на практике эти реакции используют лишь в исключительных случаях: либо когда нет другого способа получения продуктов, либо когда с ценой результата не приходится считаться.
Например, ультразвук нашел применение для инициирования полимеризации используемых в медицине и ветеринарии акрилатных клеев при ультразвуковой «сварке» костей и мягких тканей.
Следует отметить, что при ультразвуковом воздействии интенсификация диффузионных процессов в результате перемешивания жидкости (акустические потоки) может принести к ускорению химических процессов, протекающих в обрабатываемых растворах, однако этот эффект не связан с прямым химическим действием ультразвука,
Механохимические ультразвуковые эффекты и продукты реакций в кавитационных полостях в определенных условиях могут обусловить существенные изменения в биологических средах и должны учитываться при обсуждении механизма биологического действия ультразвука.
Ультразвуковая эрозия - это стойкие механические изменения на поверхности тел, граничащих с кавитирующей жидкостью, является результатом наложения химических, электрических и механических факторов, причем последним, очевидно, принадлежит основная роль.
1.10. УЛЬТРАЗВУКОВОЕ СВЕЧЕНИЕ
Ультразвуковое свечение - это слабое свечение воды и некоторых других жидкостей, помещенных в ультразвуковое ноле. В разное время было выдвинуто более десяти гипотез, в той или иной мере объяснявших экспериментальные данные.
Первая группа гипотез основана на предположении о нагревании содержимого захлопывающегося пузырька до высоких температур. Другая группа гипотез - па представлении о возможности разделения зарядов на стенках пульсирующей полости, что приводит к электрическому пробою, который, как и высокие температуры, может инициировать свечение и химические реакции.
Наряду с ионами и радикалами, долго существующими в среде, где нет веществ, способных с ними реагировать, в кавитационной полости образуются возбужденные молекулы, в том числе H2O*, которые уже спустя 10-9...10-8 с спонтанно возвращаются в исходное состояние, либо выделяя избыточную энергию в виде кванта электромагнитного излучения, либо рассеивают ее в виде теплоты.
В воде, насыщенной воздухом, под действием ультразвука с частотой 880 кГц кавитация начинается при средней интенсивности (SATA) 0,12 Вт/см2 (максимальная интенсивность 0,3...0,5 Вт/см2). При боковом освещении в воде, облучаемой ультразвуком, можно видеть облако пузырьков разных размеров, часть которых уносится из кавитационной зоны акустическими потоками. Практически одновременно с образованием пузырьков возникает ультразвуковое свечение, начинаются химические реакции и регистрируется шум в широком диапазоне частот, а также ярко выраженная субгармоническая составляющая на частоте 440 кГц.
Увеличение частоты ультразвука приводит к повышению порога кавитации.
Зависимости интенсивности ультразвукового свечения, скорости химических реакций и электропроводности воды от интенсивности ультразвука имеют одинаковый характер, что доказывает их связь с кавитацией и отражает природу процессов, протекающих в пузырьках. Зависимость ультразвукового свечения от свойств растворенных в жидкости веществ позволяет использовать его в диагностических целях, например, в тех случаях, когда патологические процессы связаны с выбросом в плазму крови соединений, влияющих па ее свечение, возникающее при кавитации.
1.11. ВЛИЯНИЕ УЛЬТРАЗВУКА НА ВОДУ И ВОДНЫЕ РАСТВОРЫ
Если кубик льда подвергнуть действию ультразвука, льда внутри мутнеет и останется мутным, как бы запомнив результат ультразвукового воздействия.
Жидкая вода «помнит» любое, в том числе и ультразвуковое, воздействие лишь короткое время 10-9...10-12с. Поэтому неправомерно объяснять ультразвуковые эффекты «структурной памятью» поды.
Нетрудно подсчитать, что в этом случае ближайшие молекулы воды соседствуют па поверхности пульсирующего пузырька в течение примерно 10-9с. Следовательно, при кавитации поверхность пузырька не успеет сформироваться, и в этом случае поверхностное натяжение будет отличаться от поверхностного натяжения покоящейся воды.
Очевидно, что если в разных участках поверхности пузырька натяжение окажется различным, то пульсирующий пузырек потеряет сферическую форму и станет источником энергичных микропотоков, способных обусловить ряд биоэффектов.
1.12. УЛЬТРАЗВУКОВАЯ КАВИТАЦИЯ В БИОЛОГИЧЕСКИХ СРЕДАХ
В медицинской и ветеринарной практике, в биотехнологии и экспериментальной биологии используется воздействие ультразвуком самых разных параметров на среды с неодинаковыми физико-химическими свойствами. В каждом случае вопрос о возможности возникновения кавитации должен рассматриваться отдельно, так как пороги кавитации и ее активность зависят от параметров ультразвука и свойств среды.
1.12.1. Кавитация в суспензии клеток
При повышении интенсивности ультразвука до значений, когда в среде возникают механические усилия, сравнимые с прочностью клеточных мембран, начинается процесс разрушения клеток. Обычно появление значительных механических возмущений в жидкостях связано с возникновением в них стабильных и нестабильных газовых пузырьков, которые могут образоваться в воде и водных средах, если интенсивность ультразвука превышает порог кавитации.
Гак, клетки одноклеточной водоросли Scandesmus Guadricanda начинают разрушаться при усредненной но пространству интенсивности, равной 0,2.,ДЗ Вт/см2, при частоте 1 МГц, что соответствует порогу кавитации в водных суспензиях с небольшой концентрацией клеток. Скорость разрушения клеток увеличивается с увеличением интенсивности ультразвука. Число разрушенных в единицу времени клеток пропорционально числу кавитационных событий.
Свечение фотобактерий в суспензии или синтез интерферона лейкоцитами резко подавляется при возникновении ультразвуковой кавитации. Подавление кавитации каким-либо способом обычно защищает клетки от разрушения и даже от более тонких изменений.
Скорость разрушения амебы Actanamoeba castellanii уменьшается, если облучать импульсным ультразвуком клетки, суспендированные в растворе желатина, порог кавитации в котором из-за его большой вязкости значительно выше, чем в воде.
Этим же объясняется снижение скорости ультразвукового разрушения эритроцитов при увеличении их концентрации, вплоть до почти полной остановки гемолиза, если суммарный объем частиц в суспензии достигает 2 %, что соответствует высоким значением эффективной вязкости среды.
Самого факта появления пульсирующих газовых пузырьков в среде еще недостаточно для разрушения клеток. Эффект наблюдается, если амплитуда пульсаций пузырьков возрастает до определенной величины. Величина эта различна для разных клеток, зависит от их формы и размера, а также прочности цитоплазматической мембраны и наличия цитоскелета.
Разрушение лейкоцитов в поле стабильных, пульсирующих с частотой 20 кГц пузырьков начинается при увеличении амплитуды колебаний до 8 мкм, высвобождение гемоглобина из эритроцитов - при 15...20 мкм. Очевидно, что эти эффекты обусловлены возникновением достаточно больших гидродинамических усилий вблизи колеблющегося пузырька, нарушающих целостность клеточных мембран.
При высоких частотах ультразвукового воздействия на суспензию клеток механизмы разрушения также имеют механическую природу. Пороговая интенсивность ультразвука, вызывающего гибель клеток, зависит как от частоты ультразвука, так и от типа клеток. Например, порог разрушающего действия ультразвука для клеток одной из популяций элодеи равен 75 мВт/см2 и находится в области 0,65 МГц, а для двух других популяций элодеи гибельная для клеток минимальная интенсивность равна 180 мВт/см2 (5 МГц).
Ультразвуковая дезинтеграция клеток получила широкое применение » биотехнологии, в биохимических и вирусологических исследованиях для выделения отдельных веществ или фрагментов клеток, а также в лабораторной диагностике для определения механической резистентности клеточных мембран (см. § 2,4).
1.12.2. Кавитация в тканях под действием низкочастотного ультразвука
В ряде случаев для получения требуемого биологического эффекта используют непрерывный ультразвук довольно большой мощности, с частотой 20…44 кГц, Источником такого ультразвука являются, например, хирургические инструменты, режущая кромка которых вибрирует с ультразвуковой частотой, что существенно облегчает резание тканей; вибрирующие инструменты для стоматологии и пр. Амплитуды колебания ультразвуковых хирургических инструментов в рабочем режиме достигают весьма больших значений, при которых вероятность возникновения кавитации в тканях весьма велика. Подтверждением этому может служить слабый характерный шум при иссечении мягких тканей, аэрозоль (туман), образующийся при разрушении папиллом ультразвуковым зондом, ультразвуковое свечение.
1.12.3. Кавитация в тканях под действием высокочастотного ультразвука
Вопрос о кавитации в биологических тканях под действием ультразвука с частотой 1 МГц и интенсивностью 0,05…2 Вт/см2 является предметом многолетней дискуссии. Сложность идентификации кавитации в ткани обусловлена ее относительной непрозрачностью, препятствующей непосредственному наблюдению и затрудняющей применение оптических методов.
Факт протекания кавитационных процессов в данной среде может быть надежно установлен при одновременном появлении, но крайней мере, трех эффектов, сопровождающих кавитацию; характерного шума, ультразвуковых химических реакций или свечения, микропотоков.
Косвенным подтверждением возможного возникновения кавитации в тканях могут служить «дыры», обнаруженные на гистологических препаратах тканей печени и других органов, облученных ультразвуком с частотой 1 МГц и интенсивностью 0,05…2 Вт/см3.
Пороги кавитации для фокусированного ультразвука в тканях не более чем в 1,5-2 раза выше, чем и отстоявшейся водопроводной воде. Гели это соотношение сохраняется и для плоской бегущей волны, то кавитацию в тканях можно ожидать при интенсивности, превышающей 0.6 Вт/см2, так как теоретический порог кавитации в воде около 0,3 Вт/см2.
Основными признаками акустической кавитации в воде и водных средах, насыщенных воздухом, помимо характерного шума можно считать ультразвуковое свечение и синтез Н2О2, H2NO2, H2NO3 а также свободных радикалов и других химически активных частиц. Эти явления наблюдаются в воде и разбавленных водных растворах при интенсивности 0,3 Вт/см2 (SA), а в плазме крови при 0,8 Вт/см2.
Очевидно, что под действием ультразвука химически активные частицы могут образоваться непосредственно в клетке. Это мало отразится на картине ультразвукового повреждения, но может принести к самым неожиданным последствиям - нарушению обменных процессов в клетке, изменению ее наследственного аппарата и т. п.
Пожалуй, только при ультразвуковом воздействии источник свечения - кавитирующий пузырек - может находиться вблизи или внутри самой клетки. Влияние этого излучения, особенно его ультрафиолетовой составляющей, может обусловить, в зависимости от интенсивности и условий облучения, стимуляцию и повышение жизнеспособности клеток, находящихся в угнетенном физиологическом состоянии, торможение деления клеток и их отдаленную гибель, увеличение проницаемости клеточных мембран, конфирмационные изменения и молекуле ДНК, инактивацию некоторых ферментов и другие эффекты.
Измерение интенсивности ультразвукового свечения в оптически плотных животных тканях затруднительно, а идентификация образующихся в ультразвуковом поле частиц химическими или биохимическими методами практически невозможна, что обусловлено их малой концентрацией и высокой химической активностью.
Использование в качестве модели относительно прозрачной ткани клубня картофеля позволяет измерить в ней интенсивность ультразвукового свечения и определить пороги кавитации, сопровождающейся образованием химически активных частиц и, очевидно, другими, свойственными кавитации, эффектами.
Для определения порога кавитации клубень картофеля нарезают на пластинки толщиной 0,05...0,25 см. Пластинки «притирают» к поверхности излучателя ультразвука, слегка смоченного водой для обеспечения акустического контакта. Свечение ткани регистрируют с помощью фотоумножителя (рис. 1.6). Химически активные частицы в тканях при ультразвуковой кавитации определяют по свечению пластинок, предварительно вымоченных в течение нескольких часов в растворе люминала. Реакция люминала с пероксидом водорода или OH-радикалами, как известно, сопровождается характерным голубовато-зеленым свечением.
При облучении ткани клубня картофеля непрерывным ультразвуком с частотой 880 кГц свечение возникает при интенсивностях 0.3-0.4Вт/см2 (SA) и усиливается с увеличением интенсивности ультразвука.
Характер зависимости свечения ткани картофеля от интенсивности ультразвука сходен с аналогичной зависимостью для воды и водных растворов. Очевидно, что в обоих случаях ультразвуковое свечение обусловлено кавитацией.
Дополнительным свидетельством этому служит шум в ткани картофеля, регистрируемый с помощью гидрофона на частоте первой субгармоники (табл. 1.4), а также интенсивное свечение, возникающее при ультразвуковом облучении образцов, пропитанных люминолом. Оно обусловлено взаимодействием люминола с Н2О2 и ОН радикалами, которые образуются при ультразвуковой кавитации. Минимальное значение интенсивности ультразвука, вызывающее это свечение, также равно 0,3...0,4 Вт/см2.
Сравнение приведенных данных с зависимостью порога возникновения ультразвукового свечения от вязкости растворов глицерина (рис. 1.7) показывает, что пороги кавитации в ткани и в растворах с вязкостью 0,25 П одного порядка.
Рис. 1.6. Регистрация свечения ткани:
1 -фотоэлектронный умножитель;
2 - исследуемая ткань;
3 - источник ультразвука.
Таблица 1.4
Пороги ультразвуковых эффектов
|
Объект |
Эффект |
Порог (SA) Вт/сма |
|
Вода |
Пузырьки газа |
0,10 |
|
Синтез Н202, H2N02 H2NO3 |
0,12 | |
|
Ультразвуковое свечение |
0,12 | |
|
Ткань клубня картофеля |
Акустический сигнал на частоте |
0,10 |
|
Ультразвуковое свечение |
0,30-0,40 | |
|
Ультразвуковое свечение ткани, пропитанной люминалом (синтез H2O2) |
0,30-0,40 | |
|
Акустический сигнал на частоте |
0,20-0,30 |
Вязкость цитоплазмы достигает (предположительно) 1 П3. Однако снижению порога кавитации в тканях, как указывалось ность, а также обусловленное внутриклеточными микротечениями обратимое уменьшение вязкости клеточного содержимого. выше, может способствовать их гетерогенность, а также обусловленное внутриклеточными микротечениями обратимое уменьшение вязкости клеточного содержимого.
Зависимость ультразвукового свечения ткани от ее толщины имеет периодический характер (рис 1.8), что обусловлено возникновением стоячих волн при высотах, кратных половине длины волны.
Исходя из этих данных и зная частоту ультразвуковых колебаний, можно оценить скорость ультразвука в ткани клубня картофеля. Она оказалась равной 1,6-103 м/с, что, по крайней мере в пределах точности измерения, не противоречит справочным данным.
Рис. 1.7. Зависимость порога кавитации от вязкости (и растворах глицерина)
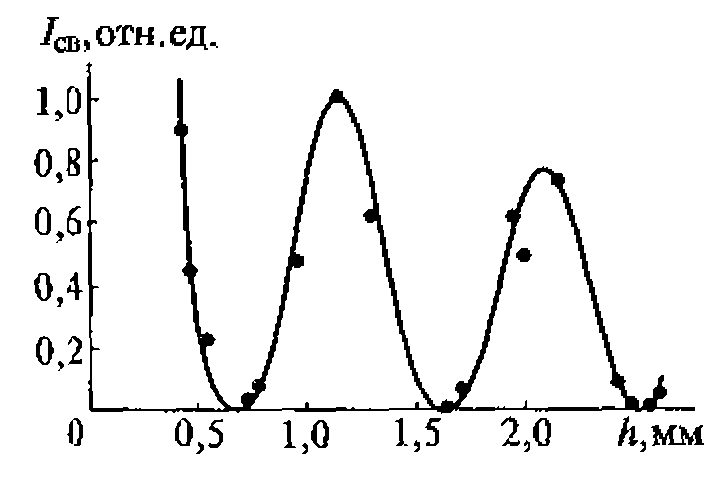
Рис. 1.8. Зависимость интенсивности ультразвукового стечения ткани от ее толщины
Порог кавитации в жидкости заметно повышается при уменьшении облучаемого ультразвуком объема. Аналогичная зависимость, очевидно, существует и в биологических тканях, где порог кавитации при фокусировании ультразвука возрастает до значений, превышающих 10 Вт/см2 (см. § 4.2). Столь высокие интенсивности ультразвука вызывают необратимое разрушение ткани в фокальной области.
1.12.4. Кавитация в тканях под действием «диагностического» ультразвука
В последнее время ультразвуковые методы все более широко применяются в медицине и ветеринарии. При этом соображения безопасности стимулируют постоянное снижение интенсивности диагностического ультразвука при разработке новых методов, а для увеличения информативности и разрешающей способности ультразвуковых методов требуется применение коротковолнового (высокочастотного) ультразвука. Однако с повышением частоты увеличивается поглощение ультразвука тканями, и для визуализации внутренних органон необходим достаточно интенсивный ультразвук, обеспечивающий уверенный прием отраженного от глубоколежащих тканей сигнала Поиски компромисса привели к использованию в диагностике либо непрерывного ультразвука относительно низкой частоты (1...2 МГц) и невысокой интенсивности (меньше 0,05 Вт/см2), либо импульсного высокочастотного (до 10 МГц), мощного (до 500 Вт/см2) ультразвука с короткой длительностью импульсов (2...5 мкс) и невысокой частотой их чередования (~1 кГц). Несмотря на высокую интенсивность в импульсе, усредненная по времени и пространству интенсивность в этом случае не превышает тысячных долей Вт/см2, Вероятность возникновения кавитации в таких условиях пренебрежимо мала.
1.13. ИЗЛУЧАТЕЛИ УЛЬТРАЗВУКА
Существует множество устройств-преобразователей, применяемых для возбуждения ультразвуковых колебаний и воли в газах, жидкостях и твердых телах. Эти устройства преобразуют тепловую, механическую, электрическую или другие виды энергии в энергию ультразвукового поля.
Проще всего получить ультразвук, используя обычную струну. Частота колебаний струны, как известно, зависит от длины и, постепенно укорачивая ее, можно извлекать все более высокие звуки. Струна длиной в 10 см колеблется уже с частотой 25 кГц, находящейся за пределами возможностей человеческого слуха.
Струна в качестве механического преобразователя используется в монохорде - приборе для определения верхнего предела слышимости.
Этим, однако, и ограничивается применение монохорда, поскольку колебания струны обладают слишком малой энергией и быстро затухают.
Наиболее удобными для исследовательских и практических целей в ветеринарии, медицине, экспериментальной биологии и ультразвуковой технологии оказались электроакустические преобразователи, в частности пьезоэлектрические и магнитострикционные. Нашли применение также струйные излучатели - ультразвуковые свистки, преобразующие кинетическую энергию струи газа или жидкости в энергию акустических колебаний. Газоструйные излучатели наиболее эффективны для получения аэрозолей в больших объемах.
Излучатели ультразвука характеризуются мощностью излучения, частотой колебаний, направленностью излучения, коэффициентом полезного действия.
Наибольшее распространение в ультразвуковой медицинской технике получили пьезоэлектрические преобразователи. Позволяя получать акустические колебания в диапазоне частот от нескольких кГц до десятков и сотен МГц, они используются в аппаратах для ультразвуковой терапии, в диагностических приборах, применяемых в медицине и ветеринарии, в устройствах для ультразвуковой стимуляции биотехнологических процессов.
Принцип действия пьезоэлектрических преобразователей основан на эффекте, открытом в 1860 г Пьером и Жолио Кюри, наблюдавшими его у кварца и некоторых других кристаллов.
Если пластинку, определенным образом вырезанную из пьезоэлектрика, подвергнуть деформации, то на ее поверхности появятся электрические заряды. Это явление получило название прямого пьезоэффекта.
При внесении пластинки в электрическое поле она деформируется, и величина деформации линейно зависит от напряженности электрического поля (обратный пьезоэффект). Переменное электрическое поле вызывает периодические деформации в пьезоэлектрике, частота которых равна частоте изменения электрического поля, Амплитуда деформации достигает наибольших значений, если частота переменного электрическою поля совпадает с собственной частотой колебаний преобразователя, определяемой его размерами.
Периодические деформации пьезоэлектрического преобразователя и служат источником акустических волн.
В ветеринарии, биотехнологии и экспериментальной биологии наряду с высокочастотным ультразвуком используется и ультразвук низкой частоты, весьма эффективный для решения ряда практических задач.
Ультразвук в диапазоне частот от самых низких и до примерно 100 кГц чаще всего получают, применяя магнитострикционные преобразователи, представляющие собой сердечник с навитой на нею обмоткой. Переменный ток, протекающий по обмотке, создает переменное магнитное поле, преобразующееся в энергию механических колебаний сердечника. Следует отметить, что этот эффект обратим, т. е. если деформировать сердечник, то в нем возникает магнитное поле, которое вызывает в обмотке появление электрического тока.
В зависимости от поставленной цели магнитострикционные преобразователи используют в сочетании с теми или иными пассивными элементами - диафрагмами, если необходимо воздействовать на процессы, протекающие в жидкости, или стержневыми концентраторами, обеспечивающими увеличение амплитуды колебаний и составляющими основу ультразвуковых хирургических и инструментов.
В медицине и ветеринарии газоструйные излучатели не получили широкого распространения. Они применяются только для получения аэрозолей в больших производственных помещениях - па фермах, птицефабриках и пр.
В отличие от магнитострикционных и пьезоэлектрических преобразователей газоструйные излучатели генерируют колебания в широком диапазоне частот, в том числе звуковых. Этим существенно ограничивается применение газоструйных аэрозольных генераторов, так как их работа сопровождается сильным шумом.
Газоструйный генератор аэрозоля представляет собой совокупность ультразвукового свистка и пульверизатора (рис. 1.9). Воздушная струя увлекает с собой жидкость из резервуара и вместе с нею через кольцевой зазор попадает на отражатель. Часть смеси воздуха с каплями жидкости отражается во внутренний объем. Здесь давление периодически повышается до критических значений, достаточных для разрыва кольцевой струи. После этого давление в резонирующем объеме снова падает ниже критического, и цикл повторяется.
Рис. 1.9. Газоструйный генератор аэрозоля:
1 - подача сжатого воздуха; 2 - отражатель кольцевой струи; 3 - кольцевой сопла
Такой газоструйный излучатель ультразвука обеспечивает дробление захваченной струей воздуха жидкости на капли микронных размеров, образующих стабильное облако аэрозоля.
1.14. ПРИЕМНИКИ УЛЬТРАЗВУКА
Обнаружить в жидкости поле ультразвука относительно большой интенсивности достаточно просто по совокупности характерных признаков: появлению па поверхности жидкости ряби, а при более высоких интенсивностях и фонтана; по акустическим течениям, приводящим к перемешиванию жидкости; по кавитации, сопровождающейся характерным шумом, ультразвуковым свечением, специфическими химическими реакциями, эрозией поверхности предметов в ультразвуковом поле; по выделению тепла, особенно на границах тел с отличающимися акустическими сопротивлениями и т, д.
Измерить параметры ультразвука - его интенсивность, амплитуду колебания, колебательную скорость и ускорение частиц в ультразвуковой волне, а также ультразвуковое давление - можно при помощи специальных устройств - приемников ультразвука. Приемники, размеры которых намного больше длины волны ультразвука, дают усредненные значения измеряемой величины, а структуру ультразвукового поля можно получить лишь с помощью приемников, размеры которых меньше длины волны.
В биомедицинской практике, как правило, учитывают частоту и интенсивность ультразвука, а также форму поля. В биотехнологии при использовании низкочастотного ультразвука измеряют плотность акустической энергии в среде.
Частота ультразвука обычно задается конструкцией и параметрами излучателей. Частота не может быть выбрана произвольно, она должна соответствовать одной из частот, разрешенных Международной электротехнической комиссией.
В медицине и экспериментальной биологии для воздействия на организм с хирургической или терапевтической целью обычно используют ультразвук с частотами 22, 44, 880 кГц, 2,65 МГц, а также ультразвук более высоких частот в диапазоне 2...10 МГц для применения в диагностике.
Природа ультразвуковых эффектов качественно одинакова в широком диапазоне частот, и лишь количественные различия приводят к появлению характерных особенностей, оправдывающих условное деление ультразвукового диапазона на низкочастотный и высокочастотный.
Биологическое действие ультразвука весьма существенно зависит от его интенсивности, меняя которую, можно получить любые эффекты - от стимуляции до разрушения. Поэтому выбор, а значит, и измерение интенсивности ультразвука требует особой тщательности.
Из множества разработанных к настоящему времени методов измерения интенсивности ультразвука в медицине чаще всего используется радиометр (ультразвуковые весы), позволяющий определить усредненную интенсивность, но давлению звукового излучения.
Для более точных измерений используют калориметрический метод, основанный на измерении изменения температуры в теплоизолированном сосуде (термосе), заполненном поглощающим ультразвук веществом. Этот метод, так же, как и радиометрический, позволяет определить только средние значения интенсивности ультразвука и характеризуется еще большей инерционностью.
Для измерения интенсивности ультразвука в разных точках поля и в тех случаях, когда необходимо знать характер быстрых изменений интенсивности ультразвука во времени, используют ультразвуковые приемники-зонды, размеры которых меньше длины волны.
Рис. 1.10. Конструкция миниатюрного гидрофона:
1 - никелевая трубочка; 2 - металлизированный внутри и снаружи пьезокерамический цилиндр; 3 - легкоплавкий припой; 4 - изолирующая прокладка; 5 - экранирующая крышка из фольги; 6 - пленка эпоксидного лака
Простейший по конструкции ультразвуковой зонд представляет собой дифференциальную термопару, один из спаев которой сенсибилизирован слоем эпоксидной смолы.
Пьезоэлектрические приемники ультразвука в жидких средах (гидрофоны) значительно превосходят термопарные зонды по многим параметрам. Приемники этого типа преобразуют ультразвуковой сигнал непосредственно в электрический. Их крайне малая инерционность позволяет воспроизводить форму сигнала и, следовательно, получать информацию о его амплитуде, фазе, частоте и спектре.
Одна из простейших конструкций приемника ультразвука с цилиндрическим пьезокерамическим приемным элементом (гидрофона) показана на рис. 1.10.
1.15. ВИЗУАЛИЗАЦИЯ УЛЬТРАЗВУКОВОГО ПОЛЯ
Ультразвуковое поле в однородной среде невозможно разглядеть невооруженным глазом. Однако в ряде случаев результат действия ультразвука па вещество сопровождается зримыми изменениями, что позволяет видеть форму и отдельные детали ультразвукового поля, иными словами, визуализировать его. Если, например, в жидкости, в которой взвешены мелкие частицы, возникает стоячая волна, то эти частицы, в зависимости от их свойств, концентрируются в пучностях или узлах, делая видимой структуру стоячей волны.
Если в подкрашенную воду опустить листок бумаги, то частицы краски тем быстрее будут диффундировать в бумагу, чем выше интенсивность ультразвука. Через короткое время на поверхности листка возникнут характерные пятна, по которым можно судить о распределении интенсивности ультразвука в поле.
Метод визуализации ультразвукового поля с помощью бумаги и красителя информативен, прост и дешев, но применим в основном для исследования ультразвуковых полей в жидких средах.
При изучении распространения ультразвука в биологических тканях удобно применять метод визуализации, предусматривающий использование в качестве модели ткани клубня картофеля и водного раствора KI. Ультразвук увеличивает проницаемость клеточных мембран по отношению к растворенным веществам, в частности к ионам йода, которые проникают внутрь клеток картофельного клубня. После окисления ионов до атомарного йода образуются характерно окрашенные комплексы с крахмалом, содержащимся в пластидах. В межклеточном пространстве крахмала практически нет.
Чтобы визуализировать ультразвуковое поле, образцы правильной формы (цилиндры, кубики), вырезанные из клубня картофеля, подвергают действию ультразвука, нарезают на тонкие (1мм), пластинки, помещают на 7...10св 1 моль раствор йодистого калия и на 2...3 с - в 3% раствор перекиси водорода, В результате получаются окрашенные «срезы» ультразвукового поля в ткани клубня. Этим методом можно, например, визуализовать фокальное пятно фокусированного ультразвука, исследовать влияние ультразвукового хирургического инструмента на рассекаемую ткань (см, подраэд. 4 .1.2).
Список литературы
1. Гаврилов Л.Р., Цирульников Е.М. Фокусированный ультразвук в физиологии и медицине. Л-д.; Наука, 1980.
2. Ершов Ю.А., Плетенева Т.Е. Механизмы токсического действия неорганических соединений. М.; Медицина, 1989.
3. Журавлев А.И., Акопян В.Б. Ультразвуковое свечение. М.: Наука, 1977.
4. Маргулис М.А. Звукохимические реакции и сонолюминесценция. М,: Химия, 1986.
5. Применение ультразвука в медицине. Физические основы / Пер. с англ.; Под ред. К. Хилла. М.: Мир, 1989.
6. Флинн Г. Физика акустической кавитации в жидкости // Физическая акустика / Пер. с англ.; Под ред. У. Мэзопа. Т. 3, Ч. Б. М.; Мир, 1967.
7. Эльпинер Н.К. Биофизика ультразвука. М.: Наука, 1973.
2. УЛЬТРАЗВУКОВЫЕ МЕТОДЫ ДИАГНОСТИКИ
Диагностические методы, основанные на применении ультразвука, в последнее время широко используются для получения информации о глубинных структурах живых организмов. Ультразвуковые методы применяют для изучения некоторых особенностей строения теток и клеточных органелл, для оценки механической прочности цитоплазматических мембран. Ультразвуковые методы диагностики безвредны и весьма информативны. Это делает их ведущими среди физических средств интроскопии и функциональной диагностики человека и животных,
История развития методов ультразвуковой диагностики насчитывает немногим более полувека. За этот период развились и выделились в самостоятельные направления: ультразвуковая визуализация внутренних органов, позволяющая обследовать состояние печени, желудка, поджелудочной железы, селезенки, почек, гениталий; ультразвуковая эхокардиография, обеспечивающая диагностику различных пороков сердца, нарушения центральной гемодинамики, а также проведение ряда других кардиологических исследований; эхоэнцефалография - комплекс методов для исследования головного мозга; ультразвуковая остеометрия, дающая возможность исследовать состояние костной структуры без нарушения целостности покровных тканей; ультразвуковая цитолизометрия, позволяющая получать информацию о механических свойствах клеточных мембран и пр.
Методы ультразвуковой диагностики удобно рассматривать, условно разделив их на группы по принципу действия, а также по способу получения и обработки информации.
2.1. УЛЬТРАЗВУКОВЫЕ ЭХОМЕТОДЫ
Ультразвуковые эхометоды основаны на эффекте отражения ультразвука от границ между тканями с различными акустическими свойствами. Эти методы позволяют дифференцировать мягкие ткани, различающиеся по плотности всего лишь на 0,1%, тогда как рентгенография, например, дает возможность различать ткани, если плотность одной из них отличается от плотности другой не менее, чем на 10 %.
2.2.1. Одномерная эхолокация
Наиболее простыми методами ультразвуковой диагностики являются, пожалуй, методы, основанные на принципе одномерной (1D) эхолокации (рис. 2.1). Зондирующий импульс ультразвука, излученный преобразователем, распространяется в ткани до ее границы и, частично отражаясь от этой границы, возвращается к преобразователю, Зондирующие импульсы и принимаемые в промежутках между ними отраженные импульсы отображаются на экране электроннолучевой трубки вертикальными отклонениями (всплесками), расстояние между которыми соответствует глубине, на которой в организме располагаются отражающие препятствия - границы тканей, органов, полостей. Расстояние между излучателем ультразвука (поверхностью тела) и отражающей преградой S-2ct, где с - скорость ультразвука в среде, а t - промежуток времени между моментом излучения ультразвукового импульса и моментом регистрации импульса, отраженного от препятствия.
Амплитуда отраженных сигналов очевидно зависит от различий в акустических импедансах (![]() ) тканей, на границе между которыми отражается ультразвук. Эти сигналы несут информацию о соотношении в скоростях ультразвука и плотностях граничащих тканей. Изображение на экране электронно-лучевой трубки называют одномерной эхограммой, или регистрацией типа А (от англ. Amplitude отклонение).
) тканей, на границе между которыми отражается ультразвук. Эти сигналы несут информацию о соотношении в скоростях ультразвука и плотностях граничащих тканей. Изображение на экране электронно-лучевой трубки называют одномерной эхограммой, или регистрацией типа А (от англ. Amplitude отклонение).
Одномерные ультразвуковые эхолокаторы нашли широкое применение, например в диагностике гематом при черепно-мозговых травмах. С помощью эхоэнцефалоскопа измеряют и сравнивают расстояния от левой и правой височных костей до поверхности раздела двух полушарий мозга, но смещению которой судят о наличии и величине гематом или других патологических нарушениях.
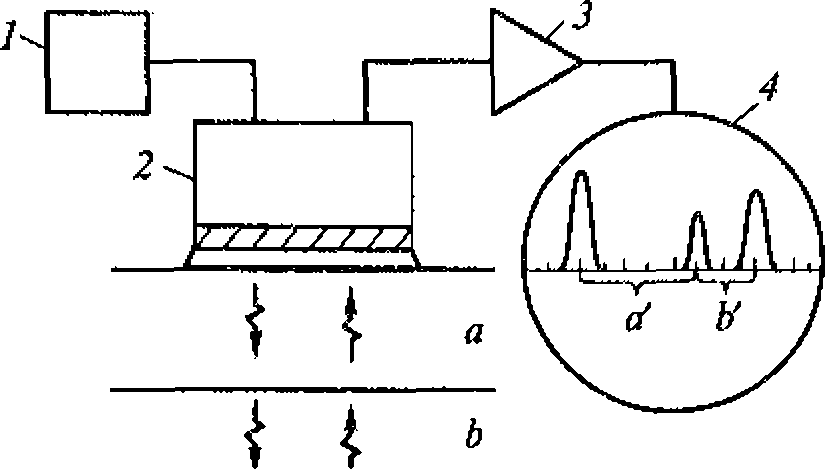
рис. 2.1. Принцип одномерной эхолокации:
1 - генератор импульсов; 2 - эхозонд; 3 - усилитель; 4 экран осциллографа; a и b толщины слоев тканей; а' и b' - соответствующие расстояния между импульсами
на экране
Поскольку поглощение ультразвука тканью мозга достаточно велико и растет с увеличением частоты, для эхоэнцефалографии используют сравнительно низкие ультразвуковые частоты - от 0,8 до 1,8 МГц. В этом диапазоне частот при средней скорости ультразвука 1500 м/с длины ультразвуковых волн составят 1,5...0,8 мм, а поскольку точность измерений не может превысить половины длины волны, то смещение границы между полушариями можно определить с точностью до 1...1,5мм. При эхоэнцефалографии более высокая точность, как правило, и не требуется.
Одномерная эхография удобна и для выявления внутрибрюшинного кровотечения при травмах живота. Известно, что в норме листки брюшины в боковых отделах живота плотно соприкасаются, а при скоплении крови или иной жидкости в брюшинной полости между ними появляется расстояние, легко фиксируемое одномерными эхолокаторами.
В настоящее время разработано много моделей ультразвуковых эхолокаторов для определения размеров различных тканей, значительно ускоривших процесс диагностики у людей и определения упитанности животных. Ультразвуковые локаторы безвредны, их использование не связано с болевыми ощущениями и не требует соблюдения условий стерильности.
Эхо-методы успешно применяют в маммографии для определения изменений в молочных железах женщин и диагностики патологий вымени. На эхограмме хорошо идентифицируются пики, свидетельствующие об отражении ультразвука от известных внутренних структур - подвешивающих связок, стенок молочных протоков, цистерн. По эхограмме можно определить асимметрию молочных желез, связанную с патологическими изменениями в них. Метод позволяет также обнаружить опухоли, очаги кальцификации, а также инородные тела в молочной железе.
Весьма полезна эхография и в диагностике заболеваний придаточных пазух носа.
Чем меньше измеряемые расстояния, тем быстрее эхо-импульс вернется к ультразвуковому преобразователю. При очень малых расстояниях этот промежуток времени может оказаться меньше так называемого мертвого времени интервала между моментом посылки зондирующего импульса и моментом, когда приемная система окажется готовой принять отраженный сигнал. Обычно это «мертвое время» составляет 10...20 мкс, и сигналы, пришедшие из глубины менее 15...20 мм, просто не воспримутся. Для того чтобы исследовать ближнюю зону используют линии задержки, например проводят измерения через слой воды толщиной в 25мм, а затем вычитают его толщину из полученных результатов. В современных ультразвуковых офтальмометрах приборах, предназначенных для исследования внутриглазных структур, эта операция выполняется автоматически.
2.1.2. Двумерная эхолокация
Методы двумерной (2D) эхолокации позволяют получить значительно больше информации о строении внутренних органов, чем методы, основанные на одномерной эхолокации. Если при одномерной эхолокации луч ультразвука остается неподвижным в пространстве, то при двумерной он либо исходит из одной точки, периодически меняя угловое направление и образуя веерное ноле обзора (секторное сканирование), либо ультразвуковой луч перемещается параллельно самому себе, занимая соседние положения в выбранной плоскости (линейное сканирование), либо излучатель-приемник (эхозонд) перемещается в заданной плоскости (сплошное двумерное сканирование).
Двумерная эхолокация с секторным сканированием предназначена главным образом для определения конфигурации и взаимного расположения органов и тканевых структур, отличающихся по акустическим параметрам и расположенных в зоне локации. Электронная схема обеспечивает изменение яркости точки, высвечивающейся на экране, пропорционально интенсивности луча, отраженного от акустических неоднородностей, Такой метод представления информации называется методом (от англ. Brightness - яркость). Этот вид локации позволяет определить геометрию внутренних структур и оценить плотность и неоднородность тканей. Если соседние ткали недостаточно отличаются друг от друга по акустическим свойствам, то контрастность изображения можно повысить, вводя в полости органов или кровь специально подобранные биологически безвредные так называемые эхоконтрастные вещества.

Рис. 2.2. Секторное сканирование качающимся ультразвуковым зондом:
1 - качающийся эхозонд; 2 - контейнер с жидкостью;
3 поверхность тела; 4 - сектор сканирования
Секторное сканирование ультразвукового луча осуществляется механически или электронным способом. При механическом сканировании либо эхозонд совершает периодические колебательные движения (рис. 2.2) (при этом ультразвуковой луч меняет направление в плоскости сканировании на угол, обычно равный 90о), либо один или несколько преобразователей (как правило три) вращаются на общем барабане.
Эхолокация секторным сканированием широко применяется в кардиологии и позволяет весьма точно оценить состояние сердца. Возможность введения луча ультразвука через межреберные промежутки позволяет без искажений и поглощения ультразвука в костной ткани практически полностью визуализировать камеры сердца и околосердечные структуры. При этом на экране исследователь видит движущееся изображение, что существенно обогащает диагностическую информацию. Секторное сканирование широко применяется при исследованиях органов брюшной полости, щитовидной и молочной желез, в гинекологической и акушерской практике, в офтальмологии.
Простота и легкость осуществления эхографии но сравнению с рентгенографией делает ее незаменимой в хирургии для обнаружения инородных тел, для проведения эндоскопических операций иод визуальным контролем и в ряде других случаев.
Двумерная эхолокация с линейным сканированием позволяет формировать эхограммы в виде прямоугольных изображений. Такое представление эхограмм удобно, когда одновременно и в одинаковом масштабе требуется отобразить детали, находящиеся вблизи от поверхности тела и в глубине его. Линейное сканирование очень удобно при исследованиях в акушерстве, а также для визуализации почек, мочевого пузыря и других внутренних органов.
В последнее время двумерная эхолокация все шире применяется для исследования физиологии и патологии репродуктивных органов сельскохозяйственных животных. Расстояние от поверхности тела до репродуктивных органов у мелких животных - овец, свиней, коз, кроликов, а также собак и кошек невелико, что позволяет визуализовать их внутренние органы, прикладывая эхозонд к поверхности тела. Информация, полученная с помощью эхолокации, уникальна, так как ее практически невозможно получить другими способами, например трансректальной пальпацией (прощупыванием через стенку прямой кишки). У крупных животных - коров, лошадей, верблюдов, ультразвуковой сигнал сильно затухает, проходя от поверхности тела до репродуктивных органов, что существенно снижает ценность эхограмм. Увеличение интенсивности ультразвука для повышения качества изображений может оказаться небезвредным для организма животных, и в таких случаях эхографию проводят, вводя эхозонд в прямую кишку животному и располагая его над исследуемым органом.
Эхография позволяет следить за развитием плода и формированием его органов, проводить внутриутробную диагностику многоплодия и врожденных болезней, определять физиологическое состояние плода по сердцебиению и подвижности, прогнозировать и диагностировать гибель плода.
2.1.3. Одномерная эхолокация движущихся структур
Одномерная эхолокация движущихся структур с отображением информации А-методом неудобна, так как наблюдать и измерять постоянно меняющиеся расстояния между пиками на эхограмм е весьма непросто. Значительно удобнее для этих целей так называемый метод Л-локации (от английского слова Motion - движение). В отличие от А-метода при М методе эхо сигналы на экране электроннолучевой трубки отображаются в виде светящихся точек, находящихся в тех местах, где при одномерной эхолокации располагались бы пики. Ряд светящихся точек движется вертикально по экрану, прорисовывая прямые линии, если поверхности, от которых отражается ультразвук, неподвижны. Если же взаиморасположение отражающих поверхностей меняется, то меняется и расстояние между светящимися точками, и па экране будут формироваться линии, отображающие движение этих поверхностей. Так, при локации сердца на экране образуется группа линий, отражающих взаиморасположение кардиоструктур во времени. Такой способ представления информации о работе сердца называется эхокардиограммой или М-эхокардиограммой (рис. 2.3),

Рис. 2.3. Пример М-эхокардиограммы с акустическим изображением сердца
М-эхокардиограммы завоевали своей информативностью большую популярность в кардиологических исследованиях, так как помимо геометрических размеров на эхокардиограмме отражаются и их изменения, что позволяет определять скорость движения кардиоэлементов и исследовать фазовую структуру кардиоциклов.
2.1.4. Доплеровские методы в ультразвуковой
диагностике
Методы, основанные на эффекте Доплера, обладают большими возможностями и занимают важное место в ультразвуковой диагностике. Они позволяют изучать динамику ряда физиологических процессов в организме, оценивать скорости и направление течения крови, движение кардиоструктур и стенок кровеносных сосудов.
Эффект Доплера заключается в том, что частота волн, испускаемых источником (fо), совпадает с частотой волн, регистрируемых приемником (f), только тогда, когда приемник и источник либо неподвижны относительно окружающей их среды, либо движутся относительно не сравнимы по величине и совпадающими по направлению скоростями. Во всех остальных случаях ![]() . Известно, например, что тон сирены приближающегося поезда кажется более высоким, чем тон сирены поезда, удаляющегося от человека, стоящего у железнодорожного полотна.
. Известно, например, что тон сирены приближающегося поезда кажется более высоким, чем тон сирены поезда, удаляющегося от человека, стоящего у железнодорожного полотна.
Принцип эффекта Доплера нетрудно понять, если представить, что источник волн (излучатель) как бы дополнительно сжимает их, если движется по направлению к приемнику, и, следовательно, приемник зарегистрирует волны более высокой частоты. Обратную картину можно представить, если источник удаляется от приемника (рис. 2.4).
Рис. 2.4 Принцип возникновения эффекта Доплера:
1- волна от неподвижного излучателя (И) к неподвижному приемнику (П); 2 - волна при движении излучателя к приемнику; 3 - волна при удалении излучателя от приемника
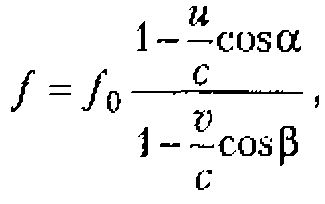
Можно показать, что в одном случае, когда и источник, и приемник движутся с разными по величине и направлению скоростями относительно окружающей среды, то частоту, регистрируемую приемником, определяют по формуле:
где ![]() - частота, излучаемая источником;
- частота, излучаемая источником;
и - скорость приемника;
v - скорость источника относительно среды;
![]() и
и ![]() - углы между направлениями движения соответственно источника и приемника и соединяющей их прямой.
- углы между направлениями движения соответственно источника и приемника и соединяющей их прямой.
Эффект Доплера возникает и при отражении волн от движущейся поверхности, которую можно рассматривать как движущийся приемник волн, излучаемых источником, и в то же время как движущийся источник отраженных волн.
Разность частот сигналов, излучаемых источником и принимаемых приемником после отражения от движущейся поверхности, называют доплеровской частотой, которая определяется но формуле
![]()
Знаки «+» или «-» показывают, приближается ли к неподвижным относительно друг друга источнику и приемнику отражающая поверхность или удаляется от них. Если скорость движения отражающей волну поверхности (![]() ) значительно ниже скорости распространения волн в среде (что справедливо для всех применений эффекта Доплера в диагностике), то доплеровскую частоту можно вычислить по формуле
) значительно ниже скорости распространения волн в среде (что справедливо для всех применений эффекта Доплера в диагностике), то доплеровскую частоту можно вычислить по формуле
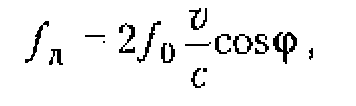
где ![]() - угол падения волны на отражающую поверхность. Частота, регистрируемая приемником, очевидно равна
- угол падения волны на отражающую поверхность. Частота, регистрируемая приемником, очевидно равна
![]()
В доплеровских методах диагностики применяют ультразвук с частотой 2 МГц.
Если принять скорость ультразвука в тканях равной 1500 м/с, а скорость движения стенки аорты при ее пульсациях примерно равной 1 м/с, то в случае, когда ультразвуковая волна падает нормально (перпендикулярно) к поверхности аорты, доплеровская частота окажется равной примерно 2,7 кГц, т. е. лежит в звуковом диапазоне. Именно поэтому электрический сигнал, несущий доплеровскую частоту, нередко выводят на наушники. Этот сигнал можно записать па обычный магнитофон и использовать для аналитических или учебных целей, либо записать па бумажную ленту в виде доплерэхограммы.
Для возникновения эффекта Доплера необязательно, чтобы ультразвук отражался от сплошной движущейся поверхности. Этот эффект возникает и при отражении акустических волн от частиц, взвешенных в жидкости и движущихся вместе с ее потоком. Если взвешенные в жидкости частицы движутся с такой же скоростью, что и сама жидкость (как это происходит и случае вязких жидкостей), то, вычислив скорость течения жидкости но доплеровской частоте, можно определить объемный расход жидкости в потоке по формуле
где s - площадь сечения потока (например, кровеносного сосуда). Этот аффект используется в приборах, называемых доплеровскими расходомерами.
В доплеровской диагностике используется как непрерывный, так и импульсный ультразвук. Применение непрерывного ультразвука дает возможность достичь высокой чувствительности, достаточной для регистрации кровотока в небольших кровеносных сосудах, в том числе у плода па ранних стадиях беременности матери, но не позволяет определить расстояние до подвижного препятствия. Доплеровские методы, основанные на применении импульсного ультразвука, обладают несколько меньшей чувствительностью, но позволяют определить расстояние от поверхности тела до подвижных отражающих структур - стенок сердца, сосудов, клеток крови.
Доплеровские методы весьма информативны в кардиологии, в акушерстве и других областях медицины и ветеринарии. При исследованиях, например гемодинамики, доплеровские расходомеры позволю определять ряд важных параметров кровотока в сосудистой системе, например скорости движения эритроцитов. Для этого датчик, в котором находятся источник и приемник ультразвука, приводят в акустический контакт с кожей, через которую ультразвук проходит в глубь тела и пересекает исследуемый кровеносный сосуд под углом (рис. 2.5).
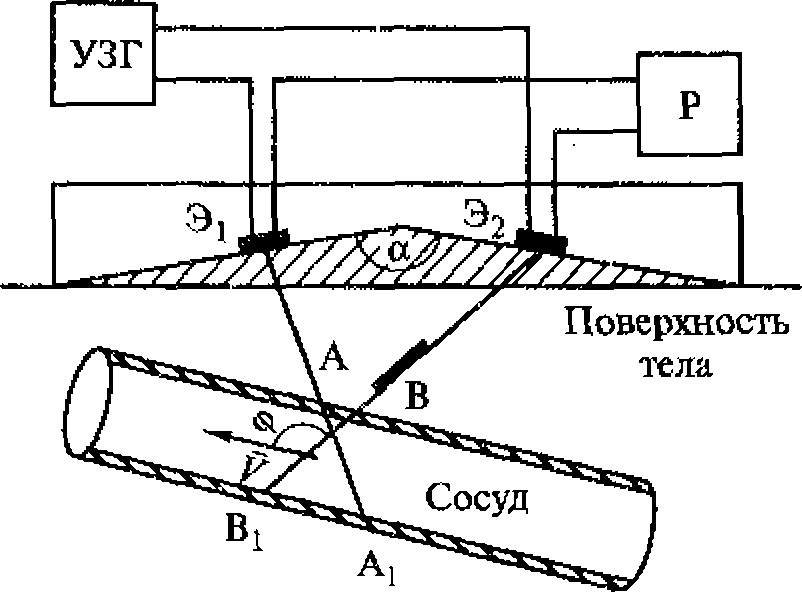
Рис. 2.5. Определение скоростей движения эритроцитов в кровеносном сосуде:
УЗГ - генератор электромагнитных колебаний ультразвуковой частоты: Э, и Э2 - эхозонды, расположенные пол углом друг к другу; Р - регистрирующее устройство; А, Л,, R, В, точки пересечения ультразвуковых лучей со стенками сосудов а - угол между ультразвуковым лучом от эхозонда Э2 и осью сосуда
Если ультразвук отражается от статических структур, которые встречаются на ею пути от источника до сосуда, то частота звука не меняется. Отражение ультразвука от пульсирующих стенок сосуда и от движущихся вместе с плазмой форменных элементов крови (в основном от эритроцитов) сопровождаем эффектом Доплера. Поскольку скорость пульсации стенок сосуда значительно меньше скорости движения эритроцитов, то доплеровская частота, вызванная движением стенок сосудов![]() , значительно меньше чем частота, обусловленная движением эритроцитов. Сигналы эти поддаются разделению, хотя мощность сигнала от стенок сосуда примерно в 30 раз больше мощности сигнала от эритроцитов. Различия в уровне сигналов объясняются тем, что пульсирующая поверхность стенки сосуда значительно превышает общую поверхность движущихся эритроцитов.
, значительно меньше чем частота, обусловленная движением эритроцитов. Сигналы эти поддаются разделению, хотя мощность сигнала от стенок сосуда примерно в 30 раз больше мощности сигнала от эритроцитов. Различия в уровне сигналов объясняются тем, что пульсирующая поверхность стенки сосуда значительно превышает общую поверхность движущихся эритроцитов.
По изменению частоты в большую или меньшую сторону доплеровские методы позволяют определить и направление течения крови. Исследования показали, что в ряде случаев при сердечно-сосудистых заболеваниях в артериях может возникнуть противоток крови. При нормальном кровотоке, как и при течении любой вязкой жидкости, скорость увеличивается от стенки к центру трубы, и концы векторов скорости составляют параболическую поверхность. В случае противотока эта поверхность имеет более сложную форму Исследование противотока имеет большое значение для диагностики сердечно-сосудистых заболеваний.
Особенно интересен и перспективен метод артериографии, позволяющий получать двумерное изображение кровотока. Доплеровский датчик с помощью особого устройства перемещают вдоль кровеносного сосуда, одновременно двигая его в плоскости, перпендикулярной оси сосуда (сканирование).
Артериограмма не только отражает форму сосуда и его разветвления, но и по яркости изображения позволяет оценить скорость кровотока в нем. По артериограмме легко определить места стенозов, поскольку в этих областях скорость кровотока увеличивается и доплеровские частоты возрастают. Хорошо видны и места закупорки сосудов, а также области отложения кальция, препятствующего распространению ультразвука и снижающего яркость изображения.
Рассеяние ультразвука может происходить не только на форменных элементах крови, но и на частичках жира, взвешенных в молоке. Поэтому доплеровский расходомер можно применять и для исследования потока молока, что весьма важно при сравнении условий доения животных и кормления молодняка. Для этого к соску прикрепляют датчик малых размеров, не препятствующий процессу кормления. Исследования показали, что если в процессе доения скорость истечения молока почти не изменяется, так как усилия, прикладываемые к соску, остаются практически постоянными, то в процессе кормления объемный расход молока и соответственно скорость его потока меняются в 60-70 раз, уменьшаясь к концу кормления пропорционально степени насыщения и усталости детеныша.
Рассеяние ультразвука происходит и на газовых пузырьках, попадающих в кровеносные сосуды при декомпрессии, а также при некоторых операциях. Доплеровские частоты, возникающие при отражении ультразвука от газовых пузырьков, хорошо регистрируются на слух. При этом в наушнике или громкоговорителе слышны звуки, похожие на шипение испорченной граммофонной пластинки. Следует отметить, что газовые пузырьки в кровеносных сосудах в некоторых случаях можно обнаружить и с помощью стетоскопа, но с гораздо меньшей чувствительностью. Так, при введении в сердце свиньи 0,1 мл воздуха его уже можно зарегистрировать ультразвуковыми доплеровскими методами, тогда как обычный стетоскоп позволяет различать появление характерных шумов, если введено не менее 1 мл газа.
Доплеровский метод позволяет легко определять, как снабжается кровью тот или иной орган, обнаруживать в венах тромбы с точностью до 50 % (обычные методы позволяют делать это с точностью, не превышающей 5 %), отличать желчные протоки от кровеносных сосудов.
Опыт, накопленный при использовании доплеровских методов в медицине, делает их весьма перспективными для диагностики ряда заболеваний сельскохозяйственных животных. Метод ультразвуковой доплерэхокардиографии был, например, весьма успешно использован для сравнительных исследований особенностей сердечной деятельности у телят при их воспитании в зимнее время на открытой площадке. Сравнение доплеровской эхотахокардиограммы телят с их электрокардиограммой и электрограмм ой дыхательных органов позволило выявить типичные, соответствующие отдельным фазам сердечного цикла изменения.
При выращивании телят на холоде зубцы эхотахограммы отличаются относительно высокими амплитудами, что свидетельствует о более энергичном сокращении сердечной мышцы, чем у телят, содержащихся в помещении.
Ультразвуковая эхотахокардиография выгодно отличается от электрокардиографии устойчивостью к электрическим помехам, небольшой массой измерительной аппаратуры, а также встроенным электропитанием, что позволяет использовать ее в полевых условиях.
Доплеровские эхо-методы нашли широкое применение в гинекологии и акушерстве. Они позволяют регистрировать сердцебиение плода, устанавливать многоплодие, измерять скорость течения крови в пупочных артериях, движения жидкости в пуповине, делать заключение о наличии эмболии (т.е. переносе током крови частиц, вызывающих закупорку сосудов), контролировать работу мочевого пузыря у плода.
2.1.5. Трехмерные и движущиеся трехмерные
изображения
Первые ультразвуковые приборы для визуализации внутренних органов стали разрабатываться в 1955 г., а уже в 1989 г. в Австрии появился «трехмерный» аппарат. Качество изображений было весьма низким. На получение одного статического трехмерного изображения уходило до получаса, и метод не нашел широкого применения в медицине. В 1996 г. благодаря успехам в разработке новых компьютерных технологий появился сканер с возможностью трехмерной реконструкции в реальном времени, и трехмерная ультразвуковая визуализация стала находить все более широкое применение в медицине.
Ультразвуковые аппараты для получения трехмерных изображений отличаются от двумерных лишь наличием специального встроенного компьютерного модуля, Компьютер последовательно накапливает полученные двумерные изображения и реконструирует их в трехмерную картину, которая и выводится на экран монитора. Необходимо отметить, что частота сканирования, интенсивность и мощность ультразвука остаются такими же, как и при обычном ультразвуком исследовании. Иными словами, по способу получения первичной информации трехмерная визуализация ничем не отличается от двумерной, однако мощная компьютерная поддержка существенно расширяет ее диагностические возможности.
Если для создания трехмерного изображения система определяет объем объекта (например, ребенка в утробе матери), а затем реконструирует изображение в трех измерениях, то в так называемой 4D-системе визуализации (три пространственных измерения плюс время) новейшие вычислительные устройства и реальном времени реконструируют объемные изображения, выстраивая их в движущийся ряд. Система 4D)-ультразвуковой визуализации позволяет увидеть в движении все внутренние органы, а ребенка в утробе почти таким, каким он выглядит на самом деле.
2.2. УЛЬТРАЗВУК В ДИАГНОСТИКЕ СОСТОЯНИЯ
КОСТНОЙ ТКАНИ
Прижизненное измерение физических параметров костной ткани оказалось возможным после разработки целого ряда рентгенологических и радиологических методов. Это и рентгенограмметрия, дающая размеры и форму кости, и рентгенографическая фотоденситометрия, позволяющая оценивать содержание кальция в костной ткани по рентгенофотометрической плотности, иными словами, по степени почернения рентгенограммы. Этот метод широко применяется в медицине и ветеринарии. Он позволил обнаружить многие общие закономерности, ![]() например уменьшение с возрастом содержания кальция и костной ткани, и разработать методы диагностики.
например уменьшение с возрастом содержания кальция и костной ткани, и разработать методы диагностики.
Стремление улучшать методы рентгенограмметрии и рентгенографической фотосенситометрии привело к замене рентгеновских лучей более короткими монохроматическими гамма-лучами (монофотопная абсорбциометрия), или гамма лучами, содержащими фотоны двух энергий, что позволяет параллельно измерить еще и толщину кости. Современные методы рентгеновской компьютерной томографии дают возможность воссоздать на экране монитора общий вид и особенности структуры разных участков кости. Плотность костной ткани можно определить по рассеянию квантов радиоактивного излучения высоких энергий, а прижизненный нейтронно-активационный анализ дает количественную информацию о содержании в костной ткани кальция, натрия, хлора, фосфора, ряда других элементов.
Каждый из указанных методов имеет определенные плюсы, но все они требуют для своей реализации применения ионизирующих излучений, специальной, часто стационарной аппаратуры. Следует также отметить, что, несмотря на меры биологической защиты, использование этих методов сопряжено с опасностью лучевого поражения исследуемою организма и обслуживающего персонала.
Изменения свойств костной ткани, связанные с изменением состава и структуры, отражаются и на ее акустических параметрах - на коэффициенте поглощения ультразвука и на скорости его распространения в кости. Метод, основанный на поглощении ультразвука костной тканью, был предложен сравнительно недавно - в 1984 г. Ослабление ультразвука связано не только с содержанием минеральных веществ, но и со структурированностью костной ткани, расположенной на пути распространения ультразвука. Ослабление проходящего через кость ультразвука заметно зависит от частоты, и в ряде случаев для повышения информативности метода измерения проводят в широком диапазоне частот.
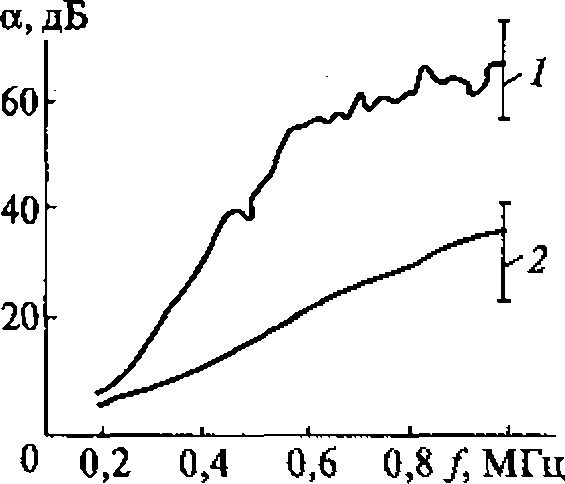
Рис. 2.6. Зависимость поглощения ультразвука костной тканью от частоты:
1 - молодой организм; 2 - зрелый организм
Система для измерений содержит бак с водой, в котором на определенном расстоянии друг от друга установлены излучатель и приемник ультразвука. Между ними располагают исследуемую конечность. Для измерений используются импульсные режимы ультразвука, частота которого за время формирования импульса меняется от 0,2 до 1 МГц. Амплитудные спектры обрабатываются компьютером, а все измерение занимает насколько секунд. Результат измерения, как уже указывалось выше, зависит не только от степени минерализации, но и от структурных особенностей кости. Поэтому ожидать высокой точности от этого метода не приходится. Повторяемость результатов обычно составляет около 35 % и сильно зависит от положения приемника ультразвука относительно излучателя.
Исследования показали, что поглощение ультразвука в костной ткани заметно увеличивается с возрастом (рис. 2.6). Как известно, с возрастом увеличивается и хрупкость костей, что обусловлено снижением минерализации костной ткани.
Намного проще для реализации в медицине и ветеринарии метод ультразвуковой остеометрии, основанный на измерении скорости распространения ультразвука в костях.
В твердых телах скорость продольной волны определяют по формуле
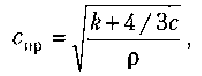
а скорость поперечной (сдвиговой) волны, смещение частиц в которой перпендикулярно распространения ультразвука, рассчитывается но формуле
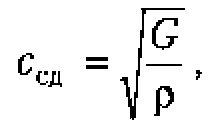
где р - плотность вещества;
G - модуль сдвига;
k - модуль объемного сжатия.
Скорость распространения продольных волн всегда больше скорости распространения сдвиговых волн: спр > cCД ![]() .
.
В ограниченных по размеру твердых телах, помимо продольной и поперечной, возникают и другие волны, скорость распространения которых определяется не только составом и структурой тела, по и его размерами и формой.
При ультразвуковой остеометрии излучатель и приемник ультразвука накладывают через специальную или любую контактную смазку (вазелиновое масло, глицерин и пр.) на поверхность тела перпендикулярно оси кости, стараясь по возможности выбрать место, где слой мягких тканей между костью и поверхностью тела мал. Конструктивно остеометр выполнен так, что реагирует лишь на первый импульс, достигший приемника.
Ультразвуковой импульс от излучателя распространяется к приемнику не только по костной, но и во мягким тканям (рис. 2.7). Скорость ультразвука в кости (сK) примерно в 1,5-2 раза выше, чем в мягких тканях (сM), поэтому расстояние L от излучателя до приемника волна пройдет за время t1=![]() , а время распространения через мышцу и кость определяется по Формуле t2=
, а время распространения через мышцу и кость определяется по Формуле t2=![]()
Через кость сигнал дойдет до приемника раньше, чем через мышцу, если![]() . Полагая, что скорость ультразвука в кости вдвое превышает скорость ультразвука в мягких тканях, можно показать, что условие
. Полагая, что скорость ультразвука в кости вдвое превышает скорость ультразвука в мягких тканях, можно показать, что условие ![]() выполняется в том случае, если
выполняется в том случае, если ![]() т. е. расстояние между излучателем и приемником более чем в четыре раза превышает толщину мягких тканей.
т. е. расстояние между излучателем и приемником более чем в четыре раза превышает толщину мягких тканей.
Иногда для определения толщины мягких тканей между костью и излучателем, а также между костью и приемником остеометры снабжают ультразвуковыми одномерными эхолокаторами. Результаты измерения толщин с помощью этих локаторов отражаются па экране или просто учитываются программой компьютера при расчетах.
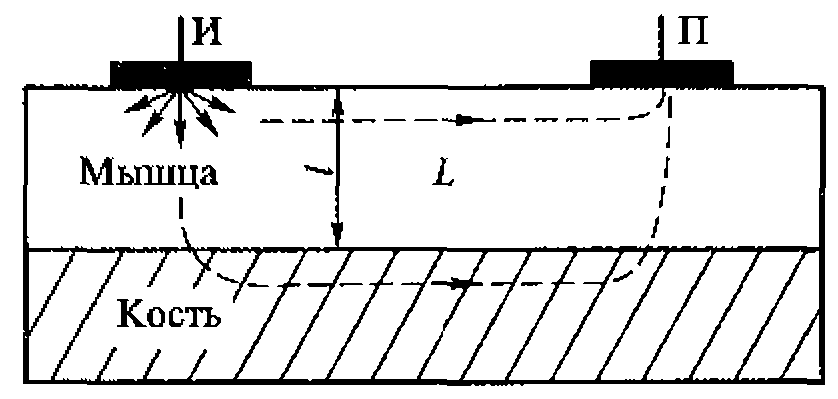
Рис. 2.7. Измерения скорости ультразвука в кости через неповрежденные покровные ткани:
L - расстояние между излучателем (И) и приемником <П);
l - толщина мышечной ткани
Учитывая большую разницу между скоростью ультразвука в костях и мягких тканях, ультразвуковую остеомeтрию весьма эффективно используют для первичной сортировки пострадавших при техногенных и природных катастрофах, а также для наблюдения за формированием костных мозолей после переломов.
Исследования, проведенные на овцах разного возраста, показали, что скорость ультразвука, резко снизившаяся в результате перелома, постепенно нарастает в течение 2,5-3 месяцев, стремясь к значениям, характерным для целой кости (рис. 2.8).
2.3. УЛЬТРАЗВУКОВОЙ МЕТОД ОЦЕНКИ ВЯЗКОУПРУГИХ
СВОЙСТВ МЯГКИХ ТКАНЕЙ
Вязкоупругие свойства кожи, мышц и других мягких тканей давно служат источником диагностической информации. Однако на практике эту информацию получают весьма субъективным методом пальпации, что существенно снижает ее ценность и не позволяет пользоваться ею в сравнительных исследованиях.
Измерить упругие свойства мягких тканей дает возможность недавно разработанный метод, основанный на измерении скорости распространения поверхностной акустической волны,
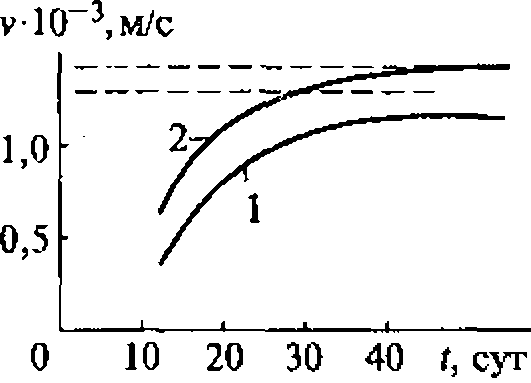
Рис. 2,8. Изменение скорости ультразвука в процессе образования костной мозоли па месте перелома бедренной кости 2,5-месячной овцы (1) и 5-месячной овцы (2):
скорость ультразвука в той же
кости до перелома
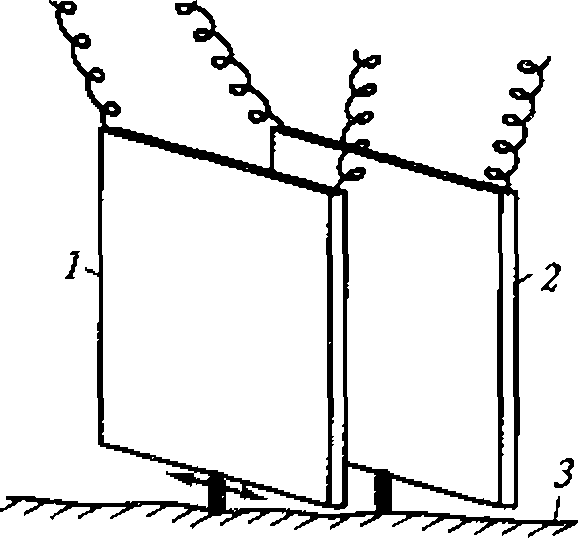
Рис. 2.9. Принцип определения вязкоупругих свойств мягких тканей:
1 - излучатель поверхностных ноли; 2 - приемник поверхностных волн; 3- поверхность исследуемой ткани; стрелка - направление колебаний излучающего стержня
В отличие от продольных акустических воли, распространяющихся в объеме среды, поверхностные сдвиговые волны затухают на расстоянии, равном нескольким длинам волн, что создает определенные трудности в изучении особенностей их распространения. Получают и регистрируют эти волны с помощью преобразователей биморфного типа, в котором используются пластины из пьезоэлектрического материала. Преобразователи снабжаются щупами, которые позволяют осуществлять точечный контакт с исследуемым участком ткани. Принцип определения вязкоупругих свойств мягких тканей показан на рис. 2.9. Один из преобразователей служит источником, а второй - приемником поверхностных волн. Исследования показали, что сдвиговая упругость биологических тканей для малых амплитуд смещения частиц среды прямо пропорциональна квадрату скорости распространения в ней акустической волны, возбуждаемой точечным осциллирующим преобразователем:
![]()
где Е - динамический модуль сдвига;
![]() - плотность среды;
- плотность среды;
![]() - скорость распространения сдвиговой волны;
- скорость распространения сдвиговой волны;
![]() - коэффициент пропорциональности, зависящий от направления колебательного смещения частиц среды.
- коэффициент пропорциональности, зависящий от направления колебательного смещения частиц среды.
Если смещения частиц параллельны плоскости поверхности среды и перпендикулярны направлению распространения полны, то коэффициент ![]() оказывается равным единице.
оказывается равным единице.
Наиболее доступны для исследования с помощью поверхностных сдвиговых волн покровные ткани, вязкоупругие свойства которых заметно меняются не только при дерматологических патологиях, но и при заболеваниях внутренних органов, а также при некоторых физиологических процессах. Это связано с существованием на поверхности тела так называемых зон Захарьина - Геда, отражающих состояние внутренних органов и систем организма.
2.4. МЕТОД УЛЬТРАЗВУКОВОЙ ЦИТОЛИЗОМЕТРИИ
Ультразвуковые методы нашли применение не только в клинической диагностике, но и в лабораторных исследованиях, В частности, в практике лабораторных исследований крови существует метод определения механической резистентности и эритроцитов. Устойчивость этих клеток к механическим, разрушающим воздействиям обычно оценивают, встряхивая кровь с антикоагулянтом в течение определенного времени, а затем по окрашиванию плазмы измеряют количество вышедшего из травмированных эритроцитов гемоглобина, либо подсчитывая число эритроцитов в единице объема под микроскопом до и после встряхивания. Этот метод пригоден лишь для эритроцитов, так как внутренний объем этих клеток не разделен на отдельные компартаменты и их содержимое вытекает через любое повреждение клеточной мембраны. Кроме того, метод источен и позволяет, как правило, лишь подтвердить установленный диагноз.
Некоторые клетки, суспендированные в водной среде и не имеющие прочной клеточной стенки, разрушаются под действием ультразвука уже при интенсивностях, используемых в терапии. К числу таких клеток относятся клетки крови и сперматозоиды. Пороги и скорость разрушения этих клеток зависят как от концентрации клеток в суспензии, температуры среды, частоты и интенсивности ультразвука, так и от прочности клеточных мембран, и, следовательно, от типа клеток и состояния организма - донора этих клеток.
Разрушение клеток в ультразвуковом поле происходит только в том случае, если интенсивность ультразвука превышает значения, совпадающие для разбавленных суспензий, с порогами кавитации в воде.
Зависимость средней скорости разрушения клеток от интенсивности ультразвука по характеру сходна с аналогичными зависимостями интенсивности ультразвукового свечения и скорости звукохимических реакций (см. §§ 1.8; 1.13). Совпадение в характере этих зависимостей, а также в порогах кавитации и разрушение клеток свидетельствует о кавитационной природе эффекта. Кроме того, скорость разрушения клеток обратно пропорциональна концентрации клеток в суспензии (рис. 2.10), что может служить подтверждением кавитационной природы разрушения, так как увеличение концентрации клеток равносильно увеличению вязкости, приводящему к возрастанию порога кавитации в жидких средах.
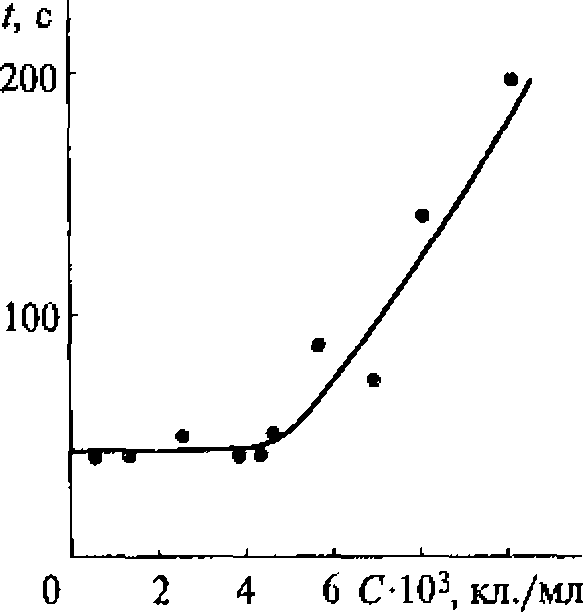
Рис. 2.10. Зависимость времени разрушения клеток в ультразвуковом поле от их концентрации (интенсивность ультразвука - 0,4 Вт/см2)
Отметим, однако, что ультразвуковое свечение и образование химически активных частиц характеризуют процессы, протекающие внутри кавитирующего пузырька, тогда как разрушение клеток происходит в результате процессов, протекающих вне его.
Замена растворенного в воде воздуха аргоном или присутствие в ней акцепторов свободных радикалов (цистеин, акриламид) не влияют на процесс ультразвукового разрушения клеток. Отсюда следует, что основную роль в процессах, ведущих к нарушению целостности клеточных мембран, играют не химические вещества, образующиеся под действием ультразвука, а механические силы, возникающие при кавитации. Такие силы, достаточные по величине для разрушения клеточных мембран, могут быть обусловлены микропотоками и ударными волнами вблизи пульсирующих или захлопывающихся пузырьков.
Акустические потоки в суспензии, возникающие в докавитационном режиме (0,05 Вт/см2), способны лишь «смывать» макромолекулы с поверхности клеточных мембран. Увеличение интенсивности ультразвука до значений, превышающих порог кавитации, приводит к появлению в среде пульсирующих газовых пузырьков, порождающих микропотоки с градиентами скоростей порядка 104 с-1 Клетки радиусом 5- 10-6м, попавшие в поле этих микропотоков, могут испытывать сдвиговые усилия, значительно превышающие значения, при которых начинают разрушаться клеточные мембраны.
Разрушение клеток начинается не сразу после включения ультразвука и заканчивается не мгновенно после его выключения. Чем выше интенсивность ультразвука, тем короче промежуток времени между моментом его включения и началом процесса разрушения клеток, и тем длительнее последействие, когда ультразвук уже выключен, а клетки продолжают разрушаться. В поисках причин такого последствия были исследованы изменения в морфологии эритроцитов, подвергнутых ультразвуковому воздействию в суспензии, и обнаружены «дыры» в цитоплазматических мембранах, через которые содержимое клеток вытекает в окружающую среду.
Скорость вытекания содержимого эритроцитов сквозь дефекты в мембранах после выключения ультразвука ограничена диффузией и вязким течением. Очевидно, эта скорость достаточно мала и может обеспечить наблюдаемое последействие. Аналогичное явление наблюдается не только для эритроцитов, но и для других клеток, разделенных внутриклеточными мембранами на компартаменты.
В обычных условиях внутриклеточные мембраны препятствуют вытеканию их содержимого через одиночные дефекты в цитоплазматической мембране. Однако под действием ультразвука внутри клеток возникают микротсчения. Они разрушают компартментацию, перемешивают содержимое и обратимо снижают вязкость цитоплазмы. После этого ничто не препятствует вытеканию содержимого клеток крови через повреждения в цитоплазматических мембранах.
Исследование зависимости скорости ультразвукового разрушения клеток от температуры на примере эритроцитов показало, что скорость сохолизиса мало изменяется в диапазоне 20…36![]() С При более высоких температурах начинается тепловой гемолиз, Ультразвук ускоряет его и быстро разрушает клетки.
С При более высоких температурах начинается тепловой гемолиз, Ультразвук ускоряет его и быстро разрушает клетки.
Суммируя приведенные данные и пренебрегая скоростью спонтанного разрушения клеток, можно показать, что средняя скорость ультразвуковою разрушения клеток рассчитывается по формуле:
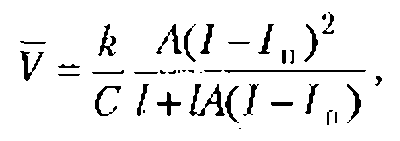
где С - концентрация клеток в суспензии;
k - коэффициент, показывающий, какая часть акустической энергии преобразуется в энергию микропотоков и затрачивается на разрушение клеток;
/ - расстояние от излучателя до той точки в объеме, где интенсивность ультразвука уменьшается в результате акустических потерь (поглощения, рассеивания) до порога кавитации;
/- интенсивность ультразвука;
/п - интенсивность, соответствующая порогу кавитации;
А - коэффициент, характеризующий потери акустической энергии.
Температуру можно не учитывать, если в опыте она не превышает 36 оС.
Из анализа приведенного выражения следует, что при l » l![]() значение
значение ![]() , и средняя скорость разрушения клеток в суспензии - линейная функция интенсивности ультразвука
, и средняя скорость разрушения клеток в суспензии - линейная функция интенсивности ультразвука ![]() а при интенсивности ультразвука, близких к пороговым,
а при интенсивности ультразвука, близких к пороговым,
Из общих соображений следовало бы, что измерять различия в скорости разрушения клеток разных типов удобнее при ![]() , где V линейно зависит от интенсивности ультразвука. Однако наиболее существенные различия в параметрах, характеризующих процесс разрушения клеток крови здоровых и больных людей и животных, были обнаружены при интенсивностях ультразвука, близких к пороговым. Эти различия уменьшаются с увеличением интенсивности ультразвука и становятся пренебрежимо малыми при 0,6...0,8 .Вт/см2.
, где V линейно зависит от интенсивности ультразвука. Однако наиболее существенные различия в параметрах, характеризующих процесс разрушения клеток крови здоровых и больных людей и животных, были обнаружены при интенсивностях ультразвука, близких к пороговым. Эти различия уменьшаются с увеличением интенсивности ультразвука и становятся пренебрежимо малыми при 0,6...0,8 .Вт/см2.
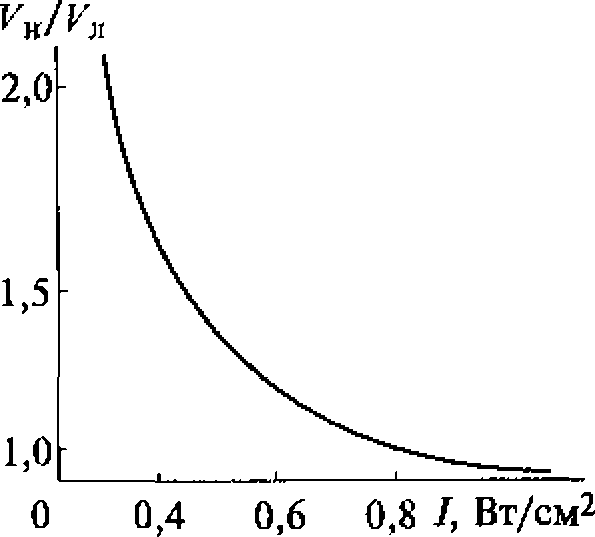
Рис. 2.11. Зависимость отношения скоростей разрушения лейкоцитов здоровых (V м) и больных лейкозом (V„) коров от интенсивности ультразвука
В качестве примера можно привести зависимость отношения скоростей разрушения лейкоцитов здоровых и больных лейкозом коров от интенсивности ультразвука (рис. 2.11), Аналогичные зависимости получены и для клеток других типов.
Следует отметить, что даже в идеальных условиях поле в ближней зоне излучателя существенно неоднородно; наряду с максимумом здесь имеются области, где амплитуды звукового давления обращается в пуль. Максимальные значения амплитуды звукового давления могут быть в 3-4 раза больше или меньше усредненных значений, что следует учитывать при определении порогов физико-химического и биологического действия ультразвука.
Ультразвуковой метод, позволяющий оцепить механическую резистентность цитоплазматических мембран как усредненную для всей исследуемой совокупности клеток, гак и с учетом индивидуальных различий их отдельных популяций, в последнее время все шире применяют в экспериментальной биологии, медицине и ветеринарии. Использованный сначала для исследования эритроцитов этот метод был назван методом ультразвуковых эритрограмм. В дальнейшем ультразвуковой метод, пригодный для опенки механической резистентности не только эритроцитов, но и любых клеток в суспензии, стали называть методом ультразвуковых цитолизограмм.
По сути метод ультразвуковых цитолизограмм представляет собой метод определения кинетических параметров ультразвуковой дезинтеграции клеток, находящихся в суспендированном состоянии. Необходимым условием для ультразвуковой дезинтеграции клеток с воспроизводимой кинетикой является стабильная кавитация. Очевидно, что разрушение клеток под действием ультразвука имеет вероятностный характер.
Регистрируя любым способом изменение концентрации клеток в суспензии в процессе воздействия ультразвуком, можно получить кривую, характеризующую распределение клеток по стойкости к ультразвуковому (механическому) воздействию - ультразвуковую цитолизограмму.
Наиболее удобный способ регистрации снижения концентрации клеток в суспензии - турбидиметрия, основанная на рассеянии света частицами среды, усредненный радиус которых более чем на порядок превышает длину волны рассеиваемого света. При этом длину волны обычно выбирают такой, чтобы поглощение света средой было минимальным.
Динамику турбидиметрического ослабления чаще всего регистрируют фотоэлектрическим способом с помощью установки, которая состоит из двулучевого колориметра, регистрирующего устройства, и генератора ультразвуковых колебаний с преобразователем небольших размеров,
В установке удобно использовать медицинские терапевтические ультразвуковые генераторы, обеспечивающие ультразвуковое излучение с частотой 880 кГц и интенсивностью в интервале 0,05...1 Вт/см2.
Принцип метода ультразвуковых цитолизограмм заключается в следующем.
При введении ультразвука в кювету колориметра с суспензией клеток (рис. 2.12) последние начинают разрушаться, и светорассеяние изменяется, отражая уменьшение числа целых клеток. В кювете с плоским стеклянным дном, параллельным излучающей поверхности преобразователя, возникает стоячая волна, и в этом случае ультразвуковое ноле может быть охарактеризовано средней плотностью энергии.
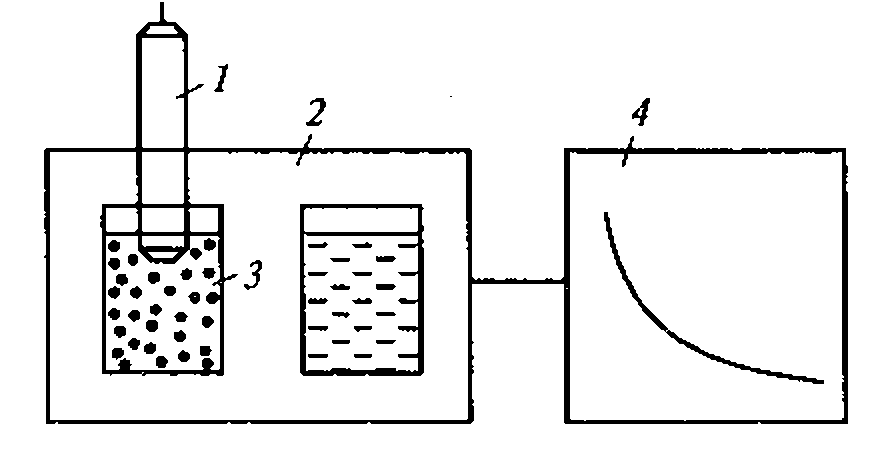
Рис. 2.12, Принцип метода ультразвуковых цитолизограмм:
1 - излучатель ультразвука; 2 - фотоэлектрический колориметр; 3 - кювета с суспензией клеток; 4 - регистратор
На диаграммной ленте непрерывно регистрируется сигнал, пропорциональный (для достаточно малых концентраций клеток) мгновенным значениям турбидиметрического ослабления (рис. 2.13, а).
При турбидиметрических измерениях необходимо учитывать, что кавитации сопровождается увеличением мутности среды. Рассеяние снега одиночной частицей, в том числе кавитационным пузырьком, возрастает пропорционально квадрату радиуса пузырька, и, следовательно, для цитолизиса удобно использовать высокочастотный ультразвук, так как размеры резонансных кавитационных пузырьков в первом приближении обратно пропорциональны частоте. Однако при частотах ультразвука более 1,5 МГц клетки, находящиеся в суспензии, быстро оседают на дно кюветы, не успевая разрушиться. Поэтому для метода ультразвуковых цитолизограмм чаще всего используют ультразвук с частотой 1 МГц.
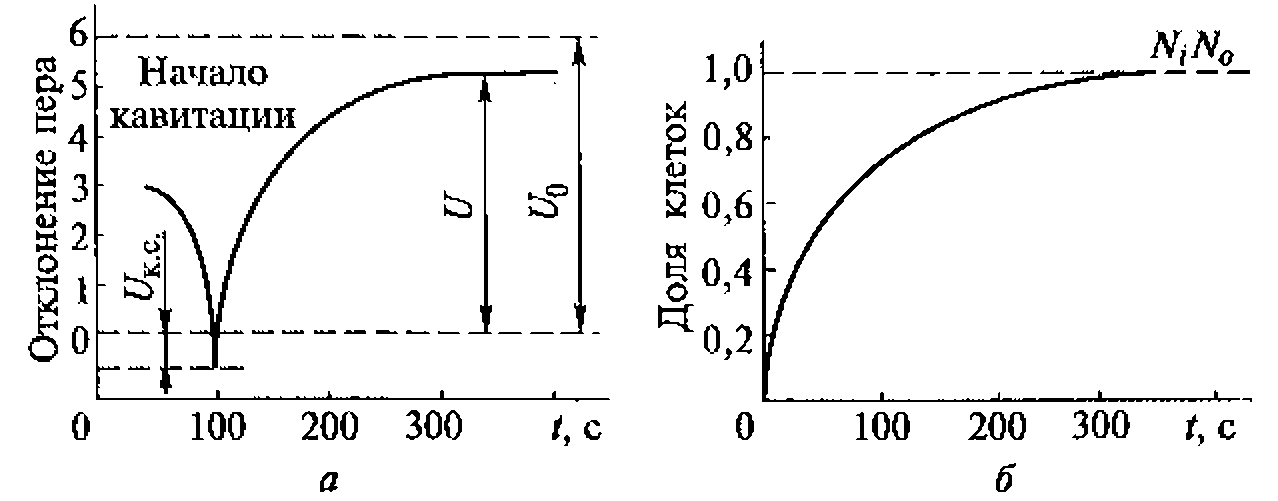
Рис. 2.13. Экспериментальная кривая (а) и нормированная кривая (б) кинетики ультразвукового цитолизиса эритроцитов свиньи
При этой частоте порог кавитации в суспензии клеток около 0,35 Вт/см2, а резонансный радиус кавитациоиного пузырька примерно 3 мкм, что соизмеримо с усредненным радиусом форменных элементов крови. Кавитационных пузырьков при этих условиях намного меньше, чем клеток в суспензии, и кавитация не вносит значительных возмущений в светорассеяние,
В устойчивом режиме кавитации обусловленное ею светорассеяние не меняется во времени, и поправка сводится к сдвигу всех мгновенных значений ординат экспериментальной кривой на величину, обусловленную кавитационным светорассеянием (рис. 2.13, б).
Нормированная ультразвуковая цитолизограмма в интегральной форме соответствует распределению изучаемых клеток по механической резистентности.
Интегральную ультразвуковую цитолизограмму дифференцируют и анализируют па наличие локальных экстремумов. Если таких экстремумов нет, то цитолизограмму можно представить в аналитическом виде:
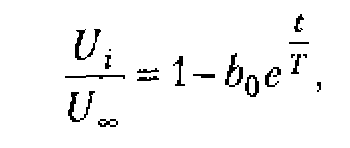
где ![]() - показания регистратора в момент измерения;
- показания регистратора в момент измерения;
![]() - показания регистратора в конце измерений, когда светорассеяние перестает изменяться, характеризуя окончание процесса.
- показания регистратора в конце измерений, когда светорассеяние перестает изменяться, характеризуя окончание процесса.
Параметры ![]() и Т находят методом наименьших квадратов, спрямляя экспериментальную кривую в полулогарифмических координатах:
и Т находят методом наименьших квадратов, спрямляя экспериментальную кривую в полулогарифмических координатах:
Если предэкспоненциальный множитель bo = 1 (в пределах ошибки измерения), то ультразвуковая цитолизограмма имеет вид простой экспоненты, описывается приведенным выражением и может быть полностью охарактеризована постоянной времени Т.
Если же величина ![]() , то цитолизограмма имеет более сложный характер и определяется выражением:
, то цитолизограмма имеет более сложный характер и определяется выражением:
при условии, что сумма коэффициентов ![]()
Ультразвуковые цитолизограммы в основном можно условно разделить на четыре типа.
- Если цитолизограмма имеет вид экспоненты, то, учитывая чисто вероятностный характер процесса ультразвукового лизиса, можно полагать, что все клетки исследуемого образца равнозначны по механической резистентности, которая пропорциональна постоянной времени (Т) экспоненты.
- Если цитолизограмма апроксимируется суммой экспонент, то, вероятно, исследуемая популяция клеток неоднородна по механической резистентности и представляет собой совокупность нескольких групп, внутри которых клетки равнозначны. В этом случае каждый из предэкспоненциальных множителей
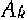 равен относительной концентрации клеток в данной группе. Механическая резистентность клеток в каждой группе может быть охарактеризована постоянной времени для этой группы
равен относительной концентрации клеток в данной группе. Механическая резистентность клеток в каждой группе может быть охарактеризована постоянной времени для этой группы 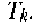 .
.
Время, за которое происходит полный лизис характеризует усредненную механическую резистентность клеток в обоих вышеприведенных случаях. В первом случае информативность параметров и ![]() равнозначна, во втором необходимо учитывать, что на параметре Т не отражается неоднородность исследуемой популяции клеток.
равнозначна, во втором необходимо учитывать, что на параметре Т не отражается неоднородность исследуемой популяции клеток.
При сравнительном анализе удобно пользоваться тремя параметрами - ![]() и bo. Степень отклонения bo от единицы характеризует неоднородность исследуемой популяции клеток, а увеличение Т или
и bo. Степень отклонения bo от единицы характеризует неоднородность исследуемой популяции клеток, а увеличение Т или ![]() свидетельствует о возрастании усредненной механической резистентности клеточных мембран.
свидетельствует о возрастании усредненной механической резистентности клеточных мембран.
- Явно не экспоненциальный характер цитолизограммы, как правило, связан со спонтанным лизисом клеток, либо с методическими ошибками (например, с неправильным определением начала процесса).
- Неполный при данных условиях ультразвуковой лизис свидетельствует либо о присутствии в образце группы клеток с аномально высокой механической резистентностью, либо о незавершенности процесса лизиса.
Анализ результатов ультразвукового цитолизиса удобно проводить с использованием компьютера.
При подборе оптимальных значений: начальной концентрации клеток и суспензии, ее температуры, средней плотности энергии в ультразвуковом поле и пр. - можно подобрать условия, варьирование которых в определенных пределах мало влияет на воспроизводимость, точность и информативность конечного результата.
Для определения оптимальных условий ультразвукового цитолизиса была исследована динамика ультразвукового разрушения тромбоцитов, эритроцитов, лейкоцитов ряда животных при изменении начальных концентраций клеток (турбодиметрическое ослабление в пределах 0,1-1,2) и при плотности энергии ультразвука 0,04...0,13 Вт/см3.
Исследование проводили при температуре 24°С, так как в интервале 22...28°С характер ультразвуковых цитолизограмм практически не зависит от температуры. Было установлено, что при 100%-ном ультразвуковом лизисе относительное турбидиметрическое ослабление для эритроцитов принимает значение 14-15, для лейкоцитов - 12-14, для кровяных пластинок - 10-12. Порог кавитации при повышении концентрации эритроцитов и лейкоцитов в суспензии до значений, соответствующих турбидиметрическому ослаблению, - 1,2 (для тромбоцитов 0,9) оставался в пределах 0,04...0,05 Вт/см3.
Турбидиметрическое ослабление, обусловленное кавитацией, через 1...2 с после се возникновения устанавливается па постоянном уровне, практически не зависит от концентрации клеток в суспензии и составляет 0,01-0,05 (в зависимости от интенсивности ультразвука) при 540...750 нм. Для форменных элементов крови различного происхождения динамика ультразвукового лизиса максимально различается при плотности энергии 0,04 Вт/см3. При 0,08...0,09 Вт/см3 различия существенно уменьшаются вплоть до полной нивелировки. Однако ошибка воспроизводимости метода в соответствии с оценкой по двум параметрам (время 50 %-иого и 100 %-ного лизиса) при плотности энергии 0,04 Вт/см3 в некоторых случаях достигает 40 %. При увеличении плотности энергии до 0,05..,0,06 Вт/см3 ошибка воспроизводимости снижается до 5 %,
Для каждого типа клеток при всех исследованных плотностях энергии в поле ультразвука существует область достаточно малых концентраций клеток, в которой динамика ультразвукового цитолизиса практически не зависит от концентрации (табл. 2.1).
Таблица 2.1
Концентрация клеток (но турбидиметрическому ослаблению), при которой динамика ультразвукового цитолизиса не зависит от плотности ультразвуковой энергии
|
Тип клепок |
Плотность энергии ультразвука, Вт/см3 | |||
|
0,05 |
0,06 |
0,08 |
0,09 | |
|
Эритроциты |
0,6 |
0,6 |
0,65 |
0,7 |
|
Лейкоциты |
0,35 |
0,4 |
0,5 |
0,55 |
|
Тромбоциты |
0,5 |
0,6 |
0,8 |
0,8 |
Во всех случаях для ультразвуковой цитолизометрии оптимальной является средняя плотность ультразвуковой энергии, равная 0,05 Вт/см3, которую можно обеспечить, излучая в кювету объемом 8 см3 звук с интенсивностью 0,4 Вт/см2. Оптимальная концентрация клеток в исследуемой суспензии соответствует величине начального турбидиметрического ослабления 0,2-0,35. При более высокой концентрации клеток усложняется интерпретация экспериментальных кривых, так как приходится учитывать поправки на нелинейность фотоэлектрической регистрации турбидиметрического ослабления. При более низких начальных концентрациях клеток снижается чувствительность метода и возникает необходимость введения поправок на светорассеяние кавитационными пузырьками. Началом процесса следует считать момент возникновения кавитации в жидкости, а цитолизис проводить при температуре 24 °С.
При выполнении указанных условий ультразвуковая цитолизометрия может быть успешно применена при диагностике ряда заболеваний, а также для оценки изменений свойств клеточных мембран при консервировании, гемосорбции, гемодиализе и других манипуляциях с клетками в суспензии.
До последнего времени систематических исследований механической прочности эритроцитов не проводилось, и лишь недавно были получены данные об ультразвуковой резистентности мембран эритроцитов человека, а также лошади, быка, коровы, пони, овцы, козы, свиньи, собаки, лисы, песца, кролика, курицы, морской свинки, белой крысы, белой мыши и др. (рис. 2.14).
Ультразвуковая резистентность эритроцитов заменю различается у животных разных видов в зависит от массы их тела, возрастая с увеличением последней в виде показательной функции
![]()
где R - резистентность эритроцитов;
М масса тела животных.
Рис. 2.14, Зависимость ультразвуковой резистентности эритроцитов от массы тела животных и человека:
1 - белая мышь; 2 - белая крыса; 3 - морская свинка; 4 - курица; 5 - кролик; 6 - песец; 7 - лиса; 8 - собака; 9 - коза; 10 овца; 11 - свинья; 12 человек; 13 - пони; 14 - корона; 15 - лошадь; 16 - бык
Показатель степени отражает характер изменения ультразвуковой резистентности с изменением массы тела. Этот показатель меньше единицы. Отсюда следует, что в ряду близких видов или в процессе роста ультразвуковая резистентность эритроцитов увеличивается медленнее, чем масса тела животных.
Поиск причин зависимости ультразвуковой резистентности от массы тела показал, что, по крайней мере, у исследованных видов эритроциты за время своего существования делают примерно одинаковое число оборотов в кровяном русле, а время одного полного оборота уменьшается с уменьшением размера и массы животного (табл. 2.2). Соответственно уменьшается и длина пути, проходимого эритроцитами за время одного оборота. Средине числа оборотов за время существования эритроцитов и время одного полного оборота были рассчитаны, исходя из данных о полном объеме крови, минутном объеме сердца и времени жизни эритроцитов соответствующих животных.
Таблица 2.2
Масса тела и некоторые параметры кровообращения теплокровных
|
Животные и человек |
Масса тела, кг. |
Цикл кровообращения, с |
Количество циклов эритроцитов |
|
Бык |
620 |
36,8 |
2,8 - 105 |
|
Лошадь |
570 |
39,7 |
2,9 - 105 |
|
Корова |
560 |
35,2 |
2,7 - 105 |
|
Пони |
150 |
- |
— |
|
Человек |
G5 |
31,7 |
2,7 105 |
|
Свинья |
50 |
27,7 |
2,7 - 105 |
|
Овца |
47 |
28,3 |
2,9 105 |
|
Коза |
44 |
26,3 |
2,8 - 105 |
|
Собака |
40 |
25,6 |
2,7 -105 |
|
Лиса |
7 |
- |
- |
|
Песец |
6 |
- |
- |
|
Кролик |
2,5 |
17,5 |
2,5 - 105 |
|
Курица |
2,4 |
12,1 |
2,2 -105 |
|
Морская свинка |
0,29 |
14,4 |
3,4 -105 |
|
Белая крыса |
0,2 |
12,5 |
3,0 - 105 |
|
Белая мышь |
0,03 |
7,9 |
3,1 - 105 |
Поскольку число оборотов эритроцитов за время их существования у всех видов животных примерно одинаково, то у мелких животных эритроциты за время их существования проходят значительно меньший путь, чем у животных крупных размеров.
По-видимому, это одна из причин, обусловливающих необходимость в более высокой механической прочности мембран эритроцитов крупных животных, так как в кровяном русле, в особенности в узких капиллярах, эритроциты подвергаются значительным механическим воздействиям. Прямая пропорциональность между ультразвуковой резистентностью эритроцитов и средним временем их полного обращения свидетельствует в пользу данного предположения. Возможно, прочность мембраны зависит от содержания в ней холестерина и сфингомиелина, увеличивающегося с увеличением массы животного при соответствующем уменьшении количества фосфатидилэтаноламина и фосфатидилхолина в мембранах.
Сравнивая зависимость, отображенную на рис. 2.14, с известной кривой «от мыши до слона», иллюстрирующей связь интенсивности обмена веществ с массой тела животного, можно предположить, что резистентность эритроцитов также связана с интенсивностью обменных процессов в организме.
Подтверждение этому было получено при сравнении скорости ультразвукового гемолиза эритроцитов животных одного вида, но находящихся в разных условиях. Так, эритроциты стриженой овцы менее устойчивы к ультразвуковому воздействию, чем эритроциты овцы, покрытой шерстью, У коз, обитающих в горах, стойкость эритроцитов выше, чем у коз, живущих в равнинной местности.
Сравнение прочности эритроцитов овцы и барана, быка и коровы, мужчины и женщины показало, что у особей женского пола ультразвуковая резистентность эритроцитов в 1,2 раза ниже, чем у особей мужского пола (рис. 2.15), Интересно отметить, что прочность эритроцитов барана после кастрации постепенно уменьшается и через 80 дней лишь незначительно превосходит прочность эритроцитов овец.
Характерные изменения в ультразвуковых эритрограммах человека и животных можно наблюдать при различных физиологических состояниях и патологиях. При циррозе печени циркулирующие в крови эритроциты частично повреждаются токсическими продуктами, которые насыщают кровь вследствие функциональной несостоятельности печени. На эритрограмме коров с циррозом печени наблюдается снижение стойкости всей массы клеток. Такая картина наиболее характерна при циррозе с выраженной недостаточностью клеток паренхимы. Аналогичные по характеру изменения наблюдаются при фасциолезе - паразитарном заболевании печени домашних и диких животных. Выделяемые паразитом продукты жизнедеятельности оказывают влияние на ткани печени, вызывающие гепатиты и циррозы.
При лейкозах обнаружено повышение ультразвуковой резистентности лейкоцитов и эритроцитов, что объясняется пополнением крови формами клеток, обладающих повышенной прочностью клеточных мембран.
При заболеваниях воспалительного характера, таких, как пневмонии, эндометриты, маститы, обнаружено увеличение содержания в крови клеток с пониженной ультразвуковой резистентностью.
Рис. 2.15. Зависимость ультразвуковой рэзистености эритроцитов теплокровных от их пола к условий сущесгвования: 1 горная коза;2 -равнинная коза;3- овца, покрытая шерстью; 4 - стриженая овца; 5 - мужчина; 6 - женщина
Характерные изменения на эритрограммах животных наблюдаются и при диспепсиях, кетозах и других заболеваниях. Изменяются эритрограммы в зависимости от условий содержания и кормления животных, в том числе домашней птицы.
Ультразвуковая резистентность эритроцитов 15-дневных эмбрионов кур коррелирует с инкубационным качеством яйца, причем повышение выводимости благодаря доинкубационной обработке яиц стимуляторами - парааминобензойной кислотой, хлорно-кислым аммонием или ультразвуком низких интенсивностей соответственно изменяет и ультразвуковую резистентность эритроцитов эмбрионов,
В условиях загрязнения окружающей среды промышленными отходами представляет интерес возможность оценки состояния рыб при ртутном отравлении по скорости разрушения их эритроцитов в ультразвуковом поле. Предварительно было показано, что некоторые отличия в строении эритроцитов рыб не являются препятствием для использования метода ультразвукового гемолиза.
Исследования показали, что скорость гемолиза эритроцитов рыбы, обитающей в среде, содержащей препараты ртути, со временем увеличивается, причем скорость ультразвукового гемолиза прямо пропорциональна концентрации ртути, накапливающейся в печени рыбы.
Разработанный вначале для ветеринарных целей метод ультразвукового цитолизиса оказался весьма полезным и в медицинской практике. Так, в результате исследования крови клинически здоровых людей обоего пола в возрасте 15-60 лет было установлено, что параметры, характеризующие ультразвуковую резистентность эритроцитов в норме, стабильны. Эта стабильность, очевидно, обусловлена действием физиологических механизмов, поддерживающих динамическое равновесие в качественном составе красной крови. Ультразвуковая резистентность эритроцитов в пределах 15-60 лет мало зависит от возраста доноров, тогда как химическая стойкость эритроцитов подвержена существенным возрастным изменениям.
Исследование эритроцитов больных выявило существенные различия в параметрах, характеризующих ультразвуковой гемолиз в норме и при опухолях. Так, полное время гемолиза эритроцитов здоровых допоров составило (485 ± 10) с, при раке молочной железы - (617 ± 30) с, при раке желудка - (603 ± 40) с, при раке легких - (555 ± 40) с и при лимфогранулематозе - (735 ± 67) с.
При опухолях ультразвуковая резистентность эритроцитов и, следовательно, их механическая стойкость заметно увеличиваются но сравнению с нормой. Аналогичные данные были получены при лейкозах крупного рогатого скота, при спонтанных опухолях у собак, при привитой под колено взрослым крысам карциноме РС-1.
Благоприятно протекающий процесс лечения опухолевого заболевания сопровождается снижением прочности мембран эритроцитов, вплоть до значений, характеризующих норму, и чем эффективнее лечение, тем быстрее стремится к норме ультразвуковая резистентность эритроцитов. Очевидно, что быстрое снижение резистентности эритроцитов до нормы можно ожидать также при удачной хирургической операции и незначительные изменения этого параметра при неполном иссечении опухоли или ее метастазов.
Различия в количестве разрушенных эритроцитов наблюдались ранее при ультразвуковой обработке (830 кГц; 0,2...0,8 Вт/см2; 5 мин) разбавленной в 10 раз крови здоровых животных и животных с гипотиреозом и экспериментальным диабетом. Резистентность эритроцитов человека к низкочастотному ультразвуковому воздействию (24 кГц, 60 Вт) при некоторых заболеваниях крови также существенно отличается от нормы. Так, при серповидной анемии и с фероцитозе устойчивость эритроцитов к ультразвуку оказалась заметно повышенной, тогда как дефицит железа в организме приводит к уменьшению стойкости клеток красной крови.
Метод ультразвуковых цитолизограграмм успешно использован и для оценки качества эритроцитов, консервированных при пониженных (+4оС) и низких (-196 °С) температурах. Ультразвуковая резистентность эритроцитов, хранящихся при +4 скачкообразно уменьшается на 4-й и 17-й день хранения, после чего остается практически неизменной, вплоть до 22 суток хранения. Этот результат хорошо согласуется с известными данными об увеличении скорости спонтанного гемолиза в эти сроки. На ультразвуковых эритрограммах, полученных на 4-й и 17-й день хранения, ясно видны различия в распределении эритроцитов по группам стойкости, выражающиеся в увеличении количества менее стойких к ультразвуковому воздействию клеток.
Консервирование эритроцитов при -196°С под комплексной защитой полиэтиленоксида с молекулярным весом 1500 и димстилацетамида, обладающих» соответственно, и экстра- и интрацеллюлярным действием, приводит к изменению распределения клеток по прочности, к увеличению числа более прочных эритроцитов. По-видимому, криофилактики оказывают стабилизирующее действие на клеточные мембраны. Судя по ультразвуковым эритрограммам, эритроциты, хранившиеся в течение 5 лет при температуре -196 °С под защитой глицерина 35%-ной концентрации, лучше переносят хранение, чем эритроциты, хранившиеся в среде, где концентрация глицерина не превышала 30 %. Это хорошо согласуется с известным фактом, что криозащитное действие глицерина в определенных пределах пропорционально его концентрации в среде.
Ультразвуковая резистентность эритроцитов, хранившихся при -196 °С, непосредственно после размораживания значительно выше, чем их резистентность после 24 ч последующего хранения при +4 °С .В связи с этим можно рекомендовать использовать их в кратчайшие после размораживания сроки.
Her принципиальных сложностей для измерения ультразвуковой резистентности лимфоцитов, тромбоцитов, сперматозоидов и других клеток. Так, при изучении лизиса форменных элементов крови свиньи в ультразвуковом поле было обнаружено, что в присутствии лейкоцитов и эритроцитов тромбоцитопения наступает при более низких интенсивностях ультразвука, чем при воздействии ультразвуком па чистую тромбоцитарную плазму.
Применение ультразвуковой цитолизометрии для оценки качества спермы позволило обнаружить различия в механической резистентности сперматозоидов животных разных видов, выявить закономерность, в соответствий с которой устойчивость сперматозоидов к механическим воздействиям тем выше, чем больше масса животного. Поэтому неудивительно, что сперма быка обладает большей криорезистентностью, чем сперма кролика, поскольку при замораживании так же, как и при ультразвуковом воздействии, механический фактор является одним из приводящих к разрушению и гибели клетки.
Неизвестно, обусловлена ли повышенная прочность сперматозоидов крупных животных биологической потребностью, или это обусловлено повышенным содержанием холестерина и сфингомиелина во всех клетках крупных животных. Отметим, однако, весьма высокую резистентность сперматозоидов рыб, что, по-видимому, объясняется условиями внешнего оплодотворения.
Ультразвуковая резистентность сперматозоидов коррелирует с их подвижностью и, следовательно, с их оплодотворяющей способностью. Это позволяет быстро и объективно оценивать пригодность спермы для искусственного оплодотворения, отрабатывать щадящие режимы ее хранения при низких температурах, подбирать подходящие криопротекторы.
Этими примерами применение ультразвуковой цитолизометрии не ограничивается. Широкое применение метода позволяет решать самые разные задачи. Метод ультразвукового разрушения эритроцитов и других клеток значительно информативнее метода определения механической прочности эритроцитов, используемого в настоящее время в клинической практике, и способен его заменить, по крайней мере, в тех случаях, когда небольшое удорожание анализов оказывается несущественным по сравнению с ценностью получаемой информации.
2.5. СОНОЛЮМИНЕСЦЕНЦИЯ В УЛЬТРАЗВУКОВОЙ
ДИАГНОСТИКЕ
Ультразвуковое свечение жидкостей зависит от их физико-химических свойств: поверхностного натяжения, давления насыщающих паров, вязкости, природы и концентрации растворенных в жидкости веществ и т. д. Поэтому если в результате тех или иных физиологических или патологических процессов в сыворотке крови, мочи или других биологических жидкостях меняется содержание веществ, влияющих на сонолюмивесцепцию, то ее можно использовать для исследования динамики этих процессов и диагностики патологических состояний.
Так, если небольшое количество (6,45 мл) плазмы крови или воды поместить в кювету, дном которой служит ультразвуковой излучатель, то после включения ультразвука интенсивностью 0,05..,0,2 Вт/см2 и частотой 500 кГц в жидкости возникает свечение, быстро уменьшающееся со временем. Скорость уменьшения интенсивности свечения воды всегда одинакова, а скорость уменьшения интенсивности свечения плазмы несколько выше, чем у воды, и заметно различается у больных и здоровых. В качестве диагностического теста удобно пользоваться величиной:
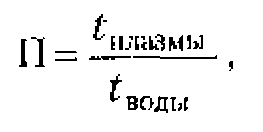
где ![]() - время, в течение которого интенсивность свечения дистиллированной воды уменьшается втрое, а
- время, в течение которого интенсивность свечения дистиллированной воды уменьшается втрое, а ![]() - время, за которое в три раза уменьшается свечение исследуемого образца плазмы.
- время, за которое в три раза уменьшается свечение исследуемого образца плазмы.
Исследования показали, что в норме величина П = 0,75-1,0, при злокачественных патологиях II = 0,016-0,15, а при других заболеваниях не падает ниже 0,2. Авторы связывают обнаруженный ими эффект с изменением газосодержания в плазме крови при патологических процессах в организме. При злокачественных новообразованиях содержание кислорода в плазме не превышает 88 % от нормы. Простота и надежность метода позволяет использовать его для дифференциальной диагностики заболеваний опухолевой и неопухолевой этиологии.
2.6. АКУСТИЧЕСКАЯ МИКРОСКОПИЯ
Современная УЗ-техника позволяет не только визуализировать крупные внутренние органы животных, но и получать контрастные акустические изображения неокрашенных или непрозрачных микрообъектов - клеток, тонких срезов мягких и костных тканей.
В акустической микроскопии используются ультразвук высокой частоты (10 МГц,,.3 ГГц), так как, чем больше частота, тем короче длина волны, и, следовательно, тем выше разрешающая способность микроскопа. Действие акустического микроскопа основано на том, что рассеянные микрообъемом ультразвуковые волны создают акустическое изображение, которое затем преобразуется в увеличенное, видимое изображение, соответствующее акустическому.
В последнее время было найдено решение, позволившее существенно уменьшить размеры акустического микроскопа и упростить работу на нем. Выносной блок, содержащий объектив и сканирующее устройство, подсоединен к компьютеру, реконструирующему акустическое изображение в двумерное или объемное видимое изображение неоднородностей в теле объекта. С помощью такого микроскопа можно легко получать изображения структуры кожи, поверхностных и подповерхностных дефектов зуба.
Список литературы
- Акатов В.А., Париков В.А. Ультразвук и его применение в ветеринарии. М.: Колос, 1970.
- Акопяп В.Б. Лечит ультразвук. М,: Колос, 1983.
- Андреев В.Г., Дмитриев В.Н.Пищалъпиков Ю. А, и др. Наблюдение сдвиговой волны, возбужденной с помощью сфокусированного ультразвука в резиноподобной среде // Акустический журнал. 1997. №2.
- Бвлановский А.С. Основы биофизики в ветеринарии. М,: Агропромиздат, 1989.
- Гавашели T.B, Акопян В.Б. Макаров С.Н Ультразвуковая резистентность эритроцитов рыбы при ртутном отравлении // Доклады ВАСХНИЛ. 1982. № 7.
- Горский С.М, Карев И.Д., Терентъев И.Т. Ультразвуковое свечение плазмы крови и диагностика рака // Акустический журнал, 1989. №2.
- Т.Журавлев AM., Акопян В.Б. Ультразвуковое свечение. М.: Наука, 1977.
- Маев R.Г. Акустическая микроскопия. Состояние и перспективы // Вестник АН СССР. 1988. № 2.
- Паункснене M.L, Владишаускас А. Ультразвуковые изменения анатомических параметров глаз животных // Научные труды вузов Литовской ССР. Сер. Ультразвук. 1984. № 16.
- Применение ультразвука в медицине. Физические основы / Пер. с англ.; Под ред. К. Хилла. М.: Мир, 1989.
- Руденко О.В., Сарвазян АЛ. Нелинейная акустика и биомедицинские приложения // Биомедицинская радиоэлектроника. 2000. №3,
- Фридман Ф.Е., Гундорова РА,, Кодзов М.Б. Ультразвук в офтальмологии, М.: Медицина, 1989.
- Янсон Х.А., Дзенис В.В..Tamapuнoв AM. Ультразвуковые исследования трубчатых костей. Рига: Зинатне, 1990.
3. ОСНОВЫ УЛЬТРАЗВУКОВОЙ СТИМУЛЯЦИИ И УЛЬТРАЗВУКОВОЙ ТЕРАПИИ
Стимуляция организма с целью повышения его защитных сил и эффективного лечения заболеваний в идеале возможна лишь в том случае, когда предельно ясны механизмы его функционирования, природа нарушений в живых системах при патологиях, последовательность реакций в организме при лечебных или стимулирующих воздействиях. Наука сегодня еще далека от понимания многих процессов, протекающих в больном и здоровом организме, представляющем собой очень сложную систему, состоящею из сложных подсистем, объединенных многочисленными связями.
Возможны два метода изучения таких систем - синтез и анализ.
Первый метод подразумевает исследование структуры биологических макромолекул и процессов на молекулярном уровне, принципов построения надмолекулярных структур, формирования из этих структур клеточных органелл, клеток, тканей, а также принципов усложнения процессов при переходе от более простого уровня структурной организации к сложному.
Второй метод предусматривает исследование организма как целостной системы и анализ структур, способных обеспечить реакцию системы на внешние воздействия.
Оба метода дополняют друг друга и поэтому терапевтическое и стимулирующее действие ультразвука необходимо рассматривать на разных уровнях биологической организации, в том числе и на системном, организменном уровне.
3.1. ОРГАНИЗМ - БИОЛОГИЧЕСКАЯ СИСТЕМА
Применение ультразвука в медицине, ветеринарии, биотехнологии можно рассматривать как способ управления биообъектами на любом уровне иерархии их построения: молекулы ![]() органеллы
органеллы ![]() клетки
клетки ![]() ткани
ткани ![]() организмы
организмы ![]() популяция.
популяция.
Химические методы управления подразумевают воздействие на низшие молекулярные уровни с опосредованным влиянием на более высокие уровни.
Физические методы управления подразумевают воздействие на средние уровни с опосредованным влиянием как на нижележащие, так и на более высокие. При этом положительный результат на заданном уровне может сопровождаться как положительными, так и отрицательными эффектами па друг их уровнях.
Ультразвуковое воздействие - типичный пример управления биообъектами физическим методом.
Для управления любым биообъектом необходимы: 1) базы данных о свойствах объекта; 2) адекватная модель объекта; 3) методы контроля состояния объекта (диагностика); 4) методы воздействия на объект для корректировки его состояния.
Эффективное управление биообъектами, в том числе с помощью ультразвука, возможно лишь па базе комплексных исследований влияния различных физических и химических факторов, из которых складывается действие ультразвука на разные уровни биологической организации.
Результаты исследования механизмов действия ультразвука на биомакромолекулы и биомакромолекулярные комплексы, в том числе цитоплазматические мембраны и клеточные органеллы, хорошо укладываются в рамки физико-химических, биохимических и биофизических закономерностей. Параметры, характеризующие чувствительность биомакромолекул к ультразвуку, могут заметно меняться, отражая изменения в их составе и структуре. Эти изменения, в свою очередь, зависят от характера физиологических и патологических процессов в организме. Однако смоделировать процессы на более высоких уровнях биологической организации по изменению свойств макромолекул весьма непросто. Примером может служить квазихимическая модель ультразвукового воздействия на рост и развитие клеточных популяций организма.
В общем случае при анализе жизнедеятельности организма нужно знать не только свойства отдельных клеток, но, что не менее важно, свойства клеточных популяций, из которых состоит организм.
Рис. 3.1. Фазы клеточного цикла:
G![]() -первая стадия подготовки; S - стадия синтеза; G
-первая стадия подготовки; S - стадия синтеза; G![]() - вторая стадия подготовки; М- стадия митоза
- вторая стадия подготовки; М- стадия митоза
Наиболее известными клеточными популяциями организма человека (пространства этих популяций), помимо миоцитов, являются клетки крови - эритроциты, лимфоциты, лейкоциты, клетки ткани печени (гепатоциты), клетки костном ткани (остеоциты).
Клеточными популяциями являются микробы, поселяющиеся в организме, который становится для них «жизненным пространством».
Построение квазихимической модели роста клеточных популяций начинается с анализа основных стадий клеточного цикла, состоящего из четырех этапов; G1- 1-й этап подготовки, S- синтез, G2- 2-й этап подготовки, М - митоз (рис. 3.1).
Установлено, что при заданных внешних условиях длительности клеточного цикла в целом и его отдельных стадий достаточно хорошо воспроизводятся и имеют характеристики, присущие данной клеточной линии.
Квазихимическая модель клеточного цикла, начиная с митозаделения материнской клетки ![]() может быть схематично представлена в виде цепи последовательных стадий-периодов:
может быть схематично представлена в виде цепи последовательных стадий-периодов:
![]()
Здесь С1 - молодая клетка непосредственно после деления, С2 Сз, Ст последующие ее фазы развития до митоза. Фазы С1 - Ст представляют клетки четырех возрастов.
Фактор размножения ![]() определяет число клеток, на которые делится митотическая клетка Ст. В простейшем случае
определяет число клеток, на которые делится митотическая клетка Ст. В простейшем случае ![]() - 2 (две клетки).
- 2 (две клетки).
Модель называется квазихимической потому, что взаимодействие клеток и химических веществ (субстратов и токсикантов) в растущей популяции отображается в виде химических реакций с помощью квазихимических уравнений. При этом отображается биохимическая структура растущей популяции - ее химические взаимодействия с окружающей средой.
Необходимым условием роста популяций тех или иных биологических видов является наличие набора М питательных веществ (субстратов) для данного биологического вида S:
![]()
где Ms - вектор набора субстратов (Ms1, Мse) для биологического вида S.
Упрощенное описание развития популяции в отсутствие токсикантов и внешних источников можно представить в виде укороченной цепи из двух стадий - роста и деления, дополненных стадией самоин-гибирования.
Получают двухстадийную модель роста и деления в присутствии двух токсикантов (ингибиторов роста) Х1, Х2.
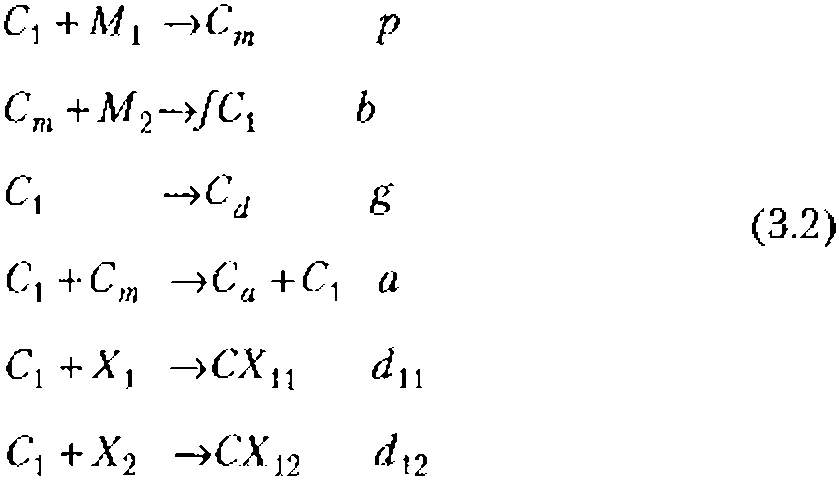
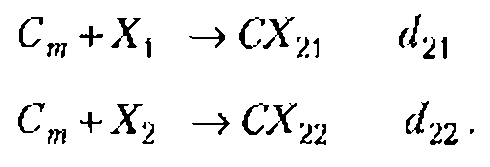
Приращение (или убыль) численности популяции в результате притока (оттока) из внешней среды ЕЕ субстратов и особей разных возрастов учтено в следующих псевдохимических уравнениях реакций:
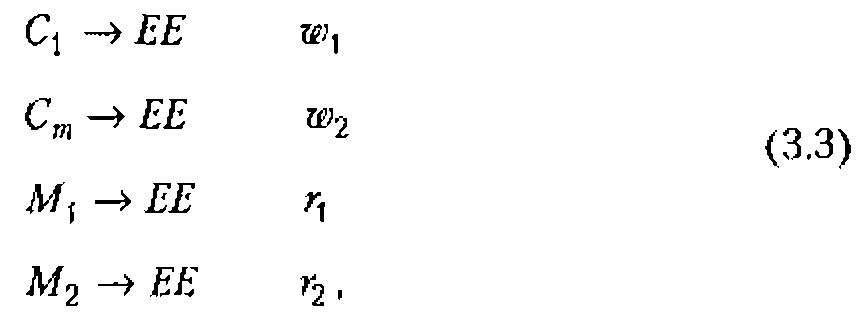
где С1 - совокупность клеток разных возрастов до митоза;
Ст - митотические клетки;
Са ~ клетки в анабиозе (покое);
М1, М2 - субстраты;
![]() - кинетические константы соответствующих реакций.
- кинетические константы соответствующих реакций.
Предполагая постоянство количеств субстратов М1, М2 кинетику цепного роста изолированной популяции, состоящей из особей C1 и Сm, можно описать системой из двух дифференциальных уравнений:
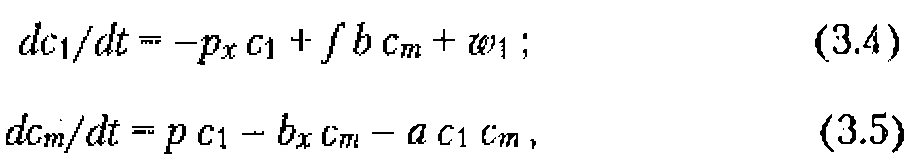
где с1 и сm - плотности популяций растущих и зрелых особей;
![]() - мощность внешнего источника особей С1;
- мощность внешнего источника особей С1;
a, b, g, р - кинетические коэффициенты автоингибирования, рождения (разветвления), гибели и роста популяционной цепи ![]() .
.
В коэффициенты р и b включены постоянные количества субстратов М\коэффициент размножения. Для разделившейся митотической клетки ![]() =2. В общем случае значение/может быть как меньше, так и больше 2. Коэффициенты bх и рх являются функциями от концентрации ингибиторов
=2. В общем случае значение/может быть как меньше, так и больше 2. Коэффициенты bх и рх являются функциями от концентрации ингибиторов ![]() \
\
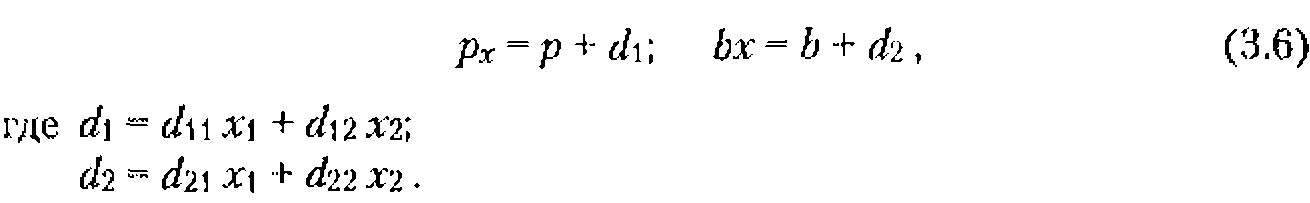
Система уравнений (3.4)--(3.5) для изолированной популяции ![]() имеет две стационарных точки (0,0) и
имеет две стационарных точки (0,0) и ![]() :
:
![]()
Первая точка (0,0) отвечает полному вымиранию популяции. Второй точке соответствует предельная численность популяции ![]() .
.
Численности популяции в целом и клеток в разных фазах развития в условиях изоляции, согласно формулам (3.7), являются функциями содержания ингибиторов в среде. Как следует из соотношений (3.6), с ростом содержания ингибиторов Х1 и Х2 возрастают величины bх и рх. При этом предельная численность клеток С1 и C2 падает и достигает нуля при равенстве
![]()
Уравнение (3.5), как правило, описывает более быстрые изменения по сравнению с (3,4). Поэтому для митотических клеток Cm, составляющих обычно небольшую долю популяции (промежуточный продукт), применимо квазистационарное приближение, В этом приближении система (3.4), (3.5) сводится к одному уравнению:
![]()
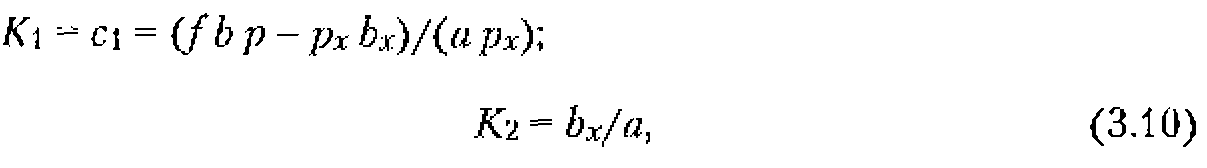
Здесь
Где К1 - предельная плотность особей С1 при ![]() ,
,
Частное решение уравнения (3.9) при ![]() имеет вид
имеет вид
![]()
где А равно левой части уравнения, если при t = 0 величина с = -c0-c1(0).
Двухстадийная модель роста популяции, описываемая квазихимичесими уравнениями (3.2), позволяет наглядно реализовать математическую формализацию и получить в явном виде аналитические зависимости, количественно описывающие ультразвуковые воздействия.
Для учета ультразвукового цитолизиса двухстадийную модель (3.2) следует дополнить стадиями
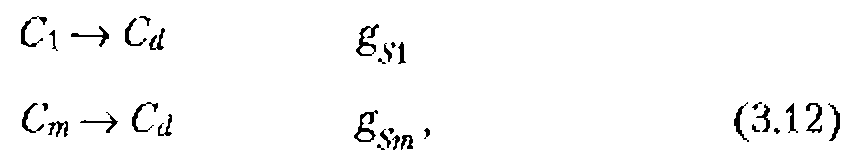
где gsv gSm - кинетические коэффициенты поражающего действия ультразвука на клетки; Cd - лизированые клетки.
Модель (3.2) предполагает, что токсиканты действуют только на растущие С1 и митотические Cm клетки и не влияют на коэффициенты роста a, b, р. Очевидно, что ультразвук в зависимости от его интенсивности не только способен привести к нарушению механической целостности клеток, но и может заметно влиять на указанные выше кинетические коэффициенты. При этом возможно как возрастание этих параметров (ультразвуковое промотирование), так и их уменьшение (ультразвуковое ингибирование).
Очевидно, что при ![]() (отсутствие ингибиторов) и
(отсутствие ингибиторов) и ![]() (изоляция) кинетические коэффициенты
(изоляция) кинетические коэффициенты ![]() прямого токсического действия равны нулю. Но химическими агентами могут быть вещества, образующиеся при сонолизе. Система уравнений (3.4)-(3.5) и уравнение (3,11) описывают рост популяции как частный случай, если вместо кинетических коэффициентов b,р и g использовать коэффициенты bs,Ps и gsi, учитывающие влияние ультразвука на рост клеток.
прямого токсического действия равны нулю. Но химическими агентами могут быть вещества, образующиеся при сонолизе. Система уравнений (3.4)-(3.5) и уравнение (3,11) описывают рост популяции как частный случай, если вместо кинетических коэффициентов b,р и g использовать коэффициенты bs,Ps и gsi, учитывающие влияние ультразвука на рост клеток.
Предельная плотность К1 особей С1 при ультразвуковом воздействии
![]()
В зависимости от характера изменения коэффициентов bs и as иод действием ультразвука величина К1s может как возрастать, так и уменьшаться. При достижении значения К1 = cо, где cо - начальная численность особей С1, скорость роста популяции согласно (3.9) обращается в нуль. Рост популяции отсутствует, и се численность остается па исходном уровне.
Условия действия ультразвука, соответствующие К1 = cо, являются в этом смысле цитостатическими.
График функции (3.11) описывает рост биологических популяций под действием ультразвука в отсутствие внешних источников особей. Данную зависимость целесообразно называть экозвуковой кривой роста популяции.
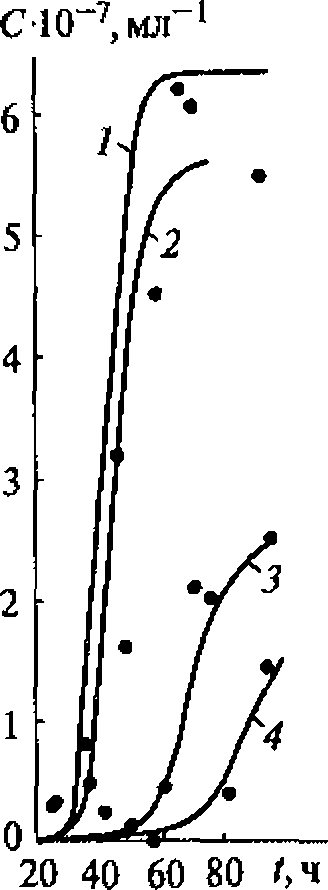
Рис. 3.2, Экспериментальные точки и теоретические графики функции t ^ /(с), описывающей рост числа клеток пивных дрожжей при разных интенсивностях ультразвука:
1 - 0,5 Вт/см2; 2 - 1,0 Вт/см2; 3- 1,5 Вт/см2;
4 - 2,0 Вт/см ;
На рис. 3.2 приведены экспериментальные точки и графики, рассчитанные по уравнению (3.11), описывающие рост числа клеток пивных дрожжей при ультразвуковом воздействии. В пределах точности измерений расчетные кривые согласуются с экспериментальными данными при изменении численности клеток примерно на шесть порядков. Коэффициенты: ![]()
![]() .
.
При большом числе параметров путем подбора нетрудно достичь согласия теории и эксперимента. Поэтому соответствие модели и объекта легко проверить теоретическими расчетами с использованием экспериментально определенных параметров.
Б представленных здесь наиболее общих уравнениях в явном виде содержатся три неизвестных параметра ![]() , и все они зависят от условий действия ультразвука. С учетом этого для построения экозвуковой кривой необходимо иметь четыре независимых параметра - aS, bS1 ps и fs, характеризующих рост популяции без токсикантов.
, и все они зависят от условий действия ультразвука. С учетом этого для построения экозвуковой кривой необходимо иметь четыре независимых параметра - aS, bS1 ps и fs, характеризующих рост популяции без токсикантов.
Коэффициент продолжения цепи ps легко определяется по начальной логарифмической фазе кривой роста. Предельное значение численности особей на этой кривой (рис. 3.2) равно отношению ![]() . В этом случае коэффициенты для уравнения (3.2)
. В этом случае коэффициенты для уравнения (3.2) ![]()
![]() .
.
Зная значение Ks1, можно рассчитать фактор размножения Иными словами, все параметры экозвуковых кривых роста популяций могут быть экспериментально определены.
Обработка доступных экспериментальных данных по описанной выше методике показывает, что расчетные кривые в пределах точности согласуются с результатами измерений (см. рис. 3.2).
Следует отметить, что предлагаемая здесь модель позволяет описывать не только ингибирование, но и стимуляцию (промотированис) биологического роста. При этом необходимо иметь в виду, что в квазихимической концепции понятие «субстрат» включает не только биохимические субстраты - вещества, но и организмы.
Например, для потребляющих организмов - консументов - в качестве субстратов могут рассматриваться соответствующие производящие организмы - продуценты (головастик + личинка![]() лягушонок).
лягушонок).
Уравнения, полученные па основе квазихимических моделей, позволяют теоретически рассчитывать эффекты совместного действия ультразвука и химических веществ на динамику популяций, т. е. решить одну из важнейших задач теоретической биологии и экологии.
В качестве количественного критерия эффектов действия ингибиторов или промоторов можно использовать отношение
![]()
где Тх, Т0 - периоды индукции (инкубации) при действии агентов х1, х2 и в их отсутствие. Эти величины рассчитывают непосредственно по уравнению (3.11).
Расчетная кривая «доза - эффект» Et (х1, х2) для дрожжей удовлетворительно согласуется с экспериментом (см. рис. 3.2).
1
Рис. 3.3. Яма с шариком - простейшая модель возможных состояний сложной биологической системы:
1 - основное состояние; 2 кпазистациопарные состояния
Биосистема в целом обычно находится в квазистационарном равновесии, как, например, шарик на дне ямы с пологими стенами и ямками различного размера, расположенными в разных местах на стенках ямы (рис. 3.3). Небольшие воздействия могут вывести систему из стационарного состояния, но защитные механизмы вернут ее обратно, подобно тому, как воздействие на шарик в яме выведет его из самой низкой точки, но под действием сил тяжести шарик снова скатится на дно. Такая модель хорошо известна в физике как модель частицы в потенциальной яме.
Если биосистема долго остается в некотором новом состоянии (в углублении на стенке основной ямы), то в ней начинают происходить структурные изменения (шарик как бы продавливает дно новой ямки и увеличивает ее глубину), и вероятность того, что система и дальше будет находиться в этом состоянии, увеличивается. В этом случае систему можно рассматривать как новую, образованную из исходной в результате определенной перестройки. Процессы перестройки углубляются со временем, и чем дальше, тем сложнее повернуть их вспять и тем более энергичные требуются воздействия, чтобы вернуть систему в исходное состояние.
Такое представление о биологической системе не противоречит известному факту, что болезнь тем легче поддается лечению, чем раньше оно начинается.
Живой организм как система реагирует на возмущения - сигналы из окружающей среды, прогнозирует ее возможные изменения в будущем и с помощью своих регуляторных механизмов так изменяет свои параметры, чтобы подготовиться к оптимальному функционированию в новых условиях.
Рис. 3.4. Области состояний системы, характеризуемой двумя параметрами: 1 - область рабочих состояний; 2 ~ область допустимых состояний
Если систему характеризуют два параметра -АиВ, то в координатах А,В (на фазовой плоскости) каждому состоянию системы i будет соответствовать изображающая точка с координатами (Аi Bi) (рис, 3.4). Совокупность всех изображающих точек составит область допустимых состояний системы.
Характеристики любой системы могут меняться лишь в ограниченных пределах, в области допустимых состояний. Выход изображающей точки за границы области означает либо разрушение системы, либо ее превращение в новую систему с другим набором параметров. В реальных условиях параметры системы меняются в более узких пределах, образуя область рабочих состояний, причем эта область, очевидно, целиком лежит в пределах области допустимых состояний.
Сложные, в том числе и биологические, системы характеризуются не двумя, а значительно большим числом параметров. Поэтому состояние системы определяется точкой в фазовом пространстве, размерность которого n равна числу свойств, характеризующих систему.
Например, состояние человека характеризуется массой его тела, температурой, давлением крови, скоростью оседания эритроцитов и множеством других параметров.
Влияние ультразвука на биосистемы проявляется па всех уровнях организации, начиная с молекулярного и кончая организменным, и зависит как от параметров, характеризующих ультразвуковое поле, так и от свойств среды и состояния системы. Реакция биосистем на ультразвук тем более сложна и трудно предсказуема, чем сложнее механизм ее функционирования, чем выше ее структурная организация.
3.2. ВЛИЯНИЕ УЛЬТРАЗВУКА НА БИОМАКРОМОЛЕКУЛЫ
В РАСТВОРАХ
В поисках первичных механизмов биологического действия ультразвука нередко исследуют влияние ультразвука на свойства простых веществ и биополимеров либо в растворах отдельных веществ или групп веществ, либо непосредственно в организме.
Два методических подхода - исследование действия ультразвука на систему в целом и на ее отдельные элементы - дополняя друг друга, позволяют оценить зависимость ультразвуковой резистентности макромолекул и макромолекулярных комплексов от их структуры и свойств, а также от свойств среды. Кроме того, такие исследования дают возможность определить, какими свойствами среды обусловлено превалирующее влияние одного или нескольких факторов из числа тех, из которых складывается физико-химическое и биологическое действие ультразвука.
Лучше всего изучено действие ультразвука на водные растворы аминокислот, оснований, белков и нуклеиновых кислот.
Аминокислоты в поле интенсивного ультразвука (10 Вт/см2, 0,6...0,8 МГц) в течение нескольких часов синтезируются из более простых веществ и сами испытывают существенные химические превращения. Однако и низкие интенсивности ультразвука способны заметно изменить их свойства.
Так, уже при 0,3 Вт/см2 (0,9 МГц) после 10…15-минутной ультразвуковой обработки наблюдаются изменения в оптических спектрах поглощения водных и водно-солевых растворов фенилаланина, тирозина и триптофана. Причем, как облучение ультразвуком раствора аминокислоты, так и растворение аминокислоты в воде, предварительно подвергнутой действию ультразвука, приводит к качественно одинаковым результатам.
Очевидно, наблюдаемые изменения в основном обусловлены взаимодействием молекул аминокислот с И2О2, HNO2, НNО3, образующихся под влиянием ультразвука в водных, насыщенных воздухом растворах.
Относительно малые изменения, обнаруженные при растворении аминокислот в предварительно обработанной ультразвуком воде, объясняются более низкой химической активностью, в частности, H2O2, HNO2 и HNO3, по сравнению с активностью промежуточных продуктов их образования.
Длительное облучение ультразвуком (2,6 МГц; 3 Вт/см2; 3 ч) в присутствии воздуха приводит к разрыву ароматического кольца в молекуле триптофана. Получасовая обработка насыщенного воздухом водного раствора цистеина ультразвуком (0,8 МГц 5 Вт/см2) приводит к полному блокированию его SH-групп, чего не наблюдается в свободной от азота среде.
Пуриновые и пиримидиновые основания в растворе также испытывают заметные изменения под действием ультразвука. По чувствительности к ультразвуку (5 Вт/см2,1 МГц) они образуют следующий ряд: тимидин —> уридин —> цитозин —> аденин. Пороговая интенсивность, при которой возникают изменения в тимидине и уридине, составляет около 0,5 Вт/см2. Насыщение раствора закисью азота N2O полностью подавляет эффект ультразвукового воздействия. Последнее свидетельствует о радикально-цепной природе ультразвукового воздействия, так как N2O является эффективным акцептором свободных радикалов.
Широкое использование ультразвука в медицинской диагностике, терапии и биотехнологии вызывает острую необходимость изучения его влияния на ферменты и другие биологически важные объекты па молекулярном уровне.
Ультразвук заметно влияет на структуру и функции белков и нуклеиновых кислот. Эти изменения зависят от размеров и формы молекул, от природы присутствующих в растворе посторонних веществ и параметров ультразвукового поля.
Белки, имеющие компактную, глобулярную форму, менее чувствительны к ультразвуку, чем фибриллярные белки.
Например, полная необратимая инактивация ![]() химотрипсина в разбавленных растворах (4 10-5 М) под действием ультразвука с интенсивностью 2 Вт/см2 (0,9 МГц) при комнатной температуре достигается лишь в результате 40-минутного воздействия.
химотрипсина в разбавленных растворах (4 10-5 М) под действием ультразвука с интенсивностью 2 Вт/см2 (0,9 МГц) при комнатной температуре достигается лишь в результате 40-минутного воздействия.
Предполагается, что инактивация фермента в основном обусловлена влиянием свободных радикалов, образующихся в облучаемых ультразвуком растворах. Об этом свидетельствует характер зависимости скорости инактивации ![]() -химотрипсина от интенсивности ультразвука, а также от природы насыщающего облучаемый раствор газа (кислород, азот, аргон, углекислый газ) и присутствия в растворе акцепторов свободных радикалов или ингибиторов свободнорадикальных процессов.
-химотрипсина от интенсивности ультразвука, а также от природы насыщающего облучаемый раствор газа (кислород, азот, аргон, углекислый газ) и присутствия в растворе акцепторов свободных радикалов или ингибиторов свободнорадикальных процессов.
Цистеин, аланин, лейцин, гистидин, метионин, валин, глутамин, а также аскорбиновая кислота, сыворочный альбумин и гликоген в различной степени защищают облучаемый ультразвуком фермент от разрушения.
Полагают, что эти вещества могут взаимодействовать с активным центром фермента, образуя подобие фермент-субстратного комплекса, более устойчивого, чем только фермент, к ультразвуковому воздействию. Однако, скорее всего, эффект обусловлен конкурентным взаимодействием этих веществ со свободными радикалами, образующимися в жидкости под действием ультразвука,
В настоящее время проведены систематические исследования ультразвуковой инактивации пероксидазы хрена, тиреоид-пероксидазы человека (ТПЧ), каталазы печени быка и уреазы соевых бобов в связи с большой практической важностью перечисленных объектов в медицине и иммунобиотехнологии.
Проведенные исследования показали важную роль молекулярной массы, структуры, концентрации фермента и свойств среды (рН, присутствие органических сорастворигелей) в кинетике ультразвуковой инактивации биокатализаторов. Особую роль в инактивации ферментов в ультразвуковом иоле играет их олигомерная структура.
Глюкозо-6-фосфат-дегидрогеназа (Г6ФДГ по классификатору ферментов 1.1.1.49) содержится во всех клетках организма человека и животных, играет ключевую роль в пентозофосфатном цикле, так как поставляет восстановленный НАДФ Н для синтеза жирных кислот. Именно поэтому Г6ФДГ была выбрана в качестве объекта для изучения кинетики ее инактивации в водных растворах иод влиянием низкочастотного ультразвука (20,8 кГц) мощностью 53...65 Вт. Ультразвук низкой частоты применяется в биотехнологии для дезинтеграции клеточных структур, а также в хирургической медицинской практике (см. гл. А),
Ультразвуковая инактивация Г6ФДГ обнаруживает три четко выраженных стадии: лаг-период, продолжительность которого уменьшается с ростом плотности ультразвуковой энергии в среде; вторая, быстрая стадия, скорость которой зависит от плотности ультразвуковой энергии; третья, медленная стадия потери активности фермента.
Ясно, что при повышении температуры от 36 до 509С Г6ФДГ претерпевает термоинактивацию. По этой причине во всех случаях инактивацию Г6ФДГ под влиянием ультразвука сравнивают с термической инактивацией фермента в аналогичных условиях.
В течение двух часов Г6ФДГ в высоких концентрациях термостабильна, но с разбавлением фермента после лаг-периода его активность резко падает, а сама инактивация характеризуется двумя стадиями. Лаг-период сокращается с уменьшением концентрации фермента, а скорость инактивации во второй фазе процесса увеличивается с разбавлением Г6ФДГ, в результате чего его концентрация снижается с 20 до 3 нМ.
Термоинактивация Г6ФДГ при 39 оС не проявляется при концентрациях 20 и 10 нМ. Однако ультразвук инактивирует Г6ФДГ как при этой, так и при более высоких температурах (44 и 50 °С). Примечательно, что при воздействии на фермент ультразвуком лаг-период исчезает, а скорости его инактивации резко возрастают.
Повышение концентрации Г6ФДГ при всех температурах ведет к увеличению его устойчивости. Ультразвуковая составляющая инактивации фермента весьма значительна и возрастает с его разбавлением и повышением температуры.
Снижение скорости термо- и ультразвуковой инактивации ферментов с увеличением их концентрации известно для пероксидазы хрена, тиреоид-пероксидазы человека, тетрамерной каталазы печени быка, гомогексамерной уреазы соевых бобов и пр.
Скорее всего, снижение скорости термо- и ультразвуковой инактивации ферментов с увеличением их концентрации связано с ассоциацией молекул белков в агрегаты. Эти агрегаты более устойчивы к воздействию температуры и ультразвуковой кавитации, инициирующей в водной среде в присутствии кислорода появление активных свободных радикалов НО2 и НО. Характер зависимости скорости ультразвуковой инактивации от концентрации в случае олигомерных ферментов - димерных Г6ФДГ и тиреоид-пероксидазы человека, тетрамерной каталазы и гомогексамерной уреазы - может объясняться также влиянием ультразвука на степень диссоциации субъединичных белков на тримеры, димеры и отдельные субъединицы в отличие от термоинактивации олигомеров, когда действие ультразвука отсутствует вообще.
Несмотря на небольшой температурный интервал, в котором исследовалась термо- и ультразвуковая инактивация Г6ФДГ-азы, можно оценить эффективные энергии активации для суммарного процесса термоинактивации и ультразвуковой инактивации Г6ФДГ-азы.
Такое сравнение приведено в табл. 3.1, из которой следует, что во всех трех случаях Еакт до точки излома (36...44 °С) существенно ниже ее значений при более высоких температурах (44...50 °С). При термоинактивации наблюдается увеличение Еакт с ростом концентрации Г6ФДГ-азы от 3 до 20 нМ, в то время как в случае суммарной инактивации для ее ультразвуковой составляющей значения Еакт проходят через максимум при концентрации фермента 5 нМ.
Из табл. 3.1 следует также, что величины Еакт при концентрациях Г6ФДГ-азы 5...20 нМ минимальны для ультразвуковой составляющей процесса, выше - для суммарной инактивации и существенно возрастают при термоинактивации фермента, т. е. ультразвук снижает активационный барьер трансформации белка. Изломы на температурных зависимостях свидетельствуют о сходной природе инактивации при термической обработке белка и воздействии ультразвуком.
Таблица 3.1
Энергия активации (ккал/моль) суммарной термической и ультразвуковой (20,8 кГц; 62 Вт) инактивации Г6ФДГ в 0,1М.фосфатном буфере
(рН7,4; 35/50)
|
Концентрация Г6ФД,ГнМ |
Суммарная инактивация |
Термоинактивация |
Ультразвукавая инактивация | |||
|
до 44 °С |
44 °С |
до44°С |
выше 44 °С |
до 44 °С |
виыше 44 °С | |
|
3,0 |
8,6 |
61,4 |
8,4 |
70,6 |
8,8 |
41,0 |
|
5,0 |
19,6 |
79,8 |
21,5 |
83,8 |
22,0 |
47,5 |
|
10,0 |
17,4 |
71,6 |
— |
139,9 |
15,4 |
31,7 |
|
20,0 |
18,7 |
61,0 |
— |
138,6 |
13,6 |
17,5 |
Инактивация ферментов зависит также от кислотности среды. Так, Г6ФДГ-аза наиболее устойчива к ультразвуку и температуре в интервале рН = 6...8, в то время как ее суммарная, термо- и ультразвуковая инактивация заметно возрастают при рН == 8,6 и 9,1, т. е. в области, где фермент проявляет максимальную каталитическую активность и, следовательно, наибольшую конформационную лабильность.
Доля ультразвуковой составляющей в суммарной инактивации Г6ФДГ-азы меняется при разных рН среды и возрастает от 26...30 % при рН = 8,6..9,1 до 50...60 % при рН = 6,0,..7,4. Кинетические кривые, отражающие суммарную и ультразвуковую инактивации Г6ФДГ-азы, полностью согласуются с диссоциативной схемой потери активности этого субъединичного фермента.
При повышении концентрации Г6ФДГ в растворе существует в виде тетрамера из четырех субъединиц (Е4), который представляет собой «димер обычного димера». В стабилизации связей между димерами главную роль играют ионные взаимодействия, а между субъединицами в димерах превалируют гидрофобные взаимодействия и водородные связи. Мономер Г6ФДГ-азы, как правило, каталитически не активен.
Схему инактивации Г6ФДГ-азы можно представить следующим образом:
![]()
где Е4, Е2, Е1 и EДен - тетрамер, димер, мономер фермента и его денатурированная форма, а ![]() константы скоростей прямых и обратных стадий.
константы скоростей прямых и обратных стадий.
Предполагается, что лаг-периоду па кинетических кривых инактивации соответствует диссоциация гетрамера на каталитически активные дим еры, Очевидно, что отношения активностей А/А0 при этом не уменьшаются. После окончания лаг-периода диссоциирует димер с лотерей каталитической активности.
Диссоциация димера Е2 состоит из двух стадий - быстрой и медленной, что отражается в виде изломов на полулогарифмических анаморфозах кинетических кривых суммарной и чисто термической инактивации. В последней стадии каталитически неактивный мономер фермента необратимо денатурирует.
При ультразвуковой кавитации с относительно высокими скоростями генерируются активные радикалы НО, O2,НO2 и атом Н превращающийся в радикал HO2 с частотой соударений:
![]()
Радикал HО играет превалирующую роль в ультразвуковой инактивации пероксидазы хрена, тиреоид-пероксидазы человека, каталазы, уреазы и многих других ферментов.
В случае Г6ФДГ-азы в течение лаг-периода продукты взаимодействия НО с аминокислотными остатками фермента ароматической природы накапливают, что приводит к диссоциации тетрамера в результате разрушения электростатических связей.
Содержание ароматических аминокислотных остатков у глюкозо-6-фосфат-дегидрогеназ довольно велико: 36-50 остатков тирозина (Тир), 40-64 остатка фенилаланина (Фен), 14-26 аминокислотных остатков гистидина (Тис) и 8-16 остатков триптофана (Три). Все перечисленные остатки с высокими скоростями реагируют с ПО: константы скорости равны для Гис 1,9 · 109, для Тир - 1,2 · 1010, для Три - 1,1 · 1010 и для Фен - 6,7 - 109 M-1c-1. Реакции НО с ароматическими аминокислотными остатками способствуют разрушению водородных связей и нарушению гидрофобных взаимодействий, что приводит к диссоциации димeра Е2 до мономера Е1 с потерей каталитической активности Г6ФДГ -азы.
Поскольку строение активного центра Г6ФДГ-азы неизвестно, говорить о прямой атаке радикалов НО на аминокислотные остатки в этом центре не приходится.
Относительное влияние свободных радикалов на ультразвуковую инактивацию ферментов оценивается по воздействию на этот процесс скавенджеров (акцепторов) радикалов НО (маннитол, этанол) и ингибиторов свободнорадикальных процессов из ряда полифенолов и их полидисульфидов.
Следует отметить, что при отсутствии кавитации ультразвук низких (терапевтических) интенсивностей практически не меняет активности хороню очищенных ферментов в растворе, поэтому влияние ультразвука непосредственно на активность того или иного фермента не может служить первичным актом взаимодействия ультразвука с биологической системой.
Если белки иммобилизованы, т.е. связаны с поверхностью клеточных мембран или нерастворимых гранул-носителей, то ультразвук даже малых интенсивностей (0,2 Вт/см2, 0,88 МГц) заметно увеличивает скорость ферментативных реакций. Этот аффект скорее всею обусловлен ультразвуковыми микропотоками, перемешивающими гонкие слои жидкости у поверхности носителя к облегчающими диффузию субстрата к ферменту.
Молекулы фибриллярных белков, в отличие от глобулярных, довольно чувствительны к ультразвуку, В особенности те, структура которых не связана жесткими поперечными связями и может изменяться при относительно слабых воздействиях. К числу таких белкой относится мышечный белок - актомиозин.
Пятиминутное облучение растворов актомиозинов как скелетной, гак и гладкой мышц ультразвуком (1 Вт/см2; 0,88 МГц) не снижает их ферментативной активности, хотя характеристическая вязкость белка и число титруемых сулемой сульфгидрильных групп, оптические спектры поглощения растворов в области 210.,.350 им и степень спиральности белковых молекул существенно зависят от интенсивности ультразвука. Свойство молекул актомиозина образовывать в определенных условиях агрегаты также изменяется, что отражается не только на вязкости растворов белка, но и на сократительной способности актомиозиновых нитей, приготовленных прессованием поверхностных пленок из облученного ультразвуком (0,9..З Вт/см2; 2,6 МГц; 10 мин) актомиозина. Нити получаются рыхлыми, непрочными и в присутствии АТФ сокращаются в 1,2 1,5 раза меньше контрольных.
Вязкость и электропроводность растворов другого фибриллярного белка - фибриногена, а также электрофоретическая подвижность его молекул меняются уже в первые минуты воздействия ультразвуком с интенсивностью 0,2...1,5 Вт/см2.
Молекулы коллагена в водно-соленых растворах, облучаемых ультразвуком (0,2…2 Вт/см2; 0,88 МГц; 5...20 мин) при температуре 20...25°С, также испытывают существенные изменения, выражающиеся в изменении температуры и теплоты денатурации коллагена. Энтальпия тепловой денатурации 0,3 %-ного раствора белка, изменяясь под действием ультразвука, достигает максимума при интенсивности 1 Вт/см2.
Аналогичная зависимость получена и при исследовании изменения коэффициента поляризации люминесценции раствора коллагена, облученного ультразвуком.
Можно предположить, что ультразвук низкой интенсивности вызывает частичную деполимеризацию молекул коллагена, а интенсивности, превышающие 1 Вт/см2, приводят к денатурации белка, причем скорость денатурации тем выше, чем выше интенсивность ультразвука.
В тканях ультразвук приводит к дестабилизации связей между молекулами коллагена и окружающим матриксом. Кратковременное облучение кожевой ткани ультразвуком (2 мин) па один-два порядка увеличивает количество экстрагируемого из нее коллагена. Мощное низкочастотное ультразвуковое воздействие в 25 раз ускоряет разволокнение коллагеновых структур даже дубленой кожевой ткани, обрезки которой составляют отходы кожевенной промышленности.
Пользуясь различной чувствительностью белков к ультразвуку, можно избирательно, ингибируя тот или иной фермент в полиферментных системах, исследовать их роль в этих системах.
Молекулы ДНК и РНК в ультразвуковом поле (10 Вт/см2; 0,8 МГц) в первые же минуты облучения распадаются на фрагменты примерно равной молекулярной массы. Воздействие в течение нескольких часов приводит к появлению в растворе свободных нуклеотидов. По-видимому, это явление может наблюдаться и тогда, когда вероятность кавитации невелика или когда в каптирующем растворе присутствуют акцепторы свободных радикалов, т.е. деполимеризация макромолекул нуклеиновых кислот обусловлена в основном гидродинамическими силами, возникающими в ультразвуковом поле. Действительно, градиенты скоростей микропотоков вблизи пульсирующего газового пузырька по порядку величины 104…105 с-1 сравнимы со значениями градиентов в гидродинамических установках, при которых происходит деградация макромолекул.
При интенсивности ультразвука 0,2...1,5 Вт/см2 (0,9 МГц; 110... 120 мин) наряду с фрагментацией наблюдаются более тонкие изменения, выражающиеся в уменьшении прочности связей между нуклеиновыми кислотами и белками в нуклеопротеидных комплексах. Этот эффект наблюдается не только при облучении ультразвуком суспензии нуклеопротеидов в среде, но и при ультразвуковой обработке одной только водной среды с последующим субсидированием в ней нуклеопротеидных частиц. В основе этого эффекта, очевидно, лежит химическое взаимодействие между нуклеопротеидными комплексами и долгоживущими химически активными частицами, возникающими в водной среде под действием ультразвука.
Влияние образующихся в ультразвуковом поле химически активных веществ на ДНК и РНК не обязательно обусловливает денатурацию или деградацию макромолекул.
Например, взаимодействие нуклеиновой кислоты с NO2 может привести к замене одного основания (цитозина) другим (урацилом). Возможно, эта и аналогичные реакции являются одной из причин хромосомных нарушений, вызываемых ультразвуком (см. подразд. 3.2,4).
Как химическое, так и механическое действие ультразвука наблюдается во всех случаях, когда интенсивность ультразвука превышает порог кавитации. Однако, если воздействию подвергаются низкомолекулярные частицы (мономеры, т-РНК), то превалирует химическое действие. Когда же молекулярный вес частиц велик (ДНК, м-РНК), то основную роль играют механические силы.
Под влиянием ультразвука изменяются и свойства нуклеопротеидных комплексов - эухроматина и гетерохроматина.
Среди множества способов дезинтеграции ультразвуковой метод, пожалуй, наиболее эффективен, технологичен и стабилен но воспроизводимости результатов, Однако не всегда можно отождествлять свойства исследуемых веществ в организме с их свойствами после выделения с помощью ультразвуковых методов. Здесь нужна разумная осторожность. Не следует забывать о возможных химических превращениях, обусловленных ультразвуком.
3.3. ФУНКЦИОНАЛЬНЫЕ И МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ Б КЛЕТКАХ
Реакции на ультразвук отдельных, не связанных друг с другом клеток и совокупности клеток различны, так как неодинаковы условия взаимодействия клеток и клеточных систем, например с микропотоками, а также потому, что па тканевом уровне функционирование отдельных клеток находится под контролем межклеточных регуляционных систем. Роль этих систем обнаруживается при сравнении действия ультразвука на клетки в суспензиях и тканях.
Так, в стоячей ультразвуковой волне (4...6 Вт/см2; 0,75...1 МГц) с клеток Не La в суспензии смываются поверхностные слои, отделяются нитевидные образования, в мембранах возникают дыры. Эти же клетки в монослое практически не испытывают изменений даже при впятеро большей интенсивности ультразвука.
Некоторые виды клеток в обычных условиях существуют в суспендированном состоянии. Это эритроциты, лейкоциты и другие клетки крови, сперматозоиды, бактерии, одноклеточные водоросли и пр. Другие клетки можно получить в виде суспензии, только применяя специальные методы. Чувствительность разных типов клеток к ультразвуковому воздействию весьма различна. Некоторые из них, например клетки амебы, выдерживают весьма интенсивное облучение. Так, после 10-минутной обработки ультразвуком интенсивностью 200 Вт/см2 (1 МГц) в суспензии остается 50% жизнеспособных особей, а клетки Не La в суспензии начинают разрушаться при 0,7 Вт/см2 (0,75 МГц,).
Одноклеточные, пожалуй, наиболее устойчивы к изменениям внешних условий, к действию различных физико-химических факторов, в том числе к действию ультразвука.
Механическая резистентность одноклеточных заметно меняется в зависимости от их величины, формы, особенностей строения, периода и жизненном цикле и т. д. Однако в среднем она достаточно высока, и многие одноклеточные остаются в суспензии целыми и жизнеспособными даже после облучения весьма интенсивным ультразвуком. Достаточно отметить, что еще никому не удавалось только с помощью ультразвука полностью избавиться от микроорганизмов в жидких средах, т.е. стерилизовать их.
Разрушению структуры клеток предшествуют заметные изменения их физиологического состояния, и если механическая резистентность клеток меняется и широких пределах (0,1.,.10 Вт/см2; 0,5...2 МГц; 1...104 с) в зависимости от типа клеток, то пороговые физиологические изменения происходят в значительно более узкой области (0,1. ..0,5 В т/см 0,5.. .2 МГц; 10… 100 с).
Хорошей моделью для изучения изменений в клетках под влиянием ультразвука являются светящиеся бактерии. Их особая ферментативная система преобразует энергию окислительных реакций в электромагнитное излучение видимого диапазона (биолюминесценция), пропорциональное интенсивности метаболизма. Кинетику процессов, происходящих в клетке, можно оценивать на расстоянии по их свечению без вмешательства в жизнедеятельность объекта и с быстродействием регистрации, скорость которой заведомо превышает скорость любого биологического процесса. Для регистрации свечения существуют чувствительные, быстродействующие и сравнительно простые приборы и методы.
В интервале 0,05...0,4 Вт/см2 (0,88 МГц) биолюминесценция фотобактерий и стимулированная ультразвуком скорость их роста пропорциональны интенсивности ультразвука, но яркость свечения нарастает быстрее, чем количество клеток и единице объема. При интенсивности ультразвука, превышающей 0,6 В г/см2, наблюдается необратимое подавление люминесценции, сила которого увеличивается с повышением интенсивности ультразвука, хотя скорость роста бактерий при повышении интенсивности вплоть до 1,5 Вт/см2 меняется несущественно. В интервале 0,4...0,6 Вт/см2 видимых изменений в свечении бактерий не наблюдается. Очевидно, при этих интенсивностях эффекты подавления и стимуляции биолюминесценции оказываются равными.
Следует отметить, что реакция фотобактерий на ультразвук может заметно меняться в зависимости от их возраста, исходного состояния, наличия в среде тех или иных составляющих и т. д.
Отличия в чувствительности различных клеток к ультразвуковому воздействию связаны с их морфологическими особенностями и функциональным состоянием.
В первую очередь, резистентность клеток к ультразвуку определяется структурой их оболочки, в наибольшей степени подверженной влиянию факторов, действующих в ультразвуковом поле. В непосредственной близости от клеточных мембран как внутри, так и вне клетки, наблюдаются периодические механические воздействия и энергичные акустические микропотоки. Напряжения сдвига под влиянием этих микропотоков могут достигать весьма больших величин (102.103 Н/м2), днако уже 10 Н/м2 (5...60 мин воздействия) оказывается достаточно, чтобы уменьшить время жизни эритроцитов и повысить их чувствительность к осмотическому лизису, увеличить проницаемость цитоплазматических мембран и изменить их поверхностную энзиматическую активность, понизить поверхностный заряд и увеличить скорость оседания эритроцитов в поле гравитационных сил.
Переменные напряжения в акустическом поле, расшатывающие структуру клеточной мембраны, и микропотоки, «смывающие» макромолекулы с поверхности клеток, приводят к повышению межфазного натяжения на границе мембрана - среда.
Стремление энергии Гиббса системы к минимуму обусловливает дополнительные напряжения в мембране, приводящие к уменьшению поверхности клетки и снижению се поверхностной энергии. Это повышение напряжения приводит, например, к изменению формы клеток Не La при кратковременном ультразвуковом воздействии (1 Вт/см2; 0,8 МГц; 1 мин), незначительной деформации эритроцитов в сходных условиях и т.д. Оно сохраняется, пока поверхностная энергия не уменьшится до исходных значений в результате адсорбции белка и других поверхностно-активных веществ из окружающей среды.
Десорбция с поверхности клеток под действием ультразвука некавитационных интеисивностей (0,05..0,3 Вт/см2; 1 МГц; 5...60 мин) молекул белков, гликопротеинов и, возможно, других биополимеров подтверждается изменениями энзиматической активности поверхности эритроцитов, потерей эритроцитами, лимфоцитами и соматическими клетками человека антигенов, связанных с их мембранами, повышением адгезивных свойств клеток, появлением в супернатанте заметных количеств гликопротеидов.
В результате ультразвукового облучения (0,05 Вт/см2; 0,88 МГц) суспензии эритроцитов (17000 кл./мм3) в физиологическом растворе в первую же минусу с поверхности каждой клетки десорбируется примерно 2 • 10-14г вещества белковой природы (для сравнения: масса
эритроцита - 10 -10г). Как видно из рис. 3.5, дальнейшее облучение не приводит к повышению в среде концентрации десорбированного вещества, по-видимому, благодаря достижению равновесия десорбция - резорбция. После прекращения ультразвукового облучения «смытые» макромолекулы быстро сорбируются на поверхности клеток, и через несколько минут идентифицировать белок в среде спектрофотометрически не удастся.
Поверхность клетки покрыта слоем фибриллярного белка, к которому, как правило, прикрепляются белковые глобулы, мукополисахариды и другие биомакромолекулы. Благодаря белковому покрытию межфазное натяжение между клеточной мембраной и окружающей средой составляет всего (0,1...2) • 10-3Дж/м2. Белковые молекулы, способные взаимодействовать и с липидами мембран, и с окружающей средой, ведут себя как поверхностно-активные вещества.
Межфазное натяжение на границе липид-вода составляет около 30 • 10-3 Дж/м2, и молекулы белка, обладая поверхностной активностью, стремятся адсорбироваться на этой поверхности, снизить межфазное натяжение, а следовательно, и свободную энергию поверхности.
Если клеточные мембраны после ультразвукового воздействия сохранили свою структурную целостность, то их функциональные характеристики восстанавливаются в течение 10...60 мин. Это восстановление, по-видимому, обеспечивается как функционированием специфических репаративных механизмов, так и процессами резорбции на поверхности мембраны белковых молекул, «смытых» микропотоками. Для заметною снижения межфазного натяжения на поверхности раздела между слоем липидов и белковым раствором должно адсорбироваться довольно много белка, поскольку его поверхностная активность невелика.
Рис. 3.5. Зависимость количества десорбироваиного с поверхности эритроцитов вещества белковой природы (поглощение надосадочной жидкости при 280 им) от времени воздействия ультразвуком (0,1 Вт/см2)
О низкой поверхностной активности биомакромолекул свидетельствует известный факт: статическое (установившееся) поверхностное натяжение плазмы крови, содержащей 7...8 % белка, на границе с воздухом всего лишь на 20...25 H/м ниже, чем у воды. Время формирования межфазной поверхности может составить десятки минут, так как коэффициент диффузии крупных белковых молекул в водных растворах относительно мал, что существенно ограничивает скорость их сближения с поверхностью.
Если измерить поверхностное натяжение раствора белка на обновляющейся поверхности, например, в потоке или на поверхности капли, формирующейся на конце пипетки, то значение этого динамического поверхностного натяжения практически не будет отличаться от значений, характерных для поды. Присутствие в среде микропузырьков газа резонансных размеров значительно увеличивает эффективность ультразвукового воздействия на клеточную поверхность.
В модельном эксперименте вблизи погруженной в воду гидрофобной мембраны с порами диаметром 3,2 мкм, в которых стабилизированы газовые пузырьки, необратимая агрегация тромбоцитов наблюдается под действием ультразвука (1 МГц) с интенсивностью 32 мВт/см2. Если интенсивность не превышает 30 мВт/см2, агрегация обратима.
Эффект обусловлен микропотоками вблизи тромбоцитов, очень чувствительных к сдвиговым усилиям. Тромбоциты начинают агрегировать, если напряжение сдвига достигает всего 5 Н/м2.
В этих же условиях из эритроцитов высвобождается АТФ, что можно фиксировать но свечению люциферин-люциферазного комплекса, добавленного в суспензию. Порог этого явления также лежит в области 20...30 мВт/см2. В отсутствии пузырьков газа или при более низких интенсивностях ультразвука эффекты не наблюдаются.
Значительно слабее действует ультразвук на двухслойные липидные мембраны, лишенные белкового покрытия. Долго не удавалось обнаружить изменений в электроемкости, проводимости или разности потенциалов искусственной мембраны, облучаемой ультразвуком с частотой 1 МГц и интенсивностью в интервале 0,1...4 Вт/см2. Более высокие интенсивности ультразвука приводят к фрагментации мембран. Однако ультразвук (0,6 Вт/см2; 0,88 МГц) в определенных условиях значительно - на 60... 100 % - увеличивает электропроводность двухслойных липидных мембран и их проницаемость по отношению к ряду ионов, а также ускоряет встраивание каналообразующего антибиотика нистатина в матрицу мембран, что может быть обусловлено как изменениями механических свойств матрицы, так и нарушениями в прилегающих к пей диффузионных слоях.
Рис. 3.6. Клетка ацетабулярии
Изменения электрофизических свойств клеточных мембран, вызванные ультразвуковым воздействием, весьма удобно исследовать, используя одноклеточный организм - ацетабулярию средиземноморскую.
Клетки ацетабулярии (рис. 3.6) длиной до 5 см и диаметром 0,3... ..,0,5 мм покрыты прочной оболочкой, толщина которой достигает 30 мкм. Более 90 % объема клетки занимает вакуоль. Протоплазма, расположенная между вакуолью и оболочкой, имеет толщину 10...12 мкм.
Потенциал покоя ацетабулярии - максимальная разность электрических потенциалов между вакуолью в внешней средой - составляет 170 мВ, Потенциал покоя обусловлен функционированием насоса Cl-ионов с равновесным калиевым потенциалом, составляющим 90 мВ. Внешние раздражители приводят к изменению потенциала покоя. Разность потенциалов устанавливается при этом на уровне 80 мВ и не меняется в течение действия внешнею фактора.
Однако ацетабулярии, как и многие другие клетки, способна к иному типу реакции на внешнее воздействие - генерации волны электрического возбуждения (потенциала действия). Отличительной особенностью потенциалов действия ацетабулярии является их большая длительность, достигающая нескольких минут, что существенно облегчает изучение процесса возбуждения. Амплитуда потенциала действия в среднем равна 110 мВ.
Специальная приставка к микроскопу (рис. 3.7) позволяет контролировать введение микроэлектродов и наблюдать за явлениями в клетке в процессе ультразвукового облучения.
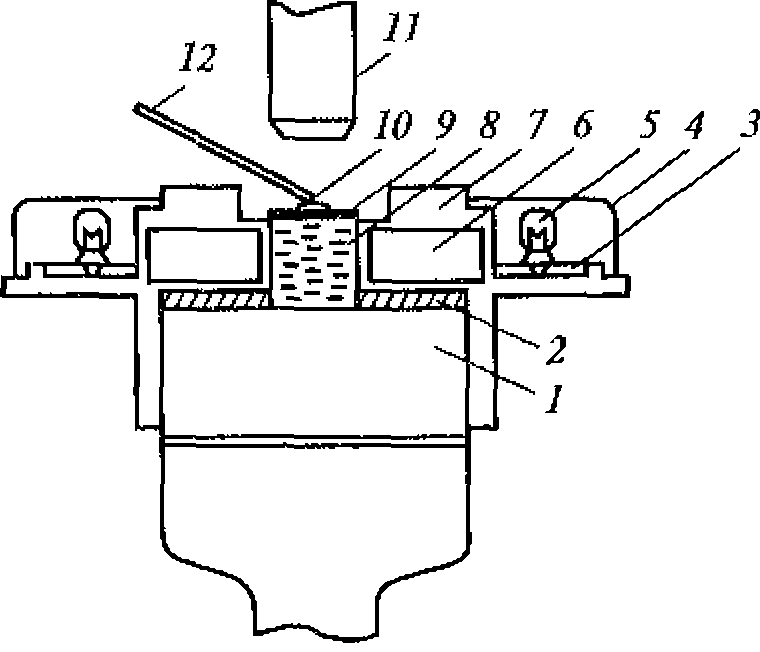
Рис. 3,7. Приставка к микроскопу для изучения реакции изолированной клетки на ультразвуковое
воздействие:
1 - акустический преобразователь; 2 - поглотитель ультразвука; 3 - кольцевая осветительная арматура; 4 - спетонепроницаемый кожух; 5 - лампочки накаливания; 6 термостатирующая рубашка; 7 корпус из светонепроницаемого материала; 8 - полость, заполненная жидкостью, рассеивающей свет; 9 - покровное стекло; 10 - исследуемый объект; 11 – объектив микроскопа; 12 – микроэлектрод
Наиболее характерная реакция клеток на ультразвуковое воздействие (0.2...5 Вт/см2; 0,9 МГц; 5...30 с) - возникновение вызванного потенциала действия. Его появление носит пороговой характер, зависит от интенсивности и длительности ультразвукового облучения (рис. 3.8), а величина на 5...20мВ превышает спонтанный потенциал действия. Типичная кривая изменения мембранного потенциала ацетабулярии приведена па рис. 3.9.
Потенциал действия не возникает, если первичная деполяризация не достигает некоторой критической величины (15...33 мВ). Исходя из этого, можно объяснить существование порогов ультразвуковых воздействий.
Рис. 3.9. Типичный потенциал действия ацетабулярии в ответ на ультразвук интенсивностью 0,5... 1 Вт/см2 и длительностью 1...5 мин (стрелками указаны моменты включения и выключения ультразвука)
Вследствие деполяризации мембран под действием ультразвука пороговой интенсивности достигается критическая величина деполяризации, после чего генерируется потенциал действия. При интенсивностях выше пороговых потенциал действия возникает через 2…5 с после включения ультразвука. В области интенсивностей ультразвука, близких к пороговым (а также при малой индивидуальной чувствительности клетки), длительность латентного периода может достигать нескольких минут. Ультразвук подпороговых интенсивностей (0f2 Вт/см2) не вызывает возбуждения клеток.
Рис. 3,8. Пороговая кривая, характеризующая зависимость возникновения биоэлектрической реакции клеток ацетабулярии от интенсивности и длительности ультразвукового воздействия: о - отсутствие реакции; • - наличие реакции
Иногда наблюдается деполяризация на 5... 10 мВ, которая исчезает в течение нескольких минут после выключения ультразвука. Этот факт, а также индивидуальные различия в величине порогов чувствительности к ультразвуковому воздействию свидетельствуют о существовании регуляторных механизмов, способных до известной степени компенсировать изменения в клетке, обусловленные действием внешних факторов.
Визуальные наблюдения за клеткой но время ультразвукового воздействия позволяют обнаружить активизацию движения цитоплазмы. Этот эффект наблюдается и при воздействии другими раздражителями (локальные повышение или понижение температуры, введение микроэлектродов и т. д.) и, по-видимому, является результатом неспецифкческсой реакции клетки на внешнее воздействие.
При относительно высоких интенсивностях ультразвука (0,6..1 Вт/см2) наблюдается значительная деполяризация клеточных мембран. После выключения ультразвука потенциал через 2...5 мин устанавливается на уровне 90 мВ. Этот уровень регистрируется 25...40 мин, после чего потенциал возвращается к исходным значениям (потенциал покоя), Пo-видимому, ультразвуковое воздействие с интенсивностью, превышающей 0,6 Вт/см2, не только нарушает диффузионное равновесие на мембране, но и ингибирует активный транспорт ионов Сl-. После выключения ультразвука диффузионное равновесие восстанавливается в течение нескольких минут, и лишь значительно позже начинает функционировать активный транспорт.
Увеличение интенсивности ультразвука до 1 Вт/см2 (3...5 мин) вызывает структурные нарушения - разрывы и контрактуру цитоплазмы, появление пузырьков, перемешивание клеточного содержимого. Однако пи при этих, ни при более высоких интенсивностях ультразвука (до 2 Вт/см2) не отмечалось разрушения клеток. Высокая механическая прочность ацетабулярии, очевидно, обусловлена большой (до 30 мкм) толщиной ее клеточной стенки.
По-видимому наиболее известное явление, связанное с деполяризацией клеточных мембран, - это изменение их проницаемости. Закономерное увеличение проницаемости под действием ультразвука хорошо проявляется в клетках в суспензии - эритроцитах, лейкоцитах, клетках дрожжей и пр.
Исследования, проведенные на суспензии эритроцитов в физиологическом растворе, показали, что ультразвук существенно увеличивает скорость диффузии глюкозы и сахарозы в клетки из богатой сахарами среды.
Концентрация углеводов в среде, содержащей эритроциты, практически не меняется в течение 4 ч при 20 °С. Воздействие ультразвуком (0,1 Вт/см2; 0,9 МГц; 20 мин) приводит к заметному уменьшению концентрации Сахаров и среде. После выключения ультразвука углеводы частично выводятся из эритроцитов (рис. 3.10).
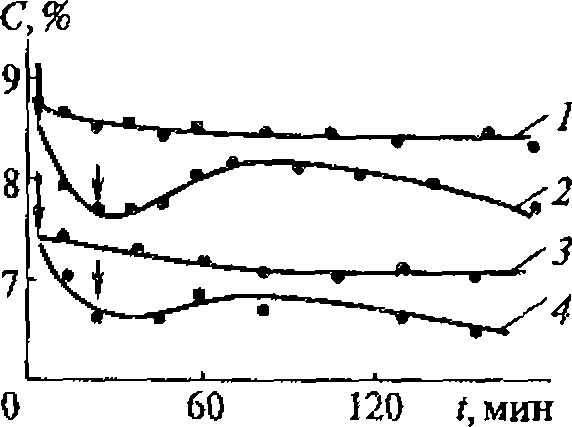
Рис. ЗЛО, Влияние ультразвука (0,1 Вт/см2) на скорость поглощения эритроцитами глюкозы (1,2) и сахарозы (3,4) из раствора: 1/3 - контроль; 2, 4 - опыт (стрелками указаны моменты включения и выключения ультразвука)
Скорость выхода ионов калия из эритроцитов вдвое возрастает при увеличении интенсивности ультразвука от 0,2 до 0,6 Вт/см2 (0,9 МГц). Эффект при кратковременном воздействии (3...5 мин) обратим, так как работа Na+-K1 насоса, функционирующего за счет энергии АTФ, восстанавливает исходную концентрацию ионов K+ в клетке после превращения ультразвукового воздействия. Если активность АТФ-азы подавить,например, уабаином, то скорость выхода ионов К+ увеличится на 5... 10 %, а исходная концентрация в клетках после выключения ультразвука не восстанавливается. Длительное, в течение 30 мин, воздействие ультразвуком снижает активность Nа+-К+-АТФ-азы мембран эритроцитов в 2-8 раз, пропорционально увеличению интенсивности ультразвука от 0,2 до 0,6 Вт/см2.
Увеличение потока ионов K+ из клетки вовне в результате облегчения пассивной диффузии и уменьшения переноса этих ионов против градиента концентрации при подавлении ультразвуком активности Na+-K+-ATO-aзы приводит к существенному изменению состава внутриклеточной среды.
Скорость переноса через биологические мембраны относительно крупных молекул практически не изменяется под действием ультразвука. Так, проницаемость мембран эритроцитов цыплят по отношению к меченому лейцину не испытывает достоверных изменений после 30-минутн от воздействия ультразвуком со средней интенсивностью 0,6 Вт/см2 и частотой 1 МГц, а скорость накопления меченого тимидица в этих же условиях (in vitro) даже несколько уменьшается.
Отсутствие эффекта увеличения под действием ультразвука проницаемости клеточных мембран по отношению к лейцину и тимидину вызывает у некоторых исследователей скептическое отношение к возможности увеличить проницаемость мембран и для других веществ. Тем не менее ультразвук (0,1...2 Вт/см2; 0,88 МГц; 5...60 мин) существенно увеличивает чувствительность бактериальных клеток к антибиотикам, широко используется в клинике для введения лекарств в организм сквозь неповрежденную кожу (фонофорез), в гистохимии для импрегнации нервных тканей серебром и т, д.
Изменения в свойствах клеточных мембран, подвергнутых ультразвуковому воздействию, могут быть вызваны переменными усилиями, возникающими в жидкости при распространении ультразвуковой волны. Частицы жидкости в ультразвуковом поле колеблются относительно состояния равновесия с частотой ультразвука. У поверхности благодаря силам сцепления частицы практически неподвижны, однако амплитуда скорости смещения быстро увеличивается по мере удаления от поверхности. Компонента скорости, касательной к поверхности на расстоянии Z от этой поверхности
![]()
![]()
- - амплитуда скорости в объеме жидкости вдали от поверхности;
- - круговая частота;
- - плотность жидкости;
![]() - вязкость жидкости.
- вязкость жидкости.
Скорость ![]() достигает
достигает ![]() при
при ![]() где
где ![]() имеет размерность длины и представляет собой толщину слоя, где скорость меняется от 0 до
имеет размерность длины и представляет собой толщину слоя, где скорость меняется от 0 до ![]() , Эта величина называется толщиной акустического поверхностного слоя.
, Эта величина называется толщиной акустического поверхностного слоя.
При интенсивности ультразвука 0,1 Вт/см2 и частоте 1 МГц толщина этого слоя около 0,56 мкм, а градиент скорости ![]() при
при ![]() , Переменное напряжение сдвига, обусловленное градиентом
, Переменное напряжение сдвига, обусловленное градиентом ![]() , и составляет 100 H/м2 (0,1 Вт/см2; 1 МГц). Это значение по абсолютной величине превосходит уровень, при котором разрушаются мембраны эритроцитов (60 Н/м2),
, и составляет 100 H/м2 (0,1 Вт/см2; 1 МГц). Это значение по абсолютной величине превосходит уровень, при котором разрушаются мембраны эритроцитов (60 Н/м2),
Изменяясь с удвоенной частотой ультразвука, переменные напряжения сдвига «не успевают» обусловить механических повреждений в клеточной мембране, изменяют, однако, состояние ее поверхности: нарушают двойной электрический слой, смещают глобулы белков, расположенные на поверхности мембран, снижают диффузионные ограничения и т.д. В результате изменяются мембранный потенциал (![]() потенциал) и проницаемость мембран, возможны также конформационные переходы в мембранных белках, ведущие к изменению их ферментативной активности.
потенциал) и проницаемость мембран, возможны также конформационные переходы в мембранных белках, ведущие к изменению их ферментативной активности.
Таким образом, переменные высокочастотные возмущения вблизи мембран могут «детектироваться» клеточной мембраной, обусловливая изменения в свойствах клеток, заметные в течение весьма длительного времени (до десятков минут) после прекращения ультразвукового воздействия.
Скорость оседания эритроцитов, например, увеличивается в результате воздействия ультразвуком с интенсивностью 8 мВт/см2 (1 МГц), что, вероятно, свидетельствует об уменьшении их поверхностного заряда.
Мембранный потенциал эритроцитов крысы заметно уменьшается под действием ультразвука и возвращается к исходным значениям через 15...30 мин после прекращения облучения.
Уменьшается на 5...10 % электрофоретическая подвижность клеток асцитной карциномы Эрлиха, подвергнутых действию ультразвука (0,5.,3,2 МГц; 10 Вт/см2 SPTA). Понижается электрофоретическая подвижность и лимфомы мышей (2 МГц; 10 Вт/см2 SPTA). Эффект обнаруживается только при кавитации и заметно уменьшается с повышением статического давления или при укорочении длительности акустического импульса, т. е. при условиях, когда возникновение кавитирующих пузырьков затруднено.
Часть клеток при облучении ультразвуком разрушается, но клетки, пережившие воздействие, по внешнему виду и способности к пролиферации не отличаются от контрольных, хотя их электрофоретическая подвижность возвращается к нормальным значениям лишь через 45...50 ч,
З.З.1 Действие ультразвука на внутриклеточные структуры
Реакция клетки на ультразвук не ограничивается изменениями только в ее поверхностных структурах, В клетках, помещенных в ультразвуковое поле, возникают энергичные микропотоки, перемешивающие ее содержимое, меняющие взаиморасположение клеточных органелл. Источниками таких микропотоков может оказаться пульсирующий газовый пузырек, если расстояние между ним и клеткой не превышает 5 • 10-2 см.
По всей вероятности, ультразвук оказывает влияние не только на жизнедеятельность клетки в целом, но и на структуру и функции отдельных клеточных органелл.
Под влиянием ультразвука (0,2 Вт/см2; 0,88 МГц) меняются условия транспорта ионов через мембрану митохондрий, наблюдается разобщение свободного дыхания и фосфорилирующего окисления в них. Степень разобщения возрастает при увеличении интенсивности ультразвука от 0,05 до 1,2 Вт/см2, достигая максимума при 1 Вт/см2 (0,88 МГц; 5 мин). При 2,5 Вт/см2 (1 МГц; 5 мин) возникают нарушения в мембранах лизосом, что можно наблюдать на типичной картине лизиса клеток печени крыс. Аналогичный эффект наблюдается и под действием низкочастотного (20 кГц) ультразвука.
В определенных условиях ультразвук (2 Вт/см2; 0,75 МГц) может вызвать разрушение ядер в клетках Не La, не нарушая при этом целостности цитоплазматических мембран. Такие специфические нарушения не могут быть обусловлены кавитацией и микропотоками и предположительно объясняются возникновением резонансных волн на поверхности ядерных мембран. Кроме того, ультразвук (0.5...3 Вт/см2; 0,8...2 МГц; 2... 10 мин) вызывает изменение числа гранул гликогена в клетках, нарушение целостности эндоплазматического ретикулума, увеличение количества лизосом, изменение структуры митохондрий в клетках и т. д.
Несмотря на кажущуюся простоту ситуации, в настоящее время оказывается весьма непросто выделить первичные явления в клетке, вызванные физико-химическими процессами в ультразвуковом поле.
Действительно, количество гликогена в клетке, число и активность лизосом, форма саркоплазматической сети меняются в широких пределах в процессе жизнедеятельности. Поэтому наблюдаемые под действием ультразвука изменения могут свидетельствовать только о биологической реакции клетки на внешнее неспецифическое воздействие. Если ультразвуковое воздействие оказалось не летальным для клетки, то возникшие в ней изменения репарируются в течение примерно 100 ч. Лишь митохондриям необходимо значительно больше времени для восстановления своей структуры и функции.
3.3.2. Последействия ультразвука
на жизнедеятельность клетки
Наблюдая за клеткой после облучения ультразвуком, можно обнаружить, что в течение достаточно длительного времени в клетке развиваются процессы последействия, приводящие к морфологическим и функциональным изменениям.
Некоторые из наблюдаемых процессов, например увеличение проницаемости и уменьшение мембранного потенциала под действием ультразвука и последующее возвращение этих параметров к исходным значениям, но крайней мере, частично, обусловлены достаточно простыми физико-химическими явлениями.
Так, состояние поверхности клетки, нарушенное ультразвуковыми микропотоками, способными «смыть» поверхностно-активные биомакромолекулы, самопроизвольно восстановится, по меньшей мере, через несколько минут.
Длительно в реальном масштабе времени и восстановление доннановского равновесия, обусловленного разделением ионов на мембране и нарушаемого микропотоками, увеличивающими градиенты концентрации.
Оба процесса - адсорбция поверхностно-активных веществ на клеточной мембране и восстановление равновесия Допнана контролируются диффузией и достаточно медленны.
Сравнивая время восстановления биологических функций клеточных мембран со временем, характерным для формирования поверхностей раздела в растворах, содержащих высокомолекулярные поверхностно-активные вещества, можно видеть, что эти величины совпадают в пределах порядка.
Так, электрофоретическая подвижность эритроцитов, сниженная в результате ультразвуковой обработки (0,02... 1 Вт/см2; 0,4 МГц и 0,8 МГц; 3 с.,.3 мин), восстанавливается через 3...5 мин после выключения ультразвука. В течение 15...30 мин остается повышенной проницаемость мембран эритроцитов и лимфоцитов для молекул красителя трипанового синего.
В связи с этим необходимо отметить, что общепринятый метод определения жизнеспособных и мертвых клеток по окрашиваемости последних трипановым сипим или другими красителями не всегда пригоден для клеток, подвергнутых ультразвуковому воздействию. Сразу после ультразвукового облучения клетки могут легко окрашиваться из-за повышенной проницаемости мембран, по через 20...50 мин окрашиваемых клеток оказывается примерно столько же, сколько и в контрольном образце, не облученном ультразвуком.
Другие процессы, развивающиеся в клетке после ультразвукового воздействия, имеют выраженный характер биологического ответа на внешнее возмущение.
Клетки тромбоцитов, например, подвергнутые ультразвуковой обработке (1 МГц; 0,2.„0,6 Вт/см2; 5 мин), на электронных микрофотографиях не отличаются от контрольных К функционируют как интактные. Однако через 30 мин инкубации при 22 °С в контрольных и облученных ультразвуком клетках возникают заметные функциональные и морфологические различия. Время рекальцификации тромбоцитов, мало изменяющееся в процессе ультразвуковой обработки (1 МГц; 0,065...2 Вт/см2, 5 мин), необратимо снижается в течение 4...6 ч после облучения.
Обратимое снижение электрокинетического потенциала клеток лимфомы мышей можно наблюдать в течение 40...48 ч после ультразвукового воздействия (2 МГц; 10 Вт/см2SPTA\ 5 мин).
Ультразвуковое воздействие на метки в суспензии или в культуре в зависимости от параметров ультразвука и условий облучения может обусловить как стимуляцию, так и подавление процессов их жизнедеятельности.
В относительно мягких условиях ультразвуковой обработки (1...5 МГц; 0,2...1 Вт/см2; 5 мин; импульсный режим) наблюдаются процессы стимулирования синтеза соединительного белка в клетках культуры фибробластов, интерферона в лейкоцитах и т.д. Увеличение интенсивности ультразвука приводит к угнетению биохимических процессов в клетках, к уменьшению числа клеток в культуре, причем наиболее выраженное угнетение наблюдается на частоте 1 МГц.
При невысоких (терапевтических) интенсивностях ультразвука эффект стимулирования синтеза белка наблюдается и в тканях теплокровных.
Так, 3-4 сеанса облучения ультразвуком (3 МГц; 0,5 Вт/см2; 5 мин) вызывают в тканях уха кролика, поврежденного криохирургическим инструментом, заметное ускорение синтеза коллагена. Этот эффект лежит в основе ультразвуковых методов ускорения заживления ран.
Ускорение биохимических процессов в клетке приводит к повышению ее физиологической активности, к увеличению сопротивляемости внешним воздействиям.
Клетки костного мозга, облученные ультразвуком (0,8 МГц; 0,3...0,7 Вт/см2; 20 мин) и введенные контрольным животным, дают начало большему числу колоний на поверхности и в паренхиме селезенки. Колонии растут быстрее, ускоряется и дифференциация колоний.
Бродильная активность дрожжей после обработки ультразвуком (425 кГц; 0,5.,.5 ч) увеличивается па 12...15 %, а количество клеток в облученной ультразвуком (0,8 МГц; 2,5 Вт/см2; 5 мин) суспензии быстро увеличивается.
Обработка ультразвуком (0,9 и 2,6 МГц; 0,5...1,2 Вт/см2; 10 мин) несколько снижает число жизнеспособных клеток костного мозга в суспензии. Однако уже после нескольких суток хранения при 40С в облученных ультразвуком образцах остается значительно больше жизнеспособных клеток, чем в контрольных образцах. Время разрушения половины клеток костного мозга в суспензии увеличивается после ультразвукового воздействия практически вдвое - с 5 до 9 дней, что позволяет при хранении уменьшить потери клеток, пригодных для трансплантации.
Увеличение интенсивности ультразвука до значений, превышающих 1...1.5 Вт/см2, приводит, как правило, к подавлению биологических функций клеток. Непрерывный ультразвук (1 и 2 МГц; 0,8...2,6 Вт/см2; 60 мин) подавляет скорость роста амниотических клеток в культуре, причем порог подавляющего действия лежит между 0,8 и 1,7 Вт/см2.
Между областями явного стимулирования и явного подавления лежит область, где наблюдается суперпозиция этих эффектов. Так, клеткам асинхронной культуры ткани китайского хомячка после ультразвуковой обработки (1 МГц; 2,5 Вт/см2 SPTA; 1 мин) предоставили возможность роста в монослое. В первые 24 ч роста не наблюдалось. Затем обнаружился рост, и к 35-му часу скорость роста нормализовалась. В данном случае остановка роста в первые 24 ч объясняется примерным равенством гибнущих и пролиферирующих клеток в среде.
Обычно клетки животных тканей в культуре хорошо переносят ультразвуковое облучение, если исключаются кавитация или нагрев. Выжившие клетки, как правило, способны к нормальному росту и развитию, хотя образованные ими колонии нередко не достигают размеров, характерных для колоний, возникших из необлученных ультразвуком клеток.
3.3.3. Ультразвуковое воздействие на деление клеток
Временное ингибирование некоторых функций организма и отдаление периодов наибольшей активности важнейших из них является общей реакцией организма и отдельных его систем на внешнее повреждающее воздействие. Особенно часто этот феномен проявляется в задержке клеточного деления в некоторых тканях в ответ на повреждающие, активирующие или сигнальные воздействия. Действие ультразвука также временно уменьшает скорость деления клеток.
На клетках мерисистемы корней гороха показано, что непрерывный ультразвук (2 МГц; 0,5...20 Вт/см2; 1 мин), как и импульсный сходных параметров, вызывает уменьшение скорости роста корня, уменьшение митотического индекса, снижение скорости синтеза белка, ДНК и РНК. Интересно отметить, что, в основном, эффект возникает в первые секунды облучения, а затем лишь незначительно увеличивается.
Животные ткани более чувствительны к ультразвуку, и скорость деления клеток в них уменьшается при весьма малых интенсивностях ультразвука. Так, пятиминутное облучение ультразвуком интенсивностью 60 мВт/см2 (1 МГц) заметно снижает митотический индекс в тканях печени крыс. Облучение ультразвуком (2 МГц; 0,1 Вт/см2; 5 мин) клеток аденокарциномы Эрлиха приводит к торможению роста опухоли, возникшей при перевивании этих меток. Патогенность облученных ультразвуком клеток карциномы имеет тенденцию к восстановлению и во втором пассаже мало отличается от контрольных образцов. Снижается скорость деления и при воздействии ультразвуком на клетки в культуре фибробластов человека.
Наиболее существенна задержка в скорости деления клеток культуры лейкомичных мышей при действии ультразвука (1 МГц; длительность импульса - 1 мс; частота следования импульсов 1 кГц; 5 Вт/см2) па «покоящуюся» клетку Задержка практически незаметна, если клетка находится в стадии митотического деления, хотя ее механическая прочность уменьшается, что, по-видимому обусловлено значительными изменениями в структуре клетки, предшествующими ее делению. Так, фибриллярная структура митотического веретена может разрушаться при воздействии ультразвуком относительно невысоких интенсивностей (0,8 МГц; 0,2.-0,5 Вт/см2).
В настоящее время есть очень мало данных, характеризующих чувствительность клеток к ультразвуку в разные фазы митотического цикла. Представляются бесспорными лишь факты задержки клеточного деления в интерфазе и меньшей чувствительности митотического индекса к ультразвуку в период митоза.
Задержка клеточного деления под влиянием различных воздействий относится не к патологическим проявлениям, а к физиологическим защитным реакциям, направленным на увеличение длительности интерфазы до значений, достаточных для репарации нарушений, накопившихся в клетке. Повреждения, не отрепарированные в интерфазе, могут во время митоза проявиться в виде серьезных дефектов, приводящих клетку к гибели.
В период митоза многие функции клетки весьма напряжены, что ослабляет работу репарационных механизмов. Поэтому задержка клеточного деления на стадии митоза не имеет биологического смысла. Внешнее воздействие именно в этот промежуток митотического цикла, возможно, приводит к хромосомным аберрациям и другим тяжелым для клетки последствиям.
3.3.4. Хромосомные аберрации, индуцируемые ультразвуком
Исследование мутагенного действия ультразвука стимулировалось, с одной стороны, опасением, что ультразвуковая терапия может иметь отрицательные последствия (так же в свое время было с радиоактивными методами лечения), а с другой - желанием получить новый способ направленного изменения наследственных признаков животных и растений. По-видимому, такой двойственный подход явился одной из причин большого разнообразия результатов, полученных разными исследователями. В числе других причин можно назвать широкий спектр параметров использованного разными исследователями ультразвука (интенсивностей, режимов и длительности облучения), различия в природе и состоянии исследуемых объектов. Не исключена также вероятность методических ошибок.
Результаты, полученные разными авторами, в первом приближении можно сравнить, сопоставляя дозы ультразвуковой энергии и возникающие при этом эффекты.
Обычно дозой называют величину D = It, где I - интенсивность ультразвука, t - время. Таким понятием дозы можно пользоваться лишь в случае, если эффект линейно зависит как от интенсивности ультразвука, так и от времени облучения, т. е. если снижение интенсивности ультразвука можно скомпенсировать увеличением времени воздействия. Для ультразвуковых биоэффектов таким понятием можно пользоваться лишь в грубом приближении. На оси, изображенной на рис. 3.1.1, обозначены дозы ультразвуковой энергии. Над осью показана область, где наблюдают эффекты, связанные с нарушением целостности хромосомных аберраций.

Рис. 3.11. Хромосомные аберрации при ультразвуковом воздействии (результаты анализа многочисленных данных, полученных рядом исследователей)
Область под осью характеризуется отсутствием влияния ультразвука на частоту хромосомных аберраций. Сравнивая дозы, мы, очевидно, не учитываем возможности того, что эффект может зависеть нелинейно от интенсивности ультразвука или времени облучения. Отчасти этим, а отчасти различиями в экспериментальных условиях и в природе исследуемых объектов может объясняться наложение областей, где одни исследователи обнаружили эффект хромосомных аберраций, а другие - нет.
Механизм возникновения аберраций в ультразвуковом поле неизвестен.
3.3.5. Комбинированное действие ультразвука и некоторых других физико-химических факторов на клетки
Широкое внедрение в клинику комплексных методов лечения и часто встречающиеся сочетания ультразвука с другими физическими факторами и фармакологическими средствами потребовали специального изучения реакции организма в целом и клетки в частности на такие комбинированные воздействия.
Особый интерес представляет исследование последовательного и одновременного действия на клетки ионизирующего и ультразвукового излучений. Подобная совокупность воздействий нередко встречается в диагностике и в терапии и требует пристального внимания в связи с тем, что, по крайней мере, ионизирующие излучения способны вызывать различные хромосомные аберрация.
Так, при сравнении действия рентгеновского излучения (290 Р) и ультразвука (1 МГц; 1,1 Вт/см2; 1 мин; непрерывный режим) на клетки меристемы корешков гороха было показано, что число микроядер в клетках увеличивается только в первом случае и никогда - во втором. Это лишний раз подтверждает мутагенную активность рентгеновского излучения и отсутствие этого свойства у ультразвука указанных параметров.
Не увеличивается число хромосомных аберраций, индуцированных в клетках костного мозга мышей рентгеновским облучением (50 Р) после предварительной ультразвуковой (0,8 М Гц; 0,1 ..1 Вт/см2; 5 мин) обработки.
Несколько иная картина наблюдалась при исследовании реакции лимфоцитов на комбинированное ультразвуковое и рентгеновское (20, 50,100 Р) воздействие. Ультразвук (0,8 МГц; 3 Вт/см2; 10 мин) существенно увеличивает число хромосомных нарушений, если цельная кровь, в которой находились лимфоциты, сначала подвергалась радиоактивному, а затем (через 5 мин) ультразвуковому воздействию. Если кровь сначала подвергалась действию ультразвука, а затем ионизирующего излучения, число хромосомных аберраций не увеличивалось. Ясли на клетки после рентгеновского облучения в течение часа действовать ультразвуком низкой интенсивности (2 МГц; 0,02 Вт/см2), число хромосомных нарушений заметно уменьшается по сравнению с контрольными образцами. Тот же ультразвук, использованный до рентгеновского облучения, заметно увеличивает (по сравнению с контрольным образцом) число нарушений в клеточных хромосомах.
Сообщается о высокой чувствительности к комбинированному воздействию и других клеточных характеристик. Обнаружен синергизм в действии ультразвука (1 МГц; 10 Вт/см2 SPTP; 5 мин) и ионизирующих излучений (600..1000 рад) на электрофоретическую подвижность раковых клеток. Ультразвук (0,9 МГц...0,14 Вт/см2; 10 мин) в 1,3 раза снижает дозу последующего облучения рентгеновскими лучами, необходимую для уничтожения 99 % клеток в культуре, способных образовывать колонии. Один лишь ультразвук не влияет на этот параметр. Пострадиационное облучение ультразвуком не меняет реакции клеток на рентгеновские лучи.
Зависимость реакции клетки па ультразвуковое воздействие от ее состояния наглядно проявляется в опытах с клетками, метаболизм которых целенаправленно изменен различными веществами или подбором внешних условий. Так, выживаемость клеток Не La повышается па 22 %, если их облучать ультразвуком (0,9 МГц; 0,2 Вт/см2; 3 с) в среде, содержащей 30...35 % версена. Защитными свойствами обладает и сывороточный компонент питательной среды, обеспечивающий нормальную работу защитных механизмов клетки. Он повышает па 80% выживаемость клеток Не La и предотвращает подавление роста культуры, облученной ультразвуком.
Комбинированное действие ультразвука с различными веществами удобно исследовать на клетках дрожжей.
Дрожжи - типичные сапрофиты, нашедшие широкое применение в пищевой промышленности и кормопроизводстве. Для своей жизнедеятельности они нуждаются лишь в кислороде, сахарах определенного типа и неорганических солях. Сахар служит источником энергии и основным исходным продуктом для синтеза белков, жиров, витаминов и других жизненно важных органических веществ. Благодаря толстой клеточной стенке дрожжи весьма резистентны к ультразвуковому воздействию и остаются жизнеспособными при достаточно интенсивном и длительном ультразвуковом облучении. Именно поэтому они являются удобной моделью для изучения действия ультразвука на проницаемость клеточных мембран, а также на некоторые процессы жизнедеятельности.
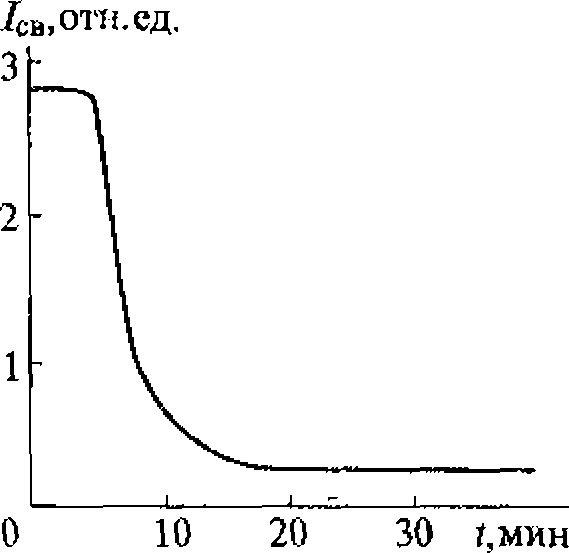
Рис. З.12. Необратимое уменьшение фотоиндуцированного стечения дрожжей а суспензии под влиянием H2S (конечная концентрация 10-2моль)
Реакция клеток дрожжей на ультразвуковое воздействие отражается на их фотоиндуцированной хемилюминесценции, связанной с активностью обменных процессов (рис. 3.12). При облучении ультразвуком с интенсивностью 0,4 Вт/см2 практически все клетки в суспензии остаются жизнеспособными. Увеличение интенсивности ультразвука до 1 Вт/см2 приводит к гибели 10 % клеток.
Добавление в суспензию дицитрофенола, Na2S или Na3N, диффундирующих в клетку сквозь цитоплазматические мембраны и подавляющих процессы дыхания в митохондриях, приводит к уменьшению интенсивности фотоиндуцированного свечения. Подавление, в зависимости от концентрации ингибиторов дыхания, может быть как обратимым, так и необратимым.
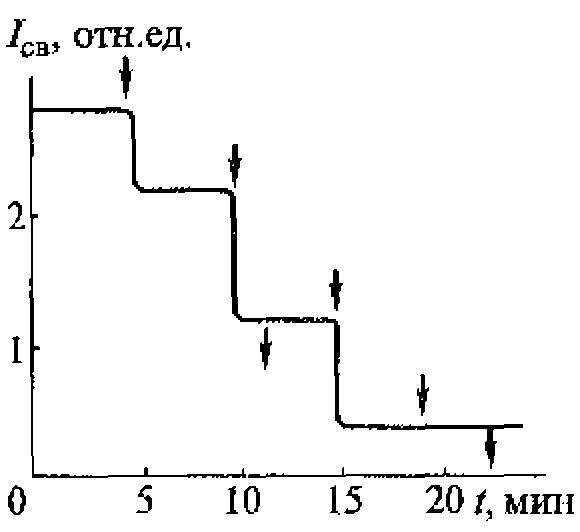
Рис. 3.13. Последовательное действие ультразвука и N2S на фотоиндуцированное свечение дрожжей в суспензии (стрелками указаны моменты включения и выключения ультразвука)
Например, Na2S в концентрации 10-2 моль приводит к необратимому уменьшению интенсивности свечения. При концентрации 10-3 моль это вещество обратимо уменьшает интенсивность свечения, восстановление которой происходит в течение 30…40 мин. Восстановление интенсивности свечения до исходною уровня, очевидно, обусловлено функционированием защитных механизмов клетки, соответствующим образом перестраивающих ее метаболизм. Ультразвук низких интенсивностей (0,1...0,2 Вт/см2) стимулирует этот процесс в 1,5-2 раза, сокращая время восстановления.
Облучение клеток ультразвуком более высоких интенсивностей (0,4 Вт/см2) в суспензии, содержащей ингибиторы дыхания в малых концентрациях, приводит к значительному усилению их действия. При совместном или последовательном воздействии ингибитором дыхания Na2S и ультразвуком наблюдается необратимое, ступенчатое уменьшение интенсивности свечения, если время между последующими воздействиями не превышает нескольких минут (рис. 3.13). Увеличение этого интервала приводит к уменьшению эффекта синергизма, а когда интервал составляет 30...40 мин и более, эффект не наблюдается вовсе.
Аналогичные результаты получены при изучении совместного действия ультразвука с динитрофенолом и Na3N. Чувствительность клеток дрожжей в суспензии к ультразвуку существенно зависит от их состояния. Так, интенсивность свечения суспензии, содержащей 1 % глюкозы, понижалась в 4-6 раз при комбинированном действии Na2S (10-3 моль) и ультразвука (1 МГц; 1 Вт/см2; 10 мин). Эффект не наблюдался, если клетки находились в среде, не содержащей глюкозу.
Скорость связывания лимфоцитами 45Са++ вдвое повышается под действием ультразвука интенсивностью 0,05 Вт/см2 и продолжительностью 30 с. Накопление Са++ в лимфоцитах влияет на характер иммунного ответа лимфоцитов и, кроме того, является необходимым условием их активации. В частности, растительный митоген кон конканавалин также существенно ускоряет процесс накопления ионов Са++ в лимфоцитах. Действие конканавалина связывают с изменениями в структуре плазматических мембран, с интенсификацией обмена мембранных белков и жирных кислот в фосфолипидах, а также с образованием кальциевых каналов, пронизывающих мембрану.
Результат комбинированного действия конканавалина и ультразвука (0,88 МГц; 0,05 Вт/см2; 60 с) на лимфоциты вчетверо превосходит влияние одного только митогена (30 мкг/ мл) или только ультразвука.
Повышение проницаемости клеточных мембран для ряда веществ, очевидно, и объясняет увеличение эффективности лекарственных веществ под действием ультразвука.
Например, ультразвук (880 кГц; 0,4 Вт/см2) существенно увеличивает эффективность влияния нарост и интенсивность биолюминесценции светящихся бактерий цитотоксических лекарственных препаратов: цитостатина, циклофосфана и антибиотика широкого спектра действия дексорубицина, используемых для лечения злокачественных новообразований.
Кокаин и кураре в низких концентрациях проявляют защитные свойства при повреждающем действии ультразвука на ткани головастиков. Вещества, защищающие клетки от повреждающего ультразвукового воздействия, можно назвать сонопротекторами по аналогии с радиопротекторами, защищающими биологические объекты от ионизирующих излучений.
3.3.6. Разрушение клеток под действием ультразвука
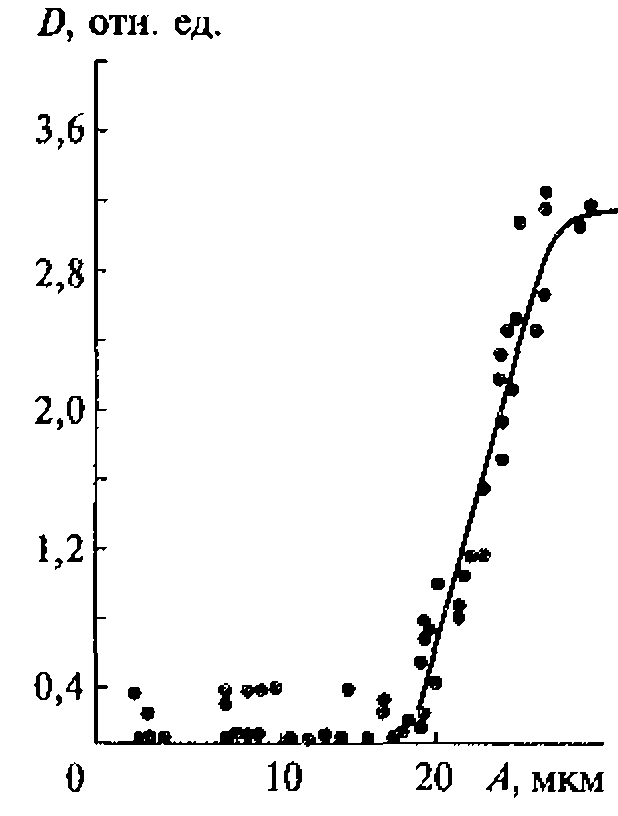
Рис. 3.14. Гемолиз эритроцитов в поле микропотоков вблизи заостренного излучателя ультразвука с частотой 20 кГц в зависимости от амплитуды колебаний инструмента
При ультразвуковой кавитации суспендированные в жидкости клетки испытывают значительные механические усилия и разрушаются (см. §§ 1.13, 2.14). Особенно эффективен для разрушения клеток низкочастотный ультразвук. Например, вблизи колеблющегося с частотой 20 кГц торца ультразвукового инструмента гемолиз наблюдается при амплитудах 16...20 мкм (рис. 3.14).
Регулируя условия ультразвукового воздействия - меняя частоту, мощность и время ультразвукового воздействия, а также состав среды, - можно получать конечный продукт с заданными свойствами. Так, дезинтеграция перевиваемой культуры клеток почки теленка, зараженной вирусом инфекционного ринотрахеита крупного рогатого скота, ультразвуком с частотой 22 кГц и амплитудой колебаний 40 мкм в течение трех минут позволяет получать частицы с повышенной способностью связывать антитела против упомянутого вируса. Эти частицы пригодны для вакцинации и изготовления эффективных диагностикумов. Дезинтеграция тех же клеток ультразвуком с частотой 44 кГц дает возможность выделять преимущественно полноценные вирусные частицы, пригодные для заражения клеток культуры тканей с целью дальнейшей наработки материала для вакцин и диагностикумов. Варьируя параметры ультразвукового воздействия, можно получить частицы с различным соотношением инфекционной и антигенной активности.
3.3.7. Механизмы биологического действия ультразвука
![]()
Поток молекул через клеточную мембрану описывается первым законом Фика:
где D - коэффициент диффузии;
dc/dx - градиент концентрации вещества.
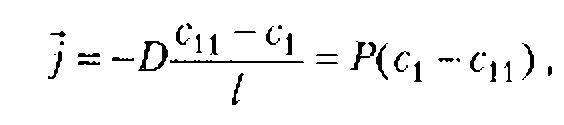
В стационарных условиях dc/dx можно заменить отношением разности концентраций с11 – с1 к толщине мембраны:
где Р = D/l - коэффициент проницаемости мембраны
Для молекул, диффундирующих сквозь нее, этот коэффициент определяется толщиной мембраны и коэффициентом диффузии.
В реальных условиях слои раствора, непосредственно прилегающие к мембране, практически не перемешиваются, следовательно, концентрация диффундирующих молекул в данных слоях может существенно отличаться от концентрации аналогичных молекул в объеме. Толщина этих так называемых слоев Нернста меняется от единиц до сотен микрометров и зависит от свойств поверхности и интенсивности перемешивания раствора. Совокупность собственно мембраны с диффузионными слоями можно рассматривать как эффективную мембрану толщину которой определяют но формуле:
![]()
где ![]() и
и ![]() толщины диффузионных слоев по обе стороны от мембраны.
толщины диффузионных слоев по обе стороны от мембраны.
Поток через мембрану описывается уравнением
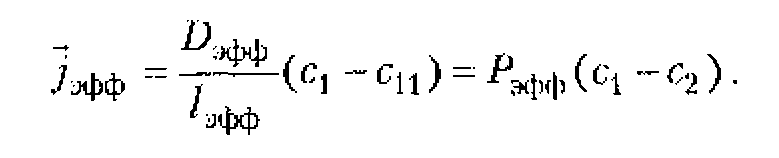
Здесь ![]() - обобщенный коэффициент диффузии с прилегающими слоями;
- обобщенный коэффициент диффузии с прилегающими слоями;
![]() - проницаемость;
- проницаемость;
![]() - концентрации молекул.
- концентрации молекул.
Под влиянием ультразвука величины ![]() и
и ![]() существенно уменьшаются в результате интенсивною перемешивания раствора микропотоками. Соответственно уменьшается
существенно уменьшаются в результате интенсивною перемешивания раствора микропотоками. Соответственно уменьшается ![]() и возрастает поток веществ через мембрану
и возрастает поток веществ через мембрану
Коэффициент диффузии в среде и диффузионных слоях также может меняться под действием ультразвука, так как цитоплазма и прилегающая к поверхности клетки среда отличаются выраженной тиксотропией, и уже при интенсивности ультразвука 40 мВт/см2, используемой в диагностике, вязкость клеточного содержимого существенно уменьшается, а температура среды несколько увеличивается за счет поглощения ультразвуковой энергии (см. § 1.3). Возрастание температуры среды и уменьшение ее вязкости приведут к увеличению коэффициента диффузии в примембраниых слоях, что обусловит увеличение потока молекул неэлектролитов через мембраны. Это может проиллюстрировать эффект ускорения транспорта Сахаров через мембраны эритроцитов под действием ультразвука с интенсивностью 0,1 Вт/см2 (см. §3.2).
Путем обычной диффузии через клеточные мембраны в клетку проникают самые разные соединения. Помимо воды это незаряженные молекулы многих растворимых в воде веществ, в том числе многих сложных лекарственных препаратов. В то же время трансмембранный транспорт ряда жизненно важных для клетки веществ осуществляется специальными, присутствующими в мембранах клетки переносчиками, Такой транспорт но градиенту концентрации, не требующий затраты энергии, называют облегченной диффузией.
При облегченной диффузии, так же, как и в случае простой диффузии, ультразвуковые микропотоки, перемешивая среду, частично снимают диффузионные ограничения и ускоряют перенос веществ. Это подтверждается ускорением поглощения эритроцитами глюкозы из инкубационной среды при облучении суспензии клеток ультразвуком с интенсивностью 0,1Вт/см2.
При активном транспорте перенос молекул через мембрану осуществляется против градиента кoнценрации с затратой энергии. Действие ультразвуковых микропотоков снижает эффективность транспортировки веществ. В этом случае поток частиц, например ионов натрия, складывается из двух слагаемых:
![]()
где ![]() - поток ионов Na+ за счет простой диффузии;
- поток ионов Na+ за счет простой диффузии;
![]() - поток ионов Na+, активно транспортируемых через мембрану.
- поток ионов Na+, активно транспортируемых через мембрану.
Очевидно, что ![]() и
и ![]() противоположно направлены и в стационарных условиях равны. Под влиянием ультразвука
противоположно направлены и в стационарных условиях равны. Под влиянием ультразвука ![]() увеличивается, а
увеличивается, а ![]() в лучшем случае не изменяется. В результате нарушается равновесие ионов па мембране, изменяется се потенциал.
в лучшем случае не изменяется. В результате нарушается равновесие ионов па мембране, изменяется се потенциал.
В этих рассуждениях не учитывалось действие ультразвука на структуру самой мембраны. Между тем, ультразвуковые патоки способны «смывать» с поверхности мембран биомакромолекулы (см, §§ 1.10 и 3.2). Это меняет условия экранировки зарядов на мембранах и влияет на их проницаемость и условия диффузии ионов через мембраны.
Интенсивные микропотоки способны нарушать целостность клеточных мембран, через разрывы в которых частично или полностью вытекает содержимое клеток. Этот случай может рассматриваться как предельный случай изменения условий транспортировки веществ через клеточную мембрану при ультразвуковом воздействии.
При нагревании за счет перехода энергии ультразвука в теплоту разность температур между центром клетки и ее периферией при интенсивности ультразвука Вт/см2 по расчетам составляет 10-3 К, а градиент температур - 2...5 град/см. Следовательно, в этих условиях оказывается возможным изменение скоростей потоков веществ в результате термодиффузионного переноса как внутри клетки, гак и через клеточную мембрану.
Потенциал Дебая (вибропотенциал), возникающий в суспензиях клеток и тканях под влиянием ультразвука, используемого в терапевтической практике, достигает 10 мВ, т. с. величин, сравнимых со значениями потенциалов клеточных мембран.
При кавитации, когда интенсивность ультразвукового излучения превышает 0,3 Вг/см2, на клеточные мембраны наряду с ударными волнами, энергичными микропотоками и потенциалами Дебая, могут влиять свободные радикалы, азотная и азотистая кислоты, а также перекись водорода.
Таким образом, изменение проницаемости клеточных мембран - универсальная реакция на ультразвуковое воздействие, независимо от того, какой из факторов ультразвука, действующих на клетку, превалирует в том или ином случае.
Нарушение состава внутриклеточной среды и микроокружения клетки не может не отразиться на скорости биохимических реакций с участием ферментов, весьма чувствительных к содержанию в среде тех или иных ионов, продуктов ферментативных реакций и некоторых других веществ.
Суммируя, можно предложить следующий механизм действия ультразвука на клетки. Физико-химические ультразвуковые эффекты в среде (механические, тепловые, электрические, химические) —> нарушение микроокружения клеточных мембран (снижение градиентов концентраций различных веществ возле мембран, обратимая десорбция молекул с их поверхности, изменение мембранного потенциала, обратимое уменьшение вязкости внутриклеточной среды) —> изменение проницаемости клеточных мембран (ускорение диффузии, изменение эффективности активного транспорта, нарушение целостности мембран) —> нарушение состава внутри - и внеклеточной среды —> изменение скоростей ферментативных реакций в клетке (небольшая активация и преимущественное подавление ферментативных реакций в клетках вследствие изменения оптимальных для функционирования ферментов концентраций веществ) —> развитие репаративных реакций в клетке, связанных с синтезом других веществ (синтез РНК и новых ферментов, продуцируемых клеткой для компенсации возникшего недостатка в продуктах ферментативных реакций) —>...
Из анализа этой схемы - результата существенных упрощений - следует, что специфичным в действии ультразвука на биологические системы является изменение микроокружения клеточных мембран, приводящее к нарушению процессов переноса веществ через мембраны. Дальнейшая цепочка процессов может быть инициирована и другими физико-химическими факторами, приводящими к аналогичным нарушениям, в частности, к увеличению проницаемости клеточных мембран.
3.4. ДЕЙСТВИЕ УЛЬТРАЗВУКА НА МНОГОКЛЕТОЧНЫЕ
СИСТЕМЫ
Ткани, органы и весь организм - это не просто сумма клеток, но сложная, иерархически организованная система, в которой клетка является простейшей подсистемой, способной в определенных условиях к самостоятельному существованию.
Реакция на локальное ультразвуковое воздействие, наблюдаемая на уровне целостного организма, представляет собой результат ряда последовательных процессов.
3.4.1. Пороги биологического действия ультразвука
Возмущения, не превышающие определенной (пороговой) величины, не приводят к видимым последствиям в биологической системе, потому что компенсируются специальными механизмами.
Очевидно, что во всех случаях первичная реакция биологических систем на ультразвуковое воздействие происходит на клеточном уровне.
Пороговой для биологического действия ультразвука является такая его интенсивность (при прочих неизменных его параметрах - частоте, времени и режиме воздействия) ниже которой не меняется проницаемость клеточных мембран, а следовательно, не начинаются регуляторные и репаративные процессы в клетках, направленные на ликвидацию последствий, вызванных указанными изменениями.
Судя по данным ряда исследователей, пороговая интенсивность не превышает 10 мВт/см2. Очевидно, что данный порог и является истинным порогом биологического действия ультразвука. Оценить его проще всего по электропроводности тканей, изменения которых можно наблюдать при интенсивностях ультразвука более 10 мВт/см2.
В некотором интервале более высоких интенсивностей ультразвука при относительно кратковременном воздействии (до 103 с) возникающие в клеточных мембранах нарушения, как правило, не приводят к видимым изменениям в структуре и функционировании клеток и тканей. Это обусловлено развитием регуляционных процессов, компенсирующих последствия повышения проницаемости мембран непосредственно во время ультразвукового облучения. Верхняя граница интервала интенсивностей, превышение которой приводит к появлению не репарируемых при ультразвуковом воздействии изменений, может быть принята в качестве еще одного, регистрируемого, порога биологического действия ультразвука, Этот порог соответствует такому значению интенсивности ультразвука, выше которого могут наблюдаться морфологические, электрофизические, физиологические и другие изменения в биосистемах, облучаемых ультразвуком в течение 1...103 с, как в процессе воздействия, так и после него.
Значение регистрируемого порога зависит от природы регистрируемого параметра, состояния биологической системы, длительности воздействия, Так, небольшая деполяризация мембран клеток ацетабулярии наблюдается при интенсивности ультразвука 0,1 Вт/см2, а потенциал действия возникает при интенсивностях, превышающих 0,2 Вт/см2; устойчивость к ультразвуку клеток дрожжей, находящихся в среде без глюкозы, значительно выше, чем в среде, содержащей глюкозу.
Регистрируемому порогу чаще всего соответствует интенсивность ультразвука 0,1 Вт/см2 (0,8,..2 МГц; 1...103 с). При интенсивностях, превышающих 0,1 Вт/см2, наряду с увеличением влияния микропотоков заметную роль начинают играть и другие факторы - в основном, выделяющаяся при ультразвуковом воздействии теплота и вибропотенциалы, В определенном интервале интенсивностей наблюдаемые биологические эффекты, возникающие при ультразвуковом воздействии, обратимы. Верхняя граница этого интервала может быть принята в качестве третьего порога. Ее превышение приводит к выраженным деструктивным изменениям, па фоне которых репаративные процессы в клетках невозможно обнаружить.
Все три порога достаточно условны и зависят от особенностей строения клеточных мембран, специализации клеток и состояния их репаративных систем, а также от свойств окружающей клетку среды. Какой из этих порогов принять за порог биологического действия ультразвука зависит от того, что принимается за результат действия ультразвука на биологическую систему
Если результатом считать стимулирование репаративных реакций клетки в результате незначительного нарушения микроокружения клетки и увеличения проницаемости ее мембран, то порог биологического действия ультразвука весьма мал (10 мВт/см2).
Если результатом действия ультразвука считать биологически значимые эффекты - регистрируемые изменения, наблюдаемые во время и после ультразвуковой обработки, то, как следует из анализа данных научной литературы, порог примерно равен 0,1 Вт/см2, хотя величина ею и зависит от длительности облучения. Если время воздействия меньше 200 с, то для получения регистрируемою биологического эффекта требуются более высокие интенсивности ультразвука.
Полагают, что биологический эффект возникает в тканях млекопитающих лишь в том случае, если произведение усредненной по времени и максимальной в пространстве интенсивности ультразвука I на время воздействия t превышает 50 Дж/см2. Это суждение основано на предположении, что биологические ультразвуковые эффекты имеют, в основном, тепловую природу так как повышение температуры ткани под действием ультразвука с частотой 1 МГц составит 2..40C если выполняется условие It=50 Дж/см2 и коэффициент поглощения ультразвука порядка 0,1 Нп/см.
Однако эта простая схема противоречит некоторым оценкам.
Так, при различных интенсивностях и времени воздействия, по при равных I • t ткани, различающиеся по коэффициенту поглощения ультразвука, нагреваются до разных значений температуры. Различные условия теплоотвода из облучаемой области ввиду разницы в количестве кровеносных сосудов, скорости кровотока и теплопроводности тканей также определяют различную степень нагревания тканей при равной подводимой энергии. Поэтому один лишь тепловой механизм не объясняет существования пороговых условий;
![]()
Коэффициент поглощения ультразвука прямо пропорционален частоте ультразвука и существенно изменяется в диапазоне 0,5... 1,5 МГц, Между тем, пороговые условия не учитывают зависимость эффекта от частоты, что также противоречит предположению о тепловой природе ультразвукового повреждения. Кроме того, биологические эффекты, обусловленные ультразвуком, как правило, не удается имитировать тепловым воздействием. Противоречат этому и многие экспериментальные данные. Так, облучение мышей ультразвуком (0,93 МГц; 5 мин) на 15-й день беременности увеличивает предродовую смертность эмбрионов. Послеродовая смертность не наблюдается, хотя четко прослеживаются нервно-мышечные нарушения, Интенсивность ультразвука, при которой возникают эти нарушения, не превышает 10 мВт/см2.
Импульсный ультразвук с интенсивностью в импульсе 10 Вт/см2 (2 МГц) вызывает гибель личинок дрозофилы, хотя средняя по времени и пространству интенсивность не превышает 3 мВт/см2, что, на первый взгляд, гарантирует отсутствие биологических эффектов. Разнообразие эффектов, обнаруживаемых при низких интенсивностях ультразвука, позволяет предположить, что интенсивности 10 мВт/см2 еще далеки от пороговых. Однако кратковременное применение ультразвука низкой интенсивности для диагностических целей, видимо, не вызывает заметных последствий. К этому выводу пришла специальная комиссия, изучившая экспериментальные данные, полученные на животных, и результаты наблюдений за детьми и их матерями, которые во время беременности исследовались с помощью ультразвуковых диагностических методов.
Кажущееся противоречие - отсутствие биологического эффекта при кратковременном воздействии и явные нарушения при длительном действии ультразвука тех же и даже меньших интенсивностей - становится понятным, если предположить, что в одном случае репарационные механизмы успевают справиться со скрытыми нарушениями, а в другом воздействие приводит к перенапряжению репарационных систем.
Если результатом биологического действия ультразвука считать деструктивные изменения, то порог ультразвукового действия совпадает с порогом кавитации в среде или с такими параметрами ультразвука, которые обеспечивают повышение температуры до 43..,45°С. Этот порог широко варьируется в зависимости от факторов, влияющих на порог кавитации в среде (величины облучаемого ультразвуком объема, вязкости среды, ее гетерогенности и т. д.), или условий теплообмена в облучаемой ультразвуком области.
3.4.2. Ультразвуковые эффекты в мягких тканях
Ультразвук, используемый в терапевтических целях (0,7..,3 МГц; 0,1 ...2 Вт/см2; 3...10 мин), вызывает в тканях организма разнообразные изменения.
При относительно низких интенсивностях, лишь ненамного превышающих пороги чувствительности к ультразвуку для конкретных тканей, наблюдается ускорение обменных процессов и стимулирование защитных механизмов. Так, ультразвук (1 MГц; 0,1 Вт/см2; 5 мин), используемый 3 раза в неделю, ускоряет процесс регенерации ткани уха кролика после хирургического вмешательства. Параллельно в регенерирующей ткани ускоряется процесс связывания, например, меченого тимидина. Обмен катехоламинов в организме также заметно возрастает.
При этих же параметрах ультразвук влияет на различные биохимические процессы в организме. Ультразвук (1 МГц; 0,2 Вт/см2; 5... 10 мин) вызывает изменения окислительно-восстановительного потенциала тканей, уменьшение содержания аскорбиновой кислоты, ускорение биосинтеза порфиринов и тиронинов, увеличение содержания нуклеиновых кислот в тканях, изменение активности ферментов, заметные изменения содержания макроэргических соединений - АТФ, фосфокреатина, гликогена, а также микро- и макроэлементов.
Более высокие интенсивности ультразвука (0,3 Вт/см2) приводят к нарушениям структуры и ультраструктуры облучаемых тканей.
Особое внимание уделено исследователями изменению электрофизических свойств кожных покровов под действием ультразвука. Такое внимание обусловлено практической необходимостью изучить механизмы фонофореза лекарственных веществ через кожу и, по возможности, оптимизировать этот процесс.
Исследования показали, что под влиянием ультразвука (0,9 МГц; 0,1...2 Вт/см2; 5...15 мин) повышается проницаемость как изолированной кожи, так и кожи в составе организма. В последнем случае эффект значительно выше и зависит от интенсивности ультразвука и природы исследуемых веществ.
Наиболее эффективен ультразвук для увеличения проницаемости покровных тканей по отношению к ионам Na, К, Li, Сl, Вr и пр. По отношению к сложным ионам и высокомолекулярным соединениям эффект значительно ниже. Однако во всех случаях проницаемость кожи увеличивается с увеличением интенсивности ультразвука до 1 Вт/см2, При более высоких интенсивностях ультразвук заметно повышает проницаемость кожи для Na, К, Са, Сl, практически не влияя на скорость переноса ионов сложной структуры.
Полученные эффекты связывают с изменением морфологических особенностей кожного покрова, вызванным ультразвуковым облучением, и отмечают разрыхление эпидермиса, увеличение количества активных потовых и сальных желез, а также увеличение диаметра выводных протоков кожных желез в 2-4 раза. Данные многих авторов, в основном, совпадают с приведенными выше, однако имеются сведения, что предварительное облучение ультразвуком (0,8 МГц) в интервале интенсивностей 0,2... 1 Вт/см2 понижает скорость электрофореза адреналина и ацетилхолина через неповрежденную кожу тогда как ультразвук более высоких интенсивностей повышает ее. Ультразвук (0,8 МГц; 0,2... 1 Вт/см2) обратимо ускоряет как пассивный, так и активный транспорт ионов Na, К, Са через кожу лягушки. Пороги эффекта лежат в области 0,2 Вт/см2, Однако если ускорение пассивного транспорта начинается сразу после включения ультразвука, изменения в скорости активного транспорта фиксируются только через 3...4 мин.
Наряду с проницаемостью изменяются и электрические свойства кожи.
Уже при интенсивности ультразвука 0,2 Вт/см2 (0,9 МГц) регистрируют относительные изменения трансмембранного потенциала изолированной кожи лягушки. С увеличением интенсивности ультразвука эта величина возрастает с 0,01 до 0,4 при интенсивности 1 Вт/см2. При интенсивностях менее 2 Вт/см2 потенциал кожи снижается после включения ультразвука, а затем восстанавливается до исходных значений. При более высоких значениях интенсивности вторая фаза отсутствует, что свидетельствует о необратимых изменениях в коже. Модулирование ультразвука усиливает эффект на 15…20 % при частотах модуляции 10...20 и 200 Гц.
Если в среду, омывающую кожу, добавлен цианистый калий, прекращающий обмен веществ, то никакого изменения потенциалов под действием ультразвука не происходит.
Фокусированный ультразвук (1 М Гц, 1...100 Вт/см2) в условиях хорошего теплообмена и отсутствия кавитации вызывает обратимое уменьшение потенциала изолированной кожи лягушки и пропорциональное интенсивности ультразвука возрастание тока короткою замыкания. С увеличением длительности облучения ток короткого замыкания постоянно увеличивается, в то время как изменения мембранного потенциала приходятся на первые 0,5 с облучения и в дальнейшем остаются на новом стационарном уровне.
Совокупность приведенных данных свидетельствует о существенной роли клеточных мембран в формировании эффекта изменения электрических свойств тканей в ответ на ультразвуковое воздействие.
Исследование реакции других животных и растительных тканей па ультразвуковое воздействие лишь подтверждает это. Особенно наглядно способность ультразвука изменять проницаемость клеточных мембран проявляется в ткани клубня картофеля.
Ткань клубня картофеля - удобная модель для исследований. Она имеет биологическую природу и клеточное строение, а отсутствие рефлекторных и сосудистых реакций существенно упрощает наблюдаемую картину. В клетках клубня картофеля содержится крахмал, который можно использовать как естественный внутриклеточный индикатор на йод. Однако при исследовании ионной проницаемости в клетку могут попасть лишь ионы йода, не дающие в комплексе с крахмалом характерной сине-фиолетовой окраски. Окрашивание наступает при «проявлении» образцов в 1...2%-ном растворе перекиси водорода. Механизм проявления сводится к тому, что ионы йода, окисляясь, переходят в атомарный йод, который при взаимодействии с крахмалом, находящимся в пластидах внутри клеток, даст характерную сине-фиолетовую окраску.
Использование ткани клубня картофеля позволяет определить некоторые закономерности процессов фонофореза ионов йода в ткань, а также исследовать различия между процессами электро- и фонофореза.
Рис. 3.15. Процессы:
а - фонофореза аионов йода и ткань клубня картофеля (1 -термостатируемая кювета; 2 - образец; 3 - раствор йодистого калия); 6 - электрофореза (1 электроды; 2 - образец; прокладка, смоченная
раствором йодистого калия)
Для исследования образцы диаметром 20 мм и высотой 15 мм из клубня картофеля помещали в кювету, дном которой служил излучатель ультразвука (рис. 3.15, а). Специальная подставка обеспечивала постоянное расстояние между поверхностью излучателя и образцом, В кювету заливали 0,5 моль раствор Кl так, чтобы только нижний край образца оказался в контакте с раствором.
После облучения образца ультразвуком (0,88 МГц; 0,1.-2 Вт/см2) его обмывали водой, разрезали поводам вдоль оси цилиндра и плоскостью осевого среза помещали на несколько секунд в слабый раствор перекиси водорода. При взаимодействии с Н2О2 ионы йода окисляются и окрашивают образец.
Для электрофореза (рис. З.15, 6) такой же цилиндрический образец помещали между двумя плоскими электродами. Между катодом и образцом -помещали пористую прокладку, пропитанную 0,5 моль раствором KI. Электрофорез проводили постоянным током 25 мА.
Глубина, на которую проникают ионы йода в ткань под действием ультразвука (0,88 МГц), пропорциональна интенсивности ультразвука и времени облучения (рис. 3.16).
Пороговые интенсивности ультразвука, при которых начинает увеличиваться проницаемость клеточных мембран ткани клубня картофеля, были определены экстраполяцией экспериментальных зависимостей и оказались равными 0,3…0,4 Вт/см2 независимо от времени облучения образцов.
Повышение температуры образцов до 45 °С лишь незначительно влияет на скорость фонофореза, хотя при более высоких температурах эффект заметно возрастает. Следовательно, по крайней мере в интервале температур 20...45°С проницаемость клеточных мембран увеличивается не в результате теплового эффекта ультразвука. По-видимому, в тканях, так же, как и в суспензиях клеток, эффект повышения проницаемости клеточных мембран обусловлен, в основном, акустическими потоками.
Рис. 3.16. Зависимость глубины фонофореза ионов йода в ткань клубня картофеля от времени облучения и интенсивности ультразвука;
1,3,5,7,9 время облучения (мин) каждого образца
Для сравнения эффектов электрофореза и фонофореза и цилиндрические образцы, вырезанные из клубня картофеля, в течение 20 мин электрофоретически вводились ионы йода. Затем образцы ополаскивали и разрезали на две части по оси цилиндра и одну половину облучали ультразвуком (0,6 Вт/см2; 5 мин). После этого обе половинки были «проявлены» в растворе перекиси водорода. Оказалось, что в той половинке (контрольной), в которую ионы йода были введены электрофоретически, окрасился в характерный сине-фиолетовый цвет лишь тонкий поверхностный слой, где клетки ткани были разрушены механически при подготовке образца; вторая же половинка, дополнительно подвергнутая ультразвуковому воздействию, изменила окраску во всем объеме.
Следовательно, при электрофорезе йод проникает в глубь ткани, но в клетки не попадает, так как сопротивление межклеточной жидкости постоянному току значительно ниже, чем сопротивление клеточных мембран. При следующей после электрофореза ультразвуковой обработке ткани проницаемость клеточных мембран увеличивается, и крахмал, находящийся в пластидах внутри клеток, оказывается доступным для ионов йода. Если образец предварительно обработать ультразвуком, а затем провести электрофорез ионов йода, то после проявления весь он окажется окрашенным.
Изменения в проницаемости клеточных мембран носят обратимый характер, если интенсивность ультразвука, обусловившего эти изменения, не превышает 0,8..1,2 Вт/см2- Повышенная проницаемость клеточных мембран сохраняется в течение 1,5...2 ч после воздействия ультразвуком. Проницаемость весьма значительна в течение первых 20 мин, а затем довольно быстро убывает.
Анализ приведенных данных свидетельствует о том, что при электрофорезе ионы глубоко проникают в ткань, но остаются в межклеточной среде и не погадают в клетки; при фонофорезе ионы проникают в ткань на меньшую глубину, но легко проникают внутрь клеток через цитоплазматическую мембрану, проницаемость которой повышена ультразвуком. При этом следует иметь в виду, что даже при 0,1...0,4 Вт/см2 проницаемость клеточных мембран в тканях животных заметно увеличивается, а дальнейшее повышение интенсивности может обусловить такие эффекты, как перегрев тканей или кавитацию.
Эти данные представляются весьма важными при выборе метода введения лекарственного вещества сквозь неповрежденную кожу. Очевидно, при необходимости повысить локальную концентрацию лекарственного вещества в ткани, например, при терапии опухолевых заболеваний, предпочтительнее метод фонофореза и его сочетание с электрофорезом. Если же необходимо ввести вещество в ткань более диффузно, то в этом случае эффективнее электрофорез.
Приведенные результаты послужили основанием для оптимизации фонофореза гидрокортизона при болезнях суставов. Оказалось, что снижение интенсивности ультразвука с используемых обычно 0,8 Вт/см2 до 0,2…0,4 Вт/см2 в непрерывном режиме и до 0,2.. 0,З Вт/см2 в импульсном режиме воздействия (0,88 МГц; 3..5 мин) ускоряет выздоровление при суставной патологии и способствует нормализации цитологических и биохимических показателей синовии. Гидрокортизон при этом депонируется в синовиальной жидкости. Такой же клинический эффект получен при фонофорезе гидрокортизона ультразвуком низких интенсивностей (0,2…0,5 Вт/см2) при пролифератах, десмоидитах, тендинитах и фиброзных периартритах у собак, крупного рогатого скота и лошадей.
Если патологический процесс локализован, а влиянию лекарственного вещества подвергается организм целиком, то это не всегда самый лучший способ лечения. Нередки случаи, когда концентрация лекарственных веществ оказывается повышенной вовсе не там, где это необходимо. Скорость транспортировки и концентрирования лекарственных веществ в очаги поражения часто лимитируется не током крови или диффузией в межклеточной жидкости, но пониженной проницаемостью клеточных мембран в очаге поражения по отношению к тем или иным веществам. Клетки занимают в мягких тканях не менее 0,9 всего объема, поэтому доступной для веществ, не проникающих через клеточные мембраны, оказывается лишь 0,1 всего объема или меньше. При электрофорезе некоторые вводимые вещества оказываются преимущественно в межклеточном пространстве. Это хорошо видно на примере ионов йода в ткани клубня картофеля.
Ультразвук, увеличивая проницаемость клеточных мембран, увеличивает объем, доступный вводимому лекарственному веществу, и способствует увеличению его концентрации и единице объема облучаемой ткани. Это наглядно проявляется при использовании фокусированного ультразвука (2,8 МГц; 50 Вт/см2; 1 с). На образцах клубней окрашивается только область, подвергнутая действию ультразвука, а мембраны клеток, расположенных в непосредственной близости к фокальной области, не испытывают заметных изменений. Размеры окрашенной области можно менять, варьируя интенсивность и время облучения.
Аналогичным способом можно концентрировать и некоторые химико-терапевтические препараты в тканях животных. Так, если в краевую вену уха кролика ввести краситель метиленовый синий, а ушную раковину того же или другого уха облучить ультразвуком (0,9 МГц; 0Д..2 Вт/см2; 5 мин), то через 20...30 мин в результате увеличения клеточных мембран краситель начнет концентрироваться в облученной ультразвуком области. Она заметно потемнеет и останется более темной, чем окружающие ткани, в течение 120..150 мин.
Представляется весьма перспективным метод транспортировки водорастворимых лекарственных веществ в липосомах - микрокаплях лекарства, покрытых слоем липидов, вводимых в кровь - с последующим высвобождением этих веществ из липосом в тканях, облучаемых ультразвуком. Вещества, содержащиеся в липосомах, высвободятся в тканях, прогретых ультразвуком, и попадут в клетки сквозь мембраны, проницаемость которых увеличена тем же ультразвуковым воздействием. Предполагается, что таким способом удастся увеличить локальную концентрацию лекарственных веществ до значений более высоких, чем достигнутые ранее исследователями, использовавшими для прогрева тканей микроволны.
Возможность локализации в тканях опухолей химико-терапевтических препаратов с помощью ультразвуковой гипертермии недавно была доказана экспериментально. На молочных железах млекопитающих, которые являются придатками кожи, специализированными для секреции молока, ультразвук (1,5 МГц; 2 Вт/см2; 10 мин) также вызывает увеличение проницаемости тканей. Концентрация предварительно введенного в кровь коз супронала быстро повышается в молоке после облучения молочной железы ультразвуком. Введенный в молочную железу этих животных антипирин сразу же после ее ультразвуковой обработки обнаруживается в крови в значительно больших количествах, чем в контрольных образцах. Возможно, именно повышением проницаемости клеточных мембран в тканях молочной железы под действием ультразвука обусловлена высокая эффективность фонофореза биоактивных пчелиных продуктов (прополис) при лечении маститов.
Широко используется и терапии способность ультразвука увеличивать проницаемость тканей глаза для различных веществ. Показано, что фонофоретически (0,9 МГц; 0,3 Вт/см2; 5 мин) удается ввести в камерную влагу глаза и такие вещества, которые без ультразвука туда не проникают (например, гепарин, дексазон). Однако не все вещества с одинаковой скоростью проникают в ткани под действием ультразвука. Скорость переноса зависит от молекулярной массы, структуры молекул лекарственых веществ, их растворимости в воде и липидах, от интенсивности ультразвука, времени облучения, частоты и т. д.
В живом организме местные реакции, выражающиеся в изменениях тканевой проницаемости, могут сопровождаться реакциями на уровне всего организма. Так, ультразвук средних терапевтических интенсивностей увеличивает проницаемость стенок сосудов но всем организме по отношению к ![]() -липопротеидам крови. В тех же условиях увеличивается проницаемость стенок периферических кровеносных сосудоп по отношению к трипановой сиви и нейтральному красному. Ультразвук более высокой интенсивности (0,9 МГц; 2 Вт/см2; 3 мин) как в непрерывном, так и в импульсном режимах, существенно повышает проницаемость тканей сердечной мышцы лягушки по отношению к витальным красителям, а также проницаемость тематоэнцефалического барьера к полуколлоидным красителям. Следовательно, изменение проницаемости тканей обусловлено не только локальным действием ультразвука, ио и общей реакцией организма на ультразвук.
-липопротеидам крови. В тех же условиях увеличивается проницаемость стенок периферических кровеносных сосудоп по отношению к трипановой сиви и нейтральному красному. Ультразвук более высокой интенсивности (0,9 МГц; 2 Вт/см2; 3 мин) как в непрерывном, так и в импульсном режимах, существенно повышает проницаемость тканей сердечной мышцы лягушки по отношению к витальным красителям, а также проницаемость тематоэнцефалического барьера к полуколлоидным красителям. Следовательно, изменение проницаемости тканей обусловлено не только локальным действием ультразвука, ио и общей реакцией организма на ультразвук.
Параллельно с проницаемостью клеточных мембран под действием ультразвука изменяются электропроводимость и коэффициент поляризации тканей, так как удельное сопротивление клеточных мембран обратно пропорционально их проницаемости по отношению к ионам, если ионный состав среды остается неизменным.
Можно предположить, что самопроизвольные сокращения портняжной мышцы лягушки, а также изменения сократительных свойств гладких и запирательных мышц теплокровных при облучении ультразвуком (0,08...2,25 Вт/см2; 1...3 МГц; 5 мин) связаны с деполяризацией клеточных мембран и подавлением биоэлектрической активности тканей.
Сопротивление биологических тканей электрическому току можно приближенно оценить, пользуясь известной формулой Велика-Горипа:
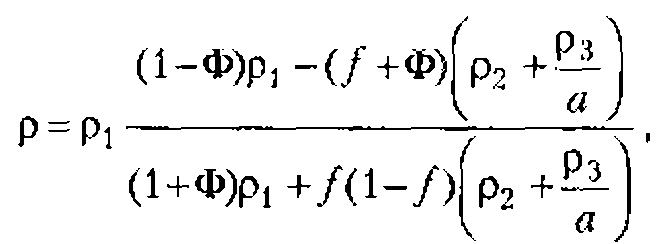
где p1, р2, р3 - сопротивление межклеточной жидкости, мембраны и внутриклеточного содержимого соответственно;
![]() - величина, равная отношению суммарного объема клеток к объему всей ткани;
- величина, равная отношению суммарного объема клеток к объему всей ткани;
![]() - геометрический фактор, для сферических клеток
- геометрический фактор, для сферических клеток ![]() = 1,5
= 1,5
![]() - диаметр клетки. Поскольку для большинства мягких биологических тканей
- диаметр клетки. Поскольку для большинства мягких биологических тканей ![]() ввиду того, что объем межклеточного пространства в них весьма мал по сравнению с общим объемом клеток, то уравнение существенно упрощается и принимает следующий вид:
ввиду того, что объем межклеточного пространства в них весьма мал по сравнению с общим объемом клеток, то уравнение существенно упрощается и принимает следующий вид:
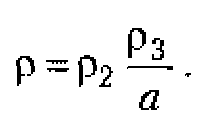
Очевидно, большая часть эффекта уменьшения сопротивления биологических тканей под действием ультразвука обусловлена увеличением проводимости мембран, так как относительно небольшие количества перекиси водорода, азотной и азотистой кислот, образующиеся в жидких средах при их обработке ультразвуком низких интенсивностей, не могут изменить проводимость клеточного содержимого и межклеточной среды.
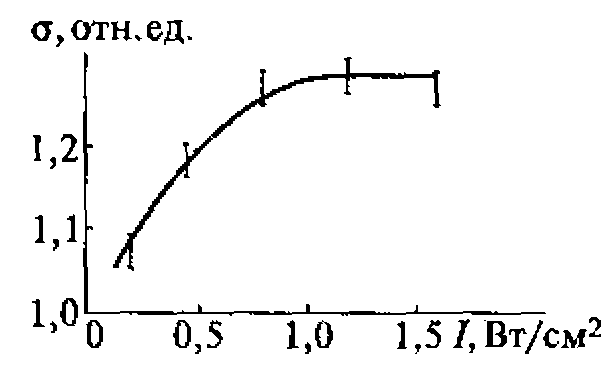
Рис. 3.17, Относительное изменение электропроводности ткани в зависимости от интенсивности от ультразвукового воздействия
Электропроводность ткани клубня картофеля увеличивается под действием ультразвука пропорционально возрастанию проницаемости клеточных мембран в интервале интенсивностей 0,2…1 Вт/см2.
Уменьшение электросопротивления под действием ультразвука наблюдается и на портняжной мышце лягушки. Импеданс ткани уменьшается во время ультразвукового облучения мышцы по закону близкому к экспоненциальному (рис. 3.17), и стремится к одному и тому же значению независимо от интенсивности ультразвука. Чем выше интенсивность, тем быстрее сопротивление ткани достигает минимальных значений. Активное сопротивление ткани - линейная функция интенсивности в интервале 0.2...2 Вт/см2. Импеданслинейная функция интенсивности лишь в интервале 0,2... 1 Вт/см2.
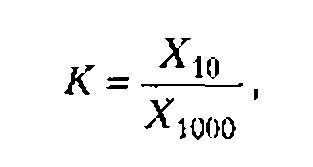
Параллельно с изменением электропроводности тканей изменяется и коэффициент их поляризации:
где X10 - комплексное сопротивление ткани, измеренное на частоте 10 кГц;
Х1000 - комплексное сопротивление ткани, измеренное на частоте 1000 кГц.
Связанный со способностью клеточных мембран разделять ионы коэффициент поляризации уменьшается при ультразвуковом облучении тканей, свидетельствуя о деполяризации мембран.
З.4.З. Действие ультразвука на кровь
Клетки крови в разбавленных суспензиях весьма чувствительны к ультразвуковому воздействию и начинают разрушаться при интенсивности 0,3 Вт/см2 (SPTA), совпадающей с порогом кавитации в воде (см. §§ 1.8; 1.13). Повышение концентрации клеток в суспензии заметно снижает скорость разрушения клеток под действием ультразвука, но, по-видимому, и в цельной крови вероятность появления пульсирующих газовых пузырьков не равна нулю, и, следовательно, не исключена возможность разрушения клеток.
Оставшиеся целыми клетки крови также мoгyт испытывать существенные изменения при ультразвуковом воздействии. Так, акустические потоки, наблюдавшиеся визуально в крови полупрозрачных тропических рыб, способны смыть макромолекулы с поверхности клеточных мембран, а вибропотенциалы, которые, судя по расчетам, достигают в крови величин, сравнимых с потенциалами клеток, могут изменить их электрические характеристики. В результате изменится проницаемость клеточных мембран, что обусловит, например, высвобождение аденозиндифосфата (АДФ) из эритроцитов, а это, в свою очередь, приведет к агрегации тромбоцитов.
Появление в кровяном русле клеток с измененными при ультразвуковом воздействии свойствами довольно быстро отразится на функционировании систем, контролирующих состав крови, так как, разнося клетки по всему организму, кровь как бы делокализует это воздействие. Если действовать ультразвуком (0,1...1 Вт/см2; 0,88 МГц) на краевую вену уха кролика, то за 5 мин воздействию подвергнется практически вся кровь. Известно, что объем крови в организме кролика массой 2,5 кг не превышает 150 см3. Сердце кролика в течение минуты перекачивает 600...700 см3 крови. Следовательно, в течение времени воздействия ультразвуком кровь несколько раз прокачивается через область, облучаемую ультразвуком.
Результаты такого воздействия весьма чувствительны для систем крови. Содержание гемоглобина, концентрация эритроцитов, скорость их оседания, вязкость и свертываемость крови заметно меняются уже в процессе ультразвукового облучения. Эти изменения в первом приближении пропорциональны интенсивности ультразвука. После ультразвукового облучения крови исследованные параметры с течением времени возвращаются к исходным значениям. Время релаксации этих параметров увеличивается пропорционально величине изменений, вызванных ультразвуком, и, очевидно, зависит от состояния регулирующих систем.
При малых изменениях параметров, характеризующих кровь, они довольно быстро возвращаются к исходным значениям по закону, близкому к экспоненциальному. Если эти изменения выходят за определенный предел, то наблюдается явление «перерегулирования», и исследуемый параметр возвращается к исходному уровню, совершая относительно него несколько затухающих колебаний.
Содержание гемоглобина в крови заметно меняется под влиянием ультразвука и быстрее остальных параметров возвращается к норме. Следом за содержанием гемоглобина возвращаются к исходным значениям скорость свертывания крови и скорость оседания эритроцитов. Вязкость крови и концентрация эритроцитов позже всех возвращаются к норме, совершая затухающие колебания относительно исходных значений, если интенсивность ультразвука превышает 0,6…1 Вт/см3. При более высоких ннтенсивностях ультразвука (1.5...3 Вт/см2) изменения в крови наблюдаются в течение многих часок и даже суток. Отмечается фазный характер изменений - лейкоцитоз сменяется лейкопенией, эозинопения переходит в эозинофилию.
Сравнительные исследования, проведенные на кроликах разных пород, показали, что, несмотря на некоторые различия, реакция всех животных на ультразвуковое воздействие, судя по изменениям в крови, имеет общий характер.
Качественно сходные изменения и биохимических и гематологических показателях наблюдали и в крови мышей, подвергшихся действию ультразвука (2 МГц; Вт/см2; 200 с). Первичными, запускающими процессы регуляции при ультразвуковом воздействии па кровь могут быть эффекты, связанные с разрушением форменных элементов, с изменением структуры и свойств их поверхностей.
Так, сокращение времени свертывания крови, по-видимому, вызвано увеличением агрегационной способности тромбоцитов в результате выброса АДФ из эритроцитов. Обратимое уменьшение числа эритроцитов в крови может быть обусловлено не только разрушением некоторого их количества, но и действием гемолизата. Гемолизат ингибирует эритропоэз в первое время и активирует его в дальнейшем благодаря увеличению количества эритропоэтина, появление которого связано с присутствием в крови продуктов распада эритроцитов. В связи с тем, что под действием ультразвука прежде всего разрушаются наименее стойкие, старые формы эритроцитов, можно предположить, что роль регуляторов эритропоэза принадлежит веществам, накапливающимся в эритроцитах в течение их жизни - прежде всего метгемоглобину и окисленным формам мембранных липидов.
3.4.4. Клеточные мембраны в механизме биологического
действия ультразвука
Изменения свойств клеточных мембран играют важную роль в механизме биологического действия ультразвука.
Известно, что изменение проницаемости клеточных мембран, приводящее к нарушению ионного состава внутриклеточной среды, обусловливает изменение в скоростях многих ферментативных реакций. В результате в клетках возникают репаративные реакции, сопровождающиеся новыми реакциями синтеза. Существенное влияние на состояние организма оказывает ультразвук, приводящий к разрушению клеток, что особенно отчетливо проявляется в системе крови. Так, парушение целостности весьма чувствительных к механическим воздействиям тромбоцитов приводит к высвобождению тромбопластина, нарушающего равновесие функционировании свертывающей - антисвертывающей системы крови, регулирующей параметры ее жидкого состояния.
Разрушение мембран эритроцитов при ультразвуковом облучении организма также приводит к существенным биологическим последствиям. Содержимое и осколки эритроцитов обнаруживаются в крови здоровых людей и без ультразвукового воздействия, хотя основной путь элиминирования эритроцитов - эритрофогоцитоз - заключае тся в поглощении эритроцитов метками ретикулоэпителиальной системы, расположенной в печени и селезенке. Возможно, существенная роль в регуляции эритропоэза принадлежит метгемоглобин у, содержание которого в эритроцитах к концу их жизни достигает 8...10 %.
Старые эритроциты обладают наименее прочной мембраной и разрушаются под действием ультразвука в первую очередь. Это приводит к увеличению содержания в крови стимуляторов эритропоэза и последующему увеличению числа эритроцитов в ней. Такая реакция подтверждает известный факт; разрушение зрелых эритроцитов стимулирует образование новых клеточных форм.
3.4.5. Системная реакция организма на ультразвуковое
воздействие
Высокочастотное ультразвуковое воздействие неспсцифично для биологических систем. В них нет специализированных рецепторов для восприятия ультразвука как такового, поэтому реакция организма па ультразвук представляет собой сложную комбинацию отдельных реакций на тепловое, механическое, химическое и электрическое воздействие,
В биологических системах нет рецепторов радиации, электромагнитных колебаний (исключая оптический диапазон) и некоторых других факторов внешней среды. Однако живые системы в ходе эволюции сталкивались с этими факторами и выработали специальные механизмы, позволяющие бороться с нежелательными последствиями их влияния, если энергия воздействия ненамного превышает средний для местообитания организма уровень.
В отличие от указанных факторов ультразвук мегагерцового диапазона никогда не влиял на живое в процессе эволюции. Это обусловлено пе только малой вероятностью условий, обеспечивающих в природе достаточно длительное генерирование относительно высокочастотного ультразвука, но и высоким коэффициентом поглощения ультразвука в воздухе.
Еще одно существенное отличие высокочастотного ультразвука от других факторов заключается в том, что ультразвуковое воздействие на организм (в клинике или эксперименте) всегда локально и затрагивает объем, во много раз меньший, чем объем всей биологической системы.
При радиационном поражении организма повреждению на каждом уровне предшествует развитие «скрытых» для данного уровня процессов, протекающих на более низком уровне биологической интеграции, и проявляется на данном уровне, когда репарационные возможности предыдущего уровня оказываются исчерпанными. Поэтому видимое радиационное поражение возникает после периода скрытого развития, и максимум наблюдаемых повреждений всегда отделен определенным промежутком времени от повреждающего воздействия.
Реакция на ультразвуковое воздействие существенно сложнее, поскольку «скрытые» процессы идут параллельно на нескольких уровнях, и каждый из них, став наблюдаемым на более высоком уровне биологической организации, накладывается па те, которые уже протекают на этом уровне и являются скрытыми по отношению к следующему в иерархии структур уровню организации.
Реакция на ультразвук становится сходной с реакцией организма на ионизирующее излучение при длительном воздействии ультразвуком (см. подразд. 3.3.1) весьма малых интенсивностей (10 мВт/см2; 1 МГц; 14...30 суток), вызывающим изменения в основном на уровне функционирования клеточных мембран.
По типу взаимодействия ультразвук низких интенсивностей является скорее информационным, чем энергетическим фактором. Действительно, нередки случаи, когда слабое ультразвуковое воздействие инициирует мощные последствия. Так, облучение ультразвуком (1...3 МГц; 0,5 Вт/см2; 6 мин) может привести к увеличению скорости циркуляции крови в тканях и повышению температуры организма на 0,5..1,5°С. Для повышения температуры организма массой 70 кг на 0,5 °С (без учета теплообмена с окружающее средой) необходимо затратить примерно 1,5 . 105 Дж. Во время ультразвукового облучения организм в лучшем случае получит 2,3 . 103 Дж, т. е. в 100 раз меньше. Учет теплообмена между организмом и средой приводит к значительно большим различиям.
После ультразвукового облучения в организме наблюдаются процессы восстановления, протекающие на разных уровнях интеграции и характеризуемые различными временными параметрами. Как и в случаях с другими факторами, реакция на ультразвук существенно зависит от интенсивности и длительности воздействия, а скорость восстановительных процессов относительно велика на низшх уровнях интеграции и мала на высших.
Под влиянием ультразвука (1 МГц; 0,2..0,6 Вт/ем2; 0,5...5 мин), как уже отмечалось, заметно увеличивается проницаемость клеточных мембран.
Наибольшие изменения в проницаемости наблюдаются в первые 30 мин после облучения, а через 6...10 ч проницаемость клеточных мембран не отличается от исходных значений. Аналогичные данные были получены ранее и при исследовании влияния на проницаемость клеточных мембран рентгеновского излучения (1кР). Достоверные изменения в проницаемости мембран клеток корешков пшеницы наблюдались в первые 4...30 мин после облучения. Изменения полностью репарируются в течение 4...24ч.
В связи с тем, что рентгеновское излучение взаимодействует со средой на молекулярном уровне, на основе сравнения вышеприведенных результатов можно предположить, что элементарное взаимодействие ультразвука также осуществляется на уровне макромолекул или макромолекулярных комплексов. Последнее не исключает, однако, возможности влияния ультразвука па различные регуляционные системы, например, путем изменения условий передачи управляющих сигналов в результате деполяризации мембран, изменения градиентов концентраций различных веществ и т. д.
На более высоких, клеточном и тканевом, уровнях организации последствия ультразвукового воздействия (0,9 МГц; 0,2...1 Вт/см2; 5 мин) наблюдаются значительно дольше. Так, изменения в тканях коры надпочечником и яичников животных в виде усиления холинэстеразной активности тканевых гомогенатов, повышения гормональной активности яичников и некоторые другие наблюдались в течение 20 дней после ультразвукового воздействия интенсивностью 1 Вт/см2. Более интенсивный ультразвук (0,6 Вт/см2) вызывает значительные морфологические изменения, наблюдаемые, по крайней мере, в течение 60 дней.
Ультразвук (0,6...1 Вт/см2) в начальные сроки (0,5...4 ч) после воздействия снижает количество РНК в тканях зрительного анализатора, к третьим суткам количество РНК увеличивается до 80... 120% и к десятому дню практически не отличается от нормы. При 0,2 Вt/cm2 количество РНК в тканях несколько увеличивается. Отличия обнаруживаются через 2 ч после ультразвукового облучения, достигают максимальных значений через сутки и в последующие 2...10 суток мало отличаются от нормы.
Приведенные результаты можно объяснить активирующим действием ультразвука низких интенсивностей (0,2 Вт/см2) и подавляющим действием ультразвука высоких интенсивностей. Не исключено, однако, что ультразвук (0,6..1 Вт/см2) вызывает задержку в клеточном делении (в интерфазе), в течение которой повреждения в клетках будут отрепарированы и не проявятся в виде серьезных дефектов в процессе митоза. Такой «морфостатический» эффект проявился и в уменьшении времени регенерации активно пролиферирующий ткани культи передней ланы тритона после воздействия слабым, диагностическим ультразвуком.
О высокой чувствительности активно пролиферирующих тканей к ультразвуку свидетельствует и повышенная смертность эмбрионов мышей, подвергнутых ультразвуковому облучению (1 МГц; 0,125..0,5Вт/см2; 3 мин) на 13-й день развития. Нарушения наблюдались во всех случаях, а эффект нарастал пропорционально квадратному корню из интенсивности ультразвука. Аналогичные явления наблюдаются и при радиационном повреждении организма.
Наиболее длительное последствие обнаруживается на уровне целого организма. Так, под действием ультразвука (0,8 МГц; 1,33 Вт/см2) в результате 15-минутной обработки возникают заметные изменения в структуре эпителия кожи человека. В коже, облученной в общей сложности в течение 14 ч (за 7,5 месяцев), повышается кератоз. При этом дозы ультрафиолетового излучения, вызывающие на облученном ультразвуком участке кожи эритему, возрастают. Тщательные исследования, проведенные через 25 лет после ультразвукового воздействия, обнаружили пониженную чувствительность кожи на облученном участке к тепловому и механическому раздражителям.
Вся ультразвуковая терапия базируется на эффектах последействия, Именно эти эффекты, обусловленные ультразвуком специально подобранных параметров, приводят в организме к изменениям, способствующим ускорению нормализации тех или иных функций, выздоровлению организма в целом.
Конечный результат ультразвукового воздействия существенно зависит от его интенсивности. Например, как повышенные, так и пониженные моторная и секреторная функции желудка собак нормализуются под действием ультразвука (0,9 МГц; 5...10 мин), если ето интенсивность не превышает 1 Вт/см2. У здоровых животных после ультразвукового воздействия функциональных изменений со стороны желудка не наблюдается, При интенсивностях, превышающих 1 Вг/см2, ультразвук во всех случаях подавляет моторную и секреторную функции желудка. Ультразвук невысоких интенсивностей (менее 1 Вт/см2; 0,9 МГц; 3 мин) усиливает моторику желчного пузыря. Увеличение интенсивности до 1 Вт/см2 приводит к обратному эффекту.
Приведенные данные, а также результаты многочисленных наблюдений, свидетельствующих об эффективном терапевтическом действии ультразвука невысоких интенсивностей, хорошо соответствуют предложенным выше моделям и укладываются в рамки следующих предположений.
Ультразвуковое воздействие низких интенсивностей (менее 1 Вт/см2) вызывает на разных уровнях структурной организации организма незначительные повреждения, легко репарируемые соответствующими системами. В здоровом, нормально функционирующем организме, процессы развития повреждений после ультразвукового воздействия полностью контролируются репарационными системами, остаются в стадии «скрытых» процессов и не вызывают видимых (клинических) реакций со стороны основных систем организма.
Если в организме имеются порочные патогенетические круги, то процессы регуляции, активизированные ультразвуковыми повреждениями, в некоторых случаях способны разорвать эти крути, что приводит, как правило, к нормализации нарушенных функций, так как нормальное состояние организма более вероятно, чем квазистационарное патологическое.
3.5. УЛЬТРАЗВУК В ФИЗИОТЕРАПЕВТИЧЕСКОЙ
ПРАКТИКЕ
Применение ультразвука существенно обогатило арсенал физиотерапевтических методов. Используя ультразвук, оказалось возможным не только успешно бороться с некоторыми болезнями, но, воздействуя на здоровый организм, повышать его жизнеспособность и сопротивляемость неблагоприятным внешним условиям. Разработаны также новые ультразвуковые методы, позволяющие сделать хирургические манипуляции практически бескровными.
Ультразвуковые методы не лишены, однако, недостатков, препятствующих их широкому применению в медицинской и ветеринарной практике.
Применение ультразвука, как, впрочем, и других лечебных воздействий, требует дозировки. При слишком низких интенсивностях и коротком времени воздействия ультразвук может оказаться неэффективным, а интенсивное и длительное воздействие может обусловить весьма существенные и не обязательно желательные изменения в организме.
3.5.1. Общая неспецифическая стимуляция методом ультразвуковой аутогемотерапии
При некоторых вяло протекающих инфекционных и других заболеваниях весьма полезной оказывается проводимая с лечебной целью аутогемотерапия - внутримышечное или внутривенное введение больному (человеку или животному) его собственной крови. Такая процедура приводит, как правило, к улучшению обменных процессов и повышению защитных сил организма.
Эффективность аутогемотерапии можно повысить, если перед вливанием кровь облучить ультрафиолетом, осторожно взболтать или подвергнуть действию ультразвука низких интенсивностей. При этом отмечается значительное улучшение общего состояния организма, повышение его жизнеспособности и сопротивляемости неблагоприятным изменениям внешней среды.
Механизм аутогемотерапии достаточно ясен. При введении собственной крови в мышцу она оказывается не там, где ей следует быть, а после возвращения в собственное кровеносное русло после какого-либо воздействия - не такой, какой она должна быть в норме, В обоих случаях организм реагирует на эти ситуации как на незнакомый сигнал о возможных дальнейших изменениях в окружающей среде или в самом организме и, не обладая стандартной программой реагирования на этот сигнал, активизируем защитные системы, готовясь (на всякий случай) к худшему.
Основываясь на этом механизме, можно значительно упростить операцию аутогемотерапии, воздействуя ультразвуком на кровь через покровные ткани непосредственно в кровеносном русле организма.
Сравнительный анализ изменений в крови кроликов и некоторых животных после обычной аутогемотерапии и после воздействия ультразвуком (0,88 МГц; 0,3...0,6 Вт/см2; 3...5 мин) - ультразвуковой аутогемотерапии - свидетельствует о качественно одинаковой реакции со стороны организма на оба воздействия. Как обычная, так и ультразвуковая аутогемотерапия приводят к изменениям кислотной, осмотической и ультразвуковой гемолитической стойкости мембран эритроцитов (рис. 3.18), хорошо кореллирующей с общей резистентностью организма и зависящей от содержания холестерина в сыворотке крови (рис. 3.19). Испытывают изменения также фагоцитоз и активность лизоцима, характеризующие естественную резистентность организма.
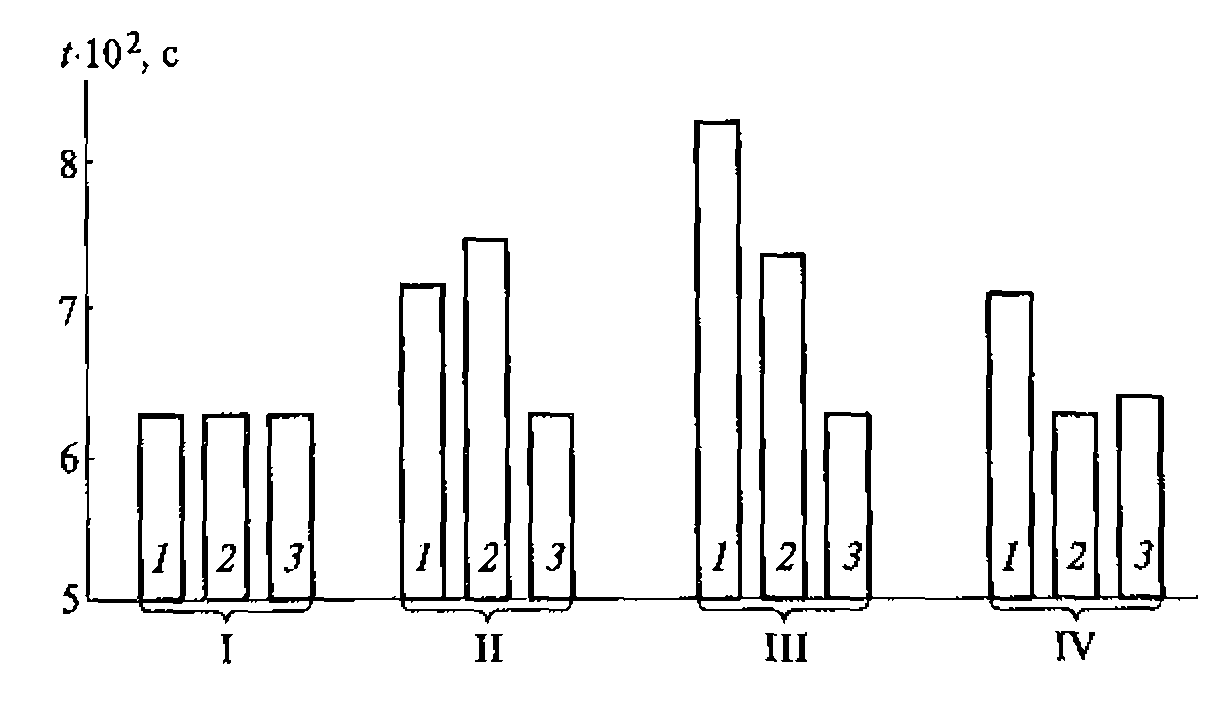
Рис. 3.18. Изменение механической резистентности эритроцитов кролика (по времени полного гемолиза):
I - до воздействия; II -немедленно после воздействия; III - через 4 ч после воздействия; IV -через 24 ч после воздействия; 1-после ультразвуковой аутогемотерапии; 2-после обычной аутогемотерапии; 3-контроль
Рис, 3.19. Изменение содержания холестерина в сыворотке крови кроликов после аутогемотерапии:
I - до воздействия; II - немедленно после воздействия; III - через 2 ч после воздействия; IV - через 4 ч после воздействия, V - через 24 ч после воздействия; 1 - ультразвуковая гемотерапия (0,3 Вт/см ); 2 - ультразвуковая гемотерапии (0,5 Вт/см ); 3- обычная аутогемотерапия; 4 - контроль
После обычной аутогемотерапии, или после 3-5-минутного воздействия ультразвуком на кровь в краевой вене уха кроликов или в хвостовой вене более крупных животных в течение последующих суток наблюдаются сходные положительные сдвиги в организме.
3.5.2. Действие ультразвука на биологически
активные точки
Рефлексотерапия лечебное воздействие иглами, теплотой, надавливанием на определенные биологически активные точки, расположенные па поверхности тела, - имеет многовековую историю, В последнее время к традиционным методам воздействия добавились и современные - воздействие электрическим током, лазерным лучом, ультразвуком.
Совокупность биологически активных точек функционально представляет собой как бы вынесенный па поверхность тела пульт индикаторов и датчиков, сигналы с которых корректируют работу внутренних органов. Функции таких индикаторов, очевидно, выполняют многочисленные рецепторы и нервные окончания, расположенные на участках рыхлой соединительной ткани в области локализации биологически активных точек.
Как известно, реакция рецепторов на внешнее воздействие всегда сопровождается деполяризацией, снижением мембранного потенциала и изменением проницаемости их мембран, по крайней мере, по отношению к ионам натрия и калия. Известно также, что изменение проницаемости клеточных мембран - универсальная реакция клеток па ультразвуковое воздействие. Таким образом, очевидно, что действие ультразвука на биологически активные точки обусловлено деполяризацией мембран рецепторов содержащихся в этих точках.
Электропроводность ткани зависит от соотношения объемов клеток и межклеточного пространства, поэтому в биологически активных точках, представляющих собой участки рыхлой ткани, электропроводность всегда выше, чем на соседних участках поверхности кожи. Изменение проницаемости и деполяризация клеточных мембран приводят к изменению электропроводности тканей, поэтому найти точку на поверхности тела и оценить направленность и степень изменений в ней в результате какого-либо воздействия проще всего по электрическим характеристикам.
В свете современных представлений ультразвуковую акупунктуру, впрочем, как и другие методы воздействия на биологически активные точки, можно отнести к пейростимулирующим методам терапии. При раздражении периферических нервных структур в них генерируются электрические импульсы, которые через рефлекторную цепь вызывают выделение специфических медиаторов в органах - мишенях. Нейромедиаторы, в свою очередь, воздействуют на рецепторы клеток, и в этих органах изменяется интенсивность обменных процессов.
Ультразвуковую акупунктуру в медицинской практике впервые применили в 1974 г. и отметили ее высокую эффективность. Десятью годами позже ультразвуковая акупунктура была успешно использована в ветеринарной практике.
Воздействие ультразвуком на биологически активные точки, расположенные на вымени коров у основания сосков, вызывает при эндометритах резкие сокращения матки, в результате чего из нее удаляются выделения. Действие ультразвуком с интенсивностью 0,08…0,1 Вт/см2 на определенные точки человека и животных приводит к возрастанию в их крови содержания адреналина и норадреналина.
Существенно увеличивается половая потенция баранов и хряков после воздействия непрерывным ультразвуком с интенсивностью 0,05…0,2 Вт/см2 в течение 1...3 мин на точку 38 БАЙ ХУЭ, расположенную на средней линии спины, на уровне верхнего края крестцовой кости, и на три пары точек 38 МУ-Я, расположенных в 50 мм от средней линии, на уровне второго, третьего и четвертого крестцовых позвонков.
Воздействие ультразвуком на общеукрепляющие точки обусловливает изменение не только в воспроизводительной функции животных. Сразу же после воздействия на эти точки у человека и животных на 7...10 % увеличивается частота пульса и на 10…12 % - частота дыхания, по через несколько часов оба показателя возвращаются к норме.
3.5.3. Стимуляция и подавление воспроизводительных
функций животных
Существует много способов повышения воспроизводительных функций животных. Это и ультрафиолетовое облучение самцов с плохой спермопродукцией, и добавление окситоцина к сперме для повышения оплодотворяемости и многоплодия, и лазерное облучение семенников производителей, увеличивающее спермопродукцию и качество спермы. Весьма успешно в качестве регулятора репродуктивных функций используется и ультразвук.
Ультразвуковое воздействие на семенники животных (по одному разу в день в течение четырех дней) также положительно влияет на их репродуктивные функции, если интенсивность ультразвука с частотой 0,88 МГц не превышает 0,1 Вт/см2, а время воздействия – 2...3 мин. Такое воздействие па хряков-производителей на 3...5 % повышает объем эякулятов и подвижность сперматозоидов, а использование этой спермы для искусственного осеменения приводит к заметному (около 15%) повышению оплодотворяемости свиней и на 20...25 % снижает внутриутробную смертность поросят. По живой массе новорожденные поросята, родившиеся у свиноматок, оплодотворенных спермой стимулированных ультразвуком производителей, не превосходят своих «обычных» собратьев, но быстрее набирают в весе и меньше болеют.
Действие ультразвука относительно низких интенсивностей (менее 1 Вт/см2 в течение 5... 10 мин) стимулирует и функциональную активность яичников свиней. В них через месяц после стимуляции примерно в 1,5 раза возрастает число зрелых фолликулов, а яичники вдвое увеличиваются в весе и размерах. При осеменении в эти сроки на 25 % увеличивается плодовитость самок, возрастает их молочная продуктивность. Поросята быстро набирают в весе и при отъеме их масса в среднем на 10 % превышает массу поросят, родившихся у нестимулированных свиноматок и выкормленных ими.
Повышение интенсивности ультразвукового воздействия на семенники до 1..3 Вт/см2 приводит к обратимому снижению объема эякулята и качества спермы, увеличению количества патологических форм сперматозоидов. Более высокие интенсивности ультразвука (4 ...5 Вт/см2) вызывают после трехкратного воздействия по 10 мин каждое (один раз в день) атрофию генеративной ткани и полное обеспложивание хряков. Воздействие ультразвуком в том же режиме, или даже при вдвое укороченной экспозиции, на половые железы месячных свинок через кожу в брюшной области, между последней и предпоследней парами сосков, приводит к полной атрофии яичников и стойкому бесплодию. Операция ультразвукового обеспложивания животных безболезненна, не сопряжена с нарушением целостности кожных покровов, не требует стерильных условий и высокой квалификации оператора.
Действие ультразвука с интенсивностью 4 Вт/см2 и более на область матки беременных животных вызывает во всех случаях ее резкое сокращение, что приводит к прерыванию беременности. При этом общее состояние самки ухудшается незначительно и в дальнейшем не отражается на ее репродуктивной функции.
Используя ультразвук, можно существенно повысить эффективность криокопсервирования сперматозоидов, быстро и объективно оценивать качество спермы (см. § 2.4), а также воздействовать на сперму с целью направленного изменения ее свойств.
Возможно, существенную роль в активизации спермы играет способность ультразвука снижать антигенную специфичность клеток, в том числе сперматозоидов, которые для организма самки являются инородными и должны были бы уничтожаться и удаляться, если бы не многочисленные механизмы, способствующие продолжению рода.
Ультразвуковое воздействие (0,88 МГц; 0,05 Вт/см2) непосредственно на сперму уже само по себе положительно влияет на ее свойства, что выражается в повышении выживаемости сперматозоидов в среднем на 10% и увеличении их подвижности на 10...25 %. Выживаемость и подвижность сперматозоидов возрастают под влиянием парааминобеизойной кислоты (ПАБК) и ряда других физических и химических воздействий. Это свидетельствует о возможной неспецифической реакции на внешние воздействия неизвестной природы. Такие воздействия воспринимаются в виде сигнала о возможных изменениях во внешней среде, которые могут оказаться и неблагоприятными. В этих условиях повышение выживаемости и подвижности сперматозоидов дает дополнительный шанс для продолжения рода в неблагоприятных условиях,
О неспецифичности воздействия и его информационной природе свидетельствуют отсутствие зависимости величины эффекта от интенсивности воздействия (в пределах, определяемых, с одной стороны, чувствительностью системы, а с другой - возможностями ее репаративных и регуляторных механизмов), а также качественное сходство в реакции биологической системы на воздействия различной природы и одинаковый эффект при комбинированном воздействии разными факторами или каждым из них в отдельности (табл. 3.3).
Такое качественное единообразие ответа системы на неспецифические воздействия уменьшает необходимость изучения первичных механизмов взаимодействия того или иною фактора с биологическими объектами, и в частности со сперматозоидами, однако знание этих механизмов позволяет априорно оценить пределы, оставаясь в которых воздействие стимулирующего фактора не приведет к отрицательным последствиям.
Таблица 3.3
Влияние ультразвука (0,88 MГц; 0,05 Вт/см2; 30 с) и ПАБК (10-3 М/л) на абсолютную выживаемость и подвижность сперматозоидов (в относительных единицах)
|
Параметры |
Контроль |
Ультразвук |
ПАБК |
Ультразвук + + ПАБК |
|
Выживаемость |
300±23 |
370±28 |
400±29 |
390±28 |
|
Подвижность |
5,1 ±0,2 |
6,1±0,2 |
6,4±0,1 |
6,2±0,2 |
При воздействии на сперму ультразвук низкой интенсивности снижает несовместимость сперматозоида и женского организма и, более того, перемешивая среду и увеличивая проницаемость мембран, облегчает доставку кислорода и питательных веществ к сперматозоидам, что повышает их активность. Благодаря способности ультразвука ускорять химические реакции активизируется также капацитация - сложный процесс подготовки сперматозоида к слиянию с яйцеклеткой. Активация, обусловленная действием ультразвука низких интенсивностей на сперму (например, хряков), приводит в итоге к увеличению ее оплодотворяющей способности (табл. 3.4).
Эффект стимуляции и в этом случае неспецифичен. Качественно сходные изменения получены после добавления в сперму 0,1 мг/мл ПАБК, после комбинированного воздействия ультразвуком и ПАБК, а также после воздействия лазерным лучом или после добавления в сперму охитоципа.
Таблица 3. 4
Результаты искусственного осеменения свиноматок спермой после обработки ультразвуком и добавления ПАБК
|
Фиксируемые параметры опыта |
Контроль |
Воздействие | ||
|
ультразвуком |
добавлением ПАБК |
ультразвуком и добавлением ПАНК | ||
|
Количество осемененных маток |
20 |
22 |
23 |
20 |
|
Количество опоросившихся маток |
10 |
17 |
15 |
15 |
|
Количество поросят на матку |
10±1 |
11±1 |
11±1 |
9±1 |
|
Живая масса новорожденного поросенка, кг |
1,37±0,03 |
1,33±0,03 |
1,32±0,03 |
1,45±0,03 |
|
Внутриутробная смертность, % |
11±2 |
5 ±2 |
7±2 |
18 ±2 |
3.5.4. Лечение заболеваний опорно-двигательного
аппарата
Ультразвуковая физиотерапия весьма эффективна при лечении острых синовитов, тендовагинитов, периоститов, фиброзных и осцифицирущих периоститов.
Воздействие одним лишь ультразвуком на очаг заболевания (местное воздействие) при острых и хронических асептических процессах, касающихся суставов, сухожилий и их влагалищ, связок и других звеньев конечностей, способствует быстрому восстановлению их опорнодвигательной функции. Обычно выздоровление наступает после 6-7 процедур, по одной ежедневно или через день. При хронических пролиферативных процессах курс лечения увеличивается до 11-12 процедур. Если клинические проявления заболевания не проходят, то курс лечения необходимо повторить через 1-2 месяца.
Благодаря ярко выраженному обезболивающему действию, ультразвук особенно эффективен при лечении неосложненных вывихов голеностопного и плечевого суставов. При острых синовитах, тендовагинитах и других заболеваниях весьма эффективен фонофорез гидрокортизона или дексазона, обеспечивающий одновременное действие ультразвука и лекарственного препарата.
Фонофорезу - введению лекарственного препарата сквозь неповрежденную кожу благодаря силам, действующим в акустическом поле, - способствует также обусловленное ультразвуком повышение проницаемости клеточных мембран, причем толщина слоя ткани, состоящей из клеток, мембраны которых обладают повышенной проницаемостью, пропорциональна интенсивности ультразвука. Повышенная проницаемость сохраняется в течение полутора-двух часов, однако наибольшая проницаемость наблюдается в течение первых 25 мин после воздействия ультразвуком. Поэтому в ряде случаев после ультразвукового воздействия весьма эффективен электрофорез. При такой последовательности электрофоретически введенные лекарственные вещества локализуются не только в межклеточном пространстве, по и попадают во внутренний объем клетки.
В физиотерапии опорно-двигательного аппарата лучше всего действует, не вызывая отрицательных последствий и быстро приводя к выздоровлению, ультразвук с интенсивностями в интервале 0,1...0,4 Вт/см2. Под влиянием низких интенсивностей ультразвука, стимулирующих обменные процессы, снижается экссудация, разрыхляется фиброзная ткань, начинается декальцификация сформировавшихся и формирующихся остеофитов и экзостозов. Увеличение интенсивности и длительности воздействия приводит к разрежению кортикального слоя кости в зоне воздействия ультразвука и другим нежелательным последствиям.
3.5.5. Ультразвуковая терапия поражений покровных тканей
Способность ультразвука ускорять процессы синтеза соединительнотканных и других белков, а также РНК в клетках, его стимулирующее, противовоспалительное и болеутоляющее действие делают ультразвуковую терапию ран весьма эффективной.
Под действием ультразвука (0,88 МГц; 0,5 Вт/см2; 3...5 мин) раны размером 3...5 см в поперечнике заживают на 18-20-й день после их появления. Таким образом, раны заживают на 8-10 дней быстрее, чем рапы, кожу вокруг которых ежедневно обеззараживают 70%-ным раствором винного спирта, а поверхность раны смазывают 50%-ным водным раствором глицерина, и на 4 - 5 дней быстрее, чем раны, края и поверхность которых ежедневно покрывают синтомициновой эмульсией.
Следует отметить, что результат комбинированного действия ультразвука с синтомициновой эмульсией не превышает результатов, обеспечиваемых применением одного лишь ультразвука. Очевидно, ультразвуковое воздействие настолько полно реализует резервы организма, что влияние других факторов на этом фоне оказывается незначительным.
Заживление послеоперационных ран можно ускорить, используя ультразвук для предварительной подготовки тканей. Дооперационное воздействие ультразвуком, стимулируя защитные процессы, ускоряет послеоперационную регенерацию тканей, заживление операционного разреза, существенно упрочняет формирующийся рубец. Так, на четвертые сутки после операции, проведенной на коже, предварительно обработанной ультразвуком, прочность рубца оказывается более чем на 30 % выше, чем прочность рубца на неподготовленном участке.
Весьма целесообразно использовать ультразвук и для лечения воспалительных инфильтратов, нередко возникающих в качестве послеоперационных осложнений. После воздействия ультразвуком с интенсивностью 0,2...0,6 Вт/см2 воспалительные явления обычно стихают после 4-5 процедур, а после 6-9 процедур инфильтраты чаще всего рассасываются. При ежедневном лечении ультразвуком площадь раны уменьшается в 1,5-2 раза быстрее, патогенные микробы исчезают из раны на 2-3 дня раньше обычного, а рубец формируется без келоидизации. В целом ультразвуковое облучение ускоряет заживление осложненных операционных ран на 2-3 дня.
Фурункулез - острое гнойно-некротическое воспаление волосяных мешочков, связанных с ними сальных желез и окружающей их клетчатки, вызывается стафилококком и возникает в местах патогенного заражения, а также механического или химического раздражения кожи. У животных фурункулы нередко образуются на вымени. Ежедневные десятиминутные воздействия ультразвуком (0,88 МГц; 0,2... 1 Вт/см2) непосредственно на поверхность фурункулов через водно-глицериновую контактную среду значительно ускоряют лечение. Уже после первой процедуры уменьшается болезненность пораженного участка, после второй или третьей снижается воспаление, боли полностью исчезают, фурункулы уменьшаются в размерах. На пятый-шестой день большинство фурункулов вскрывается, из них выделяются гнойный экссудат и гнойные пробки. Образовавшиеся на месте фурункулов язвочки в последующие 5-6 дней полностью заживают. В некоторых случаях фурункулы не вскрываются: после 10-12 процедур инфильтраты рассасываются и на их месте под кожей обнаруживаются лишь безболезненные уплотнения.
Следует отметить, что использование в качестве контактной среды вместо водно-глицериновой смеси тетрациклиновой мази лишь незначительно ускоряет процесс лечения. Очевидно, в обоих случаях эффект обусловлен терапевтическим действием ультразвука, а не действием веществ, содержащихся в среде, обеспечивающей акустический контакт между фурункулом и излучателем ультразвуковых волн.
При абсцессах ультразвуковая терапия также дает хорошие результаты. Используются те же методы воздействия и параметры ультразвука, что и при лечении фурункулеза. Применение ультразвука особенно эффективно при лечении абсцессов, расположенных неглубоко под поверхностью тела.
3.5.6. Влияние ультразвука на молочную железу и лечение ее заболеваний
Молочные железы являются придатками кожи, специализированными для секреции молока. Попытки повышения их продуктивности с помощью стимуляции самыми разными факторами, в том числе и ультразвуком, весьма многочисленны. Особенно эффективен ультразвук (0,88 МГц; 0,2...0,6 Вт/см2; 5... 10 мин) при раздаивании. Стимулируя обменные процессы, нормализуя сократительную активность гладкой и поперечно-полосатой мускулатуры, ультразвуковое воздействие улучшает кровоснабжение молочной железы, повышает молокоотдачу, уменьшает явления застоя и задержки молока, сокращает сроки раздаивания.
Стимуляция секреции молока ультразвуком у активно лактирующих животных не всегда приводит к повышению их продуктивности. Эффект зависит от исходной продуктивности и резерва возможностей организма лактирующего животного, а также от интенсивности ультразвука, локализации и длительности его воздействия. Эффективной реализации резерва продуктивности способствует воздействие ультразвуком низких интенсивностей (0,2..0,4 Вт/см2) па рефлексогенные зоны вымени животных, расположенные у основания соска. Общее воздействие на вымя также приводит к увеличению секреции на 10...12 % при условии, что интенсивность ультразвука не превышает 1 Вт/см2. При более высоких интенсивностях ультразвукового воздействия на вымя продуктивность животных или подавляется, или, если компенсаторным механизмам удается справиться с повреждающим воздействием интенсивного ультразвука, продуктивность остается па исходном уровне.
Воздействие ультразвуком на молочные железы приводит к изменению качества молока. В молоке увеличивается содержание лизоцима, ценного фермента, придающего молоку бактерицидные свойства. Чем выше концентрация лизоцима в молоке, тем ниже вероятность инфицирования молочной железы, возникновения маститов и других заболеваний. В связи с этим ультразвук низких интенсивностей может рассматриваться как хорошее средство предупреждения маститов.
Увеличение интенсивности ультразвука до 1,5...2,0 Вт/см2, как правило, несколько снижает молочную продуктивность, хотя содержание, лизоцима в молоке возрастает, и тем значительнее, чем ниже было его содержание в молоке животных до ультразвукового воздействия.
Воспаления молочной железы, вызванные гноеродными микроорганизмами (маститы), часто встречаются у людей и животных. При маститах весьма эффективны ультразвуковые методы, существенно ускоряющие и удешевляющие процесс лечения.
Первое же воздействие ультразвуком (0,88 МГц; 0,4...0,6 Вт/см2; 10 мин) на пораженную долю вымени снимает болевую реакцию. При своевременном лечении катаральные маститы прекращаются после 2-5 процедур (по одной ежедневно). В конце курса лечения болезнетворные микроорганизмы в молоке совсем исчезают.
Успешно используют ультразвук и при других формах маститов, а также при абсцессах, актиномикозах, флегмонах и отеках различной этиологии. Процесс лечения обычно составляет 5-6 дней и не превышает 2-3 недель.
Эффективен для лечения маститов комбинированный метод, включающий лечение ультразвуком и антимикробными препаратами.
3.5.7. Ультразвук в офтальмологии
Ультразвук с интенсивностью, превышающей 1 Вт/см2, вызывает нежелательные явления в структуре глаза - помутнение стекловидного тела, образование катаракты, слущивание эпителия па роговице, отек и некроз передних слоев стромы и пр. Поэтому для лечения болезней глаз используют ультразвук с интенсивностью 0,2...0,4 Вт/см2, а время воздействия обычно не превышает 5 мин. Ультразвук в таком режиме заметно активизирует обменные процессы, а также увеличивает проницаемость тканей глаза для лекарственных препаратом. В связи с этим на практике, как правило, используют фонофорез.
В лечении глазных болезней была использована и способность ультразвука стимулировать обменные процессы, ускорять биосинтез соединительнотканных белков и ряда других веществ в клетке, активизировать восстановительные процессы в поврежденных тканях.
Весьма эффективен ультразвук (0,88 МГц; 0,3 Вт/см2; 5 мин) при лечении тяжелых проникающих ран роговицы и склеры. Под его влиянием ускоряется рассасывание фибрина и лейкоцитарной инфильтрации, уменьшается отек стромы роговицы. В результате образуется тонкий, почти бессосудистый рубец, похожий по своему строению на строму роговицы.
Вирусный кератит, в том числе у кроликов, собак, лошадей и других животных, после лечения ультразвуком быстро проходит и не оставляет грубых рубцов на роговице.
Для воздействия ультразвуком на глаза животных и человека в настоящее время используется несколько разных способов. Излучатели небольшого размера (диаметром от 0,5 до 1 см) позволяют облучать ультразвуком ограниченный участок глаза при непосредственном контакте с ним. Такой метод чаще всего используют при лечении рубцов, царапин и ран кожных покровов век и кожи вокруг глаз. Для воздействия на сам глаз применяют непрямой контактный метод. В качестве прокладки, передающей акустическую энергию, используют заполненный водой мешочек из тонкой резины, принимающий форму глаза и излучателя. Однако при этом теряется 50...60 % ультразвуковой энергии и становится затруднительной точная дозировка воздействия.
Фонофорез проводят, используя специальную ванночку-векорасширитель, которую устанавливают на предварительно анестезированное глазное яблоко. Края ванночки заводят под веки, а в широкую часть наливают лекарственный раствор, который одновременно используется в качестве среды, обеспечивающей акустический контакт. При стойких хронических патологических изменениях различных структур глаза ультразвуковая терапия малоэффективна.
3.5.8. Влияние ультразвука на внутренние органы
Ультразвук в ряде случаев весьма эффективен при лечении болезней внутренних органов.
При ранних воспалительных поражениях печени ультразвук (0,88 МГц; 0,3...0,6 Вт/см2; 5...10 мин) оказывает нормализующее и противовоспалительное действие. В зрелом возрасте, особенно при гипокинезии и гепатозе, это действие проявляется значительно слабее.
Ультразвуковое воздействие (0,2,..0,4 Вт/см2) на область желчного пузыря усиливает его моторную активность. При хронических холециститах после лечения ультразвуком уменьшаются боли, исчезают диспептические явления, значительно уменьшаются или даже полностью восстанавливаются размеры печени.
Ультразвуковое воздействие (0,2...0,85 Вт/см2) на область желудка или соответствующую паравертебральную зону нормализует его моторную, эвакуаторную и секреторную функции. При гастрите, в частности у собак, ультразвук нормализует всасывательную функцию в среднем на 32 дня, а секреторную - на 37 дней раньше, чем в контроле. Эффективен ультразвук (0,2...0,6 Вт/см2) и при язвенной болезни.
Под влиянием низкочастотного ультразвука (44...65 кГц) иммунная система испытывает существенные изменения. Воздействие на область селезенки ультразвуковым инструментом с амплитудой 0,3...З мкм в течение минуты, повышая устойчивость иммунной системы к инфекциям, обеспечивает выживание, по крайней мере, 20 % животных в эксперименте после их заражения высоковирулентным штаммом коклюшных бактерий.
Интенсивность иммуногенеза в ответ на введение в организм антигена возрастает, если предварительно - за 24...48 ч - подвергнуть животное ультразвуковому воздействию. Интенсификация иммуногенеза, очевидно, обусловлена общей реакцией организма на внешнее неспецифическое воздействие и отчетливо проявляется в повышении содержания гемолизинов и гемгтлютининов в крови, а также повышении количества антител и розеткообразующих клеток в селезенке.
3.5.9. Лечение опухолей
Ультразвук низких интенсивностей (0,4...2,5 Вт/см2) редко применяется в онкологии. С одной стороны, он стимулирует иммунную систему, что в ряде случаев приводит к рассасыванию опухолей, в том числе и тех, которые не подвергались непосредственному воздействию ультразвуком, а с другой - интенсифицирует обменные процессы, ускоряя разрастание опухолевых тканей. Такая двойственность обусловливает определенную степень непредсказуемости, что и препятствует применению ультразвука низкой интенсивности в онкологии.
Ультразвук высоких интенсивностей (1000 Вt/cm2) способен полностью разрушить опухолевую ткань. При этом ввиду фокусирования область, где интенсивность ультразвука превышает порог разрушения, может быть весьма ограничена, что позволяет воздействовать на опухоль или ее фрагменты, не нарушая целостности окружающих здоровых тканей. Однако после разрушения новообразования весьма велика вероятность гибели организма от интоксикации продуктами распада опухоли, а разрушать ее по частям нельзя, так как оставшиеся фрагменты начинают бурно разрастаться, увеличивается и вероятность метастазирования.
Эффективность ультразвуковых методов в онкологии можно существенно повысить, комбинируя ультразвук с другими видами воздействия.
Значительно усиливает ультразвук низких интенсивностей действие противоопухолевых препаратов на клетки (см., например, разд. 3.2.5). Однако при введении в организм внутривенно, внутримышечно или перорально концентрация противоопухолевых препаратов в опухолях нередко оказывается ниже, чем в здоровых тканях.
Снижать количество вводимого в организм лекарства тоже нельзя, так как в низких концентрациях многие противоопухолевые препараты стимулируют злокачественный рост. Эти препараты вовсе не безвредны для организма и так же, как и в опухолях, подавляют или останавливают рост клеток в здоровых тканях.
При поверхностном расположении опухоли ультразвук может быть использован для фонофоретического введения противоопухолевых препаратов непосредственно в пораженную ткань. При этом он не только способствует накоплению препарата в опухоли, но и облегчает его проникновение внутрь клеток, поскольку увеличивает проницаемость клеточных мембран. Кроме того, благодаря синергизму ультразвука и противоопухолевых препаратов существенно интенсифицируется их действие.
Метод чрескожного фонофореза противоопухолевых препаратов, очевидно, непригоден для лечения новообразований, лежащих в глубине тканей. В этом случае для доставки препарата к опухоли можно использовать липосомы (см. подразд. 3.3.4). Доставленные током крови к прогретой ультразвуком опухоли липосомы именно здесь высвободят противоопухолевый препарат, который благодаря повышенной в результате ультразвукового воздействия проницаемости клеточных мембран будет депонироваться, в основном, в опухолевой ткани.
Аналогичный процесс, но значительно менее выраженный, наблюдается и при введении лекарственных препаратов непосредственно в кровь.
Сочетание ионизирующих излучений с ультразвуком низких интенсивностей, а также ультразвуком, обеспечивающим гипертермию опухолей, значительно повышает терапевтическую эффективность радиотерапии. Синергизм этих воздействий (см. подразд. 3.3.6) позволяет при тех же результатах в несколько раз снизить дозу лучевого воздействия и таким образом избежать сосудистых, воспалительных и других осложнений, наблюдающихся при традиционных способах радиотерапии.
Список литературы
- Аграненко ВА., Скачилова H.П. Гемотрансфузионные реакции и осложнения. М,: Медицина, 1986.
- Акопян В.Б. Лечит ультразвук. М,: Колос, 1983.
- Акопян В.Б. Физические основы ультразвуковой криобиологии // Доклады III национальной школы по криобиологии и лиофилизации. Смолян (Болгария), 1987.
- Акопян В.Б, Коржевеnко Г.Н, Шапгип-Березовский Г.Н. Скрытый резерв роста и развития живых систем //Вестник с.-х. науки, 1988.
- Акатов В.А., Париков В.А. Ультразвук и его применение в ветеринарии. М.: Колос, 1970.
- Александров В Я. Клетки, макромолекулы и температура. Л.: Наука, 1975.
- Вишневский В.И. Стимулирующий ультразвук и криоконсервирование // Криобиология, 1989. № 4.
- Гавашели T.B,t Акопян В.Б. Макаров С.Н Ультразвуковая резистентность эритроцитов рыбы при ртутном отравлении // Доклады ВАСХНИЛ. 1982. № 7.
- Гаврилов Л.Р.t Цирульников Е.М. Фокусированный ультразвук в физиологии и медицине. Л.: Наука, 1980.
- Кобахидзе З.В. Салдадзе МЛ. К теоретическим основам физиотерапии. Тбилиси: Сабчота Сакартвело, 1980.
- Криоконсервация спермы сельскохозяйственных животных. А.Д. Курбатов, Е.М. Платов, П.В. Корбан и др. Л.: Агропромяздат, 1988.
- Маргулис МЛ. Звукохимические реакции и сонолюминесцевия. М.: Химия, 1986.
- Молчанов Г.И. Ультразвук в фармации. М.: Медицина, 1980.
- Николаев ГА., Лощилов В.И. Ультразвуковая технология в хирургии. М.: Медицина, 1980.
- Нудыга В.П. Ультразвук в сельском хозяйстве. Краснодар; Краснодарское кн-е изд-во, 1975.
- Применение ультразвука в медицине. Физические основы / Пep. с англ.; Под ред. К. Хилла. М.: Мир, 1989.
- Tamapинов A.M.,Саулгозис Ю.} Янсон Х.А., Изменение скорости ультразвука и рентгенооптической плотности кости при физических нагрузках // Биомеханические исследования в травматологии и ортопедии. М.: Медицина, 1988.
- Улащик B.C., Чиркин А.А,. Ультразвуковая терапия. Минск; Беларусь, 1983.
- Флинн Г. Физика акустической кавитации в жидкости //Физическая акустика / Пep. с англ.; Под ред. У. Мэзона. М.: Мир, 1967.
- Фридман Ф.Е., Гундорова Р.А., Кодзов М.Б. Ультразвук в офтальмологии, М.: Медицина, 1989.
- Цыбров Г.Е, Ершов Ю.А.-, Швтнева Т.В. и др. Электрические явления при ультразвуковой аэрозольной обработке биологических тканей // Сообщения АН ГCCR 1989. № 1.
- Эльпинер И.К. Биофизика ультразвука. М.: Наука, 1973.
4. УЛЬТРАЗВУК В ХИРУРГИИ
Поиск и разработка методов снижения травматичности, кровопотери и болевых ощущений при хирургических операциях, методов, позволяющих ускорить заживление послеоперационных ран и рассасывание рубцов, а также методов, облегчающих труд хирурга-оператора, - важные задачи современной хирургии, решению которых способствует применение ультразвука.
Можно выделить две основные области использования ультразвука в оперативной хирургии. Это инструментальная ультразвуковая хирургия и локальные разрушения а глубине тканей с помощью фокусированного ультразвука.
4.1. ИНСТРУМЕНТАЛЬНАЯ УЛЬТРАЗВУКОВАЯ
ХИРУРГИЯ
За последние годы в практику стали широко внедряться физические методы хирургического воздействия с применением электрокоа-гуляционной, лазерной, криогенной и ультразвуковой техники.
4.1.1. Принцип действия ультразвуковых инструментов
Рабочая часть ультразвукового хирургического ножа имеет традиционную форму лезвия скальпеля, соединенного волноводом с магнитострикционным или пьезокерамическим преобразователем. Рабочая часть может иметь и другую форму в соответствии с требованиями выполняемой операции. Амплитуда колебаний режущей кромки в зависимости от поставленной задачи может быть изменена от 1 до 350 мкм, а частота выбирается в диапазоне от 20 до 100 кГц. Как известно, трение покоя больше, чем трение скольжения, поэтому трение между двумя поверхностями уменьшается, если одна из них совершает колебательные движения. Именно поэтому работа с ультразвуковыми инструментами требует от хирурга меньших усилий.
Характер разрушения тканей под действием ультразвукового хирургического инструмента зависит от строения его рабочей части, амплитуды и направления колебаний. Зависит он и от вязкоупругих свойств и однородности ткани.
При рассечении мягких тканей ультразвуковым ножом, лезвие которого совершает продольные ультразвуковые колебания, взаимодействует с тканью лишь кромка лезвия, обеспечивая процесс микрорезания, существенно усиливающего режущие свойства инструмента. Кроме того, у кромки лезвия колеблющегося инструмента выделяется теплота, локально повышающая температуру ткани и обусловливающая гемостатический эффект в результате термокоагуляции крови.
Так, применение ультразвукового скальпеля, амплитуда колебаний кромки которого лежит в интервале 15...20 мкм при частоте 44 кГц, в 6 8 раз уменьшает кровотечение из мелких и средних сосудов, в 4-6 раз снижает усилие резания, а также существенно облегчает строго послойное разделение кожи, подкожной жировой клетчатки и рубцово-измененного хряща. Очевидно, что если на инструмент наложены лишь продольные колебания, то его воздействие на стенки раневого канала минимально.
Для разрушения некоторых патологических образований используют специальные волноводы - дезинтеграторы, рабочий конец которых помимо продольных совершает и поперечные колебания. Такие инструменты оказывают существенное влияние па окружающие ткани и по мере введения инструмента разрушают их.
Ультразвуковые инструменты обладают явными преимуществами перед электро- или криохирургическими, так как не прилипают к ткани и поверхности раневого канала и не испытывают дополнительных травм. Ультразвуковой скальпель не уступает в ряде случаев и лазерному хирургическому инструменту, так как, ощущая сопротивление ткани при операции, хирург лучше контролирует процесс ее рассечения.
В зависимости от поставленной задачи ультразвуковые инструменты могут иметь самые разные размеры и форму.
Следует отметить, что при использовании ультразвукового хирургического инструмента наряду с гемостатическим эффектом наблюдаются также анальгетический и бактерицидный и/или бактериостатический эффекты.
Бактерицидный эффект позволяет использовать простую и оригинальную методику самостерилизации хирургического инструмента. Рабочую часть инструмента опускают в раствор дезинфектанта и включают генератор. Ультразвуковые колебания вызывают интенсивные микротечения жидкости вблизи инструмента, очищающие его поверхность. Кроме того, увеличивая проницаемость мембран клеток болезнетворных бактерий по отношению к дезинфицирующему веществу, ультразвук повышает эффективность его действия, что позволяет в 10 ~100 раз снизить концентрацию этого вещества в растворе. Если, например, лезвие ультразвукового скальпеля погрузить в бульон со стандартной культурой гемолитического плазмокоагулирующего стафилококка, после этого включенный инструмент подвергнуть двухминутной самостерилизации в разбавленном (0,025...0,5 %) растворе диоцида, выключить его и привести в соприкосновение с поверхностью кровяного агара, то число выросших микробных колоний окажется тем меньшим, чем выше была амплитуда колебаний инструмента (табл. 4.1).
Таблица 4.1
Число микробных колоний на агаре через 24 ч после соприкосновения с ультразвуковым инструментом, прошедшим двухминутную обработку в 0,05%-ном растворе диоцида
|
Амплитуда колебаний ультразвукового инструмента, мкм |
Число микробных колоний |
|
0 |
100 |
|
10 |
64 |
|
20 |
12 |
|
30 |
0 |
Контрольный смыв водой с ультразвукового лезвия, кантамивированного Е, coli, уже через 3 ч инкубации дает в питательной среде бурный рост культуры.
Если же загрязненный Е. coli нож, колеблющийся с ультразвуковой частотой и амплитудой 20...30 мкм, поместить на 1...2 мин хотя бы в дистиллированную воду, то последующий смыв с него не даст заметного роста культуры в течение 6...9 ч.
Чем выше амплитуда колебаний, тем более выражен эффект задержки роста культуры. Обработка вибрирующего с амплитудой 30 мкм лезвия в растворе диоцида (0,025 %) в течение 1,5 мин приводит к стерилизации инструмента.
Аналогичные данные были получены при стерилизации в растворе диоцида ультразвуковых инструментов, загрязненных средой, содержащей Вас. micoides.
На практике для стерилизации ультразвуковой инструмент, колеблющийся с максимальной амплитудой, опускают на несколько секунд в сосуд с любым дезинфицирующим раствором, например перекиси водорода.
4.1.2. Влияние ультразвукового хирургического
инструмента на рассекаемую ткань
Длина продольных акустических волн в мягких тканях и жидких средах в диапазоне хирургических ультразвуковых частот составляет 2...7,5 см. Следовательно, градиенты давлений, смещений, колебательных скоростей и ускорений в биологических тканях невелики (см. § 1.2). Поэтому клетки с размерами 10-3...10-4 см не испытывают в поле низкочастотного ультразвука практически никакого воздействия.
Значительно большее влияние на ткани могут оказывать поверхностные сдвиговые волны, возникающие в рассекаемых тканях под действием хирургического инструмента и быстро затухающие в тонком слое, граничащем с ультразвуковым инструментом, или на границах тканей с отличающимися сдвиговыми характеристиками.
Низкочастотные колебания ультразвукового хирургического инструмента даже при амплитудах, измеряемых микрометрами, вызывают увеличение проницаемости клеточных мембран тканей, соприкасающихся с инструментом.
В этом легко убедиться в модельных опытах на ткани картофеля. Производя ультразвуковым скальпелем надрезы на пластинках из клубня картофеля, можно видеть, что толщина слоя ткани с новы щепной к ионам йода проницаемостью клеточных мембран растет пропорционально амплитуде колебания инструмента и температуре ткани (рис. 4.1).
Под влиянием ультразвукового хирургического инструмента возрастет и скорость диффузии антибиотиков, цианакрилата и других веществ в костную и мягкие ткани,
Цианакрилат и некоторые другие клеи используются и хирургии для склеивания резаных ран, герметизации швов и в ряде других случаев. Однако между пленкой клея и тканыю начинают размножаться болезнетворные микробы, вызывая раздражение, нагноение и другие патологические изменения. Воздействие низкочастотным ультразвуком на клей способствует его внедрению в ткань и подавлению микрофлоры. Кроме того, ультразвук ускоряет полимеризацию клея, и соединение получается прочным. Метод склеивания мягких и костных тканей в ультразвуковом поле получил название ультразвуковой сварки. Использование этого метода значительно снижает вероятность послеоперационных осложнений. Пионерами разработки метода были ученые МГТУ им. Н.Э. Баумана.
Увеличение проницаемости клеточных мембран в тканях, подвергшихся действию ультразвука, не только способствует ускоренному введению лекарственных веществ в ткани, но и их депонированию.

Рис. 4.1. Увеличение проницаемости клеточных мембран в ткани клубня картофеля вдоль разрезов, произведенных ультразвуковым скальпелем (22 КГц) при температурах:
Амплитуда колебаний режущей кромки инструмента:
1 - 0 мкм; 2 - 10 мкм; 3 - 20 мкм; 4 - 40 мкм; 5 - 60мкм
Как известно, увеличение проницаемости цитоплазматическом оболочки - одно из начальных звеньев цепочки реакций, возникающих в клетках, тканях, органах и организме в целом (см. подразд. 3.2.7). Очевидно, что отдельными звеньями этой цепочки являются изменения активности ряда ферментов, обнаруженные в тканях, окружающих операционное поле. К таким ферментам относятся кислая фосфатаза гистиоцитов, щелочная фосфагаза и цитохромоксидаза лейкоцитов, цитохром-С макрофагов, НАД-Н и TOИ фибробластов, щелочная фосфатаза и АТФ-аза эндотелия капилляров, ацетилхолинэстераза нервных волокон и окончаний. Происходят также изменения в структуре и свойствах клеточных органелл, расширение кровеносных сосудов, увеличение кровоснабжения и, как следствие, ускорение репаративных и регенеративных процессов, а также обезболивание, повышение сопротивляемости организма болезнетворным микробам, заживление ран без грубых рубцов, нормализация функций организма в целом.
При повышении амплитуды колебаний ультразвукового хирургического инструмента возрастает и амплитуда поверхностных сдвиговых колебаний, и соответственно увеличиваются потери энергии на границах сред, отличающихся по своим сдвиговым характеристикам. Чем больше различия в этих характеристиках, тем больше потери акустической энергии, и тем больше теплоты выделится на границе сред.
Например, при практически равных объемно-упругих свойствах модули сдвига здоровых и патологических тканей могут быть больше или меньше в несколько раз. Это позволяет, используя специальные инструменты дезинтеграторы, производить селективную дезинтеграцию папиллом, ангиом, гемангиом и других новообразований до состояния аэрозоля, не нарушая целостности здоровых тканей.
Селективность ультразвукового разрушения наглядно проявляется на модели, состоящей из двух соприкасающихся слоев, например желатинового или агарового геля. Чем больше отличаются эти слои по содержанию воды, тем больше различие в их сдвиговых характеристиках. Результаты экспериментов на двухслойных гелях качественно совладают с результатами разрушения новообразований, граничащих со здоровой тканью. Механизм селективной ультразвуковой дезинтеграции новообразований может быть представлен в виде следующей цепочки: появление интенсивных сдвиговых волн на границе между слоями, отличающимися по модулю сдвига —> образование в зоне раздела разрывов, заполняемых микропузырьками газа рост и раскачка газовых пузырьков, приводящие к возникновению дополнительных разрывных усилий —> появление газовой фазы между слоями, локализующей ультразвуковое воздействие в пределах одного слоя—> селективная дезинтеграция.
Очевидно, что эффективность ультразвукового разделения слоев двухслойной полужидкой структуры и селективность разрушения слоя, в который введен волновод, зависят от различий в модулях сдвига утих слоев.
Способность ультразвука при достаточно высокой плотности энергии разрушать клетки тканей, эмульгировать жир, снижать эффективную вязкость веществ используется в липосакции - вакуумном удалении подкожного жира после его ультразвуковой дезинтеграции. Этот метод сегодня наиболее популярен при проведении хирургической коррекции фигуры. Последние исследования показали, что дезинтегрированный ультразвуком подкожный жир вовсе необязательно удалять искусственно. Он сам в течение нескольких дней всасывается в кровь без каких-либо дополнительных процедур или применения лекарственных препаратов и выводится естественным путем. Ультразвуковой метод одновременно подтягивает кожу делает се гладкой и эластичной.
Если твердое тело или ткань граничат с жидкой средой - водой, физиологическим раствором, раствором антибиотиков или других лекарственных веществ, то ультразвук вызывает в жидкости на границе раздела появление интенсивных потоков с большими градиентами скоростей. В результате этого поверхность очищается, а вещество из раствора быстро диффундирует в ткань. Этот эффект широко используется в хирургии для мытья медицинских инструментов, рук хирурга-оператора, для санитарной обработки полостей и ран,
Для санации полостей в организме или глубоких ран их заполняют раствором антибиотика и погружают в раствор ультразвуковой инструмент - дезинтегратор, рабочая часть которого представляет собой цилиндрический волновод диаметром в 3...5 мм. Для предотвращения травмирования инструментом слизистых оболочек в закрытых полостях, где визуальный контроль затруднен или невозможен, рабочий конец волновода ограждают устройством из крупноячеистой защитной сетки.
Если необходимо санировать поверхностные раны, то вокруг них выкладывают стенку из размягченного пчелиного воска или прижимают к коже, окружающей рану полый пластмассовый или стеклянный цилиндр, в который и наливают раствор антибиотика.
Иногда обработку раны проводят, постоянно подавая раствор лекарственного вещества так, чтобы слой раствора оказывался между волноводом и раневой поверхностью.
Под влиянием колеблющегося ультразвукового инструмента, введенного в раствор, в нем возникают неустойчивые кавитационные полости. Пульсации и схлопывание этих полостей приводят к появлению энергичных микротечений и ударных волн. Эта совокупность кавитационных эффектов обеспечивает смыв с поверхностей полостей и ран отмерших частиц тканей, фибринозных и других отложений, а также клеток болезнетворных микроорганизмов. Часть микроорганизмов разрушается в кавитирующей жидкости, часть гибнет под действием растворенного антибиотика.
Следует отметить, что после воздействия ультразвуком жизнеспособность оставшихся целыми бактериальных клеток заметно подавляется, резко снижается их способность размножаться и образовывать колонии, в 2-4 раза увеличивается чувствительность к действию большинства антибактериальных препаратов.
Обработка низкочастотным ультразвуком раневых поверхностей и слизистых оболочек через растворы фармакологических препаратов приводит не только к очистке и обеззараживанию поверхностей, но и к фонофорезу и депонированию лекарственных веществ в тканях. Кроме того, благодаря сосудорасширяющему действию ультразвука улучшается снабжение тканей кровью, ускоряются обменные процессы, активируются макрофаги, сокращаются сроки заживления ран, уменьшается вероятность осложнений. Например, при кишечнополостных операциях санация полости более чем вдвое сокращает число случаен гибели от перитонитов.
Совокупность эффектов, обусловливающих полезные свойства ультразвуковых инструментов, стала основой их применения в стоматологической практике. Ультразвук, использованный впервые в 1955 г. для удаления зубных камней, в дальнейшем стали применять для очистки, санации и шлифовки поверхности зубов. Разработаны специальные стоматологические методы фонофореза и электрофонофореза, позволяющие существенно повысить концентрацию лекарственных веществ в тканях, окружающих корень зуба.
Традиционные ультразвуковые инструменты оказались весьма полезными и удобными при челюстных операциях. Их кровоостанавливающее и аналгезирующее действие ярко проявляется при операциях на пронизанной кровеносными сосудами и богатой болевыми рецепторами слизистой рта.
Ультразвуковые ванны широко используются для санитарной очистки стоматологических инструментов, изделий зубных техников и т.д. Следует отметить и появление ультразвуковых зубных щеток, легко очищающих даже стойкий налет с поверхности зуба.
Применение низкочастотного ультразвука также весьма перспективно в ветеринарной хирургии. Наряду с использованием хирургического инструмента для оперативных вмешательств, санации ран и полостей, ускорения полимеризации биологических клеев для бесшовного соединения краев ран представляет интерес использование специальных ультразвуковых ванн для лечения ряда болезней копыт и копытец, приносящих ощутимый урон промышленному животноводству.
4.2. ХИРУРГИЧЕСКОЕ ВОЗДЕЙСТВИЕ ФОКУСИРОВАННЫМ УЛЬТРАЗВУКОМ НА ВНУТРЕННИЕ СТРУКТУРЫ ОРГАНИЗМА
Фокусированный ультразвук нашел применение в медицинской хирургической практике для решения ряда специфических задач. В практической ветеринарии он пока не используется, поскольку это требует стационарных условий и специальной техники. В то же время воздействие фокусированным ультразвуком широко применяется в практической медицине для разрушения небольших образований в глубине организма без травмирования окружающих тканей и нарушения целостности кожных покровов, а также в экспериментальной биологии для получения информации, необходимой при разработке новых методов диагностики и лечения.
4.2.1. Фокусирование ультразвука
Интенсивность ультразвука, излучаемого пьезопреобразователями, обычно не превышает 10 Вт/см2, поэтому если в некотором ограниченном объеме требуется получить ультразвук более высоких интенсивностей, его фокусируют, используя излучатели с вогнутой поверхностью, вогнутые отражатели ультразвука, ультразвуковые линзы или системы, состоящие из нескольких отдельных излучателей, управляемых с помощью компьютера и расположенных так, чтобы излучаемые ими ультразвуковые лучи пересекались в нужном месте пространства. Чаще всего используют керамический излучатель, представляющий собой часть сферы и фокусирующие ультразвуковую энергию в области центра кривизны излучающей поверхности (рис. 4,2).
Фокальная область представляет собой эллипсоид вращения, вытянутый в направлении распространения ультразвуковых поли. Диаметр фокального пятна зависит от частоты ультразвука и уменьшается с ее увеличением. Теоретически в среде, не поглощающей ультразвук, через фокальную область проходит не более 84% энергии от излучателя. Очевидно, что в тканях, коэффициент поглощения которых всегда отличен от нуля, эта величина еще меньше.
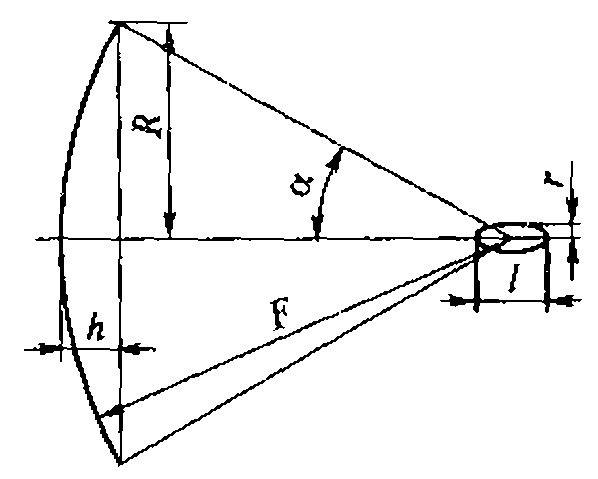
Рис. 4.2. Геометрические характеристики сферического излучателя и фокусированного ультразвукового ноля: R - радиус излучателя; F - фокусное расстояние; h - глубина; ![]() угол раскрытия; r и I радиус и длина фокальной области соответственно
угол раскрытия; r и I радиус и длина фокальной области соответственно
Точная форма области разрушения ткани зависит от ее структуры и свойств. В однородной ткани очаг разрушения по форме напоминает эллипсоид. Если же облучаемый участок состоит из различных тканей, отличающихся чувствительностью к ультразвуку, то предсказать заранее форму пораженной зоны оказывается весьма непросто. При воздействии на мозг, например, селективно может быть разрушено белое вещество, так как серое вещество и сосудистая система менее чувствительны к ультразвуку.
В последнее время в практику входят также фазированные решетки-излучатели, содержащие ряд отдельных пьезоэлементов, возбуждаемых поочередно в соответствии с особым алгоритмом. Такие электронно-управляемые решетки позволяют фокусировать ультразвук в нужном месте пространства.
Современные фокусирующие системы позволяют получать в фокальной области ультразвук с интенсивностью, измеряемой десятками тысяч Вт/см2,
Характеристики ультразвука в фокальной области легко оценить, зная размеры и радиус кривизны керамического преобразователя, а также частоту ультразвука и его интенсивность у излучающей поверхности. Так, радиус фокальной области определяют по формуле
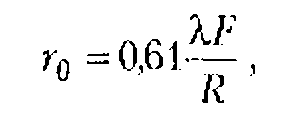
Где F расстояние от фокальной области до излучателя;
R - радиус кривизны излучателя;
![]() - длина ультразвуковой волны.
- длина ультразвуковой волны.
Длину фокальной области рассчитывают по формуле
![]()
где ![]() - угол раскрытия излучателя.
- угол раскрытия излучателя.
Интенсивность в фокальной области
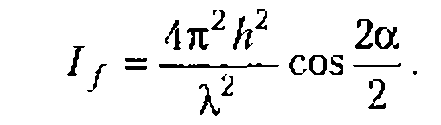
Если угол раскрытия не превышает 450 то максимальная интенсивность в центре фокальной области:
Сходясь в фокусе, ультразвуковые волны затем расходятся вновь. При этом знак кривизны фронта волны меняется на обратный (рис. 4.3). В самой фокальной области волну можно считать практически плоской и использовать для расчетов известные соотношения для плоской волны (см. §§ 1,1; 1,2).
Фокальную область излучателя совмещают с участком, который необходимо разрушить, используя стереотаксическую установку.
Воздух между излучателем и тканью, как известно, является непреодолимой преградой для ультразвука. Поэтому пространство между излучателем и поверхностью заполняют жидкостью в мешочке из тонкой резины. Чаще всего в качестве контактной жидкости используют дегазированную воду. В такой воде под действием ультразвука не выделяются пузырьки газа, поглощающие акустическую энергию.
Биологические эффекты существенно зависят от интенсивности фокусированного ультразвука, а измерить интенсивность в фокусе весьма непросто. Поэтому ее измеряют обычно в воде, акустические
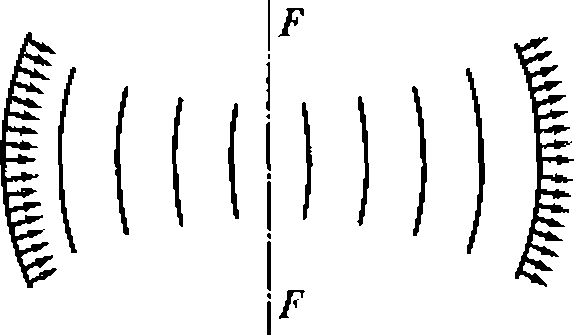
Рис. 4.3. Изменение знака кривизны фронта волны при переходе через фокус
характеристики которой близки к характеристикам биологических сред. Разработано много методов измерения интенсивности ультразвука, в том числе и фокусированного, но удобнее всего пользоваться радиометрическим методом, с помощью которого измеряют давление звука на пластинку, подвешенную к коромыслу весов и опущенную в воду.
Общая мощность излучателя W связана с действующей на поверхность пластинки силой F простым соотношением ![]() отражающей поверхности и соотношением
отражающей поверхности и соотношением ![]() поглощающей поверхности. Если силу измерять в граммах, то
поглощающей поверхности. Если силу измерять в граммах, то ![]() Средняя интенсивность в фокальной области
Средняя интенсивность в фокальной области
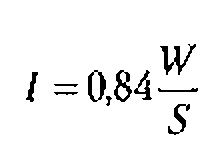
где ![]() - площадь поперечного сечения фокальной области. Коэффициент 0,84 указывает на то, что в фокальную область попадает 84 % всей энергии, излучаемой преобразователем.
- площадь поперечного сечения фокальной области. Коэффициент 0,84 указывает на то, что в фокальную область попадает 84 % всей энергии, излучаемой преобразователем.
4.2.2. Биологическое действие фокусированного
ультразвука
Действие фокусированного ультразвука на клетки и ткани обусловлено теплотой, выделяющейся при поглощении акустической энергии, и механическими возмущениями в среде. Оба фактора действуют совместно, однако, в зависимости от интенсивности ультразвука и условий воздействия, один из них может превалировать над другим.
Необходимо отметить, что порога биологического действия плоской ультразвуковой волны значительно ниже порогов действия фокусированного ультразвука на те же структуры. По-видимому, это обусловлено сравнительно малым объемом фокальной области. Известно, например, что кавитационная прочность воды и мягких биологических тканей при фокусировании ультразвука и уменьшении размеров области воздействия резко возрастает (см. § 1.13).
При относительно малых интенсивностях в фокальной области (0,4...300 Вт/см2) и импульсном режиме воздействия можно наблюдать возбуждение одиночных тканевых рецепторов и возникновение спайковой активности у черноморских скатов, раздражение центральных нервных структур виноградной улитки, слуховых рецепторов лягушки и человека и т.д. При несколько более высоких интенсивностях ультразвука или при большей длительности импульса наблюдается обратимое подавление активности нервных структур.
Инициирование обратимых изменений в отдельных структурах центральной нервной системы позволяет локализовать структуры, ответственные за тс или иные проявления в состоянии или поведении животного, а в дальнейшем и управлять его поведением. Можно также обратимо отключать соответствующие центры для проведения хирургических операций без применения анестетиков и наркотических средств.
Тепловые эффекты, обусловливающие стойкие, необратимые, гистологически регистрируемые изменения в фокальной области, возникают в тканях при интенсивностях ультразвука, измеряемых сотнями и тысячами Вт/см2, и чем выше интенсивность ультразвука, тем меньше времени требуется для разрушения ткани. Разрушения, вызываемые тепловыми эффектами, проявляются в тканях не сразу после воздействия ультразвуком, а спустя 2...3 мин и в последующие 15…20 мин продолжают увеличиваться в размерах.
Немедленные изменения «под лучом» возникают при интенсивностях ультразвука, превышающих пороги кавитации в мягких тканях. При этом кровотечение, разрывы и гомогенизацию тканей в фокальной области можно наблюдать и без применения тонких гистологических методов.
4.2.3. Использование фокусированного ультразвука в экспериментальной биологии и медицине
Возможность вызывать в тканях локальные обратимые и необратимые изменения с помощью фокусированного ультразвука широко используется на практике. В частности, бесконтактное ультразвуковое раздражение нервных структур на поверхности организма и в глубине тканей без нарушения целостности кожных покровов и, следовательно, без оперативного вмешательства позволило определить пороговые амплитуды смещения частиц среды, вызывающие возбуждение ряда нервных структур и обусловливающие разнообразные ощущения (табл. 4.2).
Таблица 4,2
Пороговые смещения, вызывающие возбуждения некоторых
нервных структур
|
Возбуждаемые структуры и ощущения |
Амплитуды смещении, мкм |
|
Рецепторы ушного лабиринта (лягушка) |
0,004 - 0,01 |
|
Тельца Пачини (коготка) |
0,03 - 0,05 |
|
Тактильные ощущения (человек) |
0,08-0,1 |
|
Ощущение тепла (человек) |
0,2 - 0,4 |
|
Ощущение холода (человек) |
0,4-0,6 |
|
Ощущение боли в кости (человек) |
0,13-0,16 |
|
Ощущение боли в коже (человек) |
0,24 - 0,5 |
|
Нарушение проводимости в нервных волокнах |
10-15 |
Часть исследований была выполнена на людях-добровольцах, и основном на авторах этих исследований, уверенных в невозможности случайного поражения жизненно важных нервных центров. Выбор объекта обусловлен тем, что только человек может сообщить о возникаюих у него ощущениях и описать их характерные особенности.
Раздражая ультразвуком чувствительные точки, можно вызвать практически все известные ощущения - прикосновения и боли, тепла и холода, щекотки и зуда; однако не все рецепторы качественно одинаковы. В одних, увеличивая интенсивность ультразвукового воздействия, можно последовательно вызвать тактильные, тепловые и болевые ощущения; в других - тактильные и тепловые; в третьих - только тактильные. Следовательно, используя фокусированный ультразвук, можно не только селективно воздействовать на отдельные рецепторные структуры, по и исследовать различия в реакции одних и тех же структур при дозированном изменении величины стимула.
Результаты исследования реакций одних и тех же рецепторов на разные ультразвуковые стимулы при различных температурах окружающей среды показали, что одни и те же воспринимающие нервные структуры обеспечивают ощущение тепла и холода, а появление того или иного ощущения зависит от соотношения температуры тела и температуры окружающей среды.
Исследования влияния фокусированного ультразвука на механорецепторы животных - тельца Пачини и слуховые рецепторы - позволили показать, что электрофизиологическая реакция этих структур возникает при механических смещениях окружаю/пей среды, составляющих сотые доли микрометра. Эти смещения в 100-1000 раз меньше размеров воспринимающих структур.
Весьма многообещающи результаты исследования возможности возбуждать с помощью фокусированного ультразвука рецепторы внутреннего уха у больных с нарушением звукопроводящих путей. При подаче к нервным окончаниям внутреннего уха сфокусированных высокочастотных ультразвуковых колебаний, модулированных сигналом звуковой частоты, глухие начинают слышать.
Ультразвуковые воздействия с интенсивностью, превышающей 30 Вт/см2, при определенных условиях могут вызвать обратимые изменения в проводимости нервных волокон. Температура тела при этом увеличивается не более чем на 1 0C.
Необратимое подавление нервной проводимости интенсивным фокусированным ультразвуком успешно используется для лечения весьма болезненных подкожных невром. Импульсный ультразвук с частотой 2,7 МГц и интенсивностью в фокальной области примерно 1700 Вт/см2 при воздействии на периферические нервы в непосредственной близости от невромы быстро снимает болевые ощущения.
Фокусированный ультразвук применяют в экспериментальной и практической медицине для торможения доброкачественного и злокачественного опухолевого роста.
Клетки опухолевых тканей разрушаются быстрее здоровых, что подтверждается гистологическими исследованиями. Через несколько дней после воздействия опухоли, как правило, размягчаются и уменьшаются в размерах. Ни роста опухоли, ни метастазирования или других отрицательных последствий после ультразвукового воздействия не наблюдается.
Следует, однако, отметить, что разрушение больших объемов опухолевых тканей часто приводит к летальному исходу в результате интоксикации организма продуктами тканевого распада. У выживших, как правило, наблюдается рассасывание остатков опухолевых тканей и полное выздоровление.
Хорошие результаты при лечении опухолевых патологий дает метод ультразвуковой гипертермии, основанный на том, чти клетки здоровой ткани выдерживают нагревание до более высокой температуры, чем клетки опухоли. Один или несколько фокусирующих излучателей позволяют обеспечить управляемый нагрев глубоко расположенных опухолевых тканей и достаточно длительное время поддерживать их при температуре, превышающей 42 0С.
Преимущество ультразвуковой гипертермии перед УВЧ - или СВЧ - нагревом состоит в том, что ультразвуковой нагрев может быть точнее локализован. Помимо чисто температурного, ультразвук обладает и цитотоксическим действием.
Механизм гибели клеток пол воздействием ультразвука при повышенных температурах практически не изучен, и лишь предполагается, что основной мишенью разрушающего действия ультразвука являются цитоплазматические мембраны. Вероятно, дальнейшие исследования позволят достичь максимальной эффективности при использовании фокусированного ультразвука для лечения заболеваний опухолевой этиологии.
Недавно был разработан новый эффективный метод уничтожения опухолей головного мозга, не поддающихся обычному хирургическому лечению. В его основе принцип разрушения патологического образования фокусированным ультразвуком. Для фокусирования энергии в нужном месте на черепе пациента располагают несколько относительно слабых источников ультразвука. С помощью компьютерной программы, в которую закладываются полученные с помощью томографии данные о структуре черепа и головного мозга пациента, рассчитываются направление и интенсивность ультразвуковых импульсов так, чтобы только в опухоли они создавали достаточно высокую плотность ультразвуковой энергии.
Одним из последних достижений в этой области можно считать разработку метода ультразвукового лечения рака простаты. Вся лечебная процедура заключается в проведении управляемого компьютером воздействия фокусированным ультразвуком на опухоль под местной анестезией. Каждый сеанс длится около 45 мин. Новый метод лечения рака предстательной железы требует всего двух сеансов, тогда как при радиационной терапии положительный эффект достигается при двадцатикратном облучении. Кроме того, ультразвуковой метод эффективнее и значительно безопаснее для больного и окружающих.
Фокусированный ультразвук можно применять при лечении болезни Меньера. Сущность болезни состоит в нарушениях во внутреннем ухе, что приводит к приступам головокружения. Ультразвук фокусируется на латеральном полукружном канале уха и разрушает определенные структуры в лабиринте. Для этого метода лечения очень важна точная дозиметрия, поскольку вблизи полукружного канала проходит лицевой нерв и разрушение этого нерва ведет к лицевому параличу. При удачном исходе операции пациенты на длительное время избавляются от головокружений.
Перспективен новый простой и безопасный способ мужской стерилизации, заключающийся в разрушении семявыводящего протока при помощи ультразвука. 13 отличие от традиционной вазэктомии, ультразвуковая стерилизация проводится без нарушения целостности покровных тканей. Семявыводящий проток фиксируют специальным зажимом, в который встроен излучатель ультразвука. Энергия ультразвука фокусируется под кожей на семявыводящем протоке, который в течение 20...50 с нагревается до 50°, что приводит к гибели клеток и образованию спаек, полностью перекрывающих просвет. Методика испытана на экспериментальных животных.
Весьма перспективно использовать ультразвук и для коррекции деятельности отдельных структур головного мозга. Так, неконтролируемые подергивания головы и конечностей, являющиеся симптомами болезни Паркинсона, можно ликвидировать, нарушив деятельность соответствующих глубинных участков мозга путем ультразвукового воздействия.
Вызванные с помощью фокусированного ультразвука локальные разрушения можно использовать не только для уничтожения патологических участков, но и для исследования роли отдельных структур мозга в процессе жизнедеятельности, а также для изучения структурных связей в центральной нервной системе. Возможно, в ходе исследований на животных будут намечены новые подходы к лечению ряда болезней человека, а также к управлению продуктивностью и поведением сельскохозяйственных животных.
Для воздействия фокусированным ультразвуком на мозг животного в его черепе заранее готовят трепанационное отверстие, так как прохождение ультразвука через неоднородную по структуре и неравномерную по толщине коего черепа приводит к сильной расфокусировке луча.
Однако в ряде случаев, в частности у крупных животных, удастся выбрать участки черепа без резких изменений толщины и кривизны, при прохождении через которые ее наблюдается существенных искажений формы ультразвукового поля и геометрии фокального пятна. Чем крупнее животное, тем легче найти на его черепе подходящие участки, так как у мелких животных весьма значительны изменения радиусов кривизны костей черепа и их толщины. При прохождении ультразвука через кости черепа мелких животных можно наблюдать смещение фокальной области от расчетного положения, расфокусировку и появление новых вторичных фокусов. Интенсивность ультразвука в этих вторичных фокусах значительно ниже, чем в главном, но нередко достаточна для того, чтобы вызвать повреждения и другие нежелательные биологические эффекты.
Использование фокусированного ультразвука в экспериментальной медицине и ветеринарии только начинается. Однако успехи, например, в лечении рака простаты, позволяют надеяться, что дальнейшие исследования дадут и руки экспериментаторам и практикам хороший инструмент воздействия на внутренние структуры организма без нарушения целостности покровных и окружающих тканей.
Список литературы
1 . Акопян В.Б. Лечит ультразвук. М,: Колос, 1983.
- А.с. 918840. Способ определения формы ультразвуковою ноля при биологических исследованиях / В.Б. Акопян, А.С. Дубовой, 1981.
- Гаврилов Л.Р„ Хэпд Дж. Разработка и экспериментальное исследование внутриполостной фазированной антенной решетки для ультразвуковой хирургии простаты // Акустический журнал. 2000. № 2.
- Гавралов Л.Р.} Хэпд Дж. Двумерные фазированные решетки для применения в хирургии: перемещение одиночного фокуса // Акустический журнал. 2000. № 4.
- Гаврилов Л.Р, Хэпд Дж„ Юшина Й,Г. Двумерные фазированные решетки для применения в хирургии: сканирование несколькими фокусами // Акустический журнал. 2000. № 5.
- Гаврилов Л,Р„ Цирульников Е.М. Фокусированный ультразвук в физиологии и медицине. Л.: Наука, 1980,
- Гладилин О.В., Догадов А.А. Фокусирующие излучатели ультразвука с электрически управляемой пространственно-временной структурой создаваемых полей // Акустический журнал. 2000. № 4.
- Дубров Э.Я. Рану лечит ультразвук // Компьютерные технологии в медицине. 1997. № 2,
- Цирульников Е.М., Гаврилов Л.Р., Дэвис И. О различных ощущениях кожной боли // Сенсорные системы. 2000.
- Николаев Г.А., Лощилов В.И. Ультразвуковая технология в хирургии. М.; Медицина, 1980.
- Применение ультразвука в медицине. Физические основы / Пер. с англ.; Под ред. К. Хилла. М.: Мир, 1989.
- Янсоп Х.А., Дзенис В.В., Татаринов A.M. Ультразвуковое исследование трубчатых костей / Рига: Зинатне, 1990.
5. УЛЬТРАЗВУК В БИОТЕХНОЛОГИИ
В основе всех ультразвуковых технологий лежат эффекты взаимодействия ультразвука со средой. Мощный ультразвук вызывает в жидких средах ряд специфических эффектов - кавитацию, интенсивные микро- и макропотоки, приводящие к быстрому и качественному перемешиванию компонентов среды, образованию стойких эмульсий, экстрагированию растворимых компонентов из находящихся в жидкости частиц, необходимо разрушению этих частиц.
Оборудование для ультразвуковых технологий условно подразделяется на две группы о зависимости от способа получения ультразвука. К первой относят оборудование, в котором используются относительно простые по конструкции жидкостные механические излучатели, позволяющие генерировать ультразвук достаточной для технологических целей мощности с частотами до 40 кГц.
Гидродинамические излучатели позволяют получать относительно недорогую ультразвуковую энергию и используются а тех случаях, когда не требуется монохроматичности и высокой интенсивности излучения.
В излучателях второго типа ультразвук возникает в результате превращения электрической энергии а механическую с помощью пьезоэлектрических или магнитострикционных преобразователей. Такие преобразователи дают, как правило, монохроматическое ультразвуковое излучение, что позволяет повышать их эффективность благодаря резонансным явлениям. Для увеличения интенсивности на высоких частотах используются ультразвуковые концентраторы, представляющие собой фокусирующие системы в виде вогнутых излучателей, а в низкочастотном диапазоне используют трансформаторы в виде стержней переменного сечения, позволяющие во много раз увеличивать амплитуду смещения излучающей поверхности. В отдельных случаях применяют также электроискровые излучатели, генерирующие в жидкости ударную волну.
5.1. УЛЬТРАЗВУК В ПИЩЕВОМ МАШИНОСТРОЕНИИ
Вопросам применения ультразвука в машиностроении посвящено немало монографий и публикаций в специальных журналах. Здесь мы ограничимся лишь перечислением основных задач биотехнологии, решаемых с использованием ультразвука.
В пищевом машиностроении ультразвук широко применяется при подготовке металлических поверхностей перед нанесением грунта, подготовке грунтованных поверхностей под нанесение красок, для полировки поверхностей, обезжиривания и очистки труднодоступных мест, деформационной правки и локальной рихтовки, повышения предела выносливости сварных соединений, их коррозионно-механической стойкости и долговечности, оперативного автоматизированного контроля геометрической точности штамиовой оснастки и деталей, повышения стойкости шлифовальных кругов на обдирочных и чистовых стадиях обработки посредством их оперативной ультразвуковой очистки от засаливания в процессе эксплуатации. Ультразвук эффективен в технологиях восстановления режущих свойств гибких полировочных кругов в операционных и межоперационных режимах, повышения классности и однородности полированной поверхности, повышения эмульсионной устойчивости смазочно-охлаждающих жидкостей и предотвращения их расслоения, повышения качества нарезания резьб метчиками, повышения стойкости метчиков и сверл малых диаметров, упрочнения галтелей и поверхностей, подвергаемых знакопеременному нагружению без применения термохимических и термических методов. Применение ультразвука ускоряет дробление стружки, защищает сверла от поломок в процессе сверления глубоких каналов, а также монтажа и демонтажа резьбовых и напряженных разъемных соединений, способствует повышению показателей конструкторско-технологической прочности композитных материалов на полимерном связующем, позволяет осуществлять сварку пластмассовых деталей.
5.2. ПРИБОРЫ УЛЬТРАЗВУКОВОГО КОНТРОЛЯ
Применение ультразвука для определения свойств, состава и строения веществ в промышленном производстве и в научных исследованиях основано на зависимости скорости и затухания ультразвуковых волн в объеме и поверхностном слое вещества от его состава и структуры, на законах отражения и рассеяния ультразвука па границах двух сред с различными акустическими свойствами, на изменении резонансных параметров твердых тел в зависимости от свойств окружающей среды. Акустические методы в ряде случаев позволяют заменить субъективную органолептическую оценку результатами объективного экспресс-анализа пищевых продуктов и сырья в технологических процессах их переработки.
5.2.1. Определение содержания белка, жира и минеральных веществ в биологических средах
Возможность определения состава биологических сред по их акустическим свойствам появилась благодаря точным методам измерения скорости распространения и коэффициента затухания ультразвука в малых объемах. Разработке этих методов предшествовали широкие исследования в области молекулярной акустики, выявившие общие закономерности, связывающие состав и структуру биологических жидкостей и тканей с их акустическими параметрами. Внедрение акустических методов в ветеринарную санитарию и технологии переработки продуктов животноводства позволяет заменить многие субъективные оценки результатами объективного экспресс-анализа мяса, молока и мясомолочных продуктов.
Исследования показали, что акустические характеристики белков, липидов, минеральных веществ и воды в тканях аддитивны, иными словами, зависят лишь от содержания каждого из этих компонентов при неизменной концентрации остальных. Кроме того, зависимость акустических свойств белка, жира и минеральных веществ от их концентрации, а также температуры существенно различается, что и позволяет одновременно измерять содержание каждого компонента в среде сложного состава.
В простейшем случае, например для раствора белка в воде, зависимость между скоростью распространения ультразвука (и) и концентрацией белка (![]() ) выражается соотношением
) выражается соотношением
![]()
где ![]() - скорость ультразвука в воде;
- скорость ультразвука в воде;
![]() - коэффициент связи между скоростью ультразвука и концентрацией белка.
- коэффициент связи между скоростью ультразвука и концентрацией белка.
Для смеси нескольких веществ - белков липидов, минеральных веществ уравнение примет вид:
![]()
где ![]() - концентрации белка, липидов и минеральных веществ;
- концентрации белка, липидов и минеральных веществ;
![]() - коэффициенты пропорциональности. Аналогичное уравнение можно записать для затухания ультразвука в растворе смеси веществ:
- коэффициенты пропорциональности. Аналогичное уравнение можно записать для затухания ультразвука в растворе смеси веществ:
![]()
Еще два уравнения, связывающие концентрации белка, липидов и минеральных веществ в биологической жидкости, можно получить, измеряя скорости ультразвука и коэффициенты его затухания при двух различных температурах - ![]()
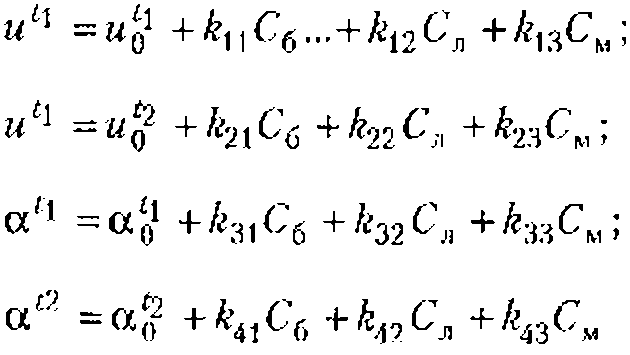
В этом случае при решении системы линейных уравнений измеряемые акустические параметры линейно зависят от концентрации в интервале от 0 до 5 %.
Аддитивность сохраняется при любых соотношениях белка, липидов и минеральных веществ, а коэффициенты в уравнениях легко определяются экспериментально. Используя приведенную выше систему уравнений, можно определить концентрацию основных компонентов биологических жидкостей.
Систему уравнений можно упростить, если учитывать не абсолютные значения ![]() , а их изменения:
, а их изменения:
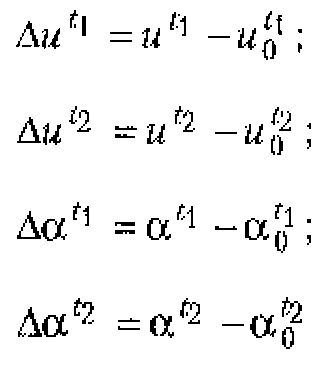
Решая уравнение относительно ![]() получаем
получаем
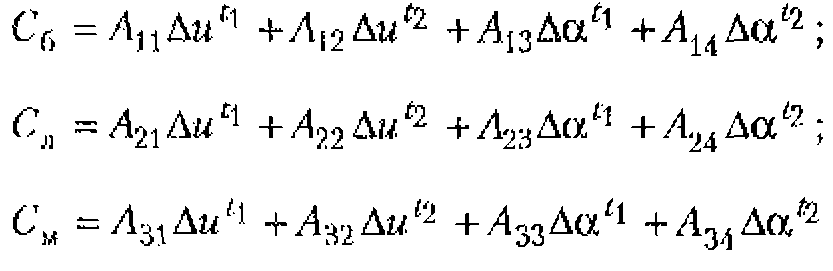
Специальные измерения при ![]() позволили определить значения коэффициентов:
позволили определить значения коэффициентов:
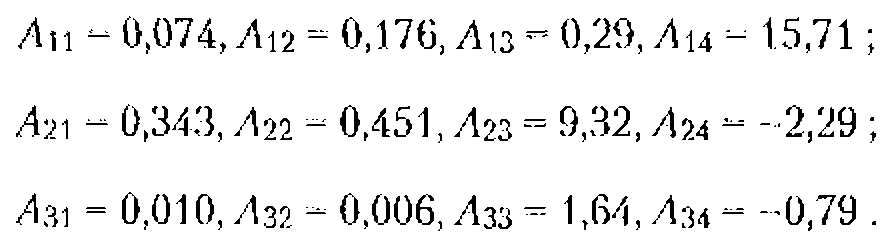
Подставляя эти коэффициенты и результаты измерений ![]() в последнюю систему уравнений, можно определить содержание белка, липидов и минеральных веществ в пробе.
в последнюю систему уравнений, можно определить содержание белка, липидов и минеральных веществ в пробе.
Во избежание ошибок измерения следует проводить в разбавленных (не более 5 %) гомогенатах, а результаты измерений умножать на коэффициент разбавления. Для приготовления гомогенатов предварительно измельченные кусочки мяса диспергируют, используя мощный низкочастотный ультразвук.
В некоторых случаях, например, при оценке качества молока, образец не требует предварительной подготовки, а измерения и расчеты можно существенно упростить, представив молоко в виде трехкомпонентной водной системы, содержащей белок, жир и сухие обезжиренные молочные остатки. Для подобных измерений на базе разработок Института биофизики РАН л Новосибирске создан удобный лабораторный прибор, позволяющий в течение нескольких минут в небольших (1 см3) образцах молока, мясного или колбасного фарша одновременно определить содержание жира, белка, минеральных веществ и воды.
5.2.2. Определение качества мяса в процессе его созревания
Определение качества мяса - одна из важнейших задач ветеринарно-санитарной экспертизы. Переход животноводства па промышленную основу и связанные с этим изменения условий содержания животных привели к появлению нестандартной продукции. Мясо одних животных отличается повышенной жесткостью, в мясе других не протекают процессы созревания.
Рутинные методы определения свежести мяса и степени его созревания либо весьма трудоемки и длительны, либо основаны на органолептике и, следовательно, необъективны.
Выгодно отличается от них ультразвуковой метод, позволяющий измерять сдвиговые характеристики, в частности сдвиговую вязкость биологических тканей.
Принцип действия ультразвуковых вискозиметров прост и основан на зависимости характера колебаний контактирующего со средой вибратора от ее вязкости.
Датчик' прибора для измерений вязкоупругих свойств тканей представляет собой стержень, торец которого совершает крутильные колебания (рис. 5.1). Контакт с исследуемой средой обусловливает дополнительные потери энергии колебаний, затрачиваемой на возбуждение в среде поверхностных волн. Такие потери энергии приводят к уменьшению амплитуды вынужденных колебаний вибратора или более быстрому затуханию его свободных колебаний. Изменяется и частота резонансных колебаний.
Потери энергии вибратора пропорциональны ![]() (
(![]() - плотность, а
- плотность, а ![]() — коэффициент сдвиговой вязкости среды). Следовательно, ультразвуковой сдвиговый вискозиметр позволяет исследовать и контролировать кинетику процессов в среде (в частности, в биологических тканях), сопровождающихся изменениями одного из этих параметров.
— коэффициент сдвиговой вязкости среды). Следовательно, ультразвуковой сдвиговый вискозиметр позволяет исследовать и контролировать кинетику процессов в среде (в частности, в биологических тканях), сопровождающихся изменениями одного из этих параметров.
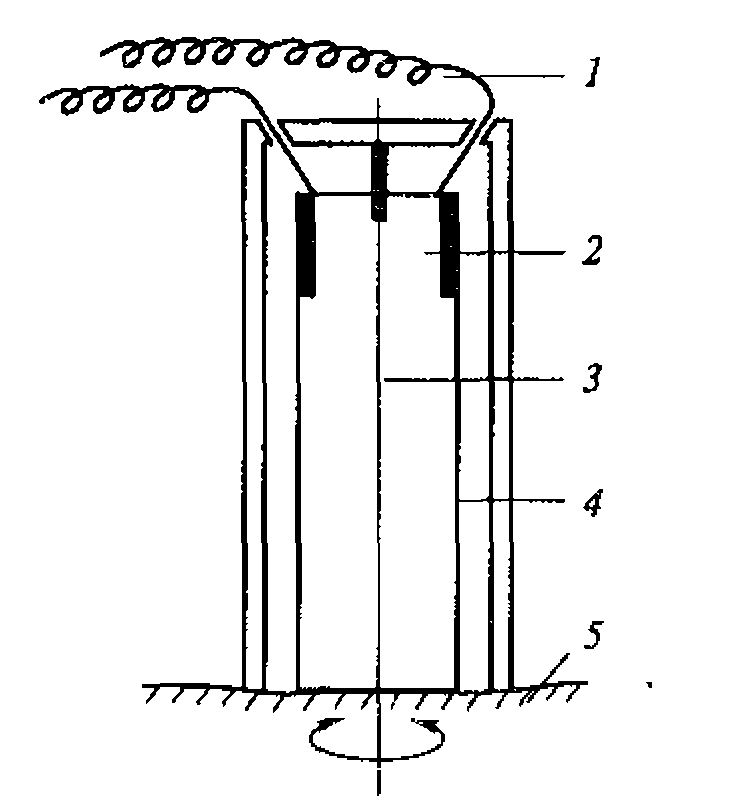
Рис. 5.1. Датчик прибора для измерения вязкоупругих характеристик мягких тканей, с помощью крутильных колебаний:
1 электрическое соединение датчика с измерительным устройством; 2 - креплении стержня к корпусу; 3 - стержень из пьезоэлектрического материала, совершающий крутильные колебания; 4- корпус датчика; 5- исследуемая ткань.
И если плотность тканей животных близка к плотности воды и меняется в весьма ограниченных пределах, то сдвиговая вязкость существенно изменяется при нарушении межклеточных контактов, при чрезмерной гидратации или дегидратации тканей.
Созревание мяса проходит в несколько стадий. Сразу же после убоя мышцы, лишенные управляющих сигналов, расслабляются. Однако примерно через 3 ч мышечные волокна начинают сокращаться, вызывая развитие напряжения во всей системе мышц. Сокращение мышц (трупное окоченение), обусловленное распадом АТФ, достигает максимального развития через 10... 12 ч после убоя. Трупное окоченение обычно проходит через 2...3 суток.
Скорость процесса зависит от температуры, замедляясь по мере охлаждения мяса. При замораживании в мышечной ткани возникают кристаллы льда, рассекающие или сильно деформирующие мышечные волокна, а также нарушающие целостность клеточных мембран. При последующем размораживании из мяса выделяется сок, что приводи т к его частичной дегидратации. При хранении мяса в неподходящих условиях в нем могут возникнуть и развиться процессы гниения, сопровождающиеся изменением структуры мышечных волокон, ослаблением механической связи между ними и т. д. Консистенция мяса изменяется, и оно становиться мягким.
Рис. 5.2. Изменение вязкости мяса при хранении
Все стадии процессов, протекающих в мясе при созревании или хранении, имеют четко выраженные морфологические особенности, а сами процессы сопровождаются характерными изменениями вязкоупругих свойств мышечной ткани (рис. 5.2).
Следует отметить, что непосредственно после убоя мясо различных животных одного вида может существенно отличаться по своим вязкоупругим характеристикам. Однако эти различия постепенно уменьшаются по мере созревания мяса и становятся пренебрежимо малыми через 30,,.40 ч. Чем выше начальное значение вязкости, тем меньше изменения вязкости в процессе трудного окоченения (табл. 5.1).
Это становился попятным, если учесть, что в момент убоя состояние животных и, следовательно, напряжение их мышц, скорость биохимических процессов и содержание АТФ в мышечной ткани могут быть разным, и очевидно, что эти различия становятся пренебрежимо малыми после распада АТФ и разрушения сократительных структур.
Таблица 5.1
Наибольшие и наименьшие значения вязкости мяса кроликов в разные периоды созревания
|
|
Вязкость мясо, ПЗ |
Различия между максимальными и минимальными значениями | |
|
Время после убоя, ч. |
Максимальное значение |
Минимальное значение | |
|
10 |
19 |
6 |
13 |
|
12 |
20 |
4 |
6 |
|
30 |
13 |
8 |
4 |
Мясо животных разных видов имеет разную начальную вязкость, которая зависит и от возраста животною, и от условий его содержания и кормления. Отличаются по вязкости и мышцы разных групп одного и того же животного.
Сравнение возможностей ультразвуковой вискозиметрии с рутинными методами оценки качества мяса - но запаху, по прозрачности и аромату бульона, по прозрачности бульона после добавления в него CuS04 но изменению рН - показало, что сдвиговая вискозиметрия, как сама по себе, так и в комплексе с известными методами, позволяет легко и быстро оценивать качество мяса при его созревании, хранении, переработке.
Другой акустический измерительный прибор, измеряющий поглощение поверхностных крутильных колебаний, дает возможность оценить качество мяса и желированных пищевых форм, проследить за процессом созревания мяса и формированием желеобразного состояния ряда продуктов по их вязкоупругим свойствам.
Изменение консистенции молочных продуктов - сметаны, йогуртов, кефира, а также сыров в процессе их приготовления и (или) хранения удобно отслеживать по поглощению и скорости распространения поверхностных волн. Прибор с точечными датчиками (рис. 5.3), не разрушающими поверхность исследуемого объекта, позволяет даже сквозь упаковку в течение нескольких секунд определить не только степень готовности различных сыров, йогуртов, сметаны и других продуктов сходной консистенции, по и наличие в их теле посторонних включений, в том числе областей, пораженных плесенью. Кроме того, он дает возможность определить степень заполнения упаковок из непрозрачных материалов, например жестяных банок.
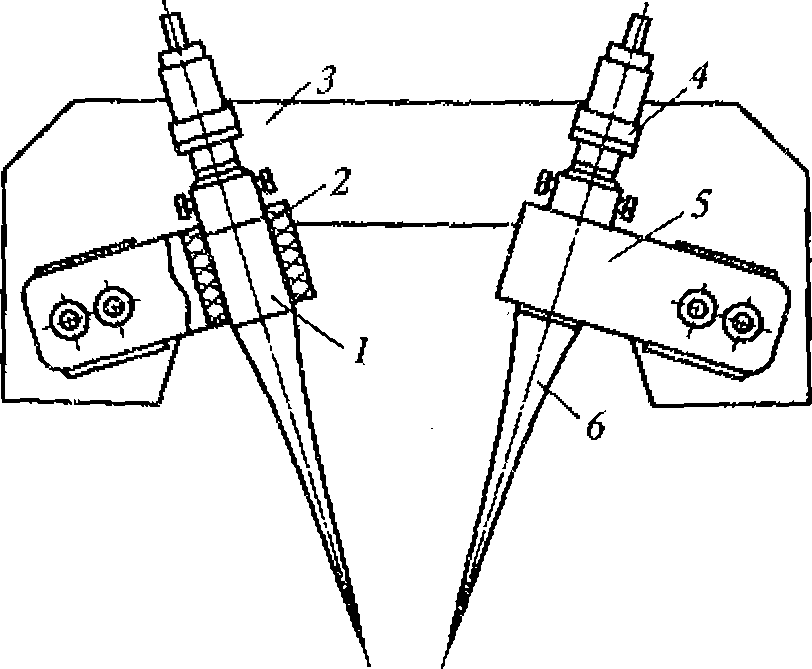
Рис. 5.3. Точечные датчики с фиксированным расстоянием между преобразователями для измерения поглощения и скорости распространения поверхностных волн:
1,6 - датчики; 2 демпфирующая прокладка; 3 обойма держателя; 4 - электрический разъем; 5 основание датчика
Для измерения вязкости в пищевой промышленности удобны ультразвуковые вискозиметры, позволяющие непрерывно регистрировать ее изменения в технологических процессах. Эти и другие акустические приборы, предназначенные для измерения физико-химических свойств пищевых веществ и их композиций, а также состояния оборудования, например уровня заполнения бункеров, наличия механических дефектов и ответственных деталях технологических узлов, толидины органических и неорганических отложений на внутренних стенках рабочих емкостей и труб и т. д., широко применяются в пищевой промышленности.
5.3. УЛЬТРАЗВУКОВАЯ ОЧИСТКА
Использование ультразвука позволяет не только ускорить процесс очистки, но и получить высокую степень чистоты рабочих поверхностей, а также заменить ручной труд и исключить применение пожароопасных и токсичных растворителей. Процесс ультразвуковой очистки обусловлен рядом специфических явлений в жидкости, вызванных действием интенсивного ультразвука: кавитацией, энергичными микропотоками, акустическим давлением, звукоканиллярным эффектом. Качество очистки зависит от частоты колебаний, плотности акустической энергии и формы поля, свойств моющей жидкости и прочности связи загрязняющих веществ с очищаемой поверхностью. Ультразвук значительно повышает активность микроорганизмов, токсических для соединений, что позволяет на один-два порядка снизить концентрацию антибактериальных препаратов при санитарной обработке агрегатов машин но переработке пищевых продуктов. Ультразвуковая очистка осуществляется, как правило, в ваннах различной емкости с встроенными в дно излучателями. Эти ванны широко применяются для очистки оборотной стеклянной тары, труб, сменных узлов машин, а также хлебопекарных и прочих поддонов и емкостного оборудования, что стало возможным благодаря разработке новых мощных и экономичных погружных преобразователей.
Специальное ультразвуковое оборудование позволяет осуществлять мойку зерна перед помолом или проращиванием, в течение нескольких секунд избавиться от осадка, а также от «масок» и «сеток» на внутренней поверхности бутылок с шампанским, не меняя его потребительских качеств, провести санитарную очистку оборотной тары и поверхности яиц, предназначенных для использования без тепловой кулинарной обработки и т. д.
Ультразвуковая очистка поверхностей вовсе не всегда сопровождается их полной санацией - освобождением от патогенной и другой микрофлоры. Для решения этой задачи чаще используют комбинированное воздействие ультразвуком и наиболее подходящим для решения конкретной задачи веществом, обладающим бактерицидным действием, При комбинированной очистке концентрацию бактерицидного вещества в растворе можно существенно понизить, гак как ультразвук обладает способностью усиливать действие тех или иных препаратов на биологические системы. Однако в ряде случаев, в частности в пищевой индустрии, считается недопустимым использование моющих или бактерицидных веществ, даже следовые количества которых могут изменить объективные или органолептические показатели продукта.
Особый интерес представляет проблема очистки поверхности скорлупы куриных яиц, где нередко обнаруживаются клетки сальмонеллы, вызывающей тяжелое заболевание у людей. Наибольшей тщательности требует санация поверхности яиц, предназначенных для приготовления блюд, рецептура которых исключает тепловую кулинарную обработку.
Разработка и реализация способа обеззараживания поверхности скорлупы куриных яиц, предназначенных для использования в кулинарных целях, стали возможными благодаря ультразвуковым эффектам, обеспечивающим смывание с поверхностей и разрушение суспендированных в жидкости живых клеток со скоростью тем большей, чем выше плотность ультразвуковой энергии в среде. Верхний предел по мощности ограничен не только современными техническими возможностями, по и прочностью скорлупы, а также необходимостью минимизировать влияние ультразвука на содержимое яйца: исключить его взбалтывание, денатурацию белка и разрушение биологически активных соединений, а также по возможности снизить вероятность фонофореза в яйцо загрязняющих или бактерицидных веществ сквозь неповрежденную скорлупу.
Для обеззараживания скорлупы яиц можно использовать стандартную ультразвуковую ванну (22 кГц), содержащую воду с растворенным в ней озоном. Слишком быстрое разрушение озона в ультразвуковом поле предотвращается легким подкислением воды в ванне соляной или уксусной кислотой. Плотность энергии ультразвука в среде составляет 5 • 104 Вт/м3. В процессе ультразвуковой обработки температура среды не должна повышаться более чем на З...4 °С.
Исследование эффективности обеззараживания, проведенное на двух наиболее стойких к внешним воздействиям штаммах сальмонелл тифимуреум и дублин, нанесенных на поверхность скорлупы в концентрациях, на два порядка превышающих значения, характерные для заражения в обычных условиях, показали высокую эффективность ультразвуковой очистки. Для обеззараживания кассету с яйцом предварительно помещают на 2 мин в подкисленный до рН 4 водный раствор озона (8,5 мг/л), а затем в течение последующих двух минут подвергают действию ультразвука.
Весьма перспективно применение новых ультразвуковых технологий для регенерации насыпных фильтрующих материалов, например кизельгура, используемого для осветления пива, песчаных фильтров на станциях очистки питьевой воды и пр,
5.4. УЛЬТРАЗВУКОВАЯ ИНТЕНСИФИКАЦИЯ ПРОИЗВОДСТВЕННЫХ ПРОЦЕССОВ
Некоторые процессы в биотехнологии - экстрагирование, суспендирование, фильтрование и даже приготовление смесей нередко требуют много времени для получения качественного продукта и могут быть интенсифицированы ультразвуком.
5.4.1. Эмульгирование
Ультразвуковое эмульгирование позволяет получать высокодисперсные, стойкие, практически однородные эмульсии без добавления эмульгаторов, стабилизаторов и других химических веществ.
Эмульгирование в поле ультразвука обусловлено кавитацией, условия возникновения и развития которой зависят от параметров ультразвука - мощности, частоты, формы поля, а также состояния среды - вязкости, температуры, природы и количества растворенных в жидкости газов, давления. Применение ультразвуковых реакторов с магнитострикционными или пьезокерамическими преобразователями позволяет получать практически монодисперсную эмульсию. Качество эмульсии, полученной в установках с гидродинамическими преобразователями, ниже, но их производительность в десятки раз выше эмульгаторов с электромеханическими преобразователями.
Водно-масляные эмульсии, полученные с применением ультразвука, используются в хлебопекарном производстве для смазывания поддонов, в колбасном и кондитерском производстве, при изготовлении косметических композиций.
Ультразвуковая гомогенизация мороженого существенно улучшает его вкус, а гомогенизация молока придает ему новые свойства, необходимые для интенсификации производства кисломолочных продуктов, сухого и сгущенного молока, сливок и т.д. Использование отходов молокоперерабатывающих заводов, отходов переработки сои, непригодного для питания человека растительного масла и некоторых других веществ позволяет с помощью ультразвуковых технологий получать заменители цельного молока для выпаивания молодняка сельскохозяйственных животных.
5.4.2. Диспергирование
Ультразвуковое диспергирование подразумевает размельчение твердых тел в жидкой среде и происходит при воздействии ультразвуком на суспензии твердых частиц или их агрегаты. Применение ультразвука позволяет на несколько порядков увеличить дисперсность продукта по сравнению с диспергированием без применения ультразвука. Процесс диспергирования обусловлен ударными волнами, возникающими при захлопывании кавитационных полостей. Скорость диспергирования зависит от мощности ультразвука, свойств жидкости и диспергируемого вещества. Эффективность ультразвукового диспергирования значительно повышается, если наряду с действием ультразвука жидкость подвергнуть статическому давлению. Ультразвуковые диспергаторы-гомогенизаторы широко используются для приготовления суспензий сухих пряностей, которые значительно легче, чем порошок, равномерно вносить в пищевые формы для приготовления фруктово-ягодных пюре, гомогенизации шоколадной и пралиновой масс.
Новые конструкции ультразвуковых диспергаторов позволяют существенно повысить производительность процессов с одновременным снижением энергетических затрат.
5.4.З. Экстрагирование
Экстракция - один из наиболее распространенных методов, используемых в процессе получения биологически активных веществ из растительного или животного сырья. Все процессы экстракции лимитирует диффузия на границе раздела фаз через диффузионный слой с градиентом концентраций экстрагируемого веществу. Использование перемешивающих устройств не дает существенного улучшения межфазного массопереноса.
Несмотря на бурное развитие производства синтетических пищевых ароматизаторов, вкусовых добавок и нутрицевтиков, еще очень многие биологически активные вещества получают из природного растительного или животного сырья.
Экстрагирование биологически активных веществ наиболее продолжительная стадия переработки сырья. Традиционные методы экстракции нередко занимают часы, сутки или даже педели. Использование ультразвука позволяет значительно ускорить процесс экстракции, увеличить выход и снизить себестоимость экстрагируемого вещества, улучшить условия труда и повысить его производительность. Однако увеличение мощности и размеров излучателей традиционной конструкции (стержневого или мембранного типа) приводит к возрастанию неоднородности ультразвукового поля и сильной кавитации в отдельных зонах поля излучения, обусловливающей возникновение в жидкости химически активных частиц, ударных волн и микропотоков с высокими градиентами скоростей. В этих условиях наблюдается инактивация многих биологически активных веществ; энзимов, витаминов и т. д.
Для совершенствования технологии и испытания ультразвукового оборудования необходим дешевый субстрат, позволяющий моделировать основные особенности процесса. Хорошей моделью для таких исследований являются пшеничные отруби, богатые крахмалом. Частицы отрубей с хорошим приближением можно рассматривать как двумерный источник высокомолекулярных труднорастворимых компонентов (тонкие чешуйки с удельной поверхностью, мало изменяющейся в процессе экстракции макромолекул) и пренебречь изменениями условий диффузии в твердой фазе.
Основными извлекаемыми компонентами являются биополимеры - белки и углеводы, а также водорастворимые витамины. Крахмал повсеместно распространен в растительных материалах и представлен амилозой и труднорастворимым амилопектином, Пшеничные отруби содержат 60 % углеводов (в основном крахмала), 15 % белка, У % клетчатки, 12 % воды, остальное - липиды и соли.
В реакторе с лопастной мешалкой при температуре 75...800C в нейтральной среде концентрация крахмала в жидкой фазе в течение 15...60 мин остается постоянной (и соответствующей 10...11 % массы отрубей). Добавление щелочи до рН 9,5-10,0 позволяет увеличить выход компонентов до 52…57%.
В ультразвуковом реакторе, конструкция которого исключает образование зон коллективных кавитационных явлений, значительно повышающих опасность инактивации биологически активных веществ, при экстракции водой в течение нескольких мину т из отрубей извлекается 59...60% сухих веществ. Эта величина практически совпадает с величиной углеводов в отрубях. При повышении рН среды до значений 7,5-8,0 из отрубей экстрагируется до 70,5 % сухих веществ, что связано с дополнительной экстракцией белков (рис. 5.4),
Увеличение скорости экстракции почти вдвое объясняется изменением диффузионного сопротивления пограничного слоя, вязкость которого зависит от растворимости экстрагируемых макромолекул и их межмолекулярного взаимодействия.
Рис. 5.4. Экстракция биополимеров из пшеничных отрубей:
1-е механическим перемешиванием (рН 6,5); 2 - в стандартной ультразвуковой ванне (рH 6,5); 3 - в ультразвуковом реакторе (рН 6,5); 4 - в ультразвуковом реакторе (рН 7,5 - 8,0)
В ультразвуковом поле наряду с крупном масштабными акустическими течениями у границ раздела фаз возникают мелкомасштабные вихревые потоки, характеризующиеся значительными градиентами скоростей, диссипацией энергии и локальным нагревом жидкости. Эти факторы ускоряют диффузию макромолекул в результате турбулентной диффузии и снижения вязкости раствора.
В эфиромасличном и пищевом производствах, в производстве соков из плодов и ягод применение ультразвука весьма перспективно, так как ни одно из этих производств не обходится без извлечения из природного сырья физиологически активных соединений, пищевых красителей, масел, отдушек, Сахаров и т. д.
Ультразвук, разрушая и гомогенизируя ткани, облегчает извлечение из них тех или иных ценных веществ. Обработка мощным ультразвуком рыбного фарша, например, существенно увеличивает выход рыбьего жира, воздействие на семена масличных культур увеличивает выход растительного масла, использование ультразвука перед прессованием винограда в ряде случаев на 10 % увеличивает отдачу сока и снижает энергетические затраты на его отделение, усиливается и интенсивность окраски сока при прессовании красных сортов винограда. Вкусовые качества виноградного сока при этом не меняются. В пищевой промышленности ультразвуковые экстракторы применяют, например, для приготовления экстрактов черного перца и других пряностей, используемых в производстве мясных и других продуктов, пищевых красителей и т. д.
Возможности существенною повышения эффективности экстракционных технологий и аппаратов в результате применения ультразвука далеко не исчерпаны. При этом снижается потребность в химических добавках, а новые принципы конструирования излучателей уменьшают вероятность инактивации БАВ.
Следует отметить, что помимо процессов экстракции ультразвук способен значительно ускорять и процесс пропитки экстрагентом растительного и животного сырья, что позволяет интенсифицировать процесс замачивания предварительно высушенного сырья, посола мяса, обработки рыбы в коптильной жидкости и т, д.
5.4.4. Осветление
Для осветления напитков, растительных масел, других жидких пищевых продуктов широко применяется фильтрование, эффективность которого существенно повышается под влиянием ультразвука, ускоряющего транспорт сквозь пористые материалы. Кроме того, используя способность ультразвука удалять с поверхностей различные отложения, можно создать самоочищающиеся ультразвуковые фильтры с относительно низким сопротивлением течению фильтрующимся средам, не повышающимся в процессе эксплуатации.
Самоочищающийся фильтр, принцип действия которого основан на интенсификации массопереноса в ультразвуковом поле, позволяет эффективно разделять жидкости и взвешенные в них частицы нерастворимых веществ. Конструкция фильтра дает возможность осуществлять ускоренный непрерывный процесс фильтрования, обеспечивать самоочищение фильтрующего элемента акустическими микропотока ми, эвакуировать отделяемую фракцию твердых частиц, повышать экономическую эффективность производства.
Интенсификацию фильтрования обычно осуществляют, управляя образованием осадка. Однако, если не осадок, а фильтрат представляет собой производственную ценность, в ряде случаев удобно воспользоваться способами, предотвращающими образование осадка. Ультразвуковому воздействию здесь нет альтернативы.
В идеализированном случае скорость фильтрования определяют по формуле
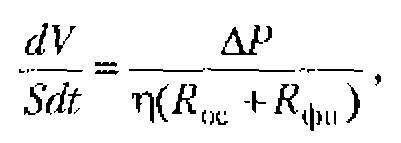
где V- объем фильтрата;
S- площадь фильтрующей перегородки;
t - время;
![]() - разность давлений по обе стороны фильтрующей перегородки;
- разность давлений по обе стороны фильтрующей перегородки;
![]() - вязкость жидкой фазы;
- вязкость жидкой фазы;
![]() - гидродинамическое сопротивление слоя осадка;
- гидродинамическое сопротивление слоя осадка;
Рис. 5.5. Ультразвуковой друк-фильтр:
1 - выход фильтрата; 2 - вход фильтруемой жидкости; 3- излучатель ультразвука; 4 - корпус: друк-фильтра; .5 - фильтрующий элемент
![]() - гидродинамическое сопротивление фильтрующей перегородки.
- гидродинамическое сопротивление фильтрующей перегородки.
Очевидно, что ![]() меняется в процессе фильтрования. И случае постепенного закупоривания пор
меняется в процессе фильтрования. И случае постепенного закупоривания пор ![]() фильтра пропорционально объему прошедшей через фильтр жидкости в степени 3/2.
фильтра пропорционально объему прошедшей через фильтр жидкости в степени 3/2.
Ультразвуковая интенсификация фильтрования наиболее наглядно иллюстрируется на друк-фильтре, простом по конструкции, но с высокими требованиями к качеству фильтрата (рис. 5.5). Эффект особенно очевиден, если задача заключается в предотвращении закупоривания пор фильтрующего элемента и ускорении процесса стерилизующего фильтрования инъекционного медицинского или ветеринарного препарата, представляющего собой раствор комплекса лекарственных веществ.
При фильтровании без ультразвука под действием разности давлений на фильтрующей перегородке 105. На скорость процесса за 20...30 мин уменьшается до пренебрежимо малых значений. За это время сквозь фильтрующую перегородку диаметром 32 см, типа «Владипор», с размерами пор в 0,2 мкм проходит не более 2...3 л раствора.
Под действием ультразвука с частотой 35 кГц и с плотностью энергии в объеме друк-фильтра 2…4 кВт/м3 начальная скорость фильтрования увеличивается примерно вдвое и остается на том же уровне в течение 8 ч, что позволяет за смену фильтровать около 200 л суспензии. Фармакологическая активность препарата в результате его обработки ультразвуком не меняется, а прошедшая ультразвуковой фильтр жидкость полностью обеззараживается и отвечает требованиям, предъявляемым к инъекционным препаратам.
Ультразвуковое поле в объеме друк-фильтра благодаря особой конструкции излучателя организовано так, чтобы фильтрующий элемент оказался вне зоны кавитации, а микропотоки активно смывали образующийся па фильтрующей перегородке осадок. В результате такого воздействия гидродинамическое сопротивление осадка ![]() остается равным нулю в течение всего процесса фильтрования, а сопротивление фильтрующей перегородки
остается равным нулю в течение всего процесса фильтрования, а сопротивление фильтрующей перегородки ![]() уменьшается благодаря снижению диффузионных ограничений у поверхности фильтрующей перегородки.
уменьшается благодаря снижению диффузионных ограничений у поверхности фильтрующей перегородки.
Ультразвуковая обработка фруктовых соков и вин также способствует их осветлению, вызывая коагуляцию взвешенных органических частиц и появление большою числа центров кристаллизации, что приводит к сокращению процесса выпадения, например, избытка винного камня с 12-15 суток до 6..10 ч.
5.4.5. Сушка
Сушка - один из распространенных и весьма энергоемких процессов в пищевой промышленности. Применение ультразвуковых методов и оборудования в ряде случаев позволяет без существенного повышения температуры ускорить отделение влаги из пористых материалов и суспензий.
Ускоренное удаление влаги при ультразвуковой сушке обеспечивается снижением диффузионного сопротивления в объеме и у поверхности высушиваемого материала, мощными турбулентными газовыми потоками у поверхности материала, вытряхивающими и уносящими микрокапли жидкости, а также толщины пограничного слоя. Эвакуация отделенной в виде паров и микрокапель жидкости осуществляется газовым потоком. В результате применения технологии ультразвуковой сушки удастся снизить температуру процесса до значений, обеспечивающих сохранность биологически активных веществ, увеличить скорость процесса сушки, уменьшить потери высушиваемого продукта. Оборудование для ультразвуковой сушки легко адаптируется к традиционным сушильным установкам с виброкипящим слоем, распылительным, тоннельным, барабанным и другим, существенно повышая их производительность и экономическую эффективность. Ультразвуковую сушку применяют в производстве лекарств, биологически активных добавок к нище, солода и т. п.
5.4.6. Очистка сточных вод
Сточные воды многих пищевых производств содержат вещества, которые могут быть использованы в качестве корма для сельскохозяйственных животных. Применение ультразвука в ряде случаев существенно облегчает выделение этих веществ. После обработки ультразвуком, например из сточных вод рыбоперерабатывающих комбинатов, удастся извлечь значительное количество кормового белка и жира, что не только позволяет получить ценные кормовые вещества, но и ускорить дальнейшую очистку сточных вод.
Стимуляция сообществ микроорганизмов ультразвуком низкой интенсивности в бассейнах биологической очистки интенсифицирует их обмен веществ, увеличивает скорость биосинтеза биологически активных соединений, ускоряет адаптацию клеток к новым условиям. Так, стимуляция ультразвуком клеток плесени Aspergilus niger; играющих важную роль в процессе очистки воды, в полтора раза ускоряет их развитие» увеличивает скорость утилизации веществ в сточных водах, например, рыбоперерабатывающих комбинатов. Развивающаяся в бассейнах плесень выделяет мощные ферменты - целлюлазу и целлобиозу, разрушающие клетчатку. Выделяющаяся при этом глюкоза полностью используется клетками плесени, превращающими ее в углекислый газ и воду. Параллельно усиливается превращение сероводорода и серы в безвредные сульфаты, В процессе жизнедеятельности клетками плесени Aspergilus niger выделяются лимонная кислота и некоторые другие органические кислоты, создающие неблагоприятную для развития бактериальных клеток среду. Усиливается и выработка антибиотиков, которые вместе с органическими кислотами быстро снижают в сточной воде количество бактерий, в том числе болезнетворных. Клетки той же плесени после обработки ультразвуком активно концентрируют в себе соединения тяжелых металлов.
В ряде случаев мощный ультразвук применяется для ускорения окислительных процессов в сточных водах, снижения общей обсемененности, для томогенизации осадка и т. д.
5.5. УЛЬТРАЗВУК В ПРОИЗВОДСТВЕ КОРМОВ (ПРЕДПОСЕВНАЯ СТИМУЛЯЦИЯ СЕМЯИ УЛЬТРАЗВУКОМ)
Рациональное кормление и хорошее содержание - лучшие способы профилактики многих заболеваний сельскохозяйственных животных. В оптимизации условий содержания ультразвук практически не применяется, но увеличить количество кормов и повысить его качество с помощью ультразвуковых методов в ряде случаев несложно и экономически весьма выгодно. Примером может служить приготовление вышеупомянутого заменителя цельного молока.
Один из путей улучшения кормовой базы - увеличение урожайности растений, составляющих рацион животных. Добиться этого можно, повышая посевные качества семян, для чего перед посевом их обрабатывают химическими веществами, подвергают механическому или термическому воздействию, влиянию ионизирующих и неионизирующих излучений. Воздействуют на них и ультразвуком самых разных частот и интенсивностей. Обычно семена обрабатывают ультразвуком в ванне с водой или водными растворами различных веществ. Наличие водной среды позволяет избежать потери акустической энергии при ее передаче от преобразователя к семенам, но создает определенные трудности в воспроизведении и интерпретации результатов.
Многих недостатков использованных ранее методов предпосевной обработки лишен разработанный недавно, но уже нашедший применение в практическом растениеводстве способ ультразвуковой стимуляции семян в суховоздушном состоянии.
Первые же случаи применения этого метода позволили обнаружить еще одну возможную причину получения исследователями разных результатов. Оказалось, что эффект повышения урожайности растений после предпосевной обработки семян существенно зависит от их биологического качества. Элитные семена мало реагируют на предпосевную стимуляцию, тогда как семена низкого качества после ультразвуковой обработки дают 30...50 %-ную прибавку урожая.
Под влиянием ультразвука на поверхности сухих семян образуются микроповреждения характерных размеров 10-5...10-6 м). Их величину и количество можно изменять, регулируя режим обработки. Эти микроповреждения снижают механическую прочность семенной оболочки и облетают газовлагообмен.
Прочная и плотная оболочка, созданная природой для сохранения семян в экстремальных условиях, в определенной степени затрудняет их прорастание и препятствует интенсивному влагогазообмену. После ультразвуковой обработки семена быстро набухают и прорастают раньше обычного, растения лучше развиваются и дают более высокий урожай семян и зеленой массы. Растения, выросшие из семян, обработанных ультразвуком, более устойчивы к различным заболеваниям и неблагоприятным условиям внешней среды. Поэтому химическое протравливание семян может быть исключено из технологического процесса их подготовки к севу.
Ультразвуковая стимуляция семян весьма эффективна для кормовых трав и злаковых. Обработка семян корнеплодов приводит к буйному росту надземной части растений и уменьшению массы корнеплодов. Используют ультразвук для повышения урожайности зерновых (пшеницы, ржи, овса, тритикале - гибрида пшеницы и ржи); огородных (огурцов, помидоров), а также декоративных и других растений, Во всех случаях эффект сохраняется, но крайней мере, во втором, дочернем поколении.
5.6. ПРИМЕНЕНИЕ УЛЬТРАЗВУКА В МЕДИЦИНСКОЙ И ВЕТЕРИНАРНОЙ БИОТЕХНОЛОГИИ
Ультразвуковые методы весьма перспективны для применения в биотехнологии, так как в зависимости от характера поставленной задачи позволяют, подбирая параметры ультразвукового воздействия, интенсифицировать или подавлять те или иные физико-химические и биологические процессы, увеличивать выход конечного продукта и уменьшать расход сырья, сделать отдельные процессы производства более технологичными и создать такие, которые без применения ультразвука были бы просто невозможны.
5.6.1. Ультразвук в криобиологии и криоконсервировании
Давно известно, что при понижении температуры замедляются биохимические процессы, лучше и дольше сохраняются биологические ткани. Поиск способов длительного хранения жизнеспособных клеток и тканей привел к разработке ряда новых методов их консервирования холодом и даже появлению новой науки - криобиологии. Успехи криобиологам открывают широкие возможности сохранения генофонда диких и сельскохозяйственных животных и растений, консервации и длительного хранения их репродуктивных клеток, сохранения клеток крови и костного мозга, а также отдельных тканей и даже органов для трансплантации.
Охлаждение живых клеток до температур ниже 0°С сопровождается замораживанием внутри- и внеклеточной воды, что приводит к образованию в клетке и вне ее кристаллов льда, возникновению механических напряжений, резкому увеличению концентрации растворенных солей в результате вымораживания чистой воды, изменению рН среды. Эти процессы могут привести к нарушению структурной целостности клеток, нарушению их функций, изменению транспорта веществ через клеточные мембраны и, следовательно, к изменению состава внутриклеточной среды. Для защиты клеток от отрицательных воздействий при замораживании используют некоторые вещества - криопротекторы, - существенно уменьшающие повреждения клеточных и тканевых структур.
Основные нарушения в клетках при криоконсервировании обусловлены механическими напряжениями, возникающими в биологической среде при замораживании. Следовательно, криорезистентиость клеток тем выше, чем выше их устойчивость к механическим воздействиям, а механическую резистентность легко оценить, используя метод ультразвуковых цитолизограмм (см. § 2.4).
При добавлении криопротектора к среде физико-химические свойства раствора стабилизируются не сразу и продолжают меняться в течение нескольких часов или даже суток до тех пор, пока раствор не станет гомогенным. Воздействие низкочастотным ультразвуком (35 кГц) мощностью 15...100 Вт существенно ускоряет растворение криопротектора в жидких средах и в течение нескольких минут стабилизирует параметры раствора. Даже отстоявшиеся в течение недели растворы криопротективиых веществ, например глицерина или полиэтиленоксида, после ультразвуковой обработки становятся более гомогенными, о чем свидетельствуют результаты рентгеноструктурного анализа их замороженных образцов. В разбавителе спермы ультразвук диспергирует лецитин с сохранением его ламелярной структуры, что существенно улучшает качество разбавителя, повышает его защитные свойства.
Клетки и ткани, помещенные в раствор криопротектора, должны выдерживаться в нем до тех пор, пока не будет достигнуто насыщение. Время эквилибрации, т. е, период, в течение которого криопротекторы насыщают клетку, также может быть сокращено с использованием ультразвука, так как, увеличивая проницаемость клеточных мембран, ультразвук ускоряет процесс переноса веществ через эти мембраны.
Ультразвук может быть полезен и для определения степени насыщения клеток в суспензии, а также тканей и органов криопротектором. При перфузии изолированного органа перед низкотемпературной консервацией раствором криопротектора измеряют и сравнивают скорости ультразвука в подводимом к органу и оттекающем от него растворе (рис. 5.6). Когда происходит насыщение, концентрация криопротектора и, следовательно, скорость ультразвука в подводимой и отводимой жидкости уравниваются.
Рис. 5.6. Ультразвуковой метод контроля степени насыщения
почки криопротектором: V1 - скорость ультразвука на входе, У2 - скорость ультразвука на выходе
При замораживании подготовленных для криоконсервирования образцов подбирают такие режимы охлаждения, чтобы образующиеся кристаллы льда как можно меньше травмировали клеточные мембраны. Если жидкость, не содержащую зародышей кристаллизации, медленно охлаждать, то она может переохладиться, оставаясь в жидком состоянии при температурах ниже точки замерзания. Этот нежелательный для криоконсервирования эффект можно предотвратить, замораживая образцы в ультразвуковом поле (рис. 5.7).
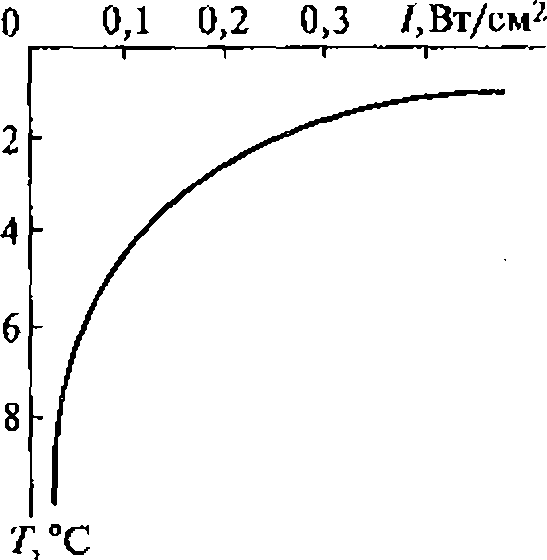
Рис. 5.7. Влияние ультразвука (0,88 МГц) на степень переохлаждения растворов криопротекторов при их замораживании
В данном случае влияние ультразвука обусловлено увеличением количества центров кристаллизации. В результате в среде формируется множество кристаллом, размеры которых сравнимы с размерами клетки. Кроме того, кристаллы льда растут с большим числом разветвлений, что также способствует выживанию клеток.
В охлажденном растворе, прежде всего, начинает вымерзать чистая вода, а в незамерзшей части жидкости быстро возрастает концентрация солей, и раствор становится гипертоническим. В такой среде клетки испытывают существенные изменения: они обезвоживаются, меняется соотношение ионов во внутриклеточной среде. Интенсивно перемешивая жидкую среду как внутри клеток, так и вне их, ультразвуковые микропотоки способствуют равномерному распределению солей и уменьшают вредные последствия пребывания клеток в гипертоническом растворе.
Качество спермы сельскохозяйственных животных, замороженной в ультразвуковом поле (880 кГц; 0,1...0,2 Вт/см2), после размораживания значительно выше, чем качество спермы, криоконсервированной без ультразвукового воздействия. Средняя активность сперматозоидов увеличивается на 1-2 балла, повышается абсолютный показатель живучести и удлиняется промежуток времени, в течение которого сперматозоиды остаются способными выполнять свои биологические функции.
Ультразвуковая обработка эритромассы, защищенной криопротектором (глицерином или полиэтиленоксидом), также способствует повышению криорезистентности клеток.
Клетки костного мозга, содержащие ядра, так же, как и безъядерные эритроциты, лучше сохраняются при криоконсервировании с использованием ультразвука. Сохранность клеток повышается по мере увеличения интенсивности ультразвукового воздействия до 0,8...0,9 Вт/см2. Ультразвук с частотой 880 кГц эффективнее ультразвука с частотой 2640 кГц. В первом случае различие в сохранности клеток в контрольных и опытных образцах составляет 12 %, а во втором -9%. Ультразвук с интенсивностью, превышающей 0,9 Вт/см2, снижает сохранность клеток. Эффект объясняется тем, что наряду с положительным воздействием на процессы криоконсервирования, ультразвук при высоких интенсивностях способен разрушать клетки в суспензии.
Процесс размораживания при криоконсервировании биологического материала не менее важен, чем процесс замораживания, так как физико-химические процессы в обоих случаях сходны, что позволяет и здесь успешно использовать ультразвуковое воздействие.
Размораживание в ультразвуковом поле осуществляется при воздействии ультразвуком на контейнеры с замороженными клеточными суспензиями, помещенными в водяную баню с температурой 40...45 0С. Оттаивание продолжают до тех пор, пока температура суспензии не достигнет 5...10 0С. Размораживание в ультразвуковом поле способствует повышению сохранности клеток на 20…25%. Эффект обусловлен не только микротечениями, ускоряющими теплообмен и снижающими температурные градиенты как внутри, так и снаружи контейнеров, но и действием ультразвука, стимулирующим репаративные процессы в клетках.
В последнее время растет интерес к проблеме криоконсервирования эмбрионов человека и животных. Решение этой проблемы наталкивается на ряд трудностей. Так, исследование возможности криоконсервирования ооцитов свиньи выявило их высокую криочувствительность. Поиск путей сохранения ооцитов при замораживании привел к использованию ультразвука низких интенсивностей для повышения их сохранности. Однако лабильные к замораживанию ооциты оказались чувствительными к ультразвуковому воздействию. Наиболее устойчивы мелкие, незрелые ооциты без четко выраженных гранул в цитоплазме. Более зрелые клетки средних размеров, характеризующиеся относительно большой растяжимостью, имеют повышенную чувствительность к ультразвуку.
Чаще всего наблюдается удаление клеток лучистого венца, нередки разрывы в плазматической мембране, деформация ооцитов, частичная дегидратация и другие нарушения. Обработка ультразвуком с интенсивностью 0,05...0,1 Вт/см2 в течение 0,5 мин в процессе эквилибрации с криопротектором, а также во время размораживания, увеличивает морфологическую сохранность законсервированных ооцитов до 65 %, по сравнению с 45 % в контрольных образцах, и способствует их дальнейшему развитию в культуре.
Анализ многочисленных данных о влиянии низких температур и ультразвука на ткани и клетки в суспензии свидетельствует о значительной роли цитоплазматических мембран в формировании ряда реакций биологических систем па ультразвуковое и криовоздействие. Мембранные структуры способны по-разному реагировать на действие каждого фактора, в зависимости от его параметров, и регулирующий эффект комбинированного воздействия зависит от км о, суммируются ли эффекты их влияния или имеет место частичная или полная взаимокомпенсация.
5.6.2. Влияние ультразвука на биосинтез интерферона
Воздействие ультразвуком низких интенсивностей на клетки в суспензии или культуре может обусловить стимуляцию процессов их жизнедеятельности. Известно, например, что в относительно мягких условиях ультразвуковой обработки (0,05...0,5 Вт/см2; 0,88 МГц; 30 с) ускоряется процесс синтеза соединительно тканого белка в культуре фибробластов.
Представляет практический интерес возможность стимуляции синтеза и ряда других белков в клетках, в частности биосинтеза интерферона в индуцированных вирусом лейкоцитах.
Интерферон синтезируется в клетках организма и в культуре тканей в ответ на воздействие природных и искусственных индукторов - вирусов, эндотоксинов, внутриклеточных паразитов, высоко- и низко- молекулярных соединений. Помимо антивирусной активности, интерферон проявляет способность подавлять размножение быстроделящихся клеток, обладает иммуномодулирующим действием. Он эффективен как радиозащитное и антитоксическое средство.
Интерферон, будучи важнейшим неспецифическим фактором повышения резистентности, продуцируется почти сразу после попадания индуктора биосинтеза, например вируса, в организм, однако естественно образующегося интерферона часто оказывается недостаточно для предупреждения развития болезни. Воздействие ультразвуком терапевтических интенсивностей на область локализации патологического процесса, очевидно, приводит к стимуляции биосинтеза интерферона. Не исключено, что именно этот эффект лежит в основе ультразвуковой физиотерапии вирусных кератитов.
При ряде патологий весьма эффективно введение в организм экзогенного интерферона, полученного либо в результате химического синтеза, либо генно-инженерными методами, либо при его биосинтезе в культуре лейкоцитов, индуцированных вирусом.
Для получения наиболее качественного (лейкоцитарного) интерферона лейкомассу из свежей крови фракционируют, обрабатывают гомологичным интерфероном (проводят прайминг) и индуцируют биосинтез интерферона каким-либо вирусом, например вирусом Сендай или вирусом болезни Ньюкасла. После этого клетки помещают в специально подобранную среду и выдерживают при температуре 37 °С, постоянно перемешивая. Через 16...8 ч клетки отделяют и выделяют из среды интерферон, активность которого можно оценить по его способности защищать клетки в культурах тканей от цитопатического действия вируса.
Воздействие ультразвуком с частотой 880 кГц и интенсивностью 0,05...0,6 Вт/см2 в течение 130...300 с на суспензию лейкоцитов до прайминга или после него, во до вирусной индукции, не приводит к заметному изменению количества синтезированного интерферона. Ультразвук с интенсивностью, превышающей 0,6 Вт/см2, подавляет процесс биосинтеза.
Воздействие ультразвуком с интенсивностью от 0,01 до 0,05 Вт/см2 на лейкоциты после вирусной индукции практически не влияет ни па скорость биосинтеза интерферона, ни па жизнеспособность клеток, оцениваемых по их окрашиваемости красителем трипановым синим. После обработки ультразвуком с интенсивностью ОД Вт/см2 в суспензии обнаруживается около 10 % погибших клеток. Дальнейшее увеличение интенсивности ультразвука приводит к экспоненциальному росту числа нежизнеспособных (прокрашиваемых) клеток, а после обработки ультразвуком интенсивностью 0,7 Вт/см2 в суспензии остается 65 % жизнеспособных лейкоцитов (рис. 5.8).
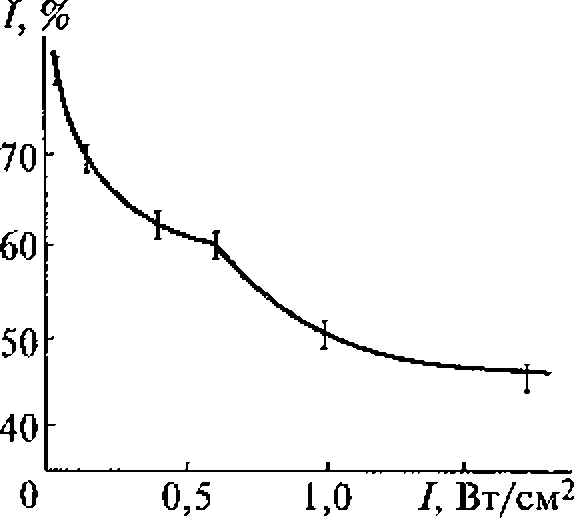
Рис. 5.8. Снижение числа жизнеспособных клеток (лейкоцитов) в суспензии вод воздействием ультразвука
Существенное увеличение скорости гибели клеток при интенсивностях ультразвука, превышающих 0,7 Вт/см2, обусловлено кавитацией, порог возникновения которой зависит от объемной концентрации клеток в среде, в разбавленных суспензиях совпадает с поротом кавитации в воде (0,3 Вт/см2) и становится весьма значительным, если объем частиц в суспензии превышает 2 %, Согласно теоретическим оценкам и экспериментальным данным, порогу кавитации в суспензии лейкоцитов, содержащей 3 ·106 кл./см3, соответствует интенсивность ультразвука 0,6 Вт/см2.
Облучение ультразвуком суспензии лейкоцитов в течение 5 мин с интенсивностью от 0,05 до 0,6 Вт/см2 приводит к увеличению на 30% количества интерферона, синтезируемого жизнеспособными клетками. Дальнейшее увеличение интенсивности ультразвука обусловливает резкое снижение количества синтезированного интерферона (в пересчете на жизнеспособные клетки). Ультразвук, интенсивность которого превышала 1 Вт/см2, приводил к практически полному подавлению биосинтеза (рис. 5.9), хотя, как было указано выше, в этих условиях около половины исходного количества клеток в суспензии не прокрашивается трипановым синим, т. е. они являются, суда по этому, вполне жизнеспособными.
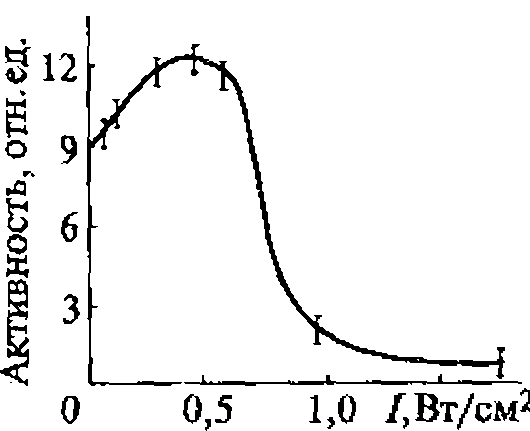
Рис. 5.9. Влияние ультразвука на количество интерферона, синтезированного лейкоцитами в суспензии (в расчете на количество жизнеспособных клеток)
Подавление биосинтеза интерферона в лейкоцитах при интенсивностях ультразвука, превышающих порог кавитации, очевидно, обусловлено процессами, сопровождающими кавитацию, например интенсивными микропотоками, возникающими как вне, так и внутри клеток. Эти микропотоки вызывают грубое нарушение внутриклеточной архитектоники, что приводит к подавлению биохимических реакций, в частности биосинтеза интерферона.
Факт увеличения количества интерферона, синтезируемого лейкоцитами в суспензии, не поддается однозначной интерпретации.
Увеличение интенсивности ультразвука в интервале от 0,1 до 0,6 Вт/см2 повышает скорость биосинтеза интерферона, но одновременно снижает число жизнеспособных клеток. Поэтому суммарный эффект невелик.
Обычно клетки, единожды использованные для синтеза интерферона, выбрасывают, гак как при повторном использовании они дают незначительное количество препарата. Однако после трехминутного ультразвукового воздействия на «отработанные» клетки наблюдается стимуляция повторного синтеза интерферона (табл. 5.2). Максимальный выход препарата может быть получен при интенсивности ультразвука 0,01...0,2 Вт/см2, Ультразвук с интенсивностью выше 0,7 Вт/см2 резко ингибирует повторный синтез интерферона.
Таблица 5.2
Зависимость выхода интерферона (по активности препарата в международных единицах) oт интенсивности ультразвукового воздействия на суспензии однократно использованных для биосинтеза лейкоцитов
|
Интенсивность ультразвука, Вт/см2 |
0 |
0,05 |
0,1 |
0,2 |
0,4 |
0,7 |
1,0 |
2,0 |
|
Титр (активность) интерферона, МЬ |
150 |
1200 |
1200 |
1200 |
900 |
900 |
150 |
150 |
Применение ультразвука для стимуляции позволяет на 20...25 % увеличить выход продукта и делает практически целесообразным повторное использование лейкоцитов.
Полученный очищенный интерферон хранят либо к виде раствора, либо в виде лиофильно высушенного препарата. При длительном хранении активность интерферона медленно снижается, что обусловлено агрегацией его молекул. Попадая в организм, интерферон связывается со специфическими рецепторами клеточной поверхности. Отдельная молекула или агрегат как одно целое могут связаться лишь с одним рецептором. Поэтому агрегация приводит к снижению количества действующих единиц, что равносильно снижению активности препарата.
Ультразвуковая обработка растворов интерферона с интенсивностью 1,0... 1,5 Вт/см2 и течение 5...10 мин увеличивает антивирусную активность интерферона в 2-4 раза. Судя по результатам электрофореза препаратов интерферона в акриламидном геле, ультразвуковое воздействие приводит к снижению концентрации в растворе частиц с молекулярной массой 120-140 тыс. дальтон и увеличению частиц с молекулярной массой 60-70 тыс. дальтон и 30-35 тыс. дальтон, что соответствует димерам и мономерам интерферона.
Клинические испытания показали целесообразность ультразвуковой обработки интерферона перед использованием для лечения вирусных заболеваний.
5.6.3. Стимуляция роста клеток в культуре
Воздействие ультразвуком с частотой 0,88 МГц и интенсивностью 0,02...0,08 Вт/см2 в течение 5…30 с способствует значительному приросту клеточной массы. Так, в контрольном опыте количество клеток перевиваемой культуры почки теленка через трое суток увеличивается с 8 · 104 кл./мл до 3,1 · 105 кл./мл. Индекс пролиферации при этом составляет 3,8. Если же исходный материал в течение 10 с обработать ультразвуком с интенсивностью 0,05 Вт/см2 (0,88 МГц), то индекс пролиферации возрастает до 9,0, а концентрация клеток за трое суток увеличивается до 7,2 · 105 кл./мл.
Аналогичные результаты получены и на других культурах, в частности на культурах клеток почки хомячка. Эффект стимуляции для различных культур качественно одинаков. Он зависит от интенсивности ультразвука и времени воздействия (рис. 5.10).
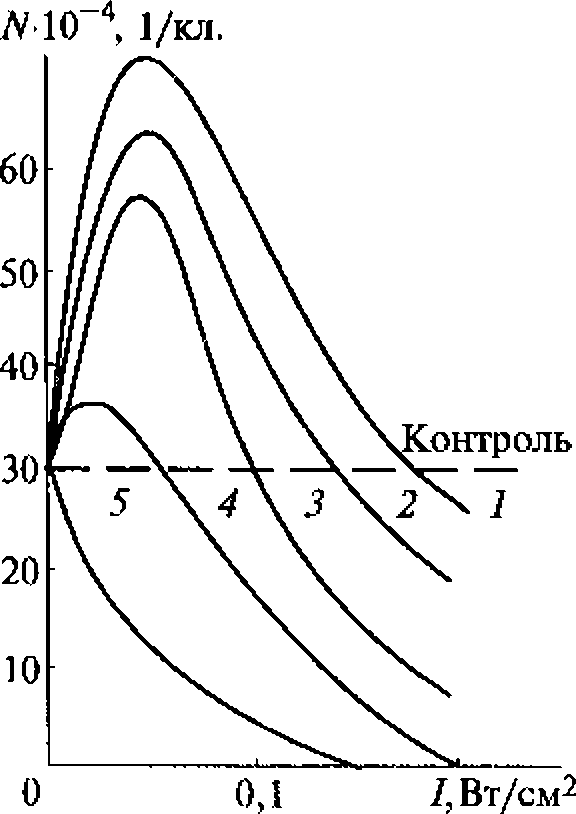
Рис. 5.10. Зависимость прироста количества клеток и культуре (па третьи сутки) от времени и интенсивности ультразвуковой стимуляции клеток перед их введением в
культуру: 1-5с, 2-10с,3- 30с, 4-35с, 5-45с
5.6.4. Предынкубационная обработка яиц ультразвуком и введение лекарственных веществ через неповрежденную скорлупу
Используя ультразвуковые методы для предынкубационной обработки яиц, можно получить ряд полезных для птицеводства эффектов,
Предынкубационная очистка поверхности яиц в низкочастотных 22...44 кГц ультразвуковых ваннах длится 30...60 с. Качество белка при этом не меняется, а уничтожение микрофлоры на скорлупе способствует увеличению выводимости цыплят. Следует, однако, отметить, что чрезмерное повышение мощности ультразвука, способствующее ускорению очистки и повышению ее качества, может привести к нарушению процесса развития эмбрионов, снижению выводимости, увеличению количества цыплят с врожденными уродствами.
Кратковременное воздействие высокочастотным ультразвуком (880 кГц) невысокой интенсивности на яйцо перед инкубацией приводит к увеличению выводимости цыплят (табл. 5.3).
Таблица 5.3
Выводимость цыплят (в процентах) после воздействия высокочастотным ультразвуком на яйцо перед инкубацией в течение 10 с (300 яиц на каждый опыт)
|
Контрольный образец |
Выводимость цыплят, % при интенсивности ультразвука, Вт/см2 | ||
|
0,05 |
0,4 |
0,7 | |
|
82±2 |
83±2 |
88± 2 |
87±2 |
Наилучшие результаты достигаются при интенсивности ультразвука 0,4 Вт/см2 и десятисекундной длительности обработки. Следует отметить, что, чем выше инкубационное качество яиц, тем меньше проявляется стимулирующее действие ультразвука. Очевидно, при низкой исходной выводимости значительным оказывается резерв роста и развития, который и реализуется при неспецифическом ультразвуковом воздействии.
В практическом птицеводстве для профилактики заболеваний и массовой гибели цыплят в инкубационное яйцо вводя т различные лекарственные вещества, в том числе антибиотики. Самый простой и распространенный способ введения антибиотиков - прокалывание скорлупы шприцем, последующее введение раствора в воздушную камеру и герметизация яйца. Этот способ позволяет легко дозировать лекарство, но требует строгой стерильности и практически не поддается автоматизации.
Известно, что ультразвук ускоряет транспорт многих веществ через мембраны и пористые перегородки и широко используется в медицине для введения лекарств в организм через неповрежденные покровные ткани, а также в промышленности для ускорения процессов пропитки ряда материалов.
Если на скорлупу нанести лекарственное вещество, например антибиотик ампициллин, или поместить яйцо в раствор этого антибиотика с концентрацией, в 10 раз превышающей концентрацию раствора, используемого для введения шприцем, то даже через десятки минут его содержание в яйце будет пренебрежимо мало. В этом легко убедиться по отсутствию лизиса - разрушения клеток в тест-культуре Sarcina lutea после добавления к ней содержимого яйца.
Если же опустить яйцо в этот же раствор антибиотика острым концом всего лишь на 1/5 но высоте и воздействовать ультразвуком, как это показано на рис. 5.11, то в содержимом яйца обнаруживается ампициллин.
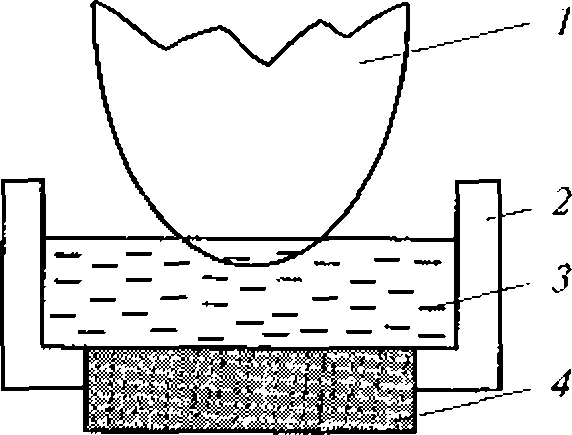
Рис. 5.11. Фонофорез лекарственных веществ в яйцо:
1 - яйцо; 2 кювета; 3 - раствор лекарственного вещества; 4 - преобразователь ультразвука
Под влиянием ультразвука (880 кГц) антибиотик активно транспортируется в яйцо через скорлупу и подскорлупную мембрану, накапливаясь в его содержимом в концентрации, сравнимой с концентрацией, полученной при введении раствора в воздушную камеру шприцем через прокол в скорлупе (табл. 5.4)
Таблица 5.4
Оценка содержания ампициллина в содержимом яйца по величине зон лизиса клеток в культуре Sarcina lutea
|
Способ введения антибиотика |
Диаметр зон лизиса, мм |
|
Шприцем через прокол в скорлупе 0,2 мл раствора с концентрацией 5 ·102 Ед./мл |
12,0 |
|
Нанесение на поверхность скорлупы раствора с концентрацией 5 · 103 Ед./мл |
Нет лизиса |
|
Введение ультразвуком сквозь скорлупу из раствора с концентрацией 5 · 103 Ед./мл в течение 5 с при интенсивности (Вт/см2); 0,2 0,6 1.0 1,5 |
2,4 16,5 17,0 Сплошной лизис |
Аналогичным способом на 18-е сутки инкубации при переносе яиц в выводные шкафы в яйцо вводят вакцину, например, против болезни Марека, что позволяет избавиться от трудоемкой и малопроизводительной операции введения вакцины внутримышечно каждому цыпленку всего поголовья молодняка.
5.6.5. Снижение уровня иммунологической специфичности клеток
В последнее время все шире используется трансфузия отдельных компонентов крови - эритроцитарной, лейкоцитарной, тромбоцитарной массы, плазмы, альбумина, что позволяет при ряде патологических состояний достичь значительно большей терапевтической эффективности, чем при переливании цельной крови.
Следует, однако, отметить, что ветеринарная гемотрансфузиология сопряжена с определенными сложностями в связи с большим числом групп крови у животных. У коров, например, не менее 11-ти, у лошадей более девяти, у овец - семь, а у свиней обнаружено 14 групп крови. Встречаются животные, кровь которых не относится ни к одной из известных групп.
Групповая специфичность клеток крови обусловлена антигенными детерминантами, представляющими собой гликопротеиды и гликопротеидные комплексы, расположенные на наружной поверхности цитоплазматической мембраны. Эти детерминанты играют основную роль в иммунологическом распознавании «своих» и «чужих» клеток, а следовательно, и в трансплантационной совместимости тканей, в том числе крови и ее форменных элементов.
Иммунологическая несовместимость может быть снижена или преодолена, если частично или полостью удалить антигенные детерминанты с клеточной поверхности.
Обработка эритроцитов гликолитическими ферментами, отщепляющими полисахаридный остаток антигенных детерминант, весьма перспективна, но практически неосуществима в настоящее время в связи с отсутствием необходимых ферментов требуемой чистоты и специфичности. Возможна и химическая модификация группоспецифичных антигенов с целью их полной инактивации, но свойства полученных при этом эритроцитов остаются пока непредсказуемыми. Этих недостатков лишен ультразвуковой метод, позволяющий механически удалять группоспецифичные антигены с мембран эритроцитов и других клеток.
В поле ультразвука докавитационных интенсивностей возникают микропотоки, обеспечивающие «смывание» (десорбцию) с поверхности клеток молекул белков и других биополимеров, что подтверждается изменением энзиматической активности клеток, потерей ими связанных с мембранами антигенов, появлением в среде, в которой суспендированы клетки, заметных количеств гликопротеидов. Во избежание обратного связывания с мембранами «смытых» микропотоками макромолекул клетки после ультразвуковой обработки следует немедленно отделить от среды.
Выбор оптимального режима ультразвуковой обработки эритроцитов с целью снижения их антигенной активности при сохранении целостности клеток и их основных свойств требует учета целого ряда обстоятельств.
Энергия микропотоков и, следовательно, эффективность снижения антигенной активности эритроцитов увеличиваются с возрастанием интенсивности ультразвука (рис. 5.12), но при этом не должен быть превышен порог кавитации, разрушающей клетки в суспензии. Порог кавитации можно повысить, увеличивая концентрацию клеток, но это ведет к уменьшению расстояния между клетками, и «смытые» с их поверхности антигены после выключения ультразвука быстро сорбируются на поверхности близлежащих клеток. Эффективность ультразвуковой обработки зависит и от частоты ультразвука. При низких частотах понижается порог кавитации и увеличивается вероятность гемолиза, при частотах, превышающих 1МГц, повышается порог кавитации, но уменьшается эффективность десорбции антигенов.
Параллельно с процессом десорбции антигенных детерминантов с поверхности эритроцитов в ультразвуковом ноле протекает и обратный процесс - сорбция антигенов клетками, а ультразвук лишь сдвигает равновесие в сторону десорбции. Поэтому только с помощью ультразвука не удастся полностью удалить антигенные детерминанты с поверхности клеток.
Максимальное и весьма существенное снижение антигенной активности эритроцитов в суспензии с концентрацией клеток 106...109 кл./мл обеспечивается ультразвуком с частотой 0,88 МГц, интенсивностью 0,4 Вт/см2 в импульсном режиме. Длительность импульсов - 4 мке, частота следования - 50 Гц, время обработки - до 30 мин.
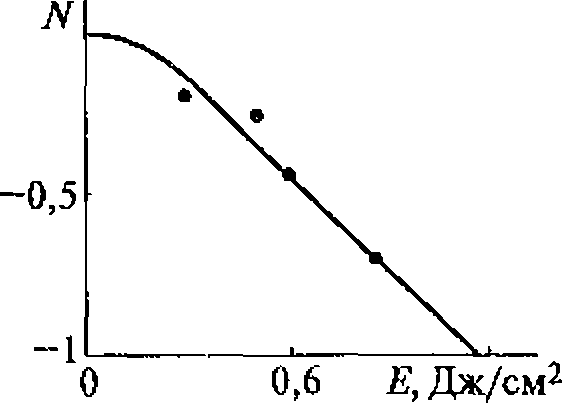
Рис. 5.12. Относительное изменение концентрации антигенов на поверхности эритроцитов в зависимости от плотности энергии ультразвука
Антигенные детерминанты разных групп крови по-разному связаны с эритроцитами. Опыты, проведенные па крови человека, показали, что снижения антигенной активности эритроцитов на 97 % удается достичь у 15 % доноров группы В (III) и лишь у 4 % доноров группы А (II).
В отличие от химических методов модификации антигенной активности клеток ультразвуковой метод позволяет не только удалить антигенные детерминанты, но и пересаживать их па мембраны других клеток.
Так, антигенные детерминанты, «смытые» с поверхности эритроцитов ультразвуковыми микропотоками, отделенные от эритроцитов центрифугированием и введенные в суспензию предварительно обработанных ультразвуком и отмытых эритроцитов других групп крови, сорбируются на этих эритроцитах, изменяя их иммунологический статус. Очевидно, что аналогичная операция может быть проведена и с другими клетками. Такая «пересадка» антигенов в настоящее время еще не практикуется, по весьма перспективна для преодоления реакций отторжения.
Ультразвук, в оптимальном режиме обеспечивающий десорбцию антигенов с клеточной поверхности, мало влияет на другие функции клеток, Эритроциты, например, после удаления с их мембран антигенов не меняют своих размеров, не теряют способности связывать и переносить кислород. Остается практически постоянным и заряд клеточных мембран, оцененный по электрофоретической подвижности клеток. Проницаемость мембран, но отношению к кислороду и ионам калия также не претерпевает заметных изменений. Более того, эхиноциты, образовавшиеся из эритроцитов при их выделении из донорской крови, после ультразвуковой обработки часто снова принимают дискоидную форму, характерную для интактных клеток. Однако ультразвуковая обработка не проходит бесследно для эритроцитов.
5.7. ПОЛУЧЕНИЕ КОРМОВЫХ ДОБАВОК С ПОМОЩЬЮ
УЛЬТРАЗВУКА
Некоторые отходы кожевенной промышленности содержат большое количество белка и после переработки могут успешно использоваться в качестве кормовой добавки. В кожевенных отходах содержится большое количество несовместимых с кормами веществ. Это кремнефтористые и сернистые соединения натрия, парадихлорбензол и ряд других веществ, включая соли хрома, используемые для консервирования кожевенного сырья и его дубления при переработке в кожу. Химические способы снижения содержания токсических веществ до допустимого уровня и разрушения прочных связей в структуре кожи требуют длительного времени, большого количества воды и различных химических соединений.
Процесс переработки кожевенного сырья примерно в 25 раз ускоряется в мощных низкочастотных ультразвуковых полях и занимает не 2-5 суток, а 2-3 часа. При такой обработке смесь отходов с растворами интенсивно перемешивается, ускоряется экстракция консервантов, разволокняется структура кожевенных отходов, что значительно повышает их перевариваемость, а значит, кормовую ценность.
Полученный эффект, очевидно, обусловлен интенсификацией пропитки кожевой ткани реагентами, ускорением химических реакций в ультразвуковом иоле (см. § 1.9), повышением скорости удаления из кожевой ткани продуктов реакции, а также механическим воздействием ударных волн и кавитационных микропотоков на структуру ткани. В результате такой обработки из отходов кожи практически полностью удаляются различные консерванты и дубители. Полученная таким способом сухая измельченная кормовая добавка содержит 70% белка и 17% жира. Содержание перевариваемого протеина составляет 420 т/кг.
Аналогичным способом можно готовить грубые корма из соломы. Обычно солому заливают на 8...14 ч раствором щелочи, что обеспечивает ее размягчение и насыщение влагой. Обработка измельченной соломы в растворе щелочи мощным низкочастотным ультразвуком в течение трех минут резко сокращает время приготовления корма, в 3-4 раза уменьшает расход щелочи, а также значительно повышает перевариваемость и питательность корма.
Успешно применяют ультразвук и для повышения эффективности производства рыбной кормовой муки. Обычно образующиеся в процессе прессования при производстве рыбной муки бульоны содержат значительное количество белков и липидов. Так, в бульоне, образовавшемся при переработке 30 т сырья, содержится около 1,5 т белка и 0,5 т жира. Этот подпрессовый бульон можно упарить, а образовавшийся концентрат использовать для обогащения кормовой муки. Однако соленые бульоны практически не пригодны для упаривания, так как при этом в конечный продукт попадает большое количество соли. Кроме того, метод уваривания весьма энергоемок. Для отделения белка и жира от жидкой среды можно использовать методы электрофлотации и электрокоагуляции, но оба эти метода требуют затраты большого количества энергии па единицу готовой продукции, в которую к тому же нередко попадает металл электродов в виде загрязняющих примесей. Этих недостатков лишен ультразвуковой метод коагуляции белков в подпрессовых бульонах. После десятиминутной обработки мощным низкочастотным ультразвуком в бульоне, выдерживаемом при 95°С, образуются хлопья, которые быстро осаждаются. Их легко отделяют с помощью сепаратора и высушивают одним их обычных способов. Применение ультразвука позволяет без существенных дополнительных затрат на 8...10 % увеличить общий выход рыбной муки - ценной кормовой добавки в рацион сельскохозяйственных животных.
Следует отметить, что в рыбной муке обычно содержится значительное количество жира, который, окисляясь при хранении продукта, снижает его качество. Однако, если к жому после прессования добавить воду в соотношении 1:4, смесь в течение 10…15 мин обработать мощным ультразвуком с частотой 18...22 кГц, а затем вновь подвергнуть прессованию, то содержание жира в жоме и в конечном продукте снижается с 13 до 8%, что существенно повышает качество рыбной муки. Отделенный при этом рыбий жир также представляет собой ценную кормовую добавку.
В качестве эффективных добавок к корму, содержащих биологически активные вещества, нередко используют одноклеточные водоросли и кормовые дрожжи, выращенные па дешевом природном сырье: измельченных отходах древесины, тростнике, кукурузных кочерыжках, лузге подсолнечника, оболочках гречихи и проса, отходах сахарного производства.
Используют дрожжи в виде белково-витаминно-минеральных добавок в рационы крупного рогатого скота, сельскохозяйственной птицы, пушных зверей. Солому и другие малоценные корма подвергают дрожжеванию, добавляя с корм дрожжи и создавая условия для их развития. Питательность грубых кормов в результате их обогащения белком, витаминами, органическими кислотами и ферментами значительно повышается.
Достаточно длительный процесс дрожжевания можно существенно ускорить, стимулируя рост и развитие клеток ультразвуком, Ультразвуковое воздействие в течение нескольких минут повышает интенсивность брожения, улучшает качество готового продукта, снижает расход дрожжей. Разрушенные мощным ультразвуком клетки сами по себе являются хорошим стимулятором развития дрожжей. Этот эффект связывают с так называемым «мортальным фактором», возникающим при разрушении клеток, стимулирующим рост и развитие остальных, оставшихся целыми клеток. Основываясь на этих представлениях, для ускорения процессов дрожжевания четвертую часть исходной суспензии подвергают мощному ультразвуковому воздействию, приводящему к разрушению клеток, а затем смешивают полученный продукт с оставшимися тремя четвертями суспензии.
Ценным источником белка и биологически активных веществ, необходимых для рационального кормления, могут служить одноклеточные водоросли, например хлорелла. Однако гемицеллюлоза, составляющая их оболочку, плохо разрушается в желудочно-кишечном тракте сельскохозяйственных животных, что существенно снижает их кормовую ценность. Кратковременное воздействие ультразвуком неразрушающих интенсивностей (10 кГц; 2 кВт) на хлореллу в суспензии с объемной концентрацией клеток от 10 до 25 % стимулирует в последующие несколько часов синтез ими биогенных стимуляторов. Скорость синтеза увеличивается, если суспензию клеток после ультразвуковой стимуляции выдерживать в темноте при температуре 3...7. После этого клетки в суспензии разрушают, используя мощный ультразвук или СВЧ-поле.
Полученная таким образом жидкая масса - «зеленое молоко» - может быть использована как в свежем, гак и в консервированном виде. Для длительного хранения массу сушат и включают в состав порошковых гранулированных концентратов или прессованных кормосмесей.
Скармливание «зеленого молока» молодняку сельскохозяйственных животных, в том числе и птице, резко снижает их падеж и в среднем на 17% увеличивает привесы. Животные с удовольствием поедают «зеленое молоко» и корма, подвергшиеся дрожжеванию. Клетки дрожжей и одноклеточных водорослей богаты полноценными белками, необходимыми живому организму солями калия, кальция и фосфора, а также витаминами. По составу дрожжи и одноклеточные очень близки к кормам животного происхождения, а по питательности и содержанию витаминов лишь немного уступают рыбной муке.
Для приготовления кормовых добавок из растительного сырья, для дрожжевания кормов и разрушения клеток хлореллы не требуется специального ультразвукового технологического оборудования. Для этой цели успешно используются давно разработанные и выпускаемые промышленностью ультразвуковые ванны различного объема.
Список литературы
- Абрамов О.В., Акопян В.Б., Зиммелис И.В. и др. Ультразвуковая предпосевная обработка семян ячменя // Вестник с.-х. науки. 1991. № 1.
- Абрамов О.В., Акопян В.Б., Рыхлецкая О. С. и др. Всхожесть и урожайность томатов в зависимости от обработки семян ультразвуком и парааминобензойной кислотой // Доклады ВАСХНИЛ. 1987. № 8.
- Акопян В.Б. Физические основы ультразвуковой криобиологии // Доклады 111 национальной школы по криобиологии и лиофилизации. Смолян (Болгария), 1987.
- Акопян В.Б., Аленичев В.Н., Гаврилов В.К., Рухман А.А. Ультразвуковая интенсификация процессов фильтрования // Ультразвуковые технологические процсссы-2000. Архангельск, 2000,
- Борисов Ю.А. Гынкина Н.M. Акустическая сушка // Физические основы ультразвуковой технологии. М.: МАДИ, 1970.
- Деблок И., Лефевр Ф., Нонгайар. Б. и др. Вязкоупругие характеристики сахарного сиропа // Пищевая промышленность. 2003. № 12.
- Долганова Н.B. Интенсификация биотехнологических процессов комплексного использования сточных вод рыбообрабатывающих предприятий. Астрахань, АГТУ, 1991.
- Казанцев В.Ф. Расчет ультразвуковых преобразователей для технологических установок. М.: Машиностроение, 1980.
- Применение ультразвука в промышленности / Под ред. А.И. Маркова. М.: Машиностроение, 1975.
- Разработка и внедрение высокоэффективного ресурсосберегающего оборудования и новых видов пищевых продуктов в пищевой и перерабатывающей отраслях АПК. Киев: Изд-во технол. ни танищ-й пром., 1991.
- Рогов И.А., Горбатов А.В. Физические методы обработки пищевых продуктов. М.: Пищевая промышленность, 1974.
- Сенченков И.К. Модальная классификация и проектирование сонотродов для ультразвуковой обработки материалов // Акустический вестник, 1998. № 4.
- Сенченков И.К., Нестеренко НЛ., Козлов В.И. Ультразвуковая сварка - ресурсосберегающий и экологически чистый способ соединения пластмасс // Экотехнологии и ресурсосбережение. 1999. № 1.
- Сарвазян А.Н.Сельков Е.Е., Чаликян Т.В. Акустический интерферометр постоянной длины с переходными слоями для прецизионных измерений в малых объемах жидкостей // Акустический журнал. 1988. № 6.
- Фихте Б.А. Гуревич Г.А. Ультразвуковая дезинтеграция микроорганизмов // Пущино: НЦБИ АН СССР, 1984.
- Хмелев В.П., Попова О.B. Многофункциональные ультразвуковые аппараты и их применение в условиях малых производств, сельском и домашнем хозяйстве. Барнаул: АлтГТУ, 1997.
- Холопов Ю.В. Ультразвуковая сварка пластмасс и металлов. Л.: Машиностроение, 1988.
- Янсон Х.А.,Дзенис В.В., Татаринов A.M. Ультразвуковое исследование трубчатых костей. Рига: Зинатне, 1990.
6. УЛЬТРАЗВУК В ФАРМАЦИИ
Интенсивное перемешивание жидкостей в ультразвуковом поле, обусловленное акустическими течениями и микропотоками с большими градиентами скоростей > способность ультразвука дробить с помощью ударных волн взвешенные в жидкой среде твердые частицы и капли не растворяющихся в ней жидкостей на мельчайшие фрагменты делают ультразвуковые методы незаменимыми и весьма перспективными в производстве лекарств. Растворение, диспергирование и эмульгирование, экстрагирование и осветление, суспендирование и сушка могут быть значительно ускорены и облегчены при заводском и аптечном изготовлении ряда лекарственных препаратов и некоторых лекарственных форм.
6.1. ИНТЕНСИФИКАЦИЯ ПРОЦЕССОВ ПРИГОТОВЛЕНИЯ ЛЕКАРСТВ
Растворение - самый распространенный процесс при изготовлении лекарств. Он прост и истребует больших усилий для приготовления растворов легкорастворимых веществ, но для веществ с пониженной растворимостью оказывается длительным и трудоемким. Среди многих методов ускорения процесса растворения ультразвуковые занимают особое место.
Скорость растворения тем выше, чем ниже концентрация растворяемого вещества в растворе. Обычно при отсутствии потоков в жидкости у поверхности растворяемого тела устанавливается градиент концентрации. Чем ближе к поверхности, тем выше концентрация и тем медленнее переход новых частиц с поверхности в раствор.
Перемешивание обычными способами ускоряет растворение. Но только ультразвуковые микропотоки способны интенсивно перемешивать топкие слои жидкости у самой поверхности.
Скорость растворения иод действием ультразвука увеличивается еще и в результате кавитационной эрозии и дробления твердых частить. Это значительно увеличивает поверхность контакта между растворителем и растворяемым веществом.
Скорость растворения существенно зависит от интенсивности ультразвука. При низких интенсивностях эффект пренебрежимо мал и резко возрастает при интенсивностях, превышающих порог кавитации. Если раствор далек от насыщения, то при постоянной полости ультразвука количество растворенного в единицу времени вещества практически пропорционально времени воздействия.
Скорость растворения в ультразвуковом поле во многом растворимости лека вещества (табл. 6.1). Чем хуже растворяется вещество в данном растворителе, тем меньше эффективность ультразвуки кого воздействия. Но даже если речь идет о малорастворимых веществах, процесс ускоряется в 2-3 раза. Уменьшается в 5-30 раз и время достижения концентрации насыщения. Это позволяет готовить сильно концентрированные растворы веществ, медленно и мало растворимых в обычных условиях.
Следует, однако, отметить, что концентрация насыщенных водных растворов некоторых веществ, например глюконата кальция и ряда карбонатов, снижается в результате ультразвукового воздействия. Этот эффект слабо изучен и не получил убедительного обоснования. Можно предположить, что данное явление связано с конкуренцией диспергирования и коагуляции.
Таблица 6.1
Ускорение ультразвуком растворения лекарственных веществ
|
Растворяемое вещество |
Растворитель |
Количество растворяемого вещества в г на 100 мл растворителя |
Бремя растворения | |
|
Перемешивание |
Ультразвуковое воздействие | |||
|
Амидопирин |
Иода |
2 |
135 с |
5с |
|
Сахар |
Вода |
10 |
60 с |
6с |
|
Сульфат меди |
Иода |
10 |
120 с |
7с |
|
Фурацилин |
Иода |
0,2 |
600 с |
40 с |
|
Желатин |
Иода |
1,0 |
120 мин |
5 мин |
|
Камфара |
Подсолнечное масло |
10 |
300 с |
6с |
|
Салициловая кислота |
Персиковое масло |
2 |
180 с |
32 с |
В состав многих лекарственных препаратов в том или ином количестве входят вещества, извлекаемые из растительного или животного сырья. В основе технологии извлечения лекарственных веществ из тканей животных и рас гений лежит экстрагирование, малоэффективный и длительный процесс.
Низкочастотный ультразвук (22...44 кГц) в десятки и сотни раз сокращает время экстракции, например, флавоноидов, феногликозидов, дубильных и других веществ, на 30% повышает выход тартроновой кислоты из капустной мезги, на 20 % - выход инулина из корней лопуха, валерьяновой кислоты из корневищ валерианы, на 10...50 % - других веществ из различного растительного сырья.
Проводя экстракцию тканей животных в ультразвуковом поле, можно быстро и эффективно извлечь адреналин из на/точечной железы, инсулин - из поджелудочной железы, лидазу - из семенников, спленин - из селезенки, цитохром С - из сердечной мышцы крупного рогатою скота, пепсин - из автолизатов свиных желудков, пантокрин - из пантов оленя и целый ряд ферментов, гормонов, витаминов из другого животного сырья.
Биологическая активность лекарства в огромной степени зависит от физико-химического состояния входящих в него веществ. В частности, активность действующего начала в линиментах, суспензиях, эмульсиях существенно меняется в зависимости от степени дисперсности частиц, значительно увеличивающейся при ультразвуковой обработке. Кроме того суспензии и эмульсии после ультразвукового воздействия не расслаиваются и сохраняют свои свойства значительно дольше, чем эмульсии и суспензии, полученные традиционными способами (табл. 6.2),
Таблица 6.2
Сравнительная устойчивость эмульсий, полученных разными методами
|
Способ получения |
Время обработки, с |
Устойчивость эмульсий, ч | |
|
Рыбий жир |
Касторовое масло | ||
|
Механический (миксер) |
300 |
1,5 |
2,1 |
|
Гидродинамический (свисток) |
300 |
7 |
A3 |
|
Ультразвуковой (магнитострикционный преобразователь) |
25 |
28 |
168 |
Частицы лекарственного вещества в эмульсиях и суспензиях, раздробленные до весьма малых размеров (0,1...0,5 мкм), приобретают новые качества. Можно, например, приготовить эмульсию рыбьего жира, лишенную специфического запаха и вкуса, С помощью ультразвука были получены и успешно применяются в лечебной практике высокоактивные эмульсии касторового и вазелинового масел, рыбьего жира, нафталиновой нефти, лечебных грязей.
Суспензии - взвеси твердых частиц в жидкости, часто применяющиеся в лечебных целях, также меняют свои свойства под действием ультразвука. Размеры частиц уменьшаются, количество их возрастает, и, следовательно, увеличиваются устойчивость суспензии и общая поверхность частиц, определяющая биодоступность. лекарственного вещества.
Например, средние размеры частиц норсульфазола в суспензии в результате ультразвуковой обработки уменьшаются с 45...120 мкм до 3...10 мкм. При введении такой суспензии в организм время достижения максимальной концентрации препарата в крови сокращается и 2-4 раза. Используют ультразвук и для приготовления лекарственных форм, содержащих бентонитовые глины.
Противогрибковая активность 1- (2-хлорфенил) дифепилметил имидазола, известного как клотримазол или трихопол, многократно возрастает под действием ультразвука (22 кГц; 1,5 Вт; 40 мин).
Седиментационно устойчивая дисперсия клотримазола в воде с ПАВ (лаурил сульфат), введенная в питательную среду с инкубируемыми микроорганизмами Candida albicans, оказалась значительно аффективнее, чем та же композиция, приготовленная без ультразвука. Минимальная цитоцидная концентрация клотримазола в обработанной ультразвуком дисперсии составила 6.10-6 - моль/л., минимальная ингибирующая концентрация -1,2 • 10-7 моль/л. Эти концентрации па порядок ниже содержания клотримазола в стандартной дисперсии, не обработанной ультразвуком. Иначе творя, для лечения грибкового заболевания (кандидоз) требуется примерно в 10 раз меньше препарата, обработанного ультразвуком, чем полученною по традиционной технологии.
Теоретические кривые роста Candida albicans в питательных средах, содержащих клотримазол (рис. 6.1), построенные по вычисленным кинетическим коэффициентам и экотоксикологическому уравнению, хорошо согласуются с экспериментальными данными. Не следует, однако, забывать, что в ультразвуковом поле, особенно при интенсивностях, превышающих порог кавитации, возможны химические превращения лекарственных веществ, способные кардинально изменить их свойства и действие па организм (см. § 1.9).
Протекторами для лекарств в ультразвуковом поле могут служить акцепторы свободных радикалов. Так, 1% аскорбиновой кислоты в растворе предотвращает ультразвуковые химические реакции с участием резорцина, новокаина, производных парааминосалициловой кислоты и других лекарственных веществ. Свойствами сонопротекторов обладают также сульфат, бисульфат и метабисульфит натрия, некоторые антиоксиданты.
Активность ряда веществ, в частности антибиотиков - бензилпенициллина, стрептомицина, тетрациклина, низина, а также интерферонов - даже увеличивается под действием ультразвука. Возможно, это обусловлено распадом самопроизвольно образующихся в растворе этих веществ димеров, гримеров, тетрамеров. Данные ассоциаты распадаются в ультразвуковом поле до отдельных молекул, что эквивалентно увеличению концентрации препарата в единице объема или возрастанию активности на единицу его массы.
Рис. 6.1. Экспериментальные точки и теоретические кривые (построены по зкотоксикологическому уравнению), описывающие рост Candida albicans в питательной среде, содержащей гидрозоль клотримазола (моль/л):
6.2. УЛЬТРАЗВУКОВЫЕ АЭРОЗОЛИ
При аэрозольтерапии лекарственное вещество, будучи распылено на мельчайшие частицы и обладая поэтому большой удельной поверхностью, при попадании в органы дыхания воздействует на большую поверхность слизистых оболочек и быстро всасывается в кровь. Аэрозоли широко используются в медицине и ветеринарии для индивидуального и группового лечения респираторных и других заболеваний человека, массовой вакцинации животных и поддержания необходимой влажности в помещениях.
Существует много способов диспергирования жидкостей - гидравлический, механический, пневматический и пр., но наиболее эффективны ультразвуковой и пневмоакустический методы.
Регулируя параметры ультразвука, можно получить частицы аэрозоля самых разных размеров - от 0,03 до 10 мкм в диаметре - и в зависимости от этого обеспечить воздействие на тс или иные отделы дыхательной системы. Чем мельче аэрозольные частицы, тем глубже они проникают в легкие. Следует особо отметить, что при ультразвуковом методе аэрозоль получается практически монодисперсным, т. е. большинство частиц имеет одинаковые размеры.
На частицах тумана при их образовании могут накапливаться электрические заряды, В среднем число положительно и отрицательно заряженных частиц примерно одинаково. Разноименно заряженные частицы притягиваются друг к другу и сливаются в более крупные капли, что снижает монодисперсность аэрозоля и, следовательно, меняет его лечебные свойства. Для предупреждения этого явления аэрозоль иногда заряжают, используя специальное устройство. Одноименный электрический заряд на частицах препятствует их сближению и слиянию в более крупные капли. Следует отмстить, что в ряде случае» положительно и отрицательно заряженные частицы лекарственного аэрозоля обладают разными лечебными свойствами. Например, антибактериальная активность положительно заряженных частиц аэрозоля фурацилина вдвое выше активности частиц, заряженных отрицательно (рис 6.2).
Рис. 6.2. Влияние положительно (+) и отрицательно (-) заряженных частиц аэрозолей физиологического раствора и фурацилина, а также их электронейтральных (11) смесей на число колоний:
K - число колоний и исходной культуре; 1 - число колоний после воздействия аэрозолем физраствора; 2 - число колоний после воздействия аэрозолем раствора фурацилина
Ультразвуковые методы получения лечебных аэрозолей не лишены недостатков. Они малопригодны для распыления маслянистых жидкостей и вязких растворов. Кроме того, ультразвуковые генераторы аэрозоля относительно малопродуктивны и пригодны либо для индивидуальной терапии, либо для лечения одновременно нескольких человек или животных в небольшом помещении. Пневмоакустические генераторы способны обеспечить лечебным аэрозолем достаточно большое животноводческое помещение, но в отличие от ультразвуковых генераторов они создают сильный шум, в связи с чем требуются специальные шумозащитные средства, а это ограничивает их применение.
Ультразвуковые аэрозоли применяют в медицинской и ветеринарной практике так же, как и аэрозоли, полненные любым другим путем.
Возможности применения ультразвука в фармации не ограничиваются приведенными примерами. Направленное изменение активности и характера действия препаратов, мытье ампул и стерилизация растворов, производство микродраже и липосомальных форм, а также некоторые другие задачи фармации могут быть решены с помощью ультразвуковых методов,
Список литературы
- Молчанов Г. И. Ультразвук в фармации, М.: Медицина, 1980.
- Горбенко П.П., Адамова И.B., Зильбер Н.А. Реакция дыхательных путей на ингаляции ультразвуковых аэрозолей дистиллированной воды и изотонического раствора хлорида натрия у больных бронхиальной астмой. Пульмонология. 1992, №1
- Улащик B.C., Чиркин А. А. Ультразвуковая терапия. Минск: Беларусь, 1983.
- Флинн Г. Физика акустической кавитации в жидкости // Физическая акустика / Пер. с англ.; Под ред. У, Мэзона. Т. 3. Ч. Б. М.: Мир, 1967.
- Цыбров Г.Е., Ершов Ю.А., Плетнева Т.В. и др. Электрические явления при ультразвуковой аэрозольной обработке биологических тканей // Сообщения АН СССР. 1989. №1.
ЗАКЛЮЧЕИЕ
Исследования механизмов биологического и лечебною действия ультразвука, разработка новых ультразвуковых методик для медицины, экспериментальной биологии, ветеринарии, биотехнологии и других областей народного хозяйства продолжаются.
Высокий коэффициент поглощения ультразвука в воздухе, применение специальных конструкций и материалов для держателем ультразвуковых преобразователей сводят до минимума ультразвуковое воздействие на обслуживающий персонал, однако встречаются индивидуумы с повышенной чувствительностью. Они испытывают дискомфорт при интенсивностях ультразвука, используемых в диагностике, или «чувствуют» ультразвук, держась за рукоятку излучателя. Таких людей немного - два-три человека на каждые 10 тысяч, - но сам факт их существования свидетельствует о возможности влияния ультразвука весьма малых интенсивностей на организм. Не вызывая определенных ощущений во время воздействия, при длительном применении ультразвук низких интенсивностей может вызнать боли в суставах, повышенную утомляемость, изменения в организме, отражающиеся на электроэнцефалограммах в виде нарушения ![]() -ритма, и т. д. Все изменения бесследно исчезают, если оператор в течение нескольких дней не имеет контакта с ультразвуковой аппаратурой.
-ритма, и т. д. Все изменения бесследно исчезают, если оператор в течение нескольких дней не имеет контакта с ультразвуковой аппаратурой.
Есть проблемы, к решению которых исследователи еще не приступали, К ним относится выяснение возможности влияния ультразвука на процессы фармакокинетики и фармакогенетики. Что касается первой проблемы, то пока идет только сбор информации о влиянии ультразвука на скорости и пути введения и выведения лекарственных веществ в клетки и ткани. О существовании второй проблемы свидетельствует, по-видимому, лишь один факт - заметное увеличение числа хромосомных аберраций в клетках, подвергнутых ультразвуковому воздействию весьма низких интенсивностей в полиэтиленовых контейнерах (см.§ 5.2), Возможно, не только вещества, выделяющиеся из полиэтилена, но и некоторые соединения, используемые в фармакологии, в комбинации с ультразвуком могут увеличивать число хромосомных аберраций или оказывать другие нежелательные воздействия на организм.
Представляется бесспорным, что дальнейшее исследование механизмов биологического действия ультразвука, разработка новых ультразвуковых методов и оборудования принесут ощутимую пользу практической медицине, ветеринарии, биотехнологии и связанным с ними областям народного хозяйства - растениеводству, кормопроизводству, перерабатывающей промышленности, а также теоретической и экспериментальной медицине.
предметный указатель
Активный транспорт 105,126 Акустическая энергия 44 Акустический импеданс 49 Акустический контакт 21,56 Акустический микроскоп 80 Акустический пограничный слой 23, 107 Акустическое изображение 80 Акустическое поле 9, 14 Акустическое сопротивление 10,19, 21 Акцепторы свободных радикалов 91, 97, 209
Аминокислоты 90,91
Амплитуда звукового давления 12,15, 67
Амплитуда переменного ускорения 11
Амплитуда сдвигового усилия 11
Амплитуда скорости 10
Ампли туда смещения 11
Аналитический эффект 156
Антиген 100,151,199,200
Антиоксидант 32, 209
Антитело 100
Артериографии 57
Аутогемотерапия 140
Ацетабулярия 102
Аэрозоль 37,43,159, 210
бактерицидный эффект 156 Белки 93,172,175,201,203 Бесплодие 144
Биологически активные вещества 182, 202 Биологически активные точки 142,143 Биолюминесценция 99
Биомакромолекулы 90,101
Биополимеры 90
Биосинтез интерферона 192, 194 Биотехнологии 171
Болевая реакция 150
Болезни копыт 162
Визуализации 17,45,46,48,59
Вирусные частицы 118
Внешнее возмущение 110,112
Внешние раздражитель и 103
Внутренние органы 151
Внутриклеточная среда 121
Внутриутробная диагностика 52 Внутриутробная смертность 143 Водородпероксид 29, 30,39,91,120
Водоросли 36,203
Волна
- акустическая
- бегущая 22
- Сдвиговая 64
- стоячая 21
- сферическая 164
Воспалительные явления 148
Воспроизводительные функции 143
Вязкость 11,66, 160, 171, 177
Вязкоупругие свойства 63, 177
Газовлагообмен 188
Гемолиз 36,66,75,76, 134
Гемостатический эффект 156
Гидродинамические излучатели 171
Гидрофон 39,46
Гипертермия 130, 168
Гликоген 24, 92
Градиент концентрации 118
Градиент скорости 23,107
Граница раздела 19
Грубые корма 202
Групповая специфичность клеток 199
Давление
-звукового излучателя 45
-радиационное 12,164
Двухслойные липидные мембраны 102
Дегидратация 17В
Дезоксирибонуклеиновая кислота (ДНК) 23, 28, 38, 97,112
Денатурации 9В, 180
Деполимеризация молекул 96
Деполяризация мембран 104, 122, 131, 137,142
Десорбция 100,199 Диагностикумы 118
Диспергирование 175, 181, 190, 206, 207, 211
Диффузионное равновесие 105 Диффузионные процессы 34 Диффузия 27,66,96,101,105,109,118
Дозы ультразвуковой энергии 11З, 138 Доплеровская частота 55
Доплеровские методы 54
Дрожжи 115, 203
Заживление ран 110,148,155,159
Заменители цельного молока 181
Затухание ультразвука 17З
Зондирующий импульс 49
Излучатели ультразвука 14, 42
Иммунная система 152
Иммунологическая несовместимость 199
Иммунологическая специфичность 199
Инактивация ферментов 38, 91, 183
Ингибиторы дыхания 116
Инкубационное качество яйца 76
Инкубация 197
Инородные тела 50
Инструменты хирургические 155, 157 Интенсивность ультразвука 10, 13
Инфразвук 8
Ионизирующее излучение 114, 153
Ионный транспорт 103, 119
Кавитации
- зародыши 26
- подавление 36
- порог 26, 36, 37, 41
Кавитация 24, 25, 28, 36, 65
Кавитация в тканях 37, 41
Калориметрический метод 45
Каталитическая активность 95
Качество мяса 175
Квазистационарное приближение 86 Квазихимическая модель 84
Кинетика инактивации 95
Клеточные мембраны 20, 24, 36, 38, 66, 101
Клеточные органеллы 83, 108
Клеточные популяции 83
Клеточный цикл 83,137
Колебательная скорость 27
Коллоидные частицы 24
Коллоидный вибропотенциал 24 Консервирование эритроцитов 77 Криохирургический инструмент 156 Кровоток 56
Комбинированные воздействия 113, 147, 179
Кормовые добавки 201
Коэффициент затухания 22
Коэффициент отражения ультразвука 20
Коэффициент логлов1ения 17,124 Коэффициент проницаемости мембран 118
Коэффициент теплопроводности 19
Крахмал 46, 127, 182
Криозащитное действие 77 Криокоисервирование 77,189
Криопротекторы 189
Криорезистентность 78,189
Кристаллизация 189
Культура клеток 110, 115, 118, 193, 196 Культура тканей 118
Лейкоциты 37,72,110, 193 Лекарственные препараты 206 Лизосомы 24, 108
Лимфоциты 78, 83, 116
Липиды 101, 173
Липосакция 160
Липосомы 130
Maгнитострикционные преобразователи 42,155,171
Макрофаги 159, 161
Маммографии 50
Массообмен 171
Межфазное натяжение 101
Мембранный потенциал 107,126
Методы диагностики 48
Механизм действия ультразвука 24, 34, 37, 118,121, 160
Механическая резистентность 71 Механорецептор 11
Механохимические эффекты 28, 34 Микронеоднородности 24,26
Микроорганизмы 26, 99, 149, 161,171 Микропотоки 24, 28, 35, 38, 66, 96, 100,
119, 171, 199, 206
Микроскопия акустическая 80 Митоген 117
Митотический цикл 83,173
Митохондрии 108
Модель 84, 89, 126, 158,182
Молоко 57, 175
Молочные железы 149
Морфологические изменения 98
Мутагенное действие 113
Мягкие ткани 62, 132, 157
Надкостница 21
Необратимые изменения 165
Неспецифическая реакция 140 Неспецифическое воздействие 140 Нуклеиновые кислоты 91, 97, 112, 125
Обезболивающее действие 146,159 Обеспложивание 144, 169
Область допустимых состояний 89
Область рабочих состояний 89
Область разрушения 163
Обратимые изменении 105, 115, 122, 126, 166
Одноклеточные 99
Озон 180
Окисление 30,135
Онкология 152
Оплодотворяемость 143
Оплодотворяющая способность 145
Опорно-двигательная функция 146 Опухоли 50, 152
Органеллы клеток 12, 24, 159
Организм 82
Отражение ультразвука 20 Отруби 182
Очистка 179
Пассивный транспорт 119
Первичная реакция 90, 134 Переносчики 119
Пероксидное окисление липидов 31 Поверхностная активность 101
Поверхностная анергия 101
Поверхностно-активные биомакромолекулы 109
Поверхностные волны 22, 155, 157 Поверхностный заряд 22
Поверхность клетки 101
Повеpxность раздела 109
Повреждающее действие 30,149
Поглощение ультразвука 17
Подавление биологических функций 111
Подавление нервной проводимости 167
Покровные ткани 147
Поляризация люминесценции 97
Порог ультразвукового действия 104, 122
Порог теплового повреждения 19 Последействие ультразвука 66, 109,138 Потенциал Дебая 24, 120
Потенциал действия 104
Потенциал покоя 104
Прединкубационная обработка яиц 196
Прерывание беременности 144 Приемники-зонды 45
Приемники ультразвука 16, 43
Продуктивность 139
Проницаемость мембран 105, 147, 153 Проницаемость тканей 146
Прочность клеточных мембран 74 Пузырьки газа 26
Пьезоэлектрические преобразователи 42 Пьезоэффект 42
Радиационное поражение 114, 36 Радикально-цепные реакции 30 Радиометр 45, 164
Радиопротекторы 117
Размораживание
- тканей 176, 191
- клеточных суспензий 192
Разрешающая способность 18, 41, 80 Разрушение 11, 41, 45, 66, 78, 165
Рак 152
Распределение интенсивностей 15, 16, 157
Рассеяние ультразвука 57
Реакция биологической системы 89 Регенераций тканей 125, 138, 159 Регуляторные механизмы 89, 145
Резервы организма 148, 149, 197 Резонансные размеры 27
Рекомбинации радикалов 29
Релея формула 20
Рентгеновское излучение 114
Рентгенография 48
Репарационные механизмы 89,145
Репарация повреждений 112, 123, 136, 139 Репродуктивные органы 52, 143 Репродуктивные функции 143
Рецептор 11, 135,161
Рефлексогенные зоны 149
Рибонуклеиновая кислота (РНК) 23, 97, 112
Ртутное отравление 76 Рыбная кормовая мука 202
Самоочищающийся фильтр 184 Самостерилизация инструмента 156 Санация полостей 160
Санитарная обработка 180
Селективная дезинтеграция 159
Сверхкритические флюиды 44
Светящиеся бактерия 99
Свободные радикалы 28, 65, 91, 97, 120, 209
Сдвиг частоты доплерннгкиий,
Сдвиговая вязкость 175
Сдвиговые полны 7
Секторное сканирование 51
Синергический эффект 114,152
Синтез белка 110,121, 147,193
Сканирование
- двухмерное 51
- секторное 51
Скорость деления клеток 111
Скорости кровотока 57
Скорость распространения волн 8 Созревание мяса 175
Сонолиз 30
Сонолюминесценция 29, 79
Сонопротекторы 117
Сопротивление клеточных мембран 128
Сопротивляемость организма 110
Сорбция 101, 200
Сперматозоиды 144
Стандартная программа реагирования 89
Стерилизация 156
Стимуляция ультразвуковая 82
Стоячая волна 27
Структура мембраны 120
Суспендирование 36, 208
Суспензия 36, 65, 71, 194, 200, 203
Сыворотка кропи 79
Тактильные ощущения 11, 166
Тепловой механизм 120, 123, 165
Тепловые эффекты 165
Терапевтическое действие ультразвука 82, 125, 152
Термодиффузионный перенос 20,120 Термошоковые белки 19
Тиксотропные явления 11, 119
Торможение деления 38
Транспорт ионов 105, 120, 125
Трехмерное изображение 59
Тромбоциты 72
Турбидиметрия 72
Увеличение проницаемости 38, 109, 105, 130, 158, 159
Увеличение урожайности 187
Ударные волны 28
Ультразвук в биотехнологии 171
Ультразвук в стоматологии 37
Ультразвук в фармации 206
Ультразвук «диагностический» 41, 48
Ультразвуковая акупунктура 142, 143 Ультразвуковая дезинтеграция 37, 98, 117, 118, 159
Ультразвуковая диагностика 41, 48 Ультразвуковая гомогенизация 166,181 Ультразвуковая обработка 33, 77, 186, 187
Ультразвуковая остеометрия 61
Ультразвуковая резистентность 73 Ультразвуковая сварка 159
Ультразвуковая сушка 186
Ультразвуковая терапия
- внутренних органов 151
- глазных болезней 150
- кожных болезней 147 опухолей 152
- суставов 146
Ультразвуковая хирургия
- инструментальная 155
- фокусированным лучом 162
Ультразвуковая цитолизометрия 64
Ультразвуковая эрозия 34
Ультразвуковая эхокардиография 48
Ультразвуковое свечение (см, сонолюминесценция) 35
Ультразвуковой вискозиметр 175 Ультразвуковые ванны 171
Ультразвуковые инструменты 155, 157 Ультразвуковые свистки 171
Фазы митотического цикла 83, 137 Фазированные решетки 162
Фазный характер 134
Ферментативная активность 96
Фибробласты человека 110
Физиотерапия 139
Фильтрат 185
Фильтрование 185
Фокальная область 162
Фокусированный ультразвук 162
Фонофорез 106, 127, 151
Фотоиндуцированная хемилюминесценция 115
Химические реакции 28
Хирургические инструменты 155
Хромосомные аберрации 113
Центральная нервная система 165
Цепные реакции 33
Цитоплазматическая мембрана 37, 101, 107, 115
Цитолизометрия 64
Цитоскелет 37
Частота дыхания 143
Частота пульса 143
Шум 28,39,43
Экстрагирование 182
Электроакустические преобразователи 171
Электрокинетический потенциал 110 Электронно-возбужденные состояния 28
Электропроводность 96, 102, 122, 131, 132 Электрофорез 126, 128, 129 Электрофоретическая подвижность 97, 115
Эмульсия 181
Эмульгирование 181
Эндоплазматический ретикулум 108 Энергический выход 30, 34
Эритроциты 11, 37, 56, 64, 73, 109, 118, 134
Эффект Доплера 54
Эхо грамма 50
Эхозонд 50
Эхолокация 49, 53
Эхо-методы 48, 50
Эхоэнцефалография 50
Эхоэнцефалоскоп 49
Яичники 137, 143




